Puntos clave
- •
El manejo integral de la enfermedad renal litiásica (ERL) implica eliminar el cálculo de la vía urinaria y buscar las causas responsables de su formación, evitando así las recurrencias.
- •
La incidencia y prevalencia de la ERL en el niño es mucho menor que la del adulto y depende de factores climáticos, raciales, socioeconómicos, metabólicos, nutritivos y genéticos.
- •
Se trata de un proceso multifactorial donde los datos obtenidos del paciente tienen que ser interpretados de forma conjunta, ya que cada uno de ellos muestra facetas diferentes de la enfermedad.
- •
El 15–45% de los niños con una ERL permanecen sin diagnosticar debido a la sintomatología inespecífica que produce, sobre todo en los niños más pequeños.
- •
La detección precoz de la etiología, reduce su incidencia en la edad pediátrica y también en el adulto.
- •
A pesar de los esfuerzos realizados en los últimos años para poder explicar por qué algunos niños producen cálculos urinarios y otros no, la patogenia de la ERL no está totalmente aclarada.
La enfermedad renal litiásica (ERL) siempre se ha considerado una enfermedad típica del adulto. Sin embargo, con bastante frecuencia también está presente en la edad pediátrica, aunque en muchas ocasiones pasa desapercibida, sin ser diagnosticada.
En los últimos años se han experimentado avances importantes en el desarrollo de nuevos procedimientos terapéuticos mucho menos invasivos para eliminar el cálculo de la vía urinaria, como por ejemplo la litotricia. Asimismo se ha progresado enormemente en la comprensión de los mecanismos fisiopatogénicos que dan lugar a la formación del cálculo. Los grandes progresos en el campo de la biología molecular nos permiten conocer, además, cuáles son las bases genéticas a partir de las cuales se producen las alteraciones metabólicas causantes de la litiasis1–3.
Como consecuencia, el manejo integral de la ERL implica no solamente eliminar el cálculo de la vía urinaria, sino también buscar las causas responsables de su formación, con el fin de evitar que se produzcan recurrencias de la enfermedad.
EpidemiologíaLa incidencia y la prevalencia de la litiasis renal en el niño, aunque mucho menores que la del adulto, no son bien conocidas. Dependen de factores genéticos, climáticos, raciales, socioeconómicos, metabólicos, nutritivos, etc., y varían ampliamente según la zona geográfica.
Estudios epidemiológicos recientes informan de que en los últimos 10 años se ha producido un incremento de la incidencia de la ERL en niños. Posibles explicaciones a este fenómeno incluyen cambios en los hábitos alimentarios en los países desarrollados y un aumento en la prevalencia de sobrepeso y obesidad en la población pediátrica4,5.
Se ha estimado que dicha incidencia oscila entre 0,13 y 1,52 casos por cada 1.000 admisiones hospitalarias y ocupan el 10% de todos los casos de litiasis en adultos6. Estos datos hay que valorarlos con precaución porque el 15–45% de los casos permanecen sin diagnosticar debido la sintomatología inespecífica que producen, sobre todo en los niños más pequeños6.
En algunas partes del mundo, como por ejemplo en Turquía, la prevalencia es mucho más alta y puede llegar a ser comparable con la de los adultos6. Ocurre a todas las edades, aunque con mucha menor frecuencia por debajo de los 2 años y a diferencia del adulto, las diferencias entre ambos sexos7–10 son poco significativas y no constantes4,11.
En estudios realizados en EE. UU. se refiere que la ERL ocurre con mucha más frecuencia en la raza blanca donde la incidencia es 2 veces mayor que en la asiática, ocurriendo raramente en los afroamericanos y en los nativos americanos12. La predisposición genética, reflejada en las diferencias raciales y en la alta incidencia de una historia familiar de urolitiasis, indica la importancia que tienen los factores genéticos en esta enfermedad4,12.
Tanto en el niño como en el adulto, la ERL se caracteriza por sus frecuentes recurrencias, que según distintos estudios oscila entre el 7 y el 54%7,8,13.
La localización de los cálculos también varía según las distintas áreas geográficas. En Europa y en EE. UU., el 90% de los casos se localizan en la vía urinaria alta, mientras que en los países en vías de desarrollo (sudeste asiático y zonas de África) lo hacen preferentemente en la vejiga (litiasis vesical endémica). La composición de estos últimos, es casi siempre de urato amónico y su etiología, a diferencia de los países desarrollados, está en relación con una dieta rica en cereales, hipoproteica y pobre en fosfatos. Se ha comprobado que cuando en un país subdesarrollado mejora el nivel de vida, se produce una disminución de los cálculos vesicales y un aumento en el número de cálculos localizados en la vía urinaria alta. En los países desarrollados, los cálculos vesicales son excepcionales y cuando aparecen son la consecuencia de anomalías anatómicas o funcionales de la vía urinaria inferior (vejiga neurógena, patología uretral, vejiga ileal, etc.)7,8,13.
Manejo de la enfermedad renal litiásicaEs necesario realizar: una historia clínica completa, un análisis microbiológico de orina, un estudio por técnicas de imagen, un análisis de la composición del cálculo y un estudio bioquímico en sangre y orina. Dichos estudios nos mostrarán facetas diferentes del proceso litiásico, por lo que nunca deberán valorarse aisladamente, sino de forma conjunta y coordinada.
Historia clínica: sintomatología, antecedentes y exploración clínicaSintomatologíaLa sintomatología varía con la edad y es tanto más difícil de interpretar cuanto más pequeño es el paciente. El síntoma más importante es el dolor, producido por la movilización del cálculo a través de la vía urinaria. En el lactante casi siempre se manifiesta en forma de llanto inconsolable, confundiéndose con el cólico del lactante. En el niño mayorcito produce episodios de dolor abdominal más o menos localizado, a veces referido a zonas lumbares, estando presente en el 40–75% de las ocasiones. El cuadro típico de cólico nefrítico del adulto, solamente aparece en el adolescente.
La hematuria macro o microscópica está presente en el 30–90% de los casos, pudiendo acompañar o no al dolor abdominal. En el 20–50% de los pacientes puede aparecer un síndrome miccional con disuria, polaquiuria, etc., sobre todo en los cálculos vesicales y uretrales o cuando se asocia una infección urinaria. Otros síntomas menos frecuentes son la fiebre, sobre todo si hay infección urinaria, los vómitos y la retención urinaria. Algunos pacientes, sobre todo los de menor edad, cursan de forma asintomática, pasando desapercibidos o diagnosticándose de forma casual2,7,8,10,13,14.
Con frecuencia, se puede pasar por alto el origen urológico del dolor. Ello se debe a la ocurrencia inconstante de disuria y hematuria, a la localización del dolor en áreas diferentes de los flancos y a la no visualización del cálculo en los estudios de imagen, en algunos casos. Se considerará siempre la posibilidad de urolitiasis en los niños que, teniendo un dolor abdominal recurrente, tienen además una historia familiar positiva de ERL, incluso aunque no exista disuria y/o hematuria15.
Existe un grupo de pacientes, muchos de ellos con antecedentes familiares de litiasis, que sin haber formado cálculos todavía visibles, presentan una sintomatología muy parecida a los pacientes litiásicos. Se trata de pacientes que tienen un riesgo de litiasis varias veces superior al de la población pediátrica normal, que forman microcálculos (cálculos de tamaño menor de 3mm) que normalmente expulsan de forma espontánea y que muchas veces pasan desapercibidos en los estudios de imagen. Se acepta que estos pacientes se encuentran en «situación de prelitiasis» y se les considera como futuros formadores de cálculos2,8,10,15. Según otros autores, este grupo de pacientes no tiene más riesgo de litiasis que la población pediátrica general.
AntecedentesSe buscarán antecedentes familiares de litiasis que, según diferentes estudios, están presentes entre el 22 y el 75%. Se investigará si existe una historia litiásica anterior, identificando la edad de comienzo, el número total de cálculos formados y el tratamiento previo recibido. Algunas enfermedades metabólicas hereditarias, como la cistinuria, la hiperoxaluria primaria, el raquitismo hipofosfatémico con hipercalciuria, la acidosis tubular renal y otras tubulopatías, pueden manifestarse muy precozmente, en los primeros meses o años de la vida.
Debe descartarse patología digestiva, como diarrea crónica, celiaquía, fibrosis quística, o enfermedades inflamatorias crónicas, como la enfermedad de Crohn o la colitis ulcerosa. En estos procesos se produce una importante pérdida intestinal de agua, electrolitos, álcalis y calcio con la aparición de una orina concentrada y ácida, asociada a una hipocitraturia y una hiperoxaluria secundaria a un aumento de la absorción intestinal de oxalato. Todo ello da lugar a una alteración de la composición iónica de la orina facilitadora de la aparición de cálculos.
En algunos pacientes, el primer episodio de litiasis renal puede ser la expresión de una enfermedad sistémica, como el hiperparatiroidismo primario, la sarcoidosis, los tumores de alto recambio celular como los linfomas (síndrome de lisis tumoral), etc. También puede indicar la presencia de otras enfermedades, como la acidosis tubular distal u otras tubulopatías más complejas10,13,14.
Además de investigar si ha habido episodios de infección del tracto urinario previos, debe practicarse un estudio microbiológico de orina con el fin de descartar una infección urinaria activa causante de una litiasis infectiva.
Debe identificarse si hay antecedentes de inmovilización en relación con problemas traumatológicos, trastornos incapacitantes como parálisis o de otro tipo, que hayan podido generar un síndrome de hipercalcemia-hipercalciuria secundario a un proceso de resorción ósea12.
Se interrogará sobre la administración previa de medicamentos que puedan haber inducido la aparición de alteraciones metabólicas importantes en la orina facilitadoras de la cristalización12.
Historia nutricionalEs fundamental llevar a cabo una historia nutricional. Cuando las transgresiones dietéticas son importantes se pueden producir cambios bioquímicos, que crearán un ambiente físico-químico en la orina favorecedor de la cristalización12.
Exploración físicaLa exploración física es útil para conocer las características del dolor abdominal (difuso, localizado, puñopercusión renal, etc.). Se medirán
Inicialmente se practicará una radiografía de abdomen simple y ecografía renal. La radiografía de abdomen solamente puede detectar los cálculos radioopacos y se considera que tiene una baja sensibilidad y especificidad para el diagnóstico de urolitiasis.
La ecografía es tan efectiva como la urografía IV para el diagnóstico de la urolitiasis. Tiene la ventaja de que es una técnica fácil de realizar y no necesita radiaciones ionizantes. Además de localizar el cálculo, es idónea para detectar dilataciones u otras anomalías estructurales la vía urinaria. No es tan sensible como otras técnicas para detectar pequeños cálculos, sobre todo cuando están localizados en el uréter6,8,9,13,14. No nos aporta datos sobre la función renal y es una técnica dependiente del observador.
En ocasiones, puede ser necesario realizar una tomografía computarizada (TC), sobre todo si en las exploraciones anteriores se sospecha una obstrucción y no se visualiza el cálculo. Gracias a esta técnica, podremos conocer el grado de obstrucción y la funcionalidad del riñón afectado6,8,9,13,14. Estudios recientes indican que la TC es mucho más exacta que la ecografía para detectar cualquier cálculo, independiente de su localización16. Tiene el inconveniente de que somete al paciente a radiación. La resonancia magnética puede ser una técnica de gran utilidad, con la ventaja de que no irradia.
La aparición del cálculo en los estudios de imagen depende de su composición. Los que están compuestos de oxalato cálcico o de fosfato cálcico tienen una imagen muy densa en las radiografías convencionales y en la TC. Los cálculos de estruvita y los de cistina son de densidad intermedia. Los cálculos de acido úrico son radiotransparentes, necesitando la administración de contraste para poder visualizarlos, teniendo además una baja densidad en la TC6.
Análisis del cálculoSiguiendo los trabajos de Grases et al3, con amplia difusión tanto dentro como fuera de nuestro país, el análisis del cálculo puede ser de gran utilidad a la hora de aclarar la etiología de la litiasis. Cada tipo de cálculo, en función de su composición, representa una determinada forma clínica de la enfermedad litiásica, con una fisiopatología, evolución, pronóstico y tratamiento diferente (véase el apartado «Tipos de cálculos»).
En primer lugar, se analizará la estructura macroscópica del cálculo antes y después de su fragmentación, mediante una lupa binocular, valorando la estructura cristalina, el orden de deposición de los distintos componentes y la visualización del corazón del cálculo3.
Posteriormente, deberán identificarse el o los componentes mayoritarios del cálculo mediante espectroscopia infrarroja. Se trata de un método sencillo y específico, que consiste en exponer los componentes del cálculo a la radiación infrarroja, obteniéndose patrones específicos para cada componente a una determinada longitud de onda. El análisis químico del cálculo es un método inexacto que actualmente ha quedado totalmente en desuso3.
Por último, si es posible, será de gran utilidad el estudio de la estructura microscópica del cálculo mediante microscopía de barrido con análisis por dispersión de rayos X, pudiendo llegar a determinar por este procedimiento incluso los nucleantes heterogéneos y las posibles etapas del desarrollo del cálculo (véase el apartado de estudio físico-químico de la orina)3.
Estudio de laboratorioEstudio bioquímico en sangre y orinaDespués del primer episodio de litiasis renal, es necesario realizar un estudio metabólico completo, ya que se ha referido que el 48–86% de los niños con ERL tienen alteraciones metabólicas11,17,18.
Siempre que sea posible, se recogerán una o 2 muestras de orina de 24h y tras cada una de ellas una micción aislada (segunda micción de la mañana), prolongando el ayuno de la noche. Entre la orina de 24h y la micción aislada se realizará una extracción de sangre para analítica. En el lactante y el niño pequeño, donde la recogida de orina minutada es extremadamente difícil, el estudio se realizará en orina de micción aislada. Diversos autores han subrayado que los cocientes soluto/creatinina en orina de la segunda micción de la mañana tienen una buena correlación con la excreción de solutos en orina de 24h19.
Con el fin de que el estudio bioquímico refleje lo más exactamente posible la situación metabólica del paciente, se realizará en régimen ambulatorio, bajo la dieta libre y en las condiciones de vida habituales del niño. Deberá esperarse a que el paciente permanezca asintomático y fuera de la fase aguda del cuadro clínico que motivó el diagnóstico. Siempre que sea posible, un mes antes del estudio se suspenderá todo medicamento que pueda provocar cambios en la composición química de la orina.
Tanto en sangre como en la orina de 24h, se determinarán: creatinina, urea, ácido úrico, iones, calcio total y calcio iónico, fósforo y magnesio. En la sangre se realizará además una gasometría capilar y, cuando exista hipercalciuria o hipofosforemia, una parathormona intacta (PTHi). En la orina se determinará también: pH, oxalato, citrato, amonio, sulfato y tCO2. En la orina de micción aislada se determinará: pH, cociente calcio/creatinina, test de Brand para el cribado de la cistinuria, sedimento o citometría urinaria para valorar la presencia de hematuria, proteinuria, leucocituria, bacteriuria, cristaluria (cristales hexagonales de cistina, de 2,8 dihidoxiadenina y de algunas drogas como indinavir) y urocultivo para detectar una infección urinaria activa, causante de una litiasis infectiva8,10,14.
Por último, debe hacerse un perfil de pH urinario durante 3–4 días, determinando el pH con tira reactiva en el domicilio, antes del desayuno, antes de la comida y antes de la cena. El perfil de pH urinario nos aportará datos referentes a la etiología de la litiasis, permitiéndonos visualizar el ambiente urinario en el que se produce. El pH alcalino favorece la precipitación de fosfato cálcico y fosfato amónico-magnésico, y nos hará pensar en una litiasis infectiva o en procesos que cursan con cálculos de fosfato cálcico, como la acidosis tubular distal o el hiperparatiroidismo primario. Como el ácido úrico y la cistina precipitan en las orinas ácidas, ante un pH < 5,5 debe sospecharse una alteración del metabolismo de las purinas o una cistinuria. La solubilidad del oxalato cálcico está poco influenciada por el pH urinario14.
Debe realizarse también un análisis de heces, con el fin de buscar bacterias degradadoras del oxalato, especialmente el Oxalobacter formigenes, que usa el oxalato como fuente de energía y que su ausencia podría dar lugar a la una hiperoxaluria secundaria y facilitar la formación de cálculos20.
En algunas ocasiones, será necesario realizar un estudio de aminoácidos en sangre y orina, y de ácidos orgánicos en orina, así como un estudio genético, si se sospecha que la causa de la ERL es una enfermedad hereditaria como la oxaluria primaria, la cistinuria clásica, etc.
La principal fuente de error al realizar un estudio metabólico se deriva de la recogida incorrecta de la orina de 24h. Además de explicar a los familiares cómo deben realizar la recogida, en todas las orinas se comprueba, como criterio de fiabilidad de que está bien recogida, que la creatininuria del paciente expresada enmg/kg/24h es igual a la de los controles normales para su grupo de edad. Los valores de la creatininuria para nuestra población normal varían con la edad y queda reflejados en la tabla 121,22.
Valores de referencias de la excreción urinaria de los distintos metabolitos relacionados con la litiasis renal (estudio Haurtxo).
| Metabolito | Edad | Orina 24h | Micción aislada |
|---|---|---|---|
| Creatininuria | mg/kg/24ha | ||
| 3–4 años | 17,87±3,19 | – | |
| 5–7 años | 19,88±3,20 | – | |
| 8–10 años | 20,73±3,30 | – | |
| 11–14 años | 22,51±3,50 | – | |
| mEq/kg/24h | – | ||
| Excreción sodiod | < 3 | – | |
| Excreción potasiod | > 3 |
| Calciuria | mg/kg/24hb | Cociente Ca/Cr mg/mg | |||
| 0–6 meses | – | < 0,80 | |||
| 7–12 meses | – | < 0,60 | |||
| 1–2 años | – | < 0,47 | |||
| Hombre | Mujer | ||||
| P3 | 0,51 | 0,01 | 0,01 | ||
| 3–14 años | P50 | 2,34 | 0,08 | 0,06 | |
| P97 | 5,56 | 0,29 | 0,28 | ||
| Uricosuria | mg/24h/1,73m2a | IE úrico mg/100 FGc | |
| Pretérmino | |||
| 29–33 semanas | – | < 8,8 | |
| 34–37 semanas | – | < 4,6 | |
| RN término | – | < 3,3 | |
| 3–4 años | 688±144 | ||
| 5–11 años | 600±140 | 0,56 | |
| 12–14 años | 545±128 |
| Oxaluria | mg/24h/1,73m2a | Cociente Ox/Cr mmol/molc | ||
| Valor máximo | ||||
| 0–6 meses | – | 360 | ||
| 7–24 meses | – | 174 | ||
| 25–48 meses | – | 101 | ||
| 3–14 años | Hombre | 23,63±7 | – | |
| Mujer | 26,35±9 | |||
| Citraturia | mg/kg/24ha | Cociente Citr/Cr mg/g | |
| 3–14 años | 9,62±4,05 | > 400 | |
| Magnesuria | Cociente Citr/Cr mg/mg | ||
| 2–15 años | 2,10±1,13 | 0,11±0,06 |
| Cistinuriad | mg/24h/1,73m2 | ||
| < 60 |
Al realizar el estudio metabólico, a las dificultades existentes para obtener orinas minutadas, sobre todo en los niños más pequeños, se suman las variaciones observadas en la excreción urinaria de los distintos metabolitos relacionados con la litiasis (calciuria, uricosuria, oxaluria, citraturia, etc.) en función de la edad, el sexo y de otros factores ya mencionados (genéticos, raciales, geográficos, nutricionales, etc.). Ello impide poder utilizar un único valor de referencia como normalmente se hace en los pacientes adultos. Además, la metodología utilizada por los distintos autores para obtener los valores de referencia ha sido muy diferente, lo que ha dado lugar a que dichos valores varíen considerablemente entre las distintas publicaciones de la literatura. De todo lo dicho, se deduce que si queremos realizar una valoración metabólica adecuada en estos pacientes va a ser imprescindible que cada laboratorio disponga de sus propios valores normales.
En nuestra Sección de Nefrología Pediátrica hemos obtenido los valores de referencia de la excreción urinaria de la calciuria, la uricosuria, la oxaluria y la citraturia, entre otros, en 359 niños sanos con edades comprendidas entre los 3 y los 14 años (estudio Haurtxo, tabla 1)21–25.
Factores relacionados con la enfermedad renal litiásicaLa ERL es un proceso muy complejo que puede ser la consecuencia de malformaciones anatómicas del tracto urinario que favorecen la estasis urinaria, las infecciones de orina, las alteraciones metabólicas, los desequilibrios nutricionales, la administración de fármacos o estar en relación con factores genéticos y ambientales. Cuando se realiza un estudio adecuado, la ERL idiopática es poco frecuente26,27.
Lectura rápida
El análisis del cálculo puede ser de gran utilidad a la hora de aclarar la etiología de la ERL. Cada tipo de cálculo, en función de su composición, representa una determinada forma clínica de la enfermedad litiásica con una fisiopatología, una evolución, un pronóstico y un tratamiento diferentes.
En general, se acepta como dieta litogénica aquella que ofrece un aporte reducido de líquidos y/o un aporte excesivo de alimentos ricos en calcio, proteínas animales, oxalato y sal8,10,13,14.
El aporte reducido de líquidos eleva la saturación de las distintas sales en la orina. El exceso de calcio, la restricción severa de fósforo y un aporte elevado de proteínas animales, glucosa o sacarosa incrementan la excreción urinaria de calcio. La restricción excesiva de calcio produce una hiperoxaluria de origen intestinal. El exceso de sal produce una hipocitraturia y un aumento de la excreción de calcio por la orina28, habiéndose descrito una relación fuerte entre el sodio urinario y la excreción de calcio, y una relación inversa entre la ingesta de potasio y la calciuria12. Las dietas cetogénicas utilizadas para el control de las convulsiones favorecen la aparición de cálculos de acido úrico y de sales de calcio. El exceso de alimentos ricos en oxalato, como el cacao, el chocolate, el té, las espinacas, la remolacha, el zumo de arándano, las bebidas de cola, etc., pueden producir hiperoxaluria. Lo mismo ocurre con el zumo de naranja, que contiene oxalato y vitamina C, esta última precursora del oxalato28.
Alteraciones metabólicas en orina relacionadas con la enfermedad renal litiásicaLas alteraciones metabólicas pueden ser primarias o derivarse de factores ambientales y/o nutricionales. Aproximadamente, en el 75% de los niños con ERL se descubre una causa metabólica causante de la enfermedad6,19.
HipercalciuriaLa hipercalciuria se define como el aumento de la excreción urinaria de calcio, siendo secundaria a múltiples causas. Se considera idiopática cuando no está asociada con la hipercalcemia o con otras causas de hipercalciuria.
Existen 3 mecanismos que contribuyen a la hipercalciuria: la absorción intestinal de calcio aumentada (hipercalciuria absortiva), aumento de las pérdidas renales (hipercalciuria renal) y aumento de la resorción ósea de calcio (hipercalciuria resortiva). Múltiples factores genéticos y ambientales pueden afectar a alguno de estos mecanismos. La tabla 2 refleja las distintas causas que dan lugar a una hipercalciuria.
Causas de la hipercalciuria.
| Renales |
| Hipercalciuria Idiopática |
| Acidosis tubular distal |
| Seudohipoaldosteronismo primario tipo II |
| Hipomagnesemia familiar con hipercalciuria |
| Raquitismo hipofosfatémico hereditario con hipercalciuria |
| Síndrome de Bartter |
| Enfermedad de Dent |
| Síndrome de Fanconi |
| Riñón en esponja |
| Pielonefritis aguda |
| Endocrinológicas |
| Diabetes mellitus |
| Hipertiroidismo |
| Síndrome de Cushing |
| Obesidad |
| Síndrome hipercalcémico |
| Síndrome de Williams |
| Hiperparatiroidismo primario |
| Hipercalcemia-hipercalciuria idiopática |
| Hipercalcemia secundaria: cáncer, sarcoidosis, inmovilización, intoxicación vitamina D |
| Transgresiones dietéticas |
| Exceso de calcio |
| Restricción severa de fósforo |
| Exceso de proteínas animales |
| Exceso de sal |
| Déficit de potasio |
| Exceso de glucosa o sacarosa |
| Dieta cetogénica |
| Fármacos |
| Diuréticos de asa, esteroides, nutrición parenteral, aporte excesivo de calcio, otros |
En estudios recientes se ha descrito que la incidencia de la hipercalciuria idiopática (HI) como factor etiológico de la ERL oscila entre el 30 y el 60%10,11, siendo el factor de riesgo litógeno más frecuente.
Según el estudio Haurtxo29, entre los 3 y 14 años, cuando la calciuria se expresa enmg/kg/24h, no varía ni con la edad ni con el sexo. Los valores obtenidos en este estudio son más elevados que los referidos en la literatura americana30,31 y europea32, superando los 4mg/kg/24h, que es aceptado normalmente como el límite superior de la calciuria normal. Sin embargo, son muy similares a los obtenidos en algunos estudios realizados en nuestro propio país (tabla 1)33.
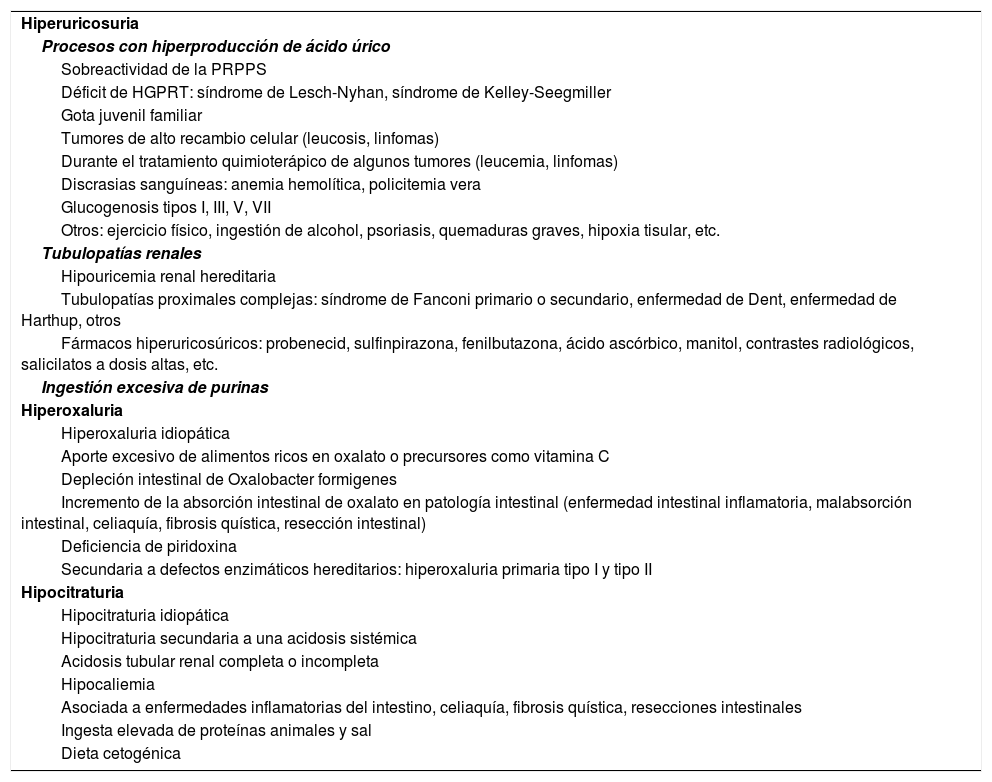
HiperuricosuriaEl ácido úrico es el producto final del metabolismo de las purinas. La hiperuricosuria puede ser secundaria a una hiperproducción de ácido úrico, a un defecto tubular o a una ingesta elevada de alimentos ricos en purinas. Puede ser familiar o idiopática y puede presentarse en forma individual o asociada a una hipercalciuria (tabla 3). Aunque habitualmente la frecuencia de la litiasis úrica es baja, contribuye de forma importante en la formación de cálculos de oxalato cálcico (nucleación heterogénea).
Causas de hiperuricosuria, hiperoxaluria e hipocitraturia.
| Hiperuricosuria |
| Procesos con hiperproducción de ácido úrico |
| Sobreactividad de la PRPPS |
| Déficit de HGPRT: síndrome de Lesch-Nyhan, síndrome de Kelley-Seegmiller |
| Gota juvenil familiar |
| Tumores de alto recambio celular (leucosis, linfomas) |
| Durante el tratamiento quimioterápico de algunos tumores (leucemia, linfomas) |
| Discrasias sanguíneas: anemia hemolítica, policitemia vera |
| Glucogenosis tipos I, III, V, VII |
| Otros: ejercicio físico, ingestión de alcohol, psoriasis, quemaduras graves, hipoxia tisular, etc. |
| Tubulopatías renales |
| Hipouricemia renal hereditaria |
| Tubulopatías proximales complejas: síndrome de Fanconi primario o secundario, enfermedad de Dent, enfermedad de Harthup, otros |
| Fármacos hiperuricosúricos: probenecid, sulfinpirazona, fenilbutazona, ácido ascórbico, manitol, contrastes radiológicos, salicilatos a dosis altas, etc. |
| Ingestión excesiva de purinas |
| Hiperoxaluria |
| Hiperoxaluria idiopática |
| Aporte excesivo de alimentos ricos en oxalato o precursores como vitamina C |
| Depleción intestinal de Oxalobacter formigenes |
| Incremento de la absorción intestinal de oxalato en patología intestinal (enfermedad intestinal inflamatoria, malabsorción intestinal, celiaquía, fibrosis quística, resección intestinal) |
| Deficiencia de piridoxina |
| Secundaria a defectos enzimáticos hereditarios: hiperoxaluria primaria tipo I y tipo II |
| Hipocitraturia |
| Hipocitraturia idiopática |
| Hipocitraturia secundaria a una acidosis sistémica |
| Acidosis tubular renal completa o incompleta |
| Hipocaliemia |
| Asociada a enfermedades inflamatorias del intestino, celiaquía, fibrosis quística, resecciones intestinales |
| Ingesta elevada de proteínas animales y sal |
| Dieta cetogénica |
El estudio Haurtxo demuestra que entre los 3 y los 14 años, cuando se expresa en mg/24h/1,73m2, no varía con el sexo pero sí con la edad (tabla 1), disminuyendo progresivamente a lo largo del crecimiento21. Igual que ocurre con la calciuria, estos valores son superiores a los publicados previamente34. Existen
Lectura rápida
El estudio metabólico debe realizarse en una o 2 muestras de orina de 24h, cuando el paciente se encuentre asintomático, en régimen ambulatorio, bajo dieta libre y en condiciones habituales de vida.
Es imprescindible que cada laboratorio disponga de sus propios valores de referencia, de la excreción urinaria de los distintos metabolitos relacionados con la litiasis (calciuria, uricosuria, oxaluria, citraturia, etc.), ya que sufren variaciones en relación con la edad, sexo y otros factores.
Lectura rápida
La ERL es un proceso muy complejo, que puede ser la consecuencia de: malformaciones anatómicas del tracto urinario que favorecen la estasis urinaria, las infecciones de orina, las alteraciones metabólicas, los desequilibrios nutricionales, la administración de fármacos o estar en relación con factores genéticos y ambientales.
El origen de la hiperoxaluria puede ser primario o secundario y está en relación con diversas situaciones clínicas, las cuales quedan reflejadas en la tabla 3.
Los valores de la oxaluria en el estudio Haurtxo, realizados en una población pediátrica entre 3 y 14 años, no sufren variaciones con la edad pero sí con el sexo, siendo discretamente más elevados en las niñas. Aunque estas diferencias son significativas, no parecen tener relevancia clínica (tabla 1)37. Algunos estudios recientes han obtenido valores más elevados que los nuestros38. Durante la infancia, la excreción de oxalato por la orina es más elevada25.
HipocitraturiaLa citraturia, según el estudio Haurtxo, no varía con la edad ni con el sexo (tabla 1), pero sus valores presentan una gran dispersión, lo que dificulta la detección de las hipocitraturias leve-moderadas39. En la infancia la citraturia es más elevada.
En los pacientes con litiasis renal e hipocitraturia debe descartarse siempre una acidosis tubular renal completa o incompleta. Las causas de la hipocitraturia quedan reflejadas en la tabla 3.
Administración de fármacosPueden inducir la aparición de alteraciones metabólicas importantes en la orina facilitadoras de la cristalización, actuando a 3 niveles diferentes:
- –
Cristalizando ellos mismos, como ocurre con fármacos que siendo pocos solubles alcanzan altas concentraciones en la orina (fenitoína, triamtereno, sulfonamidas, indinavir, ceftriasona)28.
- –
Produciendo un aumentando de la concentración urinaria de metabolitos relacionados con la ERL, como los fármacos anticancerosos (aumento de acido úrico en orina), los glucocorticoides (aumento de calcio en la orina), el alopurinol (utilizado en el síndrome de lisis tumoral da lugar a aumento de la xantina), el aporte de calcio y de vitamina D, y los diuréticos de asa (aumento de calcio y oxalato).
- –
Alterando el pH de la orina y descendiendo la solubilidad de algunos metabolitos, como en el caso de fármacos que inhiben la anhidrasa carbónica en el riñón, como la acetazolamida, que produce una acidosis metabólica y, como consecuencia, una hipocitraturia y una elevación del pH urinario28.
Como ya se ha mencionado previamente, la infección unida o no a anomalías estructurales del tracto urinario es una etiología frecuente de la ERL (véase cálculos infecciosos). Según algunos estudios, puede existir una asociación entre sobrepeso-obesidad y la ERL en el niño. Otros estudios recientes, a diferencia de lo que ocurre en el adulto, no han confirmado dicha asociación40.
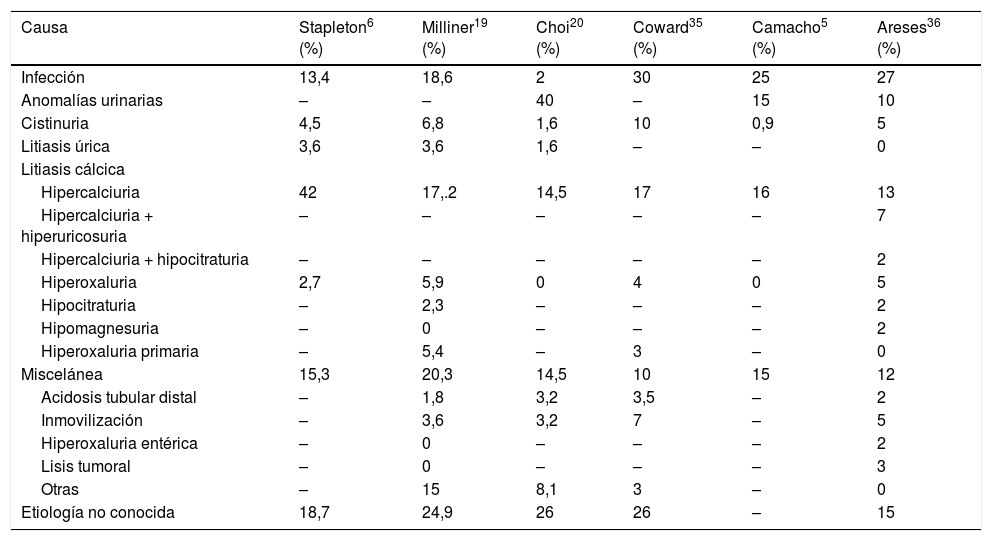
En la tabla 4 se reflejan las diferentes etiologías de la ERL según las distintas series de la literatura. Aunque existen diferencias importantes entre unos autores y otros, todos coinciden en que casi la mitad de los casos son secundarios a algún tipo de alteración metabólica. Entre ellas, la más frecuente, como ocurre en la edad adulta, es la hipercalciuria, que está presente en el 42% de los pacientes de Stapleton. En nuestra serie, ya sea de forma aislada o en combinación con otras alteraciones metabólicas, explica el 22% de todas las litiasis.
Causas de la enfermedad renal litiásica en niños según distintos autores.
| Causa | Stapleton6 (%) | Milliner19 (%) | Choi20 (%) | Coward35 (%) | Camacho5 (%) | Areses36 (%) |
|---|---|---|---|---|---|---|
| Infección | 13,4 | 18,6 | 2 | 30 | 25 | 27 |
| Anomalías urinarias | – | – | 40 | – | 15 | 10 |
| Cistinuria | 4,5 | 6,8 | 1,6 | 10 | 0,9 | 5 |
| Litiasis úrica | 3,6 | 3,6 | 1,6 | – | – | 0 |
| Litiasis cálcica | ||||||
| Hipercalciuria | 42 | 17,.2 | 14,5 | 17 | 16 | 13 |
| Hipercalciuria + hiperuricosuria | – | – | – | – | – | 7 |
| Hipercalciuria + hipocitraturia | – | – | – | – | – | 2 |
| Hiperoxaluria | 2,7 | 5,9 | 0 | 4 | 0 | 5 |
| Hipocitraturia | – | 2,3 | – | – | – | 2 |
| Hipomagnesuria | – | 0 | – | – | – | 2 |
| Hiperoxaluria primaria | – | 5,4 | – | 3 | – | 0 |
| Miscelánea | 15,3 | 20,3 | 14,5 | 10 | 15 | 12 |
| Acidosis tubular distal | – | 1,8 | 3,2 | 3,5 | – | 2 |
| Inmovilización | – | 3,6 | 3,2 | 7 | – | 5 |
| Hiperoxaluria entérica | – | 0 | – | – | – | 2 |
| Lisis tumoral | – | 0 | – | – | – | 3 |
| Otras | – | 15 | 8,1 | 3 | – | 0 |
| Etiología no conocida | 18,7 | 24,9 | 26 | 26 | – | 15 |
Existen factores físico-químicos en la orina que desempeñan un papel importante en el complejo proceso que da origen a una litiasis renal. Para que se forme un cálculo es necesario que la orina esté supersaturada con respecto a la sal que va a constituir el futuro cálculo. La supersaturación de una sal en la orina se define como aquella energía libre o fuerza termodinámica necesaria para que se produzca la cristalización de dicha sal.
NucleaciónEl primer proceso que tiene lugar en la formación de un cálculo es la nucleación, que no es más que el paso cinético inicial, que permite la transformación de un líquido en un sólido en una orina supersaturada.
La precipitación de las sales se inicia alrededor de partículas existentes previamente en la orina (detritus celulares, cilindros hialinos, otras especies cristalinas), que al ir aumentando de tamaño forman los embriones del cristal que, si siguen creciendo, formarán un núcleo estable. Todo este proceso se conoce con el nombre de nucleación heterogénea, que es la que normalmente ocurre en la orina. Hay 2 fenómenos íntimamente relacionados con la nucleación heterogénea. El primero de ellos es la nucleación secundaria, es decir, la formación de nuevos cristales sobre superficies preexistentes de su propia especie. El segundo fenómeno se conoce con el nombre de epitaxia, en donde material de un tipo de cristal precipita sobre la superficie de otro diferente. Así, por ejemplo, el urato sódico o el fosfato cálcico actuando como agentes nucleantes pueden hacer precipitar los cristales de oxalato cálcico. Un caso de epitaxia especial es el que ocurre con el ácido úrico y el urato sódico que promueven la deposición de oxalato cálcico sin epitaxia, es decir, en ausencia de partículas de urato (salting-out)41.
Crecimiento y agregación del cristalTras la nucleación, se producirá el crecimiento del cristal, que supone la incorporación gradual de las unidades que van a constituir el futuro cristal a lugares específicos del núcleo. En las soluciones supersaturadas como la orina, este proceso es favorable y se produce con gran facilidad. Una vez formados los cristales tiene lugar el proceso de agregación o unión de los cristales entre sí con la formación final de una masa sólida que, con el tiempo, se hace visible, es decir, se forma un cálculo41.
Retención del cristalLa formación de cristales ocurre en todas las personas. Una vez formados, atraviesan la vía urinaria en unos minutos y son eliminados sin dificultad. Para que sea posible la formación de un cálculo es necesario que se produzca la retención del cristal, para lo que el cristal debe adherirse a las células tubulares o epiteliales mediante un complejo proceso no entendido todavía en su totalidad y en donde van a desempeñar un papel
En la orina existe una serie de sustancias modificadoras de la cristalización, que se comportan como inhibidores o como promotores de la misma. Dentro de los inhibidores, unos van a actuar formando complejos solubles, como por ejemplo el citrato con el calcio (citrato cálcico) y el magnesio con el oxalato (oxalato magnésico), reduciendo de esta manera la supersaturación del oxalato cálcico (inhibidores de bajo peso molecular). Otros inhibidores actúan como adsorbentes en la superficie de los cristales previamente formados, alterando las propiedades físico-químicas y eléctricas de dichas superficies e inhibiendo la velocidad de crecimiento y de la agregación de los mismos (macromoléculas urinarias). Entre ellos, tenemos que mencionar a los pirofosfatos, glucosaminoglicanos, la nefrocalcina, la proteína de Tamm-Horsfall, la uropontina, FKBP-12, bikunin y litostatina12.
Por el contrario, las sustancias promotoras aumentan la supersaturación urinaria, como ocurre cuando existe una concentración anormalmente elevada de los metabolitos relacionados con la ERL (hipercalciuria, hiperuricosuria o hiperoxaluria). Otros promotores, como las mucoproteínas, los uromucoides, etc., favorecen la velocidad de crecimiento y de la agregación de los cristales al alterar las propiedades físico-químicas de los mismos. Las nanobacterias también han sido implicadas en la formación de algunos cálculos, ya que tienen la capacidad de producir carbonato de apatita en su pared celular y actuar como el nido en el proceso de formación del cálculo. Algunos autores han aislado nanobacterias en el 97% de los cálculos renales12,42.
Algunas sustancias pueden actuar como promotores en una fase de la litogénesis y como inhibidores en otra fase. Normalmente, existe un equilibrio entre los inhibidores y los promotores, y como consecuencia no se forman cálculos. Cuando este equilibrio se rompe, se inicia el proceso litógeno43,44.
La orina es una solución metaestable en donde el umbral de supersaturación por encima del cual comienza la cristalización de forma espontánea se denomina producto de formación y la línea que separa la fase de subsaturación de la supersaturada, producto de solubilidad. El intervalo que se encuentra entre el producto de formación y el producto de solubilidad se conoce con el nombre de zona metaestable de supersaturación, en donde a pesar de que la orina está supersaturada, debido al equilibrio existente entre los inhibidores y los promotores, no se forma la energía libre suficiente para que se produzca la cristalización espontánea (fig. 1A). Si por los motivos que sean se produce un predominio urinario de las sustancias inhibidoras, el producto de formación se eleva y la zona metaestable de supersaturación se hace más amplia, lo que equivale a decir que son necesarios valores más elevados de saturación urinaria para que se produzcan la cristalización y la formación de cálculos (fig. 1B). Por el contrario, si existe un predominio de los promotores el producto de formación desciende y la zona metaestable es menor o, lo que es lo mismo, son necesarios valores de saturación menores para que se produzca la cristalización y la formación de cálculos (fig. 1C)43,44.
Representación gráfica de la zona metaestable de supersaturación. A) Debido al equilibrio entre los inhibidores y los promotores urinarios, no existe riesgo de cristalización. B) Debido al predominio de los inhibidores, son necesarios niveles de supersaturación urinaria más elevados, para que aparezca la cristalización. C) Debido al predominio de los promotores, son necesarios niveles de supersaturación menos elevados para que aparezca la cristalización.
En resumen, la supersaturación urinaria es una condición necesaria para la formación de un cálculo, pero no suficiente. A un mismo nivel de saturación, si predominan los inhibidores hay menos riesgo de cristalización y de litiasis, y si predominan los promotores el riesgo sería mayor. Estudios recientes realizados en niños han demostrado que los pacientes litiásicos tienen valores de glucosaminoglicanos disminuidos cuando se comparan con pacientes hipercalciúricos sin litiasis y con niños normales45. Otros estudios han demostrado que la menor incidencia de litiasis de oxalato cálcico en la edad pediátrica podría ser atribuida, entre otros factores, a la existencia de un producto de formación urinario y unos valores urinarios de los inhibidores de bajo peso molecular (citrato, magnesio), más elevados en el niño que en el adulto. Se ha demostrado, además, que las macromoléculas urinarias (glucosaminoglicanos, nefrocalcina, etc.) tienen un efecto inhibidor de la agregación del oxalato cálcico y de la adhesión del cristal a las células tubulares, más potente en el niño que en el adulto, con lo que la formación del nido del cálculo se encuentra dificultada46,47.
Cálculo del estado de saturación de las distintas sales urinariasEn nuestra unidad, disponemos de un programa informático, el Programa Equil48, creado por Finlayson, que nos permite calcular el nivel de saturación de las distintas sales disueltas en la orina en los pacientes con litiasis, a partir del pH urinario y de la concentración en moles/l del Na, K, Ca, Mg, NH4, PO4, SO4, citrato, urato, Cl y tCO2. Teniendo en cuenta una serie de principios físico-químicos, como la concentración iónica libre, los coeficientes de actividad, la fuerza iónica, la formación de complejos libres, etc., se calculan el producto de actividad iónica y la supersaturación relativa de una sal de la orina. Se considera que si la saturación urinaria de una sal es inferior a 1 la orina está subsaturada de esa sal, si es igual a 1, saturada y si es superior a 1, supersaturada.
En este momento, se acepta que el grado de saturación urinaria, aunque a veces no discrimina adecuadamente a los pacientes litiásicos de los controles normales, es un índice de gran utilidad clínica para medir el riesgo de cristalización y, por tanto, el riesgo de recurrencia en un paciente determinado. También puede ser útil para predecir la composición del cálculo y la eficacia del tratamiento en estos pacientes17,18.
Existen otros métodos más sencillos, como el uso del Bonn Risk Index realizado en orina de 24h o en micción aislada, para evaluar el riesgo de formación de cálculos de oxalato cálcico, entre otros49.
Tipos de cálculos renales: mecanismos de formaciónLa composición de los cálculos normalmente es mixta predominando siempre alguno de sus componentes. Teniendo en cuenta todos los conceptos físico-químicos mencionados y sobre la base de los componentes mayoritarios de los cálculos, a su ubicación y a sus factores etiológicos los podemos clasificar en:
Cálculos infecciososOcupan el 12–15% de todos los cálculos en el niño. Son producidos por gérmenes productores de ureasa, como Proteus mirabilis,
La ureasa produce amonio y bicarbonato como consecuencia de la hidrólisis de la urea, lo que a su vez provoca un aumento del pH urinario. En un ambiente urinario alcalino, el bicarbonato se convierte en carbonato y el amonio se une a los iones de fosfato y magnesio formando cristales de estruvita. La masa cristalina formada junto con el detritus orgánico (residuos celulares, microorganismos, mucoproteínas, etc.), por simple sedimentación, se convertirá en cálculos.
Los gérmenes no productores de ureasa también son litogénicos, aunque en menor grado y, en ocasiones, la infección urinaria no es la causa sino la consecuencia, siendo la forma de presentación de la litiasis8,10,14. En más del 50% de los casos, los cálculos infecciosos se asocian a hipercalciuria12 y con bastante frecuencia a anomalías estructurales del tracto urinario.
Cálculos de oxalato cálcicoEn el 40–50% de los casos el cálculo de oxalato cálcico, que puede ser monohidrato o dihidrato. Los cálculos de oxalato cálcico monohidrato se dividen, a su vez, en papilares y no papilares, y suelen generarse en pacientes con excreción urinaria de calcio y oxalato normales50. Los dihidratos no son papilares.
Los monohidratos papilares son cálculos semiesféricos de 2–3mm de diámetro, con una superficie convexa y la otra cóncava, que es la que permanecerá unida a la papila renal. Inician su formación sobre la papila renal, en zonas donde las células uroepiteliales han sido lesionadas por el propio cristal. El detritus orgánico o las sales de fosfato (brucita e hidroxiapatita) a pH de orina superior a 6 actúan como inductor (nucleación heterogénea) de los cristales de oxalato cálcico, iniciando así el crecimiento del futuro cálculo. En esta situación, los inhibidores de la cristalización, como el citrato, el magnesio y el fitato, retardan o impiden la cristalización del oxalato cálcico. Si existe un déficit de inhibidores, estaría favorecida la formación de este tipo de cálculos (véase el apartado «Estudio físico-químico de la orina»)3.
La estructura interna de los cálculos de oxalato cálcico monohidrato no papilares es diferente de la de los papilares. Están compuestos por una zona central ocupada por el nucleante heterogéneo responsable de su formación, como detritus celulares, fosfato cálcico a pH alcalino y ácido úrico a pH acido (nucleación heterogénea). Sobre este corazón central crece oxalato cálcico monohidrato columnar que acaba constituyendo un cálculo de oxalato cálcico. Un déficit de los inhibidores desempeña también en este caso, un papel importante en la formación del calculo3,50.
Los cálculos de oxalato cálcico dihidrato suelen generarse en personas con hipercalciuria y/o hiperoxaluria y a valores de pH superiores a 6. Estos cálculos aparecen recluidos en cavidades de baja eficacia urodinámica. Las sales de fosfato cálcico actuando como agentes nucleantes heterogéneos favorecen la formación del cálculo. Presentan una estructura desordenada en la que los cristales de oxalato cálcico se superponen unos sobre otros3,50.
Cálculos de fosfato cálcicoRepresentan el 15% de todos los cálculos. La litiasis fosfática de brucita o de hidroxiapatita no es papilar y requiere la existencia de cavidades renales de baja eficacia urodinámica, combinada con valores de pH urinario de 6–7. Los microcristales que se van generando sedimentan alrededor de las paredes de las cavidades y, aunque el crecimiento es lento, pueden alcanzar grandes tamaños, creciendo paralelos unos a otros formando estructuras en empalizada3. Con frecuencia, en este tipo de cálculos existe déficit de inhibidores.
Cálculos de ácido úricoRepresentan el 2–4% de todos los casos de litiasis en el niño pero la incidencia y la prevalencia varían según el área geográfica, y llegan a ser muy elevadas en algunos países, como por ejemplo en Israel.
En la formación de cálculos de ácido úrico el factor determinante es la excreción elevada del mismo en orinas ácidas, ya que el ácido úrico es poco soluble en la orina acida. Existen otros factores necesarios para su formación como la existencia de cavidades renales con poca eficacia urodinámica que facilitarían la sedimentación y el crecimiento de los cristales y/o la disminución de inhibidores de la cristalización, como los glucosaminoglicanos y glicoproteínas. Es frecuente detectar cristales de oxalato cálcico entre los cristales de ácido úrico, confirmando así la capacidad de los cristales de ácido úrico para actuar como agente nucleante heterogéneo del oxalato cálcico. En los casos en que el pH de la orina sea mayor de 7, como por ejemplo ocurre en una ITU, el ácido úrico se encuentra en forma de urato amónico el cual puede llegar a estar supersaturado y precipitar, generándose así cálculos de urato amónico3.
Cálculos renales de cistinaLa cistina es un aminoácido muy poco soluble en la orina ácida. Una eliminación elevada de la misma asociada a un pH urinario ácido, como ocurre en la cistinuria clásica, da lugar a que su saturación urinaria ascienda, precipitando y formando cálculos. Este tipo de cálculos no suelen ser papilares y representan el 3% de todos los cálculos. Su formación obedece fundamentalmente a procesos combinados de sedimentación y crecimiento cristalino3.
Cálculos renales poco frecuentesLos producidos por la ingestión de algunos fármacos ya mencionados, los de carbonato cálcico, urato cálcico, los de 2,8-dihidroxiadenina, xantina, ácido orótico, litiasis del lactante inducida por leches en polvo contaminadas con melamina, etc.3.
En conclusión, a pesar de los grandes esfuerzos llevados a cabo en los últimos años para poder explicar por qué algunos niños producen cálculos urinarios y otros no, todavía hoy la patogenia de la ERL no está totalmente aclarada. Se trata de un proceso multifactorial en donde todos los datos obtenidos del paciente tienen que ser valorados de forma conjunta. En más de la mitad de los casos la litiasis es secundaria a alteraciones metabólicas; la más frecuente de ellas es la hipercalciuria idiopática. La segunda causa es la infección y/o las malformaciones urinarias, mientras que los defectos metabólicos enzimáticos hereditarios son poco frecuentes. El estudio de la saturación urinaria mediante el programa Equil puede ser de gran ayuda cuando se utiliza como índice de cristalización y de riesgo litógeno. A su vez, sirve para predecir la composición del cálculo y comprobar la eficacia del tratamiento establecido. El perfil de las anomalías metabólicas detectadas en el niño recuerda en gran medida a las detectadas en el adulto, lo que sugiere que la predisposición a la litiasis está presente desde la niñez. Si somos capaces de detectar de forma precoz todas estas anomalías, conseguiremos reducir la incidencia de la litiasis no solamente en el niño, sino también en la edad adulta.