Puntos clave
La varicela y el herpes zoster son 2 enfermedades producidas por el mismo virus, el virus de la varicela-zoster (VVZ). La varicela, la infección primaria por el VVZ, es una enfermedad exantemática de la infancia, aunque también afecta a adultos jóvenes, caracterizada por un exantema vesicular generalizado, con lesiones en diferentes estadios de evolución y resolución (costras), y a veces va acompañada de fiebre. Es una enfermedad muy contagiosa, que afecta al 90% de los individuos susceptibles cuando el virus se difunde en comunidades semicerradas, como guarderías o escuelas, y su período de incubación es de alrededor de 14 días. Es endémica en los países desarrollados, con ondas epidémicas cada 2–3 años, y su distribución es estacional, con predominio en los meses de marzo y abril. Los casos en preescolares y escolares suelen ser de carácter benigno. En cambio, cuando afecta a los recién nacidos y a los adultos es más grave, y en los pacientes inmunodeprimidos suele ser muy grave1,2.
El herpes zoster, la infección secundaria por el VVZ, afecta principalmente a los adultos mayores y a los pacientes inmunodeprimidos de cualquier edad. se caracteriza por una erupción vesicular unilateral dolorosa, localizada en el dermatoma inervado por las raíces sensoriales de los ganglios dorsales o craneales inflamados como consecuencia de la reactivación del virus, donde ha permanecido latente, desde la infección primaria. La infección latente se produce en la mayoría de las personas primoinfectadas por el virus, pero sólo el 15% desarrolla el herpes zoster en algún momento de su vida1,2.
La primera vacuna de virus vivos atenuados para prevenir la varicela (cepa OKA) fue desarrollada por Takahashi, en Japón, en 1974. Para atenuar el virus, llevó a cabo 11 pases en células HuEF a 34ºC, 12 en fibroblastos embrionarios de cobaya (GPEF) y 2 en células diploides humanas (WI-38). Posteriormente, el virus presentó 3 pases más en células diploides humanas MRC-5, para adaptarlo a estas células y a la preparación de la vacuna. una vez lavados los cultivos celulares y obtenida una solución libre de células, los títulos de unidades formadoras de placa (uFP) oscilan, por lo general, entre 1.500 y 5.0002.
El virus vacunal obtenido tiene menor patogenicidad en los niños, transmisibilidad y tendencia a producir herpes zoster que el virus salvaje. Además, a diferencia de éste, es ligeramente sensible a la temperatura de 39ºC y puede diferenciarse del virus salvaje mediante la amplificación por reacción en cadena de la polimerasa (PCR) de un fragmento adecuado del ácido desoxirribonucleico (ADN) y la comparación de los patrones de migración de los fragmentos de ADN escindidos por restricción por endonucleasas1.
La vacuna obtenida por Takahashi se registró, en Japón, en 1987 para uso exclusivo en pacientes inmunodeprimidos, y comercializada por el laboratorio japonés Biken. En 1988 se autorizó para uso en niños sanos en Japón y Corea del Sur. A partir de 1984, la vacuna de SmithKline (cepa OKARIT) de primera formulación (Vacuna antivaricela SKF®) se registró en varios países europeos, entre ellos España, para uso exclusivo en inmunodeprimidos. Esta vacuna contenía un mínimo de 1.995 UFP/dosis en la fecha de caducidad, siempre que se hubiera conservado de forma adecuada, –20ºC. En 1995, se reformuló para evitar la necesidad de congelarla y facilitar su uso en la población sana. Esta vacuna reformulada contiene como mínimo 1.995 UFP/dosis tras su caducidad cuando se almacena a temperaturas entre 2 y 8ºC, y ya se ha comercializado en muchos países para su uso en la población sana. En España está autorizada como una especialidad de "diagnóstico hospitalario" y sus indicaciones son: adolescentes y adultos sanos seronegativos de 13 o más años de edad, pacientes no inmunes de riesgo alto y sus contactos inmediatos susceptibles sanos.
La vacuna de Merck (cepa OKA/Merck) de primera formulación (Varivax®) se registró en Estados Unidos en 1995 para uso en niños a partir de los 12 meses de edad y en adultos sanos. Debía conservarse congelada a −20ºC, y en estas condiciones contenía un mínimo de 1.350 UFP tras su caducidad. Después, la vacuna se reformuló (Varivax II®) y se conservaba en nevera durante 3 meses. La vacuna actual (Varivax III®) se mantiene durante 18 meses entre 2 y 8ºC y contiene en el momento de su caducidad un mínimo de 1.350 UFP. En 2006 se comercializó en España para uso en la población infantil sana (a partir de los 12 meses de edad) y en adolescentes y adultos susceptibles.
Eficacia protectora de la vacunaEn el ensayo clínico controlado efectuado en Estados Unidos en niños sanos con la cepa OKA-Merck, con lotes que contenían dosis elevadas de inmunógeno (8.700 UFP/dosis), la eficacia protectora frente a cualquier forma clínica de varicela fue del 100% durante el primer año, y descendió al 97% el segundo año y al 95% el quinto1,3,4.
En un estudio efectuado en 1992 en niños sanos de Finlandia con la cepa OKA/SK-Bio, la eficacia a los 30 meses de los lotes con títulos elevados de inmunógeno (de 10.000-15.850 UFP/dosis) fue del 88%, aunque los casos registrados en los niños vacunados fueron leves, con presencia de un exantema papular o muy pocas vesículas y sin fiebre. En los vacunados con lotes de concentraciones bajas de inmunógeno (630–1.260 UFP), la eficacia protectora sobre cualquier forma clínica de la enfermedad fue menor (55%)3,5.
Efectividad de la vacunaciónPara continuar evaluando el valor protector de la vacuna frente a la enfermedad clínica, hay que realizar estudios epidemiológicos observacionales (cohortes y casos y controles). Estos estudios no miden la eficacia (valor protector en condiciones experimentales), sino la efectividad (protección en las condiciones usuales de aplicación de la vacuna).
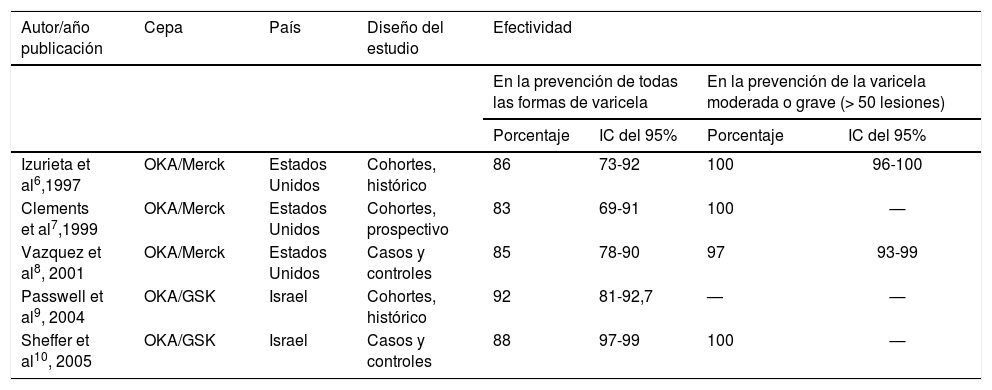
Los estudios observacionales de evaluación de la efectividad en Estados Unidos han proporcionado resultados muy prometedores y han demostrado que la vacuna es muy efectiva, sobre todo en la prevención de la varicela de intensidad moderada o grave6–12. En los estudios efectuados (tabla 1) se ha calculado la protección frente a todas las formas de varicela, incluidas las leves (< 50 lesiones) y frente a las formas moderadas o graves; la efectividad ha oscilado entre el 83 y el 95% y el 97 y el 100%, respectivamente6–10.
Efectividad de la vacuna de la varicela en Estados Unidos con la cepa OKA/Merck y en Israel con la cepa OKA/GSK después de su comercialización
| Autor/año publicación | Cepa | País | Diseño del estudio | Efectividad | |||
|---|---|---|---|---|---|---|---|
| En la prevención de todas las formas de varicela | En la prevención de la varicela moderada o grave (> 50 lesiones) | ||||||
| Porcentaje | IC del 95% | Porcentaje | IC del 95% | ||||
| Izurieta et al6,1997 | OKA/Merck | Estados Unidos | Cohortes, histórico | 86 | 73-92 | 100 | 96-100 |
| Clements et al7,1999 | OKA/Merck | Estados Unidos | Cohortes, prospectivo | 83 | 69-91 | 100 | — |
| Vazquez et al8, 2001 | OKA/Merck | Estados Unidos | Casos y controles | 85 | 78-90 | 97 | 93-99 |
| Passwell et al9, 2004 | OKA/GSK | Israel | Cohortes, histórico | 92 | 81-92,7 | — | — |
| Sheffer et al10, 2005 | OKA/GSK | Israel | Casos y controles | 88 | 97-99 | 100 | — |
IC: intervalo de confianza.
La mejor valoración del impacto de la vacunación de la varicela la proporciona el descenso espectacular en la incidencia de la enfermedad observado después de la introducción de la vacunación universal en Estados Unidos (1995)11 y Uruguay (1999)12.
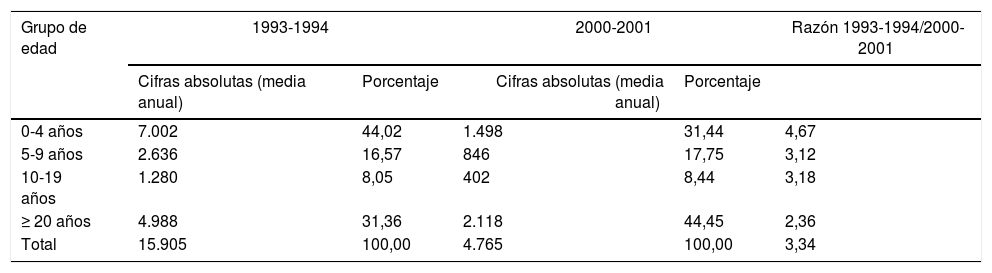
Los Centers for Disease Control and Prevention de Atlanta (Estados Unidos) han establecido un sistema de vigilancia activa mediante médicos centinela en los condados de Texas, California y Pensilvania11. En estos lugares, las coberturas vacunales alcanzadas en el año 2000 oscilaron entre el 73,6 y el 83,8% en los niños de 19–35 meses de edad, y la incidencia de varicela se redujo entre el 71 y el 84%. En estudios efectuados en organizaciones de mantenimiento de la salud se han obtenido resultados semejantes13,14. En todos los estudios el descenso de la incidencia se produjo en las cohortes de niños vacunados y de no vacunados y en los adultos, lo que indica que hay inmunidad de grupo11,13,15. También se ha producido un importante descenso en los ingresos hospitalarios con una tasa de incidencia estimada de hospitalización para todas las edades que descendió de 0,5/10.000 en 1993 a 0,1/10.000 en el año 2001 (tabla 2)16. Por último, también ha sido importante el impacto en la mortalidad por varicela. En Estados Unidos, en los últimos 10 años se ha reducido de 145 (1990–1994) a 57 (1999–2001) muertes anuales, con un descenso del 66%, y no sólo en los niños, sino también en los adultos, aunque en menor proporción y ello se ha debido a la vacunación universal de la población infantil17.
Ingresos hospitalarios por varicela en Estados Unidos según la edad, antes (1993–1994) y después (2000–2001) de la introducción de la vacunación16
| Grupo de edad | 1993-1994 | 2000-2001 | Razón 1993-1994/2000-2001 | ||
|---|---|---|---|---|---|
| Cifras absolutas (media anual) | Porcentaje | Cifras absolutas (media anual) | Porcentaje | ||
| 0-4 años | 7.002 | 44,02 | 1.498 | 31,44 | 4,67 |
| 5-9 años | 2.636 | 16,57 | 846 | 17,75 | 3,12 |
| 10-19 años | 1.280 | 8,05 | 402 | 8,44 | 3,18 |
| ≥ 20 años | 4.988 | 31,36 | 2.118 | 44,45 | 2,36 |
| Total | 15.905 | 100,00 | 4.765 | 100,00 | 3,34 |
En Uruguay, la introducción en 1999 de la vacunación masiva ha conseguido un descenso espectacular en la incidencia de la varicela. En ese país, la única vacuna utilizada ha sido Varilrix®, de GSK Biologicals. Se administró una dosis a los 12 meses de edad y las coberturas vacunales alcanzadas fueron muy elevadas, superiores al 90%12. La importante reducción observada en la incidencia de casos en los grupos de edad no vacunados indica que la vacunación universal proporciona un elevado grado de inmunidad de grupo18. También se ha observado una importante disminución del 73% en los ingresos hospitalarios por varicela durante el período 1997–2003 y en la incidencia de complicaciones neurológicas de esta enfermedad18,19. Debido a la densidad baja de población de Montevideo (1,5 millones de habitantes), no se ha detectado aún el descenso de la mortalidad por varicela que, sin duda, se ha producido tras la puesta en marcha de la vacunación universal.
Impacto de la vacunación universal infantil en la epidemiología de la infección por el virus varicela-zosterLa vacunación universal disminuye la circulación del virus en los niños. Como consecuencia, disminuye la incidencia de la enfermedad en los niños de los grupos de edad no vacunados, quienes tienen menos probabilidad de entrar en contacto con el virus que antes de la vacunación masiva. Lo mismo ocurre con los adultos infectados durante su infancia, que tendrán menos probabilidades de presentar reinfecciones que refuercen su inmunidad celular, que es fundamental para la prevención del herpes zoster. Estos argumentos se han utilizado para formular hipótesis que, si se probaran, irían en contra de la puesta en marcha de los programas de vacunación universal de la población infantil frente a la varicela.
Riesgo de desplazamiento de la varicela a la edad adultaPara algunos autores, al implantar los programas de vacunación frente a la varicela (1 dosis a los 12–15 meses), los niños que permanecieran no vacunados tendrían menos probabilidad de entrar en contacto con el virus durante la infancia que en la época prevacunal, lo que podría incrementar a medio y largo plazo la proporción de adolescentes y adultos jóvenes susceptibles a la enfermedad. Ello podría tener consecuencias negativas en el futuro, dado que en la edad adulta la enfermedad suele ser más grave y las complicaciones, más frecuentes1,20. En definitiva, habría riesgo de convertir una infección habitualmente benigna de los niños en una enfermedad grave de los adultos1,21. De todas formas, la mayoría de los expertos minimizan este hipotético efecto negativo de la vacunación universal22. La experiencia de otras vacunaciones y los resultados de varios modelos matemáticos hacen prever que el efecto neto a medio y largo plazo en el total de la población sería, con toda probabilidad, favorable a la vacunación, con una disminución clara de la incidencia de casos y complicaciones de la enfermedad, tanto en niños como en adultos23,24.
Riesgo de incremento de la incidencia de herpes zoster a largo plazoEn la actualidad, están en marcha estudios de vigilancia epidemiológica del herpes zoster en Estados Unidos, sin que hasta el momento se haya observado un incremento de la enfermedad, aunque probablemente todavía es pronto para que el fenómeno pudiese aparecer, pues sólo han transcurrido 10 años desde el inicio de la vacunación masiva25. sólo en un estudio efectuado en Massachusetts, se ha observado un cierto incremento de la incidencia de herpes zoster en la época posvacunal26. No obstante, un ensayo clínico controlado ha de mostrado la eficacia de una vacuna que contiene el VVZ atenuado en la prevención del herpes zoster y la neuralgia postherpética en las personas a partir de 60 años de edad27.
Otras indicaciones de la vacunaProfilaxis postexposiciónDatos de diferentes estudios indican que la vacuna contra la varicela es efectiva en la prevención o modificación de la gravedad de la enfermedad si se utiliza en los 3–5 días siguientes a la exposición28. El Advisory Committee on Immunization Practices (ACIP) recomienda el uso de la vacuna en personas susceptibles tras una exposición a la varicela.
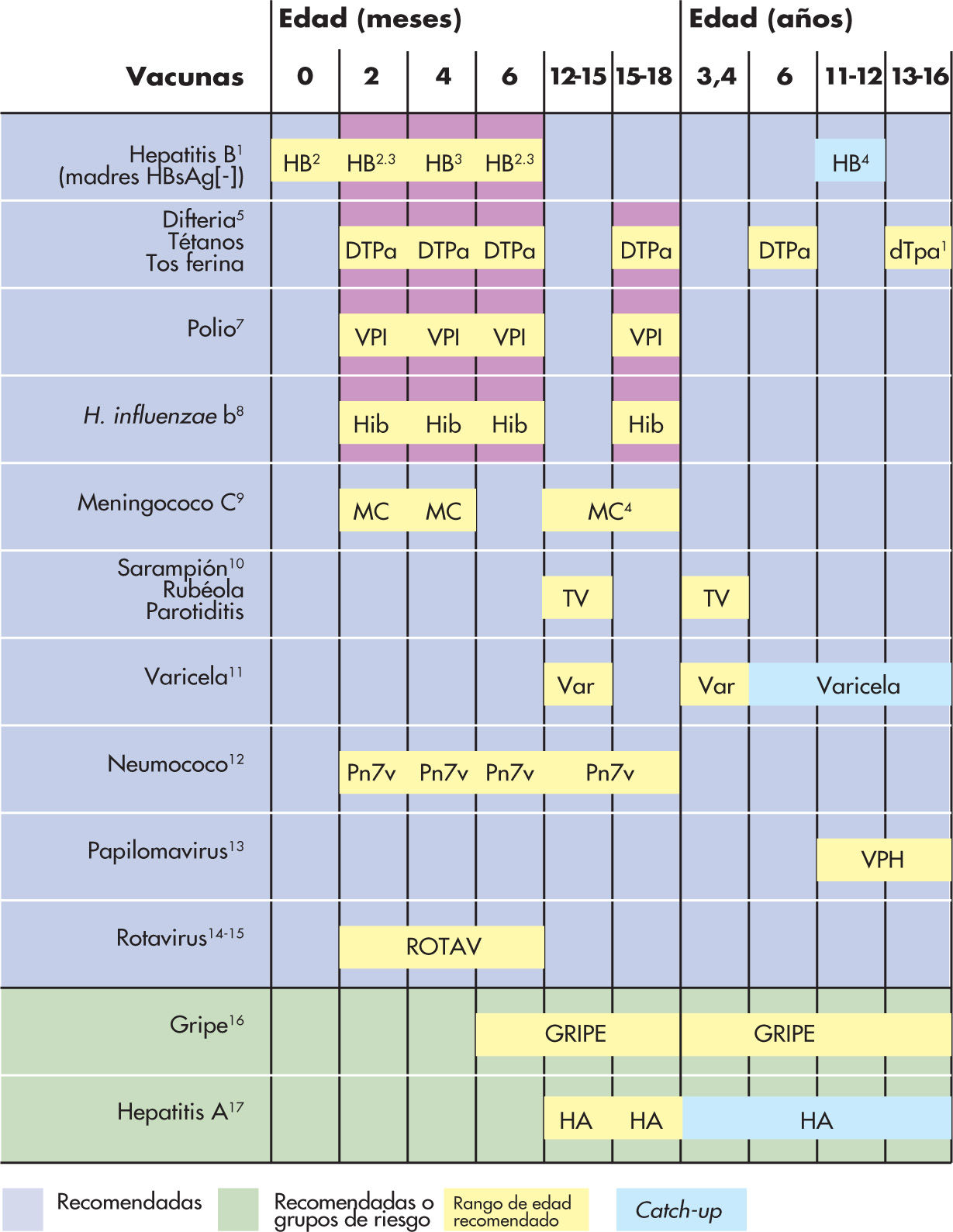
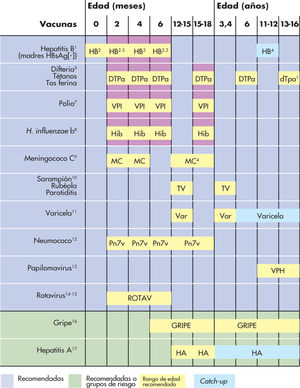
Nuevas estrategias en la vacunaciónUn hecho que preocupa en la vacunación de la varicela es la presentación de la enfermedad en un vacunado, la varicela breakthrough (o varicela modificada). Se trata de una forma clínica que aparece, al menos, 42 días después de la vacunación y que es más leve, con un número menor de lesiones (normalmente menos de 50), muchas de las cuales son maculopápulas en lugar de vesículas; la mayoría de pacientes no presenta fiebre y no se han observado complicaciones graves. Debido a estos fallos vacunales, parece necesaria una segunda dosis. Así, el ACIP recomienda, actualmente, una segunda dosis de vacuna de la varicela en los niños sanos de 12 meses a 12 años de edad. Esta modificación se incorporó en el calendario de la American Academy of Pediatrics de enero de 2007, a los 4–6 años de edad. El Comité Asesor de Vacunas de la Asociación Española de Pediatría ha propuesto esta pauta de 2 dosis en el calendario vacunal 2008, a los 12–15 meses y a los 3–4 años (fig. 1)29. A partir de esa edad, se deben vacunar con 2 dosis, separadas por un intervalo de 4–8 semanas, todos los niños y adolescentes susceptibles y que no hayan recibido aún la vacuna frente a la varicela.
Calendario vacunal de la Asociación Española de Pediatría 2008. Comité asesor de vacunas. Las explicaciones referentes a los superíndices se pueden encontrar en Bernaola et al29. HBsAg: antígeno de superficie de la hepatitis B.