Puntos clave
La creciente complejidad de los pacientes pediátricos atendidos en los hospitales hace necesario disponer de accesos vasculares tanto para la extracción de muestras analíticas, como para la administración de los tratamientos medicamentosos intravenosos y, al igual que en los cuidados intensivos, para la monitorización hemodinámica1,2. La utilización de los catéteres intravenosos no es inocua y conlleva riesgos, principalmente de origen infeccioso2,3.
La bacteriemia relacionada con el catéter (BRC) es la causa más frecuente de infección nosocomial en las unidades de cuidados intensivos pediátricas (UCIP) o neonatales4,5.
Los recién nacidos prematuros y con bajo peso son los más vulnerables y las tasas de incidencia aumentan según disminuye el peso5,6. La densidad de incidencia de BRC en las UCIP de EE.UU. es de 5,3 casos por 1.000 días de catéter central y en las neonatales de hasta 6,4 por cada 1.000 días de catéter central dependiendo del peso6. En nuestro medio (Multicéntrico SECIP, 2007) es 6,7/1.0007.
EtiologíaLos microorganismos causantes de BRC más frecuentes son los grampositivos (70% de los casos), y entre ellos destaca Staphylococcus coagulasa negativo (37,8%) y Enterococccus sp. (11,2%). Los bacilos aerobios gramnegativos (Enterobacter sp., Pseudomonas aeruginosa, Klebsiella pneumoniae y Escherichia coli) representan el 25%, y las levaduras (Candida sp.) en torno al 5%5,7,8.
PatogeniaLa infección relacionada con el catéter incluye 3 entidades: la colonización, la infección del punto de entrada y la BRC. Esta última es la entidad de mayor trascendencia, por la gravedad y el posible impacto sobre el pronóstico de los pacientes.
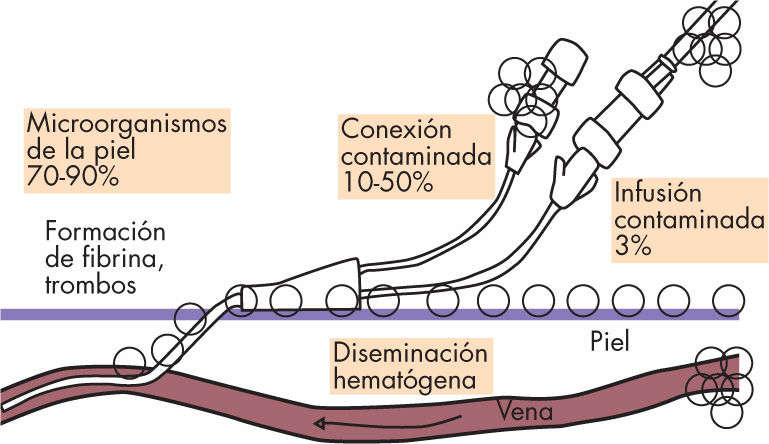
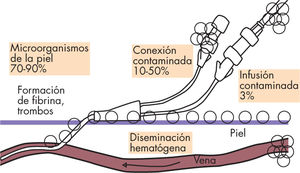
La colonización del catéter es el paso previo a la infección y a su complicación mayor que es la bacteriemia2,7,9. Ésta comienza precozmente, en las primeras 24h de la inserción del dispositivo (fig. 1). La vía de acceso de los microorganismos al catéter varía según los días de permanencia del mismo. La vía extraluminal es la más frecuente en los catéteres centrales de menos de 8 días de evolución. Se produce por el paso de microorganismos provenientes de la piel en el momento de inserción del catéter o posteriormente, colonizando la superficie externa a través del manguito de fibrina que se forma tras la inserción. La vía intraluminal afecta a los catéteres que superan los 8 días de permanencia, en general por la contaminación de las conexiones o menos frecuentemente por la contaminación del equipo o del líquido de infusión. La fuente más frecuente de los procesos bacteriémicos es siempre la endoluminal. Los catéteres también pueden colonizarse por siembra hematógena de otro foco séptico2,7.
Patogenia de la bacteriemia relacionada con el catéter. Modificada de Straumanis2.
Lectura rápida
Un número creciente de pacientes pediátricos precisan un acceso vascular seguro para la administración de tratamientos intravenosos, extracción de muestras analíticas, realización de técnicas terapéuticas invasivas como la monitorización hemodinámica, la hemodiálisis, la administración de nutrición parenteral, la asistencia de oxigenación con membrana extracorpórea, etc. Los niños son más susceptibles a las complicaciones infecciosas de los catéteres, y las tasas de bacteriemia relacionada con el catéter (BRC) aumentan con la menor edad y menor peso. La adherencia a las prácticas protocolizadas de inserción y mantenimiento de las vías centrales, la correcta higiene de manos, y la desinfección de la piel con clorhexidina al 2% han demostrado disminuir la incidencia de la BRC. La vigilancia epidemiológica de la infección relacionada con el catéter también se relaciona con un descenso de las tasas de infección y retroalimenta la adherencia a las prácticas protocolizadas de actuación.
La localización del catéter en pediatría, al no relacionarse con el riesgo de infección, debe basarse en la situación clínica y en las condiciones del paciente, eligiendo las de menor riesgo de complicaciones y de mayor facilidad de inserción.
La mayor parte de las BRC se producen en los catéteres venosos centrales de corta duración, definidos como los que tienen menos de 30 días de permanencia, no tunelizados. El riesgo es mayor en los catéteres venosos centrales multilumen7,10.
Entre los factores de riesgo que cuentan con evidencia científica en la literatura destacan los fallos en las medidas de asepsia tanto al insertar como al manipular el catéter; la duración de la canalización venosa; el material de fabricación de los catéteres, y son los de cloruro de polivinilo y polietileno los que tienen mayor riesgo frente a los de teflón o de poliuretano10. En cuanto a la localización, estudios en adultos han comprobado un mayor riesgo en la localización femoral que no ha sido corroborado en niños2,3. Otros han encontrado mayor riesgo en la administración de nutrición parenteral a través del catéter.
La asistencia de oxigenación por membrana extracorpórea supone un alto riesgo para el desarrollo de infecciones, sobre todo en pacientes cardíacos con tórax abierto, en los que está justificado el uso de profilaxis antibiótica5,11,12. El peso al nacer es también un factor de riesgo en los estudios de unidades neonatales, riesgo que aumenta al disminuir el peso3,5,13,14.
PrevenciónLas medidas educativas de formación continuada del personal sanitario para la prevención de BRC son muy eficaces para evitar las complicaciones infecciosas de los catéteres centrales y están recomendadas encarecidamente por numerosos estudios y guías de consenso que cuentan con evidencia científica4,10,15–17. La formación debe basarse en las recomendaciones que cuentan con evidencia científica en la prevención de la infección del catéter y deben adaptarse al medio de la unidad o del hospital donde se trabaja. Debe vigilarse la adherencia del personal formado a las recomendaciones y establecer un círculo de retroalimentación formativa4,15–17.
También cuentan con un alto grado de recomendación la vigilancia epidemiológica, estableciendo registros de datos de incidencia de BRC por personal experto (infectólogos, epidemiólogos, pediatras, intensivistas o enfermeros especializados en control de la infección nosocomial). Los resultados deben comunicarse al personal sanitario involucrado y a los responsables administrativos de la unidad como parte de las medidas educativas4,9,18,19.
Se han establecido una serie de recomendaciones de probada eficacia en la evidencia científica, tanto en la inserción como en el mantenimiento de los catéteres centrales, cuyo seguimiento apoyan con insistencia los diferentes organismos encargados del estudio y supervisión de las infecciones relacionadas con la asistencia sanitaria4,10,13,15,16,18.
Numerosas publicaciones han confirmado la disminución de las tasas de BRC si se siguen una serie de medidas protocolizadas cuyo cumplimiento se supervisa de forma que se impide su transgresión5,13,20–24. Estas estrategias deben adaptarse a cada unidad según sus características.
Existe una corriente de opinión científica que considera que la reducción de la BRC es una exigencia de la asistencia sanitaria de calidad. Estas iniciativas han propuesto las campañas de “bacteriemia cero” prioritarias en diversos sistemas de salud10,25.
Las medidas más eficaces, cuya adherencia se recomienda en la inserción y mantenimiento de los catéteres, para la prevención de la BRC, son las que se comentan a continuación10,13,15,16,20 (tabla 1).
Medidas preventivas en el manejo y cuidado de catéteres
| Técnica de inserción |
| Limpieza de la piel con clorhexidina al 2-5% o povidona yodada al 10% |
| Lavado de manos |
| Utilización de guantes y bata estériles, mascarilla y gorro Emplear apósitos y fijaciones estériles |
| Control posterior |
| Minimizar las desconexiones del sistema y hacerlo siempre con guantes y técnica aséptica Emplear el menor número de llaves de 3 pasos cuando sea posible, taponando los orificios no utilizados. Son de utilidad los dispositivos cerrados sin agujas en las conexiones. Siempre desinfectar antes con antiséptico para manipular |
| Si se precisa, pinchar el sistema de perfusión desinfectar previamente con antiséptico Aplicar antiséptico (clorhexidina al 2%), en el punto de entrada del catéter, cuando se cambien los apósitos |
| Cambiar los apósitos cada 48h los textiles y los plásticos semipermeables cada 7 días. Cambiar las líneas cada 72h (cada 24h si se trata de lípidos, y tras cada transfusión) No reemplazar o recanalizar las vías de forma rutinaria ni hacerlo a través de guía si se sospecha infección de la misma |
| Retirar las vías tan pronto como sea posible y siempre que aparezcan signos de flebitis (dureza, dolor a la palpación, enrojecimiento) |
Se debe realizar antisepsia cutánea de la zona de inserción y desinfección con clorhexidina al 2%. Es primordial asegurar una máxima adherencia a una técnica aséptica en la inserción incluyendo el uso de bata estéril, mascarilla, gorro, guantes y paños estériles. En este último punto es fundamental mantener una amplia cobertura estéril del campo de inserción. Si se precisa se debe usar, más que un paño, una sábana estéril. El lavado quirúrgico de las manos en la inserción debe ser cuidadoso. No se aconseja administrar profilaxis antibiótica sistémica tras la inserción del catéter.
Para la manipulación del catéter es necesaria la desinfección de las manos con soluciones alcohólicas. Se debe emplear una técnica aséptica durante la manipulación del catéter incluyendo la desinfección de los tapones con clorhexidina al 2% y el uso de guantes estériles. Hay que tener en cuenta que el uso de guantes no excluye la higiene de manos. Es importante minimizar las desconexiones del sistema y hacerlo siempre con guantes y técnica aséptica.
Se recomienda la utilización de apósitos estériles: gasas estériles o apósitos transparentes semipermeables preferentemente para la cura del punto de inserción. Los sistemas de cobertura impregnados en clorhexidina al 2% pueden ser de utilidad en los casos de alto riesgo de desarrollar episodios de BRC. No se recomienda utilizar sistemáticamente ungüentos y pomadas antimicrobianas en el punto de inserción. Es precisa la monitorización diaria sitio de inserción para valorar la presencia de signos de infección. Los apósitos deben sustituirse siempre que estén húmedos, sucios o sueltos; cada 48h los de material textil. Sin embargo, si se mantienen limpios, los apósitos estériles transparentes semipermeables pueden mantenerse 7 días. Se debe aplicar antiséptico (clorhexidina al 2%), en el punto de entrada del catéter, cuando se cambien los apósitos.
Se debe emplear el menor número de conexiones posibles y tapar las que no se utilicen. Cuando sea imprescindible emplear llaves de 3 pasos, se taponarán los orificios no utilizados.
Siempre que se manipulen los puntos de acceso se deben desinfectar antes con antiséptico. Pueden ser de utilidad los dispositivos cerrados sin agujas en las conexiones. Los dispositivos de inyección y extracción sin aguja pueden disminuir la incidencia de infección. Deben seguirse las recomendaciones del fabricante y desinfectarse bien con clorhexidina al 2% preferentemente antes de manipularse o bien con povidona yodada si existe incompatibilidad con el material del dispositivo. La higiene de manos y el uso de guantes estériles son imprescindibles para su manipulación.
Se recomienda cambiar los sistemas de administración intravenosa cada 72 a 96h excepto si se trata de infusión de hemoderivados o de lípidos, en cuyo caso se deben cambiar cada 24h.
No se requiere reemplazar o recanalizar las vías de forma rutinaria y está contraindicado hacerlo a través de guía si se sospecha infección de la misma.
El riesgo de infección aumenta con la permanencia del catéter por lo que valorar diariamente la posibilidad de prescindir del catéter y retirar las vías tan pronto como sea posible es una buena medida, así como siempre que aparezcan signos de flebitis (dureza, dolor a la palpación, enrojecimiento).
Lectura rápida
El diagnóstico de sospecha de la BRC no exige de entrada la retirada del catéter. Si el paciente se mantiene estable, tanto los estudios microbiológicos de BRC sin retirada del mismo, como los hemocultivos pareados diferenciales cuantitativos o de tiempo (obtenidos por extracción a través de las luces del catéter y por punción de una vena periférica) son sensibles y específicos. Si confirman la BRC debe retirarse el catéter y enviar a cultivar la punta del mismo.
EtiologíaLos microorganismos responsables de la BRC más frecuentes son los grampositivos, sobre todo Staphylococcus coagulasa negativo, los gramnegativos y Candida sp. La vía de infección más común es el paso de los microorganismos de la piel a través de la pared externa del catéter al torrente sanguíneo. También pueden contaminarse las conexiones del catéter.
En general no se recomienda la sustitución del catéter infectado por otro a través de guía metálica. Los catéteres deben retirarse tan pronto como no resulten imprescindibles.
Generalmente es poco específica y la fiebre es el síntoma más frecuente. También se puede acompañar de signos de inflamación local, eritema, induración o pus en el punto de inserción, o mal funcionamiento del catéter. En ocasiones las manifestaciones revisten mayor gravedad, pudiendo causar sepsis2,3,7,9.
DiagnósticoLa sospecha clínica es insuficiente para el diagnóstico porque es poco sensible y específica por lo que se requiere una confirmación bacteriológica4,7,9,13,26,27 (tabla 2).
Definiciones de colonización, infección y bacteriemia relacionadas con el a catéter
| Situación | Criterios diagnósticos |
|---|---|
| Colonización del catéter | Presencia de 1–14 UFC en cultivo semicuantitativo de la punta de catéter (superficie externa) en ausencia de signos de infección local o general |
| Infección relacionada con el catéter posible | Presencia de 15 o más UFC en cultivo semicuantitativo o más de 1.000 UFC en cultivo cuantitativo de la punta de catéter que es la responsable de una infección local (pus en el punto de inserción, infección cutánea o subcutánea, celulitis, trombosis venosa o tromboflebitis) o de una infección general (fiebre, leucocitosis y síndrome séptico con o sin shock). Todos estos signos pueden asociarse o no a un hemocultivo positivo. Puede existir un hemocultivo positivo sin asociarse a estos signos. Ninguna otra fuente de infección |
| Bacteriemia/fungemia relacionada con el catéter | Al menos un hemocultivo positivo de vena periférica y uno de: presencia de 15 o más UFC en cultivo semicuantitativo de la punta de catéter del mismo microorganismo Crecimiento cuantitativo de hemocultivos simultáneo con un ratio > 3:1 CVC frente a periférico o tiempo diferencial para la positividad > 2h entre CVC y periférico para igual microorganismo. Pus en lugar de inserción cultivando igual microorganismo |
| Bacteriemia/fungemia asociada a líquido de perfusión contaminado | Aislamiento del mismo microorganismo en los cultivos del líquido de infusión, en los hemocultivos extraídos por vena periférica, en la luz interna de la conexión y en la punta del catéter |
| Bacteriemia/fungemia por siembra hematógena de un foco séptico distante | Aislamiento del mismo microorganismo en el hemocultivo, en el foco séptico y en el extremo distal del catéter |
CVC: catéter venoso central; UFC: unidades formadoras de colonias.
Los criterios diagnósticos difieren si son desde el punto de vista clínico o desde el punto de vista de vigilancia epidemiológica. El criterio clínico exige el aislamiento del mismo microorganismo en el catéter, con los diferentes métodos de cultivo aceptados (de la punta, diferenciales cuantitativos o de tiempo) y en sangre periférica. Los criterios válidos para la vigilancia exigen un hemocultivo positivo y unas manifestaciones clínicas indicativas de infección sin otro foco responsable4,26,27.
El diagnóstico de certeza7,27 se establece cuando se aísla el mismo microorganismo en el hemocultivo obtenido por vía periférica y en el catéter retirado. En este último se debe obtener un crecimiento de más 15 unidades formadoras de colonias (UFC) en el cultivo semicuantitativo tras el rodamiento de 5cm de segmento distal del catéter en placa (técnica de Maki), o bien un crecimiento mayor de 102 UFC obtenido del cultivo cuantitativo del caldo de enriquecimiento (con técnica de sonicación) del catéter.
Existen otras técnicas de diagnóstico que no exigen la retirada del catéter. En caso de no retirar el catéter, el diagnóstico se establece mediante:
- —
Hemocultivos diferenciales cuantitativos: se extrae sangre a través de todas las luces del catéter y de una vena periférica. Si se aísla el mismo microorganismo y el recuento de UFC es 3 veces mayor en la sangre obtenida del catéter que en la de vena periférica, se establece el diagnóstico de BRC.
- —
Hemocultivos diferenciales de tiempo: se extrae sangre a través de todas las luces del catéter y de una vena periférica. Si se aísla el mismo microorganismo y el tiempo de crecimiento se anticipa en 2h en la sangre extraída del catéter con respecto a la de la vía periférica, se establece el diagnóstico de BRC.
Lectura rápida
El tratamiento empírico de la BRC debe iniciarse precozmente al sospechar la infección y posteriormente ajustarse a los aislamientos obtenidos. Inicialmente se intentará una cobertura amplia que aborde grampositivos incluido S. aureus resistente a meticilina (vancomicina o teicoplanina) y gramnegativos (aminoglucósido, cefalosporina antipseudomonas, o bien un carbapenem). En casos especiales y en situaciones de alto riesgo de infección por Candida spp. (pacientes previamente colonizados o inmunodeprimidos) se recomienda añadir una equinocandina o fluconazol, según el perfil de sensibilidad de los aislamientos de la unidad. En casos seleccionados puede intentarse el tratamiento de la BRC conservando el catéter, sobre todo en los catéteres permanentes en los que la situación clínica del paciente desaconseje otra canalización o sea muy difícil obtener otro acceso intravascular. La antibioterapia empírica sistémica se debe iniciar por otro acceso vascular y establecer una terapia de sellado del catéter con antibióticos. El tratamiento de sellado debe asociarse al tratamiento sistémico siempre, y ambos deben mantenerse durante 7 a 14 días.
La antibioterapia sistémica se iniciará de forma empírica siempre que exista sepsis, shock, fallo multiorgánico, signos locales de infección supurada, neutropenia u otra inmunosupresión grave7,27.
El tratamiento antibiótico empírico depende del tiempo que lleva insertado el catéter, de si el paciente recibe o no nutrición parenteral y de los aislamientos microbiológicos de cada unidad. En principio debe cubrir cocos grampositivos, incluyendo S. aureus resistente a meticilina, por lo que se recomienda utilizar vancomicina o teicoplanina. También debe ampliarse el espectro antimicrobiano a los bacilos gramnegativos, incluida Pseudomonas aeruginosa, por lo que se puede emplear un aminoglucósido, una penicilina o cefalosporina antipseudomonas, o bien un carbapenémico. En casos seleccionados y en situaciones de alto riesgo de infección por Candida spp. (pacientes previamente colonizados o inmunodeprimidos) se recomienda añadir equinocandina o fluconazol, según el perfil de sensibilidad de los aislamientos de la unidad.
Cuando se reciban los resultados microbiológicos se debe realizar un tratamiento etiológico, ajustando el tratamiento al antimicrobiano de menor espectro y más específico para el microorganismo aislado. La duración del tratamiento varía según el microorganismo causante y si se retira o no el catéter. En general se considera el primer día, en cuanto a la duración del tratamiento, el día del primer hemocultivo negativo obtenido.
En el caso de la BRC no complicada por Staphylococcus coagulasa negativo, se recomienda prolongar el tratamiento entre 5 y 7 días si se retira el catéter y entre 10 y 14 días si no se retira y se combina con la técnica de sellado con antibióticos. Alternativamente puede no tratarse en el caso de que se retire el catéter, los cultivos posteriores sean negativos en ausencia de tratamiento antibiótico, el paciente no sea portador de ningún dispositivo intravascular o protésico y la evolución clínica confirme la ausencia de infección27,29.
En el caso de la BRC por S. aureus debe tratarse durante 4 a 6 semanas y el catéter debe ser retirado. Debe confirmarse la negatividad de los cultivos 72h después de iniciado el tratamiento y debe investigarse la ausencia de endocarditis o tromboflebitis con ecografía27.
En casos seleccionados, en pacientes con bajo riesgo de diseminación hematógena (los que no tienen enfermedad de base ni inmunodeficiencias, habiéndose retirado el catéter y que tras 72h de tratamiento los hemocultivos son negativos) se podría considerar una menor duración del tratamiento antibiótico, un mínimo de 2 semanas, siempre y cuando se intensifique la evaluación de las complicaciones metastásicos de la BRC, incluida la ecografía transesofágica para descartar una endocarditis27.
En la BRC no complicada por Enterococcus sp. se recomiendan de 7 a 14 días de tratamiento, tanto si se retira el catéter como si se conserva y se instaura sellado con antibiótico27.
En la BRC por microorganismos gramnegativos debe tratarse de 7 a 14 días. Si el microorganismo es multirresistente se han de combinar 2 antibióticos de clases diferentes en la terapia inicial “desescalando” posteriormente. Por lo general se recomienda retirar el catéter y realizar un estudio de diseminación metastásica27.
Si el aislamiento es de Candida sp., debe tratarse durante 14 días después del primer hemocultivo negativo y se recomienda la retirada del catéter y el estudio de extensión de la candidemia27,30.
Estas recomendaciones se aplicarán siempre y cuando no haya complicaciones, se obtenga una buena respuesta inicial y en ausencia de cardiopatía valvular o material protésico. Si la bacteriemia se mantiene tras la retirada del catéter y el tratamiento antibiótico adecuado, debe investigarse la presencia de endocarditis o trombosis séptica y prolongar el tratamiento durante 4–6 semanas.
Las recomendaciones de retirada y cambio de catéter27 en la BRC son las siguientes:
- —
Facilidad de sustitución.
- —
Persistencia de la bacteriemia tras 48h de tratamiento antimicrobiano correcto.
- —
Presencia de infección en el túnel subcutáneo.
- —
Causa embolias y/o endocarditis o se trata de un paciente cardiópata.
- —
Los causantes de la BRC son microorganismos difíciles de erradicar sin su retirada y/o con alto índice de recidivas: levaduras, S. aureus, Bacillus sp., Corynebacterium jeikeium, Pseudomonas spp. y Stenotrophomonas spp.
- —
No se recomienda sustituir el catéter por otro en la misma localización mediante guía metálica10,15,16,27.
Lectura rápida
La utilización de catéteres venosos centrales en los pacientes pediátricos representa un reto a la asistencia sanitaria. Su uso conlleva riesgos y, entre ellos, los infecciosos aumentan la morbimortalidad, la estancia hospitalaria y los gastos derivados. Sin embargo, numerosos estudios que cuentan con evidencia científica demuestran que las tasas de infección y de BRC pueden disminuirse de manera significativa con el empleo de protocolos de actuación sistemáticos. La disminución de las tasas de infección relacionadas con los catéteres es una exigencia para una atención sanitaria de calidad.
Se debe intentar un tratamiento conservador sin retirada del catéter permanente en los casos en que la situación clínica del paciente desaconseje otra canalización o sea muy difícil obtener otro acceso intravascular. Se debe iniciar la antibioterapia empírica sistémica por otro acceso vascular y establecer una terapia de sellado del catéter con antibióticos. Sólo cuando es imposible otro acceso vascular, y de no ser posible el sellado del catéter, se administrará el antibiótico por el catéter colonizado7,27.
El tratamiento de sellado del catéter con antibióticos está indicado en los catéteres de larga duración que precisan ser conservados por las condiciones clínicas del paciente, siempre y cuando no se observen signos de supuración de la puerta de entrada o del túnel cutáneo. El tratamiento de sellado debe asociarse al tratamiento sistémico siempre, y ambos deben mantenerse entre 7 y 14 días.
En el caso de que se obtengan múltiples aislamientos positivos en la sangre extraída del catéter de Staphylococcus coagulasa negativo o de bacilos gramnegativos y los hemocultivos de sangre periférica extraídos al mismo tiempo sean negativos, se considera que se trata de una colonización intraluminal del catéter que se puede tratar con técnica de sellado de 10 a 14 días sin antibioterapia sistémica, porque el riesgo de BRC es alto si se mantiene el catéter27.
La técnica del sellado de antibióticos de los catéteres pretende erradicar la infección intraluminal del catéter que es la que ocurre en los catéteres de larga duración. Se administran concentraciones supraterapéuticas de antibióticos que se mantienen intraluminales durante el tiempo de sellado. La solución antibiótica de sellado se mezcla con heparina o con suero fisiológico en el volumen necesario para rellenar el catéter y generalmente se cambia cada 24–48h durante 2 semanas. La eficacia de esta técnica para conservar el catéter se sitúa en torno al 70% según los diferentes estudios. Las infecciones por S. aureus y por Candida sp. tienen menor respuesta positiva.
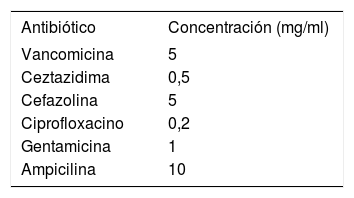
Se debe emplear un antibiótico eficaz para erradicar el microorganismo involucrado. Las concentraciones recomendadas de los antibióticos más utilizados para la solución de sellado se expresan en la tabla 3.
El volumen de sellado varía según el tipo de catéter y debe comprobarse en las especificaciones técnicas que le acompañan. En general, para un catéter tipo Hickman se precisan 2ml y 5 en catéter con reservorio tipo port-a-cath.
Cada 2–3 días se deben realizar hemocultivos de control y se debe vigilar estrechamente al paciente para diagnosticar las complicaciones de la BRC.
Se debe retirar el catéter si persiste la fiebre tras 3 días de antibioterapia y sellado, si reaparece la fiebre a los 3 días de finalizado el tratamiento sistémico y el sellado, si persisten los hemocultivos positivos al mismo agente causal, o aparecen complicaciones (tromboflebitis supurada o endocarditis). El catéter retirado debe enviarse para cultivo.
La utilización de catéteres venosos centrales en los pacientes pediátricos ha supuesto un gran avance asistencial en la pediatría. Como todas las actuaciones terapéuticas, su uso conlleva riesgos y, entre ellos, los infecciosos son los más frecuentes. Las infecciones relacionadas con los dispositivos intravasculares y la BRC aumentan la morbimortalidad, la estancia hospitalaria y los gastos derivados de ésta. Sin embargo, estudios con evidencia científica demuestran que las tasas de infección y de BRC pueden disminuirse significativamente con el empleo de protocolos de actuación sistemáticos. La utilización de estas pautas debe ser prioritaria en las unidades pediátricas que emplean catéteres vasculares y la disminución de las tasas de infección una exigencia y un reto para la asistencia sanitaria de calidad4,17,18.