- •
La mayoría de los niños infectados por Helicobater pylori (Hp) tienen una gastritis. El ulcus es poco frecuente en la infancia.
- •
No hay síntomas específicos de la infección por Hp. El 50% de los niños están asintomáticos.
- •
No hay evidencia de asociación entre el dolor abdominal recurrente y la infección por Hp, ni está indicado investigarla en niños con criterios de dolor abdominal funcional.
- •
La prueba de oro del diagnóstico consiste en la positividad de 2 tests invasivos. El test del aliento con urea 13C (TAU 13C) y la detección de antígeno en heces son útiles para el diagnóstico y el control postratamiento. Ninguno de las pruebas no invasivas diagnostica la enfermedad gastroduodenal.
- •
La indicación de tratar a los pacientes con ulcus y a los familiares de primer grado con cáncer gástrico es clara. El médico valorará en cada caso, junto con la familia, el tratamiento de los niños con gastritis.
- •
El incremento de las resistencias del Hp a antibióticos, especialmente a claritromicina, dificulta su erradicación. El tratamiento clásico es la triple terapia con un inhibidor de la bomba de protones o subcitrato de bismuto + amoxicilina + metronidazol o claritromicina. La terapia secuencial es una alternativa.
El manejo de la infección por Helicobacter pylori (Hp) en los niños constituye un dilema en la práctica diaria. La primera preocupación es saber en qué pacientes debemos investigar la infección y, en este sentido, cabe recordar la pobre relación de ésta con la sintomatología, y en concreto, con el dolor abdominal recurrente, por lo que debemos evitar emprender el diagnóstico de la infección por Hp en aquellos niños que presenten un dolor abdominal de características funcionales. Otro de los principales debates es el papel de las pruebas no invasivas en el diagnóstico de la infección y si alguna de ellas puede sustituir a la endoscopia. Actualmente, uno de los principales problemas prácticos en el manejo de la infección por Hp es su dificultad de tratamiento debido al incremento de las resistencias del germen a los antibióticos.
Epidemiología y transmisiónLa prevalencia de la infección es baja en los países industrializados y alta en países pobres o en vías de desarrollo, o en las comunidades de inmigrantes y medios económicamente menos favorecidos de los países ricos. Se estima que la prevalencia actual de la infección en los niños europeos varía entre el 5 y el 15%1. Mientras que la prevalencia en Europa y Estados Unidos disminuye de modo importante2, en África, Asia y América Central y del Sur sigue siendo alta, aunque también en algunas comunidades de países en vías de desarrollo la prevalencia está declinando rápidamente3.
En la población infantil de la península ibérica, la prevalencia es mayor que en la del centro y norte de Europa. Se considera que en niños en edad escolar en España la prevalencia está en torno al 20%4. Los datos epidemiológicos portugueses más recientes revelan una prevalencia global de la infección por Hp del 31,6% en niños asintomáticos del área urbana de Lisboa, siendo la incidencia anual del 11,6%. La media de edad de adquisición de la infección es 6,5 años, confirmando así que la infección se adquiere en la infancia precoz. La prevalencia se incrementa con la edad, llegando al 51% entre los 11 y los 15 años de edad5. La prevalencia de la infección es mayor en los medios más pobres y desfavorecidos, en franca relación con el hacinamiento y la falta de higiene. Una de las teorías más aceptadas respecto del modo de transmisión de la infección es la de la transmisión directa de persona a persona, vía oro-oral o feco-oral, evidencia basada en el cultivo de la bacteria en heces6 y en la detección del ADN del Hp en la placa dental7.
Probablemente, la forma más frecuente de transmisión de la infección sea la intrafamiliar, sobre todo la transmisión entre hermanos y de padres a hijos, siendo especialmente importante el papel de las madres en la transmisión de la infección, especialmente durante el primer año de vida, y posteriormente, el papel de los hermanos mayores8.
La relación entre lactancia materna e infección por Hp es contradictoria, ya que frente a estudios que destacan el papel protector de la leche materna9, hay otros que muestran una mayor prevalencia de la infección en niños lactados con leche materna, comparados con otros que recibieron lactancia artificial10.También se ha relacionado la infección por Hp con el contacto con algunos animales de compañía y con la ingesta de agua de fuentes no controladas.
PatogeniaEl Hp ejerce su acción patógena uniéndose a las células epiteliales gástricas mediante una cierta cantidad de adhesinas (HpaA, BabA, OipA, SabA) y utiliza la ureasa para disminuir el pH de la capa mucosa gástrica y crear un medio adecuado a su propia supervivencia. La apoptosis celular la realiza, sobre todo, por la acción de una citotoxina vacuolizante VacA, codificada por el gen vacA, y una proteína citotóxica, CagA, codificada por el gen cagA, genes ambos que se consideran los factores de virulencia más importantes del Hp y determinantes de que la infección progrese a las gastritis crónica activa, o a la úlcera péptica y/o al cáncer gástrico. Los genotipos del vacA y cagA del Hp son los más frecuentes, tanto en niños como en adultos con úlcera péptica11, aunque su prevalencia aumenta con la edad y también varía según el área geográfica12. Un reciente estudio realizado en cepas de Hp procedentes de niños encuentra una asociación entre el gen jhp0562 y la enfermedad ulcerosa péptica, y muestra que los factores de virulencia como cagA, vacAs1, babA, oipA, homB y hopQ1 están asociados al gen jhp0562. Este gen codifica la proteína de membrana celular glucosiltranferasa, esencial para la supervivencia del Hp13.
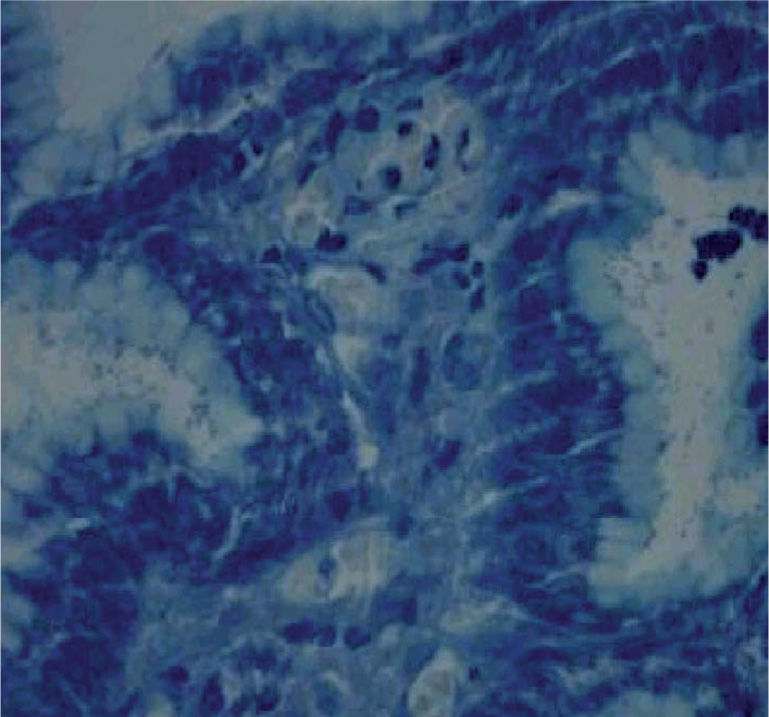
Respuesta inflamatoria. Enfermedad gastroduodenalLa colonización permanente de la mucosa gastroduodenal por Hp va a causar una inflamación con un infiltrado mixto en el que predominan los polinucleares, pero también linfocitos y células plasmáticas. Una de las características de este infiltrado en la edad pediátrica y en la adolescencia es que el predominio de linfocitos y células plasmáticas es mayor que en los adultos, aunque la afectación de la mucosa es, en general, más leve que en la edad adulta. El hallazgo histológico más frecuente en los niños es el de una gastritis crónica superficial activa.
El ulcus gastroduodenal relacionado con la infección por Hp es menos frecuente en los niños que en los adultos, y en la edad pediátrica es más frecuente en los niños más mayores, en torno a la adolescencia, y en las comunidades en las que la infección es más prevalente o en las infectadas por cepas más virulentas11. La infección por Hp es la causa más frecuente de ulcus duodenal primario en niños; sin embargo; su prevalencia está declinando14. En un reciente trabajo prospectivo, multicéntrico, europeo, que incluye a cerca de 700 niños a los que a lo largo de un mes se les hizo una endoscopia, se encontró una frecuencia del 8,5% de úlceras y/o erosiones gastroduodenales, de las que sólo el 27% estaba en relación con la infección por Hp15.
En el niño, también se han descrito la gastritis atrófica y la metaplasia intestinal, lesiones ambas relacionadas como factores de riesgo para el posterior desarrollo del cáncer gástrico y que pueden estar presentes durante muchos años antes de la aparición de la displasia y de la malignidad. El linfoma MALT de bajo grado de malignidad asociado a la gastritis crónica por Hp, aunque con muy poca frecuencia, ha sido también descrito en niños y adolescentes, pero no se han referido casos de carcinoma gástrico relacionado con la infección por Hp en la infancia16.
ClínicaManifestaciones digestivasNo hay síntomas específicos de la infección por Hp. Uno de los aspectos más interesantes de la clínica de la infección por Hp en la edad pediátrica es la ausencia de síntomas en muchos de los niños y adolescentes infectados17. Los pacientes con ulcus, sobre todo los niños mayores, manifiestan una sintomatología compatible con lo que se denomina dispepsia ulcerosa. En ausencia de úlcera gastroduodenal, el 50% de los niños que presentan una gastritis por Hp están asintomáticos, y la otra mitad presenta síntomas compatibles con lo que se llama dispepsia no ulcerosa, que se interpreta con dificultad, y que puede incluir síntomas vagos, como dolor abdominal o molestias en el hemiabdomen superior, náuseas y/o vómitos, sensación de plenitud, ruidos hidroaéreos, en suma, un cuadro difícilmente diferenciable de la dispepsia funcional sin base orgánica o relacionada con dismotilidad18.
La mayor parte de los estudios indican una falta de evidencia de relación causal entre el dolor abdominal crónico de los niños y la infección por Hp. Durante mucho tiempo, se asoció el dolor abdominal recurrente con
Lectura rápida
El manejo de la infección por Helicobacter pylori (Hp) es siempre controvertido.
La prevalencia de la infección es mayor en los países pobres en relación con la falta de higiene. En Norteamérica y Europa la prevalencia está disminuyendo de manera importante. La infección se adquiere antes de los 5–6 años y la prevalencia aumenta con la edad.
La teoría más aceptada de la transmisión de la infección es la de persona-persona, vía oro-oral o feco-oral. Es importante el papel de las madres en la transmisión de la infección en el primer año de edad y el de los hermanos mayores en edades posteriores.
Los genotipos vacA y cagA del Hp son los más importantes factores de virulencia del germen y los más frecuentes en el ulcus.
Lectura rápida
La colonización permanente de la mucosa gástrica por el Hp causa una inflamación con un infiltrado mixto con predominio de neutrófilos pero también linfocitos y células plasmáticas, dando lugar a una gastritis crónica superficial activa, característica en la edad pediátrica. El ulcus péptico es menos frecuente en niños que en adultos y en la edad pediátrica se diagnostica en torno a la adolescencia. La atrofia gástrica y la metaplasia intestinal, factores de riesgo para el desarrollo del cáncer, y el linfoma MALT de bajo grado de malignidad han sido descritos en niños, pero no se conocen casos de carcinoma gástrico.
Diversos estudios han demostrado que puede haber una asociación entre la infección por Hp y la anemia ferropénica refractaria al tratamiento, pero el tema sigue siendo controvertido. No está claro cuál es el mecanismo por el cual el Hp podría producir una ferropenia, si se trata de pérdidas hemáticas por el tubo digestivo o de una disminución de la absorción duodenal del hierro por la hipoacidez y el bajo nivel de ácido ascórbico de estos niños, secundaria a la gastritis. Se ha sugerido que lo que probablemente ocurra es un secuestro del hierro en el antro por parte de los receptores de la bacteria, que son capaces de capturarlo y usarlo para su crecimiento, o bien un secuestro por la lactoferrina, cuyos valores en la mucosa gástrica de los pacientes infectados están elevados. Tanto la infección por Hp como la anemia ferropénica se asocian con frecuencia en medios socioeconómicos pobres, especialmente en escolares y adolescentes, pero no es fácil encontrar una relación causal entre ambas entidades. A pesar de lo contradictorio del tema, las guías recientemente publicadas por la ESPGHAN-NASPGHAN aconsejan considerar el diagnóstico de la infección por Hp en niños con anemia ferropénica una vez descartadas otras causas25.
Retraso de tallaTanto hace una década como en la actualidad, diversos estudios longitudinales avalan la hipótesis de que la infección por Hp puede afectar al crecimiento de los niños infectados26,27, pero estudios prospectivos bien diseñados no han encontrado una evidencia clara del papel del Hp en el retraso de la talla, relacionándolo más bien con factores socioeconómicos y la hiponutrición. Una de las teorías que explicarían la afectación del crecimiento de estos niños está en relación con la anemia ferropénica asociada a la infección por Hp28.
Otra de las explicaciones alternativas a la afectación del crecimiento de estos niños podría ser el efecto de la gastritis sobre las hormonas que controlan el apetito, y el factor de crecimiento similar a la insulina tipo 1. Recientemente se ha demostrado que el estómago es una fuente de ghrelina y leptina, y existen informaciones contradictorias en cuanto a la modificación de los niveles plasmáticos y/o gástricos de estas hormonas como consecuencia de la infección gástrica por Hp. La colonización por la bacteria produciría un aumento de los niveles de leptina y una disminución de los de ghrelina, lo que repercutiría en el apetito de los niños disminuyendo el aporte calórico y afectando secundariamente al índice de masa corporal y a la velocidad de crecimiento29.
Púrpura trombopénica idiopáticaEn la última década se ha observado que algunos pacientes portadores de una púrpura trombopénica idiopática (PTI) crónica han respondido a la erradicación del Hp con un incremento en el número de plaquetas. La explicación biológica de la posible asociación de la infección por Hp y la PTI es la similitud de los anticuerpos antiplaquetarios del suero con la citotoxina asociada al gen cagA del Hp30. Los estudios realizados en niños a este respecto han sido discordantes, pero un estudio multicéntrico italiano muestra, en una amplia cohorte de pacientes pediátricos, un aumento significativo de las plaquetas después de la erradicación del Hp31,32.
Diagnóstico¿Qué pacientes deben de ser estudiados?A lo largo de la última década, varios colectivos de gastroenterólogos pediátricos, a través de diferentes documentos de consenso, han tratado de dar respuesta a esta duda y de establecer unas bases para el manejo de la infección por Hp en niños y adolescentes. Ninguno de estos colectivos consideraba que debiera hacerse un cribado del Hp en los pacientes con dolor abdominal recurrente, ni justificaban hacer un cribado del Hp en la infancia como prevención del cáncer gástrico.
En la actualidad, las nuevas guías publicadas conjuntamente por ESPGHAN y NAPSGHAN insisten en que la investigación del Hp no está recomendada en niños con criterios diagnósticos de dolor abdominal funcional, a no ser que, buscando una enfermedad orgánica, se haya realizado una endoscopia. Las guías recuerdan que el objetivo principal de la investigación de los síntomas gastrointestinales es determinar la causa de éstos y no la presencia del Hp. Asimismo refieren que la investigación de la infección por Hp puede ser considerada en niños con familiaridad de primer grado de cáncer gástrico y en los pacientes con anemia ferropénica refractaria, una vez descartadas otras causas. Por otro lado, consideran que el Hp no debe ser investigado en las otitis media, las infecciones del tracto respiratorio, la enfermedad periodontal, la alergia alimentaria, el síndrome de muerte súbita del lactante, la PTI y el retraso de talla, puesto que actualmente no hay evidencia de relación causal entre la infección por Hp y estas entidades clínicas25.
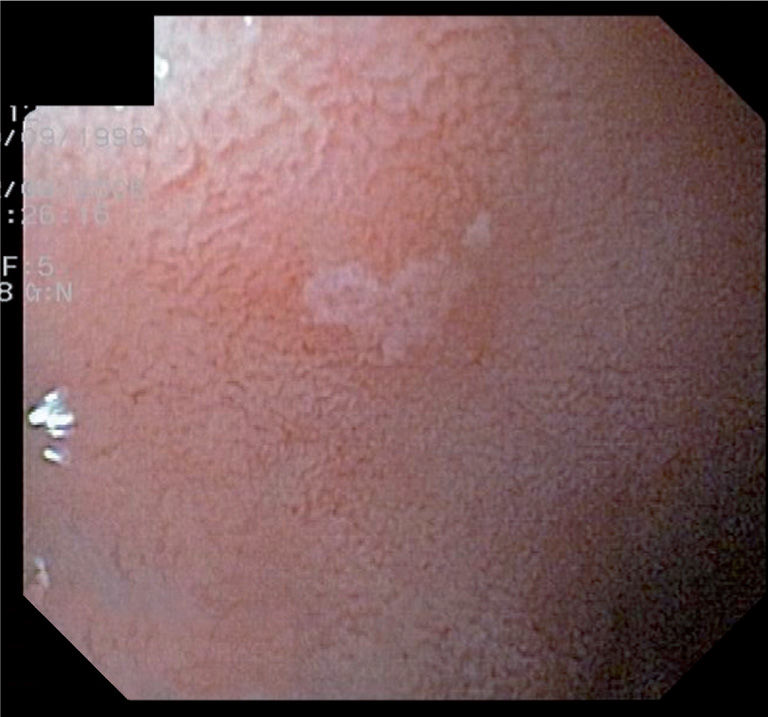
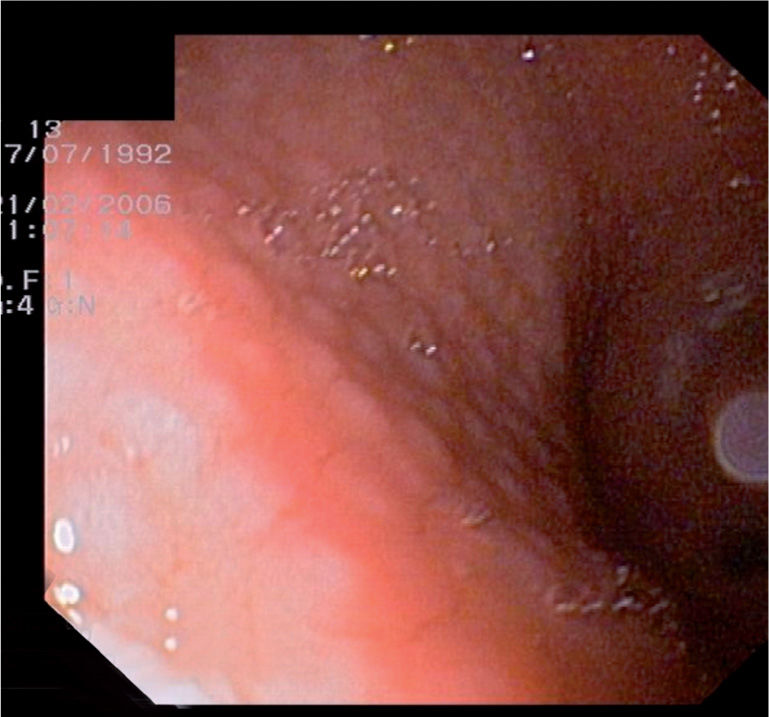
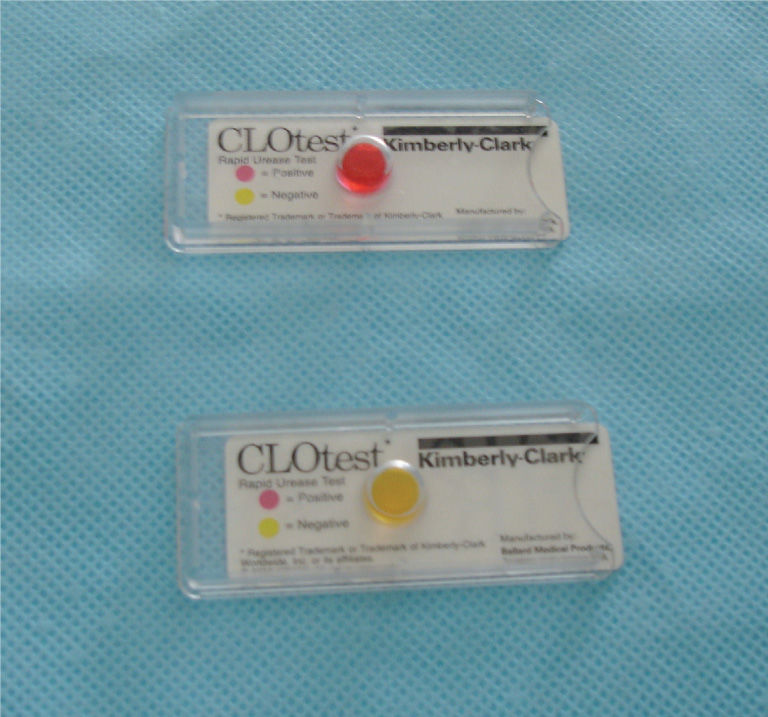
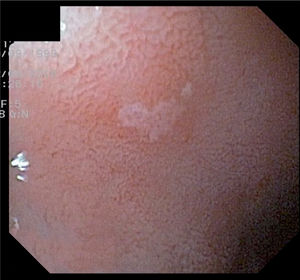
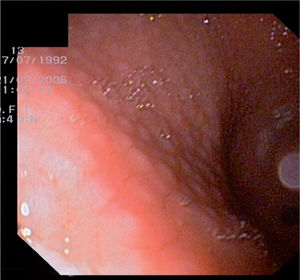
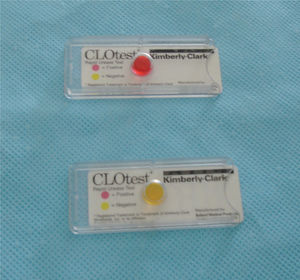
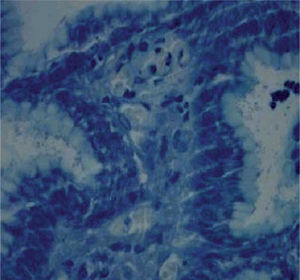
Métodos diagnósticos (tabla 1)Métodos invasivosLa endoscopia permite la visualización de un posible ulcus (fig. 1), o lo que es más frecuente y característico en los niños, la existencia de un patrón nodular de la mucosa gástrica (fig. 2). La endoscopia posibilita también tomar biopsias de mucosa gástrica y tener, en pocos minutos, un diagnóstico etiológico fiable a la cabecera del paciente mediante el test de ureasa (fig. 3) y permite el diagnóstico histológico (fig. 4) de la gastritis, la posible atrofia gástrica o el linfoma MALT. Así mismo, podemos cultivar la mucosa gástrica, que aunque poco sensible, es la prueba diagnóstica más específica, y disponer de un antibiograma que nos oriente en el tratamiento.
La detección de anticuerpos tipo IgG en el suero mediante ELISA tiene una sensibilidad media del 80%, menor aún en los niños menores de 6 años, y además no discrimina entre infección actual o pasada, por lo que no se recomienda su uso en el diagnóstico de la infección por Hp en niños. La detección de anticuerpos en orina y saliva, y las pruebas rápidas en sangre completa ofrecen pobres resultados en los niños.
El test de aliento con urea 13C (TAU 13C) está considerado la prueba no invasiva más útil para el diagnóstico de la infección, pero su especificidad disminuye en menores de 6 años. El tratamiento con inhibidores de la bomba de protones y/o antibióticos debe de ser suspendido 4 semanas antes de la prueba porque puede causar falsos negativos.
La detección de antígeno en heces es una prueba útil, tanto para el diagnóstico, como para la monitorización de la respuesta al
Lectura rápida
No hay síntomas específicos de la infección por Hp. Los pacientes con ulcus presentan síntomas de dispepsia ulcerosa. En ausencia de ulcus, los niños pueden presentar síntomas dispépticos vagos o estar asintomáticos. Está demostrada la falta de relación del dolor abdominal recurrente con la infección por Hp. La relación causal entre la infección por Hp, la anemia ferropénica refractaria, el retraso de talla y la púrpura trombocitopénica idiopática es controvertida.
Lectura rápida
Dada la pobre relación del dolor abdominal recurrente con la infección por Hp, no se recomienda investigar el Hp en niños con criterios diagnósticos de dolor abdominal funcional. Está recomendado el estudio del Hp en niños con familiares de primer grado con cáncer gástrico, y a pesar de la falta clara de relación causal, podemos plantearnos dicho estudio en pacientes con anemia ferropénica refractaria, una vez descartadas otras causas.
Para el diagnóstico de la infección disponemos de métodos invasivos y no invasivos. Las pruebas invasivas son las basadas en la endoscopia, que nos permite visualizar la úlcera gástrica o duodenal, o bien objetivar la lesión más frecuente en la infancia, consistente en un patrón nodular de la mucosa. La endoscopia permite hacer biopsias para el estudio histológico, el test de ureasa y el cultivo de la mucosa.
De modo general, todas las pruebas podrían ser apropiadas para la detección de la infección antes o después del tratamiento, a excepción de la serología, ya que los anticuerpos permanecen positivos largo tiempo después de la erradicación. Aunque todas las pruebas son factibles en la edad pediátrica, la sensibilidad de algunas desciende en los niños menores de 6 años.
La prueba de oro o gold standard en el diagnóstico de la infección por Hp consiste en la positividad de 2 de los tests basados en la biopsia de la mucosa gástrica, obtenida mediante endoscopia. Hay que tener en cuenta que ninguna de las pruebas no invasivas diagnostica la enfermedad gastroduodenal. Las nuevas guías de ESPGHAN/NAPSGHAN, aunque no recomiendan explícitamente realizar siempre una endoscopia, nos recuerdan que el objetivo principal del diagnóstico no es la detección del Hp, sino saber la causa de los síntomas, y en este sentido, no recomiendan la estrategia de «test and treat» (la detección del Hp mediante un test no invasivo y su tratamiento en caso de positividad), puesto que no provee información de la afectación gastroduodenal25. El TAU 13C y la detección de antígeno de Hp en heces son 2 buenos métodos no invasivos para el control de la erradicación de la bacteria después del tratamiento33.
Un trabajo multicéntrico italiano en el que se incluyó a más de 2.000 pacientes estudió la idoneidad de la indicación de endoscopia en niños con dispepsia y concluyó que la endoscopia no es la indicación apropiada en niños con síntomas dispépticos, excepto en aquellos niños con historia familiar de ulcus péptico y/o infección por Hp, mayores de 10 años de edad, con síntomas persistentes de más de 6 meses de evolución suficientemente importantes como para interrumpir la actividad cotidiana35.
Tratamiento¿Deben de tratarse todos los niños infectados por Helicobacter pylori?La indicación de tratamiento universal a todos los individuos sintomáticos que presentan una infección activa por Hp constituye un dilema.
En las guías de la ESPGHAN/NAPSGHAN del 2011, la recomendación del tratamiento erradicador de la infección por Hp en los niños con ulcus péptico es clara. La indicación de tratamiento en ausencia de ulcus sigue siendo una duda. Si consideramos, por un lado, la falta de relación causal entre la infección por Hp y los síntomas abdominales en ausencia de ulcus, y por otro, que la erradicación del germen, si no existe ulcera péptica, la mayor parte de las veces no va seguida de una mejoría de los síntomas, podríamos plantearnos la idoneidad de una terapia erradicadora. Sin embargo, aunque no está indicado el tratamiento de la infección por Hp como forma preventiva del cáncer gástrico, también debemos considerar los riesgos reales de desarrollo de una atrofia gástrica, o una úlcera o un linfoma. Por lo tanto, los autores de las guías ESPGHAN/NASPGHAN creen que debe ofrecerse una terapia erradicadora a los niños infectados por Hp con familiares de primer grado con cáncer gástrico y afirman que la decisión de tratar a los niños con una gastritis por Hp, sin ulcus gastroduodenal, debe de ser considerada por el clínico, de forma individual, junto con el paciente y su familia, teniendo en cuenta los potenciales riesgos y beneficios del tratamiento25.
¿Cuál es el tratamiento de la infección por Helicobacter pylori?Clásicamente, el tratamiento de la infección por Hp se basa en una triple terapia, que incluye la administración de 2 antibióticos y un antisecretor ácido. Las combinaciones terapéuticas más usadas a lo largo de los años han sido las triples terapias basadas en subcitrato de bismuto o un inhibidor de la bomba de protones (IBP), por un lado, junto con amoxicilina + claritromicina o metronidazol, por otro.
La respuesta terapéutica de los niños y adolescentes es, en general, más pobre que la de los adultos, en parte por el mal cumplimiento del tratamiento, pero sobre todo por el incremento de las resistencias del germen a los antibióticos. Un tratamiento erradicador es efectivo si alcanza un nivel de erradicación superior al 80% en una valoración por intención de tratar, o del 90% por protocolo, y en los últimos años, algunas de las combinaciones que clásicamente se han utilizado en la edad pediátrica no alcanzan esas tasas de erradicación.
Un registro multicéntrico europeo (PERTH) en el que se recogen los resultados de 27 diferentes regímenes terapéuticos utilizados en más de 500 niños refiere una tasa global de erradicación del 65,6, y del 79,7% en los pacientes con ulcus péptico, cifras más bajas de lo aceptable. Los tratamientos más frecuentemente utilizados eran las triples terapias que incluían el omeprazol, con las que se obtenían tasas de erradicación escasamente por encima del 60%, mientras que con las triples terapias basadas en las sales de bismuto mejoraban los resultados, obteniéndose una tasa de erradicación del 80% con la combinación de bismuto, amoxicilina y metronidazol36.
Otro trabajo prospectivo, multicéntrico, europeo, que estudió la resistencia a antibióticos en mucosas gástricas de más de 1.000 niños a los que se realizó una endoscopia detectó un 24% de resistencia primaria a claritromicina, más alta en varones, niños menores de 6 años comparado con los de más de 12 años, y en pacientes del sur de Europa (Grecia, Italia, España y Portugal). La resistencia a metronidazol era del 25%, más alta en niños nacidos fuera de Europa. La resistencia a amoxicilina era excepcional, el 0,6%, y la doble resistencia a claritromicina y metronidazol, el 6,9%37.
En España, las tasas de resistencia a claritromicina y metronidazol han ido aumentando en la última década, especialmente la resistencia a claritromicina. En un estudio realizado en biopsias gástricas en niños de Madrid se registraron los siguientes datos: un 32,8% de resistencia primaria a metronidazol y un 49,2% de resistencia primaria a claritromicina; un 1,8% de resistencia a ciprofloxacino y un 17,2% de doble resistencia a claritromicina y metronidazol. Todas las cepas fueron sensibles a amoxicilina, tetraciclina y rifampicina38. En otro trabajo realizado por el mismo grupo, se halló que las cepas de Hp resistentes a claritromicina estaban fuertemente asociadas a los pacientes pediátricos y a los individuos previamente tratados, y además, estas cepas presentaban más frecuentemente el genotipo vacA s2/m2, que el cagA39.
Dado que una de las causas más frecuentes del fracaso del tratamiento es la creciente resistencia a claritromicina, relacionada probablemente con el uso de los macrólidos para cualquier indicación, es interesante buscar una alternativa a las triples terapias convencionales. Una propuesta alternativa es la terapia secuencial (TS), que consiste en la administración de 5 días de doble terapia con un IBP y amoxicilina, seguido de otros 5 días de triple terapia con el IBP, claritromicina y tinidazol con la se obtuvieron, tanto en adultos como en niños, tasas de erradicación de más del 90% frente a tasas de menos del 80% con triples terapias clásicas, siendo mejores los resultados en los resistentes a claritromicina que en los de metronidazol40–42. La supuesta razón de las ventajas de esta TS es que la amoxicilina utilizada en la fase inicial del tratamiento rompe la pared de la bacteria, favoreciendo la entrada de los macrólidos que actúan en los genes bacterianos inhibiendo la síntesis proteica, aumentando así la eficacia de la segunda fase del tratamiento43. La TS sigue siendo una aceptable combinación terapéutica, aunque más re
Lectura rápida
Las pruebas no invasivas son: el test de aliento con urea 13C (TAU 13C), la detección de antígeno en heces y la determinación de anticuerpos específicos en suero. Tanto el TAU 13C como la detección de antígenos en heces son muy sensibles y útiles para el diagnóstico y el control postratamiento. La especificidad del TAU 13C baja en menores de 6 años. La serología es menos sensible, no discrimina la infección actual de la pasada y no es útil para el control postratamiento. Las pruebas no invasivas no diagnostican la enfermedad gastroduodenal.
La prueba de oro en el diagnóstico de la infección es la positividad de 2 tests basados en la biopsia gástrica obtenida por gastroscopia. Los expertos pediátricos no recomiendan el test and treat.
Lectura rápida
El tratamiento de la infección por Hp está claramente indicado en los pacientes con ulcus. Debe ofrecerse un tratamiento a los familiares de primer grado con cáncer gástrico, pero no está indicado el tratamiento de los niños como forma preventiva del cáncer. En ausencia de ulcus, la decisión de tratar puede ser considerada por el clínico, en cada caso, junto con los familiares, teniendo en cuenta los potenciales riesgos de la infección y los efectos secundarios de la terapia.
El tratamiento clásico es la triple terapia basada en un inhibidor de la bomba de protones (IBP) o subcitrato de bismuto + amoxicilina + metronidazol o claritromicina. El problema real es el incremento de la resistencia del Hp a los antibióticos, especialmente a claritromicina. La terapia secuencial (TS), consistente en 5 días con IBP + amoxicilina, y otros 5 días con IBP + metronidazol + claritromicina trata de superar la resistencia antibiótica no siempre con éxito. La realización de una endoscopia nos permite cultivar la mucosa y disponer de un antibiograma que oriente el tratamiento.
El beneficio de los probióticos en el tratamiento de la infección por Hp es un tema continuo de debate. En estudios realizados in vitro se ha visto que los probióticos pueden tener capacidad de inhibir el crecimiento de algunas cepas de Hp y que, al disminuir la densidad de gérmenes, podrían ayudar en el tratamiento, o en la prevención, de la colonización por el germen o la prevención de la infección. En una reciente revisión de la literatura respecto del papel de los probióticos en niños infectados por Hp se refiere que no hay evidencia de que los probióticos solos puedan utilizarse en el tratamiento de la infección, aunque pueden prevenir los efectos secundarios de la administración de antibióticos48.
¿Qué combinaciones terapéuticas debemos de utilizar?Es importante lograr la erradicación del germen con la pauta terapéutica que escojamos y prevenir, de esta manera, la resistencia antibiótica secundaria y la difusión en la población de cepas de Hp resistentes a antibióticos. El fracaso del tratamiento inicial es una de las causas más frecuentes del desarrollo de resistencias secundarias e implica, además, un engorroso seguimiento del niño, con repetición de pruebas diagnósticas, incluida la endoscopia, y de tratamientos, no siempre con éxito, con la consiguiente preocupación de los padres, habitualmente no justificada por la benignidad de la infección en los niños y la escasa relación de ésta con los síntomas.
Antes de emprender un tratamiento, es interesante conocer las tasas de resistencia antibiótica del Hp en niños y adolescentes de nuestra área geográfica, especialmente la susceptibilidad a la claritromicina, y no iniciar una combinación terapéutica que contenga claritromicina en poblaciones con tasas de resistencia a dicho antibiótico de más del 20%.
La guía de ESPGHAN/NASPGHAN25 recomienda para su utilización en primera línea, una serie de combinaciones terapéuticas, sin especificar preferencias. Estas combinaciones son: triple terapia con IBP + amoxicilina + imidazol, o IBP + amoxicilina + claritromicina, o sales de bismuto + amoxicilina + imidazol, o TS. Las dosis habituales de estos fármacos son: IBP, 1–2mg/kg/día; amoxicilina, 50mg/kg/día (máximo 2g/día); metronidazol, 20mg/kg/día (máximo 1g/día); claritromicina, 20mg/kg/día (máximo 1g/día), y subcitrato o subsalicilato de bismuto, 8mg/kg/día.
Respecto de la duración del tratamiento, la guía da la opción de escoger entre 7 y 14 días, teniendo en cuenta el coste, el cumplimiento por parte del paciente y los efectos secundarios de la medicación. Dos metaanálisis recientes encuentran y sugieren que la prolongación del tratamiento a 14 días mejora los resultados.49–50 Si falla el tratamiento, la primera recomendación de la guía es, si no se hizo previamente, realizar una endoscopia para cultivar la mucosa gástrica y orientar la segunda línea de tratamiento según el antibiograma. Si se hizo endoscopia previa pero no cultivo, puede recurrirse a la técnica de hibridación in situ (FISH) en biopsias previamente incluidas en parafina, que permite estudiar la susceptibilidad a claritromicina y evitar este antibiótico en caso de resistencia. La tercera recomendación incluye varias posibilidades, como las de emprender un segundo tratamiento modificando la terapia previa, bien añadiendo un antibiótico o utilizando diferentes antibióticos, o añadiendo bismuto y/o aumentando las dosis y/o la duración del tratamiento. La guía sugiere 2 combinaciones posibles como segunda línea de tratamiento. La primera es la cuádruple terapia clásica con IBP + metronidazol + amoxicilina + bismuto, y la segunda es la combinación de IBP + levofloxacino + amoxicilina, si bien la utilización de quinolonas en los niños es limitada.