Puntos clave
- •
No existe una única prueba de laboratorio que permita excluir la presencia de una enfermedad reumática.
- •
El hemograma con bioquímica y reactantes de fase aguda (proteína C reactiva, velocidad de sedimentación globular) son exploraciones básicas que permiten orientar a los pacientes con síntomas musculoesqueléticos hacia procesos inflamatorios u otros (neoplasias, infecciones).
- •
El diagnóstico de las artritis inflamatorias en la infancia es clínico y, a diferencia de las artritis del adulto, la mayoría son factor reumatoide negativo.
- •
La ferritina es un marcador inespecífico de inflamación, pero en la artritis idiopática juvenil de inicio sistémico los altos niveles de ferritina son un dato clave para el diagnóstico.
- •
Solo debería solicitarse el estudio de anticuerpos antinucleares cuando haya una alta sospecha de enfermedad reumática, ya que es frecuente encontrar anticuerpos antinucleares positivos en población sana sin traducción patológica.
El diagnóstico de las enfermedades reumáticas en niños se basa en la historia clínica y la exploración física. No existe una única prueba que permita considerar o excluir una enfermedad reumática1. Las pruebas de laboratorio son de utilidad para obtener evidencia de inflamación, ayudar al diagnóstico, determinar la actividad de la enfermedad y medir la respuesta al tratamiento. Para su uso apropiado y racional, deben ser solicitadas e interpretadas en el contexto de la situación clínica del paciente2. Las exploraciones para el estudio de un niño con sospecha de enfermedad reumática se han clasificado en 2 grupos: exploraciones básicas, disponibles en la mayoría de laboratorios, y exploraciones específicas, dirigidas a orientar el diagnóstico o realizar el seguimiento.
Exploraciones básicasHemograma y bioquímicaEl estudio inicial de laboratorio debe incluir un hemograma para el diagnóstico diferencial entre procesos inflamatorios y no inflamatorios que pueden simular una enfermedad reumática, como infecciones y leucemias. En enfermedades inflamatorias es común el hallazgo de una anemia normocítica normocroma. En pacientes con lupus eritematoso sistémico (LES) puede haber anemias hemolíticas autoinmunitarias, leucopenia (con linfopenia y/o neutropenia) y trombocitopenia2. Una bioquímica con transaminasas, enzimas musculares (creatincinasa, aldolasa) y lactato deshidrogenasa (LDH) serán de utilidad para valorar afectación sistémica, presencia de miositis u otras afecciones, especialmente neoplasias en caso de valores muy altos de LDH.
Reactantes de fase aguda: proteína C reactiva, velocidad de sedimentación globular y procalcitoninaLos valores de velocidad de sedimentación globular (VSG) pueden afectarse por muchos factores (edad, sexo, valores de hemoglobina…). Es de utilidad para monitorizar la actividad de la enfermedad y la respuesta al tratamiento, pero tiene baja especificidad. La proteína C reactiva (PCR) tiene como ventajas sobre la VSG: a) sus valores cambian más rápidamente en respuesta a la inflamación (aumenta en 4 h, alcanzan el máximo a las 24-48 h y disminuyen rápidamente con tratamiento apropiado), y b) sus niveles no se ven influidos por factores externos. En el LES, la PCR generalmente es normal y su aumento puede indicar una infección concomitante. La procalcitonina (PCT) se produce principalmente durante infecciones bacterianas graves, siendo su nivel habitualmente bajo durante infecciones virales y enfermedades autoinmunitarias. En pacientes con enfermedades autoinmunitarias y/o con inmunodepresión farmacológica con alto riesgo de infecciones graves, la PCT es de utilidad para ayudar a distinguir entre infección bacteriana y brote de enfermedad inflamatoria3.
AntiestreptolisinasSon anticuerpos frente al antígeno O del estreptococo betahemolítico del grupo A. El hallazgo de antiestreptolisinas (ASLO), independientemente de su cifra, solo indica infección estreptocócica previa. Para el diagnóstico de fiebre reumática es necesario cumplir los criterios de Jones4,5 (tabla 1). Niños sanos en edad escolar generalmente presentan títulos alrededor de 100-400 Ul/ml6. Después de una faringitis estreptocócica, el pico de ASLO aparece a las 4-5 semanas, que corresponde habitualmente a la segunda o tercera semana de fiebre reumática. Los títulos disminuyen rápidamente en los siguientes meses y no son útiles como medida de la actividad de la fiebre reumática, que debe monitorizarse con reactantes de fase aguda. En el seguimiento, un aumento en el título de ASLO respecto al previo puede ser signo de reinfección, que puede ser debido a un mal cumplimiento del tratamiento profiláctico con penicilina. Un 20% de los pacientes no muestran un aumento en el título de ASLO; en estos casos, se pueden determinar otros anticuerpos frente al estreptococo (anti-ADNasa B, estreptocinasa, antihialuronidasa), siendo los anti-ADNasa B los más utilizados7.
Criterios de Jones para el diagnóstico de fiebre reumática: la presencia de 2 criterios mayores, o de 1 criterio mayor y 2 menores, junto a la evidencia de infección previa por estreptococo beta-hemolítico del grupo A indican una alta probabilidad de fiebre reumática.
| Criterios mayores |
| Carditis |
| Poliartritis |
| Corea de Sydenham |
| Eritema marginatum |
| Nódulos subcutáneos |
| Criterios menores |
| Artralgias (dolor sin inflamación articular) |
| Fiebre |
| Aumento de los reactantes de fase aguda (VSG o PCR) |
| Intervalo PR alargado en el ECG |
| Evidencia de infección previa por estreptococo del grupo A |
| Cultivo faríngeo positivo, o |
| positividad del test rápido de detección de antígeno estreptocócico, o |
| título de anticuerpos contra estreptococo muy elevado, o |
| título de anticuerpos en aumento |
ECG: electrocardiograma; PCR: proteína C reactiva; VSG: velocidad de sedimentación globular.
Es una proteína de almacenamiento de hierro. Sus intervalos de referencia en la edad pediátrica varían ampliamente dependiendo de la edad y sexo pero, en todas las edades, una ferritina inferior a 12 μg/l indica ferropenia. No obstante, los procesos inflamatorios (incluso en casos de ferropenia) ocasionan una acumulación de hierro en los macrófagos que conduce a una sobreproducción de ferritina. La ferritina, pues, se comporta como un marcador inespecífico de proceso inflamatorio. En la artritis idiopática juvenil de inicio sistémico (AIJis), los altos niveles de ferritina son un dato clave para el diagnóstico de la enfermedad y constituyen una herramienta para monitorizar su actividad. Niveles extremadamente altos (> 10.000 μg/l) son muy sospechosos de linfohistiocitosis hemofagocítica (HLH), con una sensibilidad del 90% y una especificidad del 96% para HLH8. La HLH primaria es una enfermedad genética de comienzo habitual en el primer año de vida, mientras que las formas de HLH adquiridas pueden ser debidas a infección, neoplasia o enfermedad reumática, recibiendo en este último caso la denominación de síndrome de activación del macrófago. Otras condiciones que aumentan los niveles de ferritina son el shock séptico, enfermedades hepáticas y transfusiones repetidas sin quelación.
ComplementoEl sistema del complemento consiste en > 30 proteínas que pueden promover la respuesta inflamatoria y aumentar o «complementar» la inmunidad humoral9. La actividad hemolítica total del complemento (CH50) valora la integridad de todo el sistema del complemento. Las fracciones C3 y C4 del complemento son las que se determinan habitualmente: niveles bajos de C3 y/o C4 son habituales en LES, glomerulonefritis aguda postinfecciosa, enfermedades hepáticas y deficiencias congénitas del sistema de complemento. En procesos inflamatorios podemos encontrar un aumento de los niveles de complemento con una actividad hemolítica aumentada. El déficit hereditario de C1q, C4 y C2 se asocia a un aumento de riesgo de enfermedad autoinmunitaria, especialmente LES2.
Factor reumatoideEs un anticuerpo IgM dirigido contra el fragmento constante de la inmunoglobulina G. Es una prueba básica en el cribado de adultos con síntomas musculoesqueléticos, siendo positivo en el 85% de adultos con artritis reumatoide. No obstante, podemos encontrar un factor reumatoide positivo en otras situaciones, especialmente en enfermedades donde hay una estimulación antigénica crónica (endocarditis bacteriana subaguda, hepatitis B y C, virus de la inmunodeficiencia humana, leishmaniasis)10. Además, en la AIJ solo es positiva en un 5-10% de los pacientes, por lo que en niños solo sería de utilidad solicitarlo en unidades especializadas donde se efectúa el seguimiento de niños con AIJ11, pero nunca como test de cribado en caso de síntomas musculoesqueléticos1.
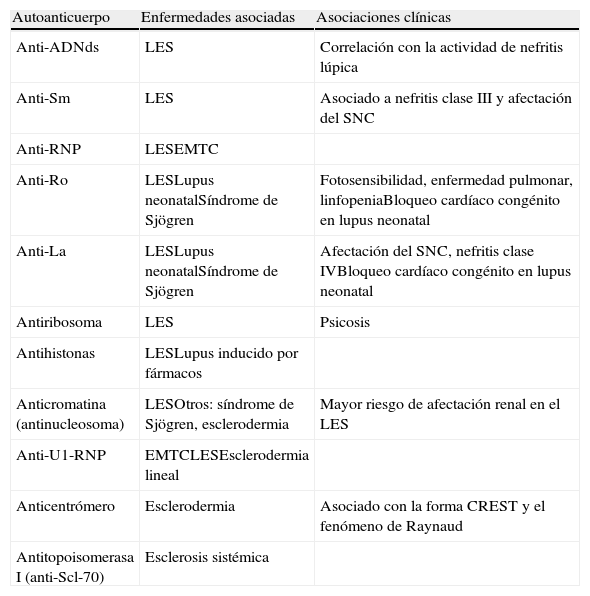
Anticuerpos antinuclearesSon diferentes autoanticuerpos dirigidos contra antígenos localizados en los núcleos celulares, que pueden desarrollarse en el contexto de una enfermedad autoinmunitaria pero también como respuesta a una infección, fármacos o tóxicos (tabla 2). El título de anticuerpos antinucleares (ANA) (número de veces que se diluye la sangre hasta que el anticuerpo no se detecta) va a ser de utilidad, conjuntamente con la clínica del paciente, para tomar decisiones acerca de la importancia de un resultado positivo. En un alto porcentaje de población sana adulta podemos encontrar ANA, sobre todo a títulos bajos (1:40 en un 31,7% de sujetos, descendiendo al 3,3% a títulos 1:32012). A pesar de que la prevalencia en niños sanos es inferior, dada esta alta tasa de falsos positivos el estudio de ANA tampoco se recomienda como test de cribado en niños con síntomas musculoesqueléticos13. Además, hay muchas enfermedades reumáticas en las que los ANA son negativos (AIJis, artritis reactivas, fiebre reumática, púrpura de Schönlein-Henoch). Algunos autores sugieren que el hallazgo de ANA no sería significativo si no se acompaña de una clínica y analítica compatibles con LES14 u otra enfermedad del tejido conectivo, especialmente si el título es < 1:64013,15. De forma inversa, unos ANA negativos hacen que el diagnóstico de colagenopatía sea extremadamente improbable. Además de lo expuesto, los ANA serán de utilidad en la consulta de reumatología pediátrica para identificar a pacientes con AIJ con más riesgo de uveítis16. Los tipos de ANA se definen por el antígeno contra el que van dirigidos. Algunos son relativamente específicos para una enfermedad en concreto o para manifestaciones específicas en el LES, mientras que otros van a ser de utilidad para monitorizar la enfermedad. La tabla 3 muestra los principales tipos de ANA y su asociación clínica. En conclusión, en una consulta general los ANA solo deberían solicitarse si hay una alta sospecha de que los síntomas del paciente sean debidos a una enfermedad reumática sistémica.
Condiciones asociadas a ANA positivos. En los casos de enfermedad autoinmunitaria, entre paréntesis se detalla la prevalencia de positividad de los ANA.
| Sujetos sanos |
| Incremento de la frecuencia con la edad. |
| Enfermedades autoinmunitarias sistémicas |
| LES (93%) |
| Enfermedad mixta del tejido conectivo (93%) |
| Esclerodermia (85%) |
| Síndrome de Sjögren (48%) |
| AIJ oligoarticular (71%) |
| Dermatomiositis juvenil (61%) |
| Lupus inducido por fármacos (100%) |
| Enfermedades autoinmunitarias órgano-específicas |
| Hepatitis autoinmunitaria (63-91%) |
| Tiroiditis autoinmunitaria (50%) |
| Infecciones |
| Virus de Epstein-Barr, parvovirus B19, VIH, VHC |
| Tuberculosis |
| Endocarditis bacteriana subaguda |
| Enfermedad de Lyme |
| Neoplasias |
| Leucemia linfoblástica aguda |
| Fármacos y otros |
| Hidralacina, isoniacida, antiepilépticos |
| Implantes de silicona |
ANA: anticuerpos antinucleares; AIJ: artritis idiopática juvenil; LES: lupus eritematoso sistémico; VHC: virus hepatitis C; VIH: virus de la inmunodeficiencia humana.
Tipos de ANA y principales asociaciones clínicas.
| Autoanticuerpo | Enfermedades asociadas | Asociaciones clínicas |
| Anti-ADNds | LES | Correlación con la actividad de nefritis lúpica |
| Anti-Sm | LES | Asociado a nefritis clase III y afectación del SNC |
| Anti-RNP | LESEMTC | |
| Anti-Ro | LESLupus neonatalSíndrome de Sjögren | Fotosensibilidad, enfermedad pulmonar, linfopeniaBloqueo cardíaco congénito en lupus neonatal |
| Anti-La | LESLupus neonatalSíndrome de Sjögren | Afectación del SNC, nefritis clase IVBloqueo cardíaco congénito en lupus neonatal |
| Antiribosoma | LES | Psicosis |
| Antihistonas | LESLupus inducido por fármacos | |
| Anticromatina (antinucleosoma) | LESOtros: síndrome de Sjögren, esclerodermia | Mayor riesgo de afectación renal en el LES |
| Anti-U1-RNP | EMTCLESEsclerodermia lineal | |
| Anticentrómero | Esclerodermia | Asociado con la forma CREST y el fenómeno de Raynaud |
| Antitopoisomerasa I (anti-Scl-70) | Esclerosis sistémica |
ADNds: ADN de doble hebra; ANA: anticuerpos antinucleares; CREST: calcinosis, Raynaud, dismotilidad esofágica, esclerodactilia, telangiectasias (forma limitada de la esclerodermia); EMTC: enfermedad mixta del tejido conectivo; LES: lupus eritematoso sistémico; RNP: ribonucleoproteína; SNC: sistema nervioso central.
Grupo heterogéneo de autoanticuerpos dirigidos contra proteínas plasmáticas que se unen a los fosfolípidos de la membrana celular. Su presencia se asocia a trombosis arteriales y venosas, manifestaciones hematológicas, cutáneas y neurológicas. Pueden detectarse en pacientes con LES o, más infrecuentemente, de forma primaria17. También se encuentran en individuos sanos tras un proceso infeccioso, donde habitualmente no darán sintomatología protrombótica. Para su diagnóstico se solicita el anticoagulante lúpico, anticuerpos anticardiolipina y anti-β2 glucoproteína, y debe obtenerse la positividad de alguno de estos anticuerpos en 2 o más determinaciones separadas al menos 12 semanas9.
Anticuerpos anticitoplasma de neutrófiloLos anticuerpos anticitoplasma de neutrófilo (ANCA) son anticuerpos contra antígenos contenidos en los gránulos azurófilos de los neutrófilos. Los c-ANCA (patrón granular citoplasmático) son bastante específicos de granulomatosis con angeítis (conocida como granulomatosis de Wegener) siendo positivos en 70-90% de los casos18. Los p-ANCA (patrón perinuclear) pueden detectarse en el síndrome Churg-Strauss, poliangeítis microscópica, colitis ulcerosa y colangitis esclerosante primaria, siendo su utilidad clínica más limitada2.
HLA B27La prevalencia del HLA-B27 en la población general europea es del 8%19; en cambio, es del 90% en la espondilitis anquilosante juvenil y del 60% en niños con espondiloartropatías. Debe tenerse en cuenta que solo un pequeño porcentaje de pacientes HLA-B27 positivos van a desarrollar alguna de estas enfermedades y, de forma inversa, que no todos los pacientes con espondiloartropatías tienen el HLA B27. Por lo tanto, su presencia o ausencia es un dato más para el diagnóstico de estas entidades pero no lo excluye.
ConclusiónLa anamnesis y la exploración física son claves para orientar el diagnóstico de las enfermedades reumáticas. El estudio de laboratorio inicial debería incluir un hemograma, bioquímica y reactantes de fase aguda. El resto de las pruebas de laboratorio solo deben solicitarse en función de la sospecha clínica, ya que en niños no existe una única prueba que permita confirmar o excluir la presencia de una enfermedad reumática.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.