Puntos clave
La ecografía es el método de estudio sistemático para el cribado de las anomalías fetales que incluso en manos experimentadas tiene limitaciones técnicas. El uso de la resonancia magnética (RM) en pacientes embarazadas fue descrito en 1983 por Smith et al1. Gracias al desarrollo de las secuencias ultrarrápidas en los años noventa la RM se está convirtiendo en un método de estudio no invasivo complementario a la ecografía para detectar anomalías fetales que ayuda a establecer el pronóstico y el manejo perinatal. Sin embargo, la mayoría de los estudios se centran en enfermedades cerebrales y del tórax y es menor el número de publicaciones que describan las aplicaciones de la RM fetal en procesos patológicos de cuello, gastrointestinales o genitourinarios. En este artículo se revisa con RM la anatomía y patología del cuello, tórax, abdomen y pelvis fetal, así como las ventajas y desventajas de la RM frente a la ecografía.
ANATOMÍA NORMAL- —
Cuello. La nasofaringe, la hipofaringe, la tráquea y el esófago muestran hiperseñal en T2 al estar rellenas de líquido amniótico. El tiroides presenta hiperintensidad en T1.
- —
Tórax. La aorta, los vasos pulmonares y el corazón aparecen hipointensos en secuencias SSFSE T2 y T1 y son hiperintensos en la secuencia FIESTA. El timo tiene una señal intermedia en SSFSE T2.
- —
Abdomen. El estómago es fácilmente reconocible como una estructura sacular hiperintensa en T2, al igual que la vesícula biliar. El intestino delgado proximal aparece hiperintenso en T2 y el intestino delgado distal, colon y recto hiperintenso en T1 al contener meconio. El hígado es claramente visualizado como una estructura hiperintensa en T1 e hipointensa en T2. Los riñones, los sistemas pielocaliciales y sobre todo la vejiga se visualizan con claridad en secuencias T22.
La masa más frecuente detectada prenatalmente en el cuello es el higroma quístico que está normalmente localizado en la región posterolateral. Es una lesión linfática quística normalmente multitabicada e hiperintensa en T2. Se asocia al síndrome de Turner y en menor medida a la trisomía 21.
Las masas anteriores más frecuentes son el bocio y el teratoma. El bocio puede ser debido a hipertiroidismo e hipotiroidismo materno y presenta hiperintensidad en T1 que lo diferencia del teratoma. El teratoma se origina de línea media o del tiroides; es una masa grande sólida o solidoquística de crecimiento rápido que envuelve estructuras adyacentes y puede extenderse al mediastino. La calcificación se visualiza mejor por ecografía y es prácticamente patognomónica3. La RM valora mejor que la ecografía la permeabilidad de la vía aérea por si fuera necesario tratamiento ex útero intraparto (EXIT). Otras masas menos frecuentes son los hemangiomas y los quistes branquiales o laríngeos congénitos.
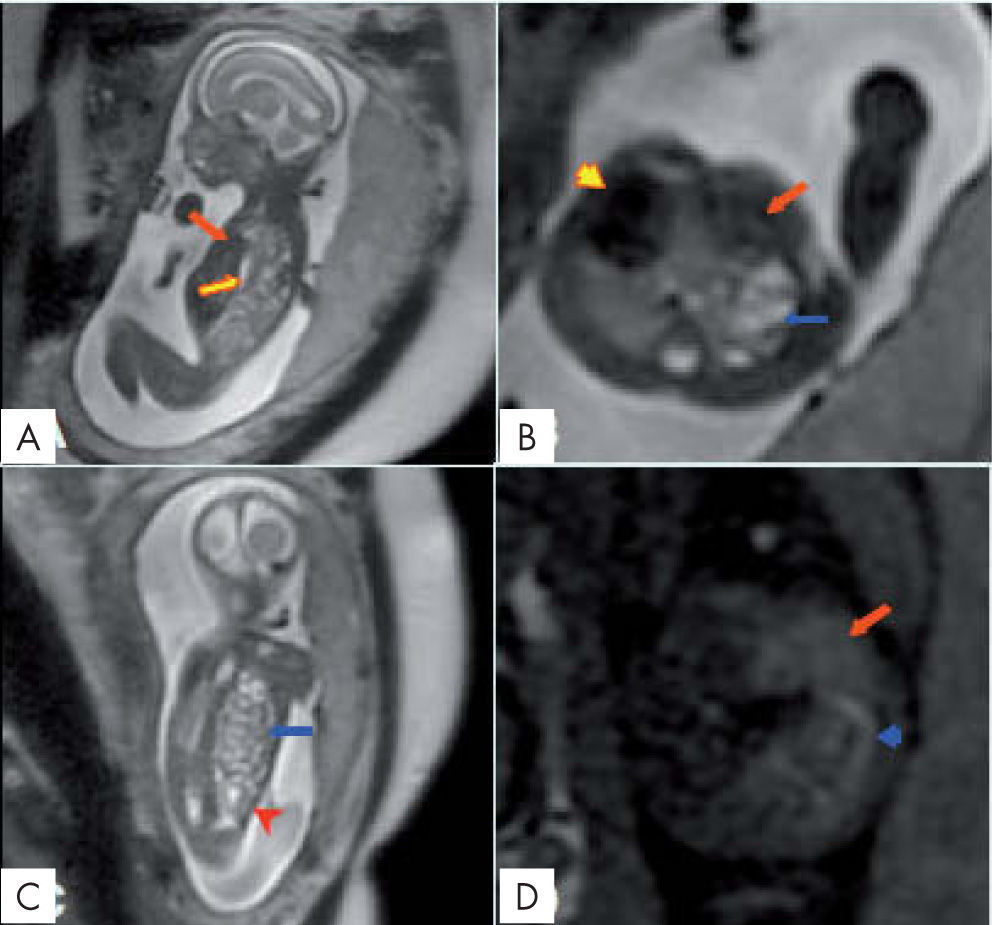
ANOMALÍAS TORÁCICASHernia diafragmática congénitaEl 80-90% son izquierdas (hernia de Bochdalek). La RM puede valorar en plano sagital y coronal el defecto diafragmático y diferencia por su intensidad de señal y morfología el contenido de la hernia, lo cual no siempre posible por ecografía. El estómago, intestino delgado y colon se hernian con frecuencia. El tamaño de la hernia y la herniación del hígado determinan el grado de hipoplasia pulmonar. Si hay herniación hepática la mortalidad es del 57%. Con la RM podemos medir el volumen pulmonar del pulmón ipsolateral a la hernia y el contralateral obteniendo un volumen pulmonar observado (VPO) total y podemos calcular un volumen pulmonar predictivo o esperado (VPE) según la edad gestacional. La relación VPO/VPE × 100 establece el volumen pulmonar relativo (VPR). Se considera hipoplasia los valores de VPR < 80%4. Todos los fetos con valores < 14,3% presentan un 100% de mortalidad, los valores > 32,8 tienen un 100% de supervivencia y los valores > 44% no necesitarán oxigenación por membrana extracorpórea (ECMO)5. El diagnóstico debe establecerse antes de la semana 24 y tratar aquellos casos con baja supervivencia (< 60%) con taponamiento traqueal mediante fetoscopia que incrementa la supervivencia un 30-40% (fig. 1).
Hernia diafragmática izquierda. A. Sagital SSFSE T2. B. Axial FSE T2. C. Coronal FSE T2. D. Eco de gradiente en T1. Hígado (flecha roja), riñón izquierdo (cabeza de flecha roja), asas de delgado (flecha azul), ángulo esplénico del colon (cabeza de flecha azul), estómago (flecha amarilla), y corazón (cabeza de flecha amarilla). Se calcula el volumen pulmonar esperado total que fue de 14,18ml. El volumen pulmonar total observado es de 6,73ml. El volumen pulmonar relativo es del 47%. Hay criterios de hipoplasia pulmonar. Edad gestacional de 20 semanas.
Las malformaciones adenomatoideas quísticas (MAQ) son las masas más comunes (75% de todas las lesiones pulmonares). Pueden ser sólidas o quísticas con vascularización por la arteria pulmonar y drenaje a venas pulmonares. Son unilaterales y afectan a un lóbulo entero. Los hallazgos en la RM varían en tipo I (lesión unilocular hiperintensa), tipo II (lesión multilocular hiperintensa) y tipo III (masa sólida hiperintensa adyacente al pulmón normal que aparece hipointenso). Suelen ser estables o pueden desaparecer intraútero (19%)6. Requieren cirugía posnatal pasado el mes de vida por el riesgo de infección y el bajo riesgo de malignización.
Secuestro broncopulmonarRepresenta el 23% de las anomalías torácicas7. Consiste en tejido broncopulmonar que no conecta con el árbol bronquial ni con las arterias pulmonares que se encuentran irrigadas por vascularización sistémica. Se asocia a otras anomalías en más del 50% de los casos. Su localización más frecuente es el lóbulo inferior izquierdo (LII) (90%) y en el 85-90% es supradiafragmático. El secuestro tipo extralobular es el tipo presente en el feto. En más del 50% de los secuestros hay hallazgos histológicos de MAQ tipo II. En la RM presentan un componente sólido hiperintenso en T2, similar a la MAQ tipo III con vaso anómalo sistémico. La RM puede detectar pequeñas lesiones o anomalías no visibles por ecografía. Tiene un excelente pronóstico cuando es un hecho aislado y desaparecen intraútero en el 50-75%.
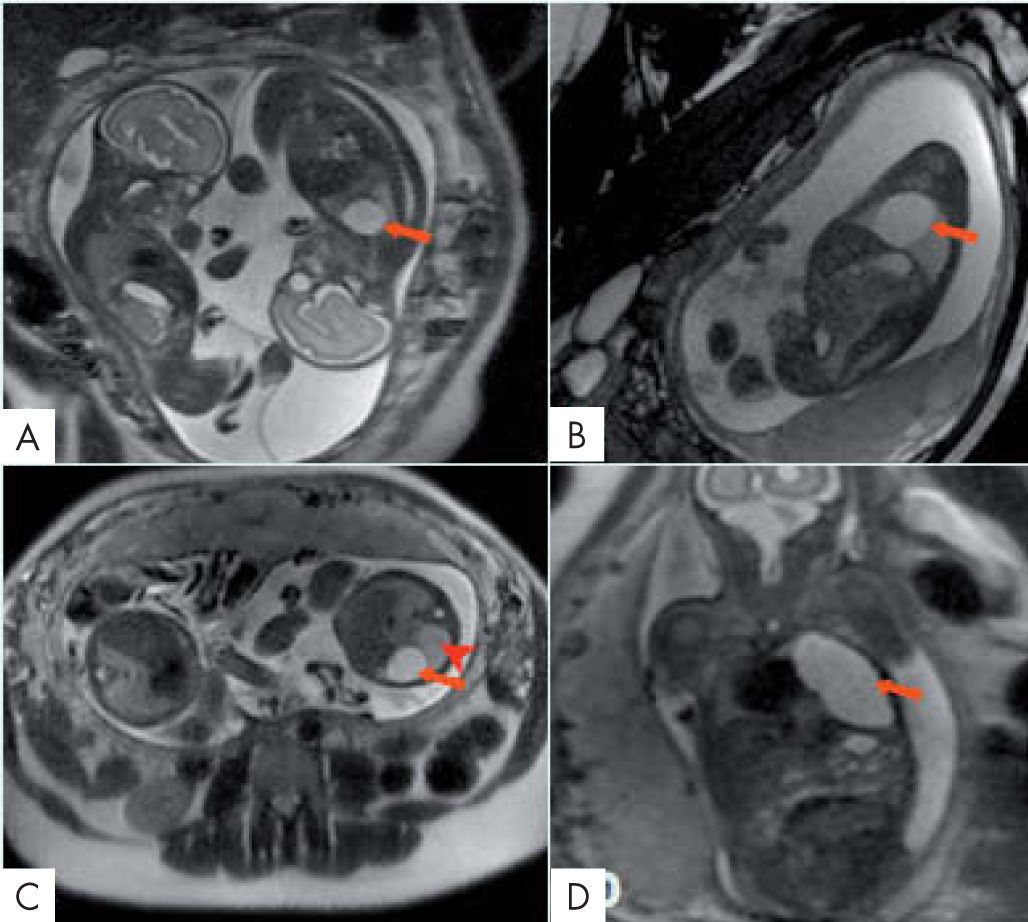
Quiste broncogénicoEn la RM aparece como un quiste de bordes bien definidos próximo a la carina, hiperintenso en T28 (fig. 2). El papel de la RM queda limitado a los casos que presenten obstrucción bronquial que se beneficiarían de EXIT con ECMO con resección de la lesión obstructiva seguida de reconstrucción de la vía aérea durante las primeras horas de vida.
Quiste broncogénico. Gemelos bicoriales y biamnióticos. Edad gestacional de 22 semanas. A. Coronal SSFSE T2. B. Sagital FIESTA. C. Axial SSFSE T2. D. Coronal FIESTA. Quiste broncogénico en pulmón izquierdo (flecha). El parénquima pulmonar izquierdo aparece más hiperintenso por hiperinsufación pulmonar (cabeza de flecha roja). Se calcula el volumen pulmonar observado que fue de 25,35ml. El volumen pulmonar esperado es de 38,88ml y el volumen pulmonar relativo del 65%. Se observa leve hipoplasia pulmonar.
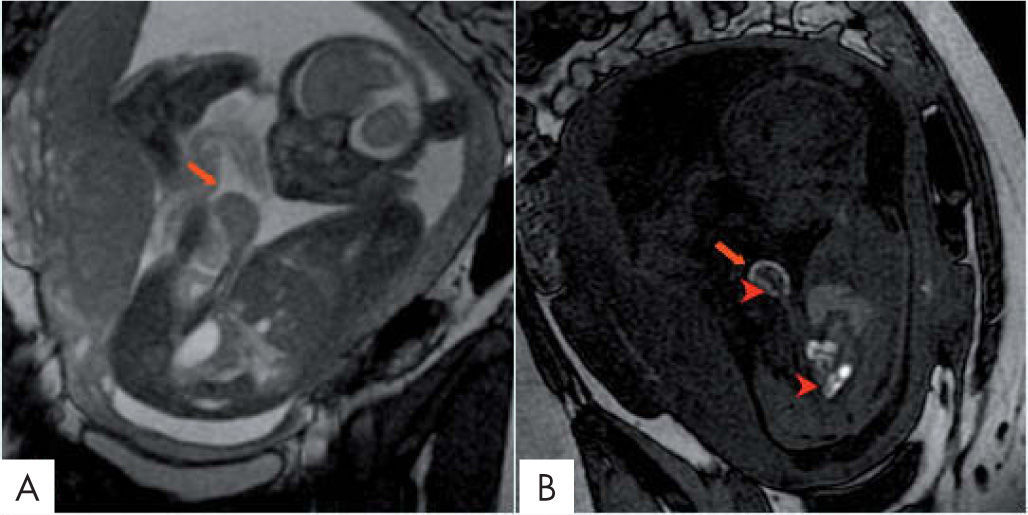
Es un defecto de la pared abdominal en línea media con herniación de contenido abdominal, recubiertas de peritoneo y amnios con inserción del cordón umbilical en el ápex del encefalocele. El hígado, el estómago y las asas de intestino delgado se hernian con más frecuencia y son fácilmente identificados por RM (fig. 3). Se asocia a anomalías cromosómicas en el 30-40% (la más habitual la trisomía 18) y a múltiples anomalías fetales9.
GastrosquisisEs un defecto paraumbilical de la pared abdominal anterior. Típicamente de localización derecha, con prolapso de asas de intestino delgado (menos frecuente hígado o colon) que flotan en el líquido amniótico sin recubrimiento membranal. Se asocia a oligoamnios y retraso del crecimiento intrauterino (CIR). Si se acompaña de polihidramnios hay que descartar obstrucción o atresia intestinal. La RM facilita la visualización en los casos de oligoamnios o obesidad materna10.
Atresia esofágicaEl diagnóstico se establece por el signo de la bolsa esofágica11, polihidramnios, estómago pequeño y CIR en el segundo o tercer trimestre. Se asocia a trisomía 18; si no presenta fístula traqueal es más común en la trisomía 21.
Atresia o membrana antralSigno de única burbuja que corresponde al estómago dilatado. No se visualiza el duodeno.
Atresia duodenalSe diagnostica por el signo de la doble burbuja del estómago y duodeno que incluye estenosis duodenal, páncreas anular, bandas de Ladd y vólvulo12. Se asocia a trisomía 21 en el 5-15%.
Atresia de intestino delgadoSe observa dilatación de asas intestinales proximales a la obstrucción. La RM proporciona información adicional; cuando la atresia es yeyunal, las asas dilatadas serán hipointensas en T1 e hiperintensas en T2, y cuando es ileal aparecerán dilatadas asas hiperintensas en T1 e hipointensas en T2 al contener meconio13.
Peritonitis meconialLa RM identifica las asas dilatadas, ascitis, polihidramnios y las masas quísticas (seudoquistes meconiales). Se asocia a fibrosis quística en el 8%.
Atresia analAsas intestinales en forma de U o V en pelvis sugieren el diagnóstico. Frecuentemente se asocia a fístula del tracto urinario que produce enterolitos14 o a síndrome de VACTERL.
Masas abdominalesLa mayoría son quistes benignos: de duplicación intestinal, del mesenterio, del ovario, del colédoco y del uraco. La RM permite la detección, localización y caracterización, diferenciándolos de las asas intestinales. Las masas hepáticas congénitas son masas grandes sólidas (hemangioendotelioma, hepatoblastoma, metástasis de neuroblastoma o leucemia) o quísticas (hamartoma mesenquimal)15.
ANOMALÍAS GENITOURINARIASHidronefrosisLa RM permite establecer el diagnóstico de las diferentes causas de hidronefrosis: estenosis de la unión pieloureteral, las válvulas uretras posteriores, megauréter congénito y duplicidad renal (la RM puede visualizar ureterocele asociado a la desembocadura ectópica del uréter superior y el reflujo del uréter inferior).
Anomalías renalesLa RM ayuda a establecer el diagnóstico de agenesia renal bilateral ya que el oligoamnios grave dificulta la valoración por ecografía. La agenesia renal unilateral, el riñón ectópico y riñón en herradura son fácilmente diagnosticados por RM.
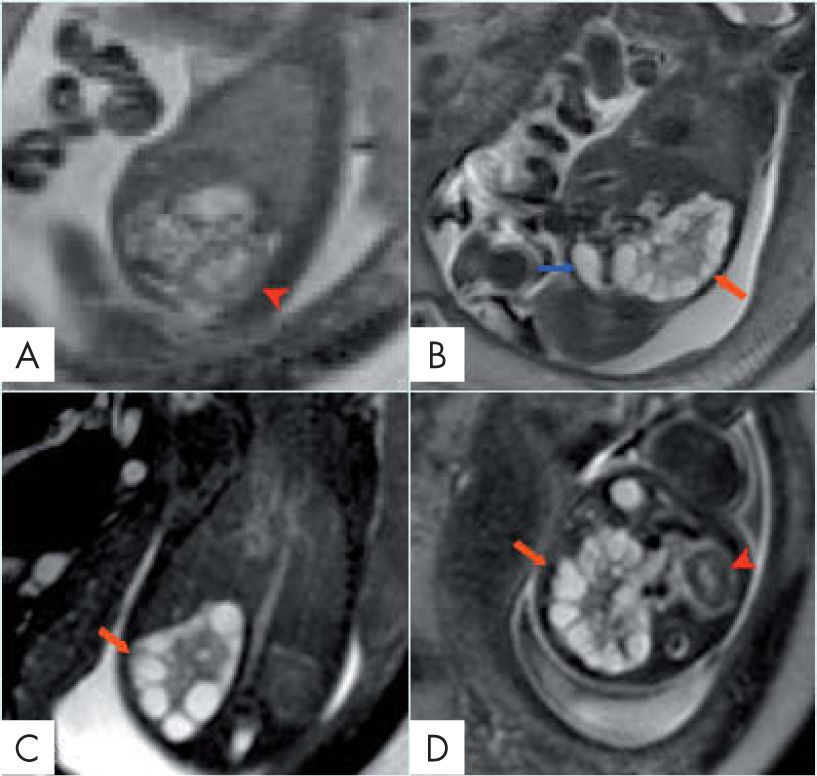
Riñón displásico multiquísticoSe observan riñones aumentados con múltiples quistes de diferente tamaño en situación periférica y central, con escaso parénquima renal, separados del sistema pielocalicial e hiperintensos en T2 (fig. 4). Es bilateral en el 20% (mal pronóstico) y hay anomalía renal contralateral en el 40%. Se asocia a síndrome de Meckel-Gruber, trisomía 13 y trisomía 1816.
Displasia multiquística renal derecha. A. Sagital SSFSE T2. Riñón izquierdo normal (cabeza de flecha). B. Sagital SSFSE T2. Riñón derecho aumentado de tamaño con múltiples quistes corticales y medulares (flecha roja). Vejiga (flecha azul). La cantidad de líquido amniótico es normal. C. Coronal SSFSE T2. D. Axial SSFSE T2. Riñón derecho displásico multiquístico (flecha roja). Riñón izquierdo normal (cabeza de flecha). Edad gestacional de 27,2 semanas.
Los riñones son grandes, con alta intensidad uniforme en T2 con pérdida de diferenciación corticomedular y no se identifica el sistema pielocalicial. Vejiga de pequeño tamaño, oligoanhidramnios y tórax pequeño en relación con el abdomen. Se asocia a síndrome de Meckel-Gruber y trisomía 1317.
MASAS RETROPERITONEALESNefroma mesoblástico renalLa masa renal sólida más común es un tumor benigno con pronóstico excelente que se acompaña en el 70% de polihidramnios18. La RM delimita mejor su dependencia de órgano con una masa sólida de señal uniforme levemente hiperintensa en T2.
NeuroblastomaMás del 90% tiene origen suprarrenal y el 50% son quísticas. Las masas sólidas metastatizan con más frecuencia y las metástasis hepáticas son frecuentes3. Hay que establecer el diagnóstico diferencial con la hemorragia suprarrenal (la RM muestra la señal de la hemorragia en los diferentes estadios) y secuestro pulmonar infradiafragmático (la RM puede mostrar el aporte sistémico vascular).
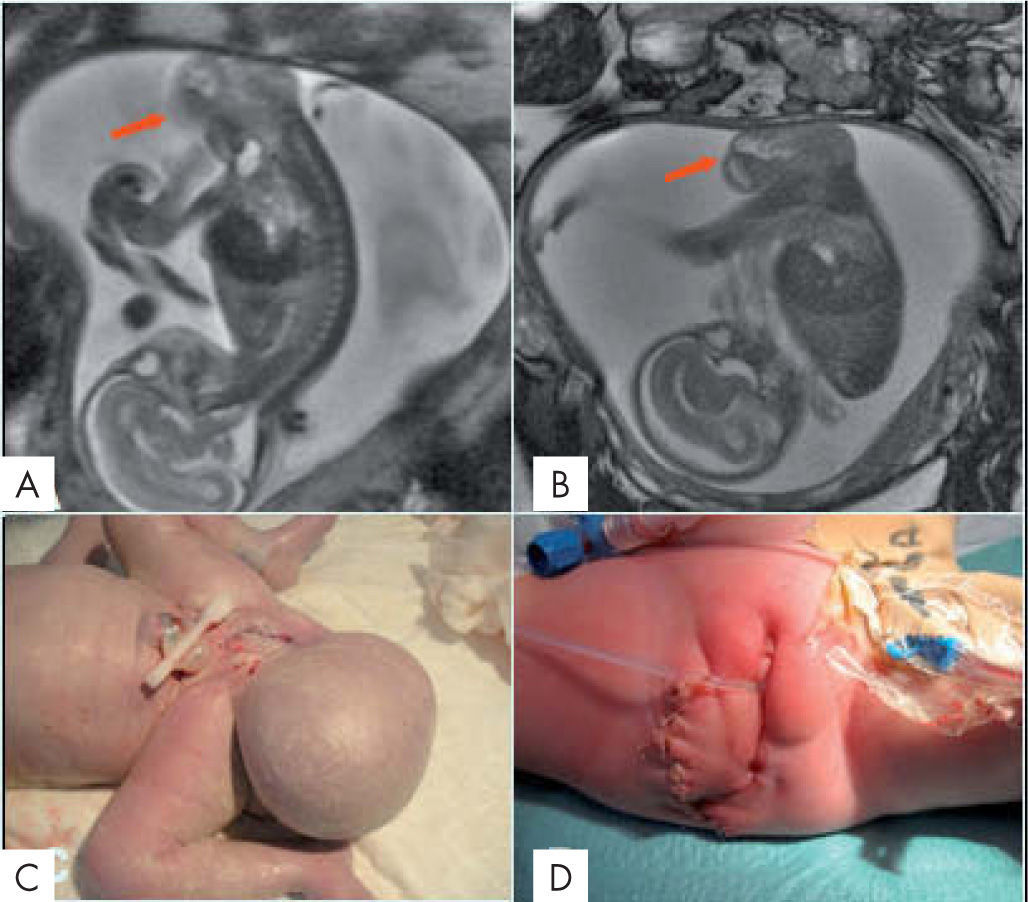
Teratoma sacroccígeoEl 70-80% de los teratomas se originan en esta localización. La RM valora mejor el componente intrapélvico que la ecografía (fig. 5). Pueden ser tumores maduros o inmaduros con alto riesgo de malignización. Son sólidos y/o quísticos muy vascularizados con mortalidad del 50%19.