La retinopatía del prematuro (RP) puede definirse como una vitreorretinopatía fibroproliferativa y vasoproliferativa periférica que tiene lugar en recién nacidos inmaduros, generalmente sometidos a oxigenoterapia, y de etiopatogenia actualmente desconocida1,2. Tiene importantes similitudes con la retinopatía diabética.
La proliferación, con gran potencial patogénico, comienza en el extremo periférico de la retina madura del niño y en su evolución puede producir tracción en esta retina con desplazamiento de sus estructuras principales y su desprendimiento, entre otras graves complicaciones, que pueden ser potencialmente evitables.
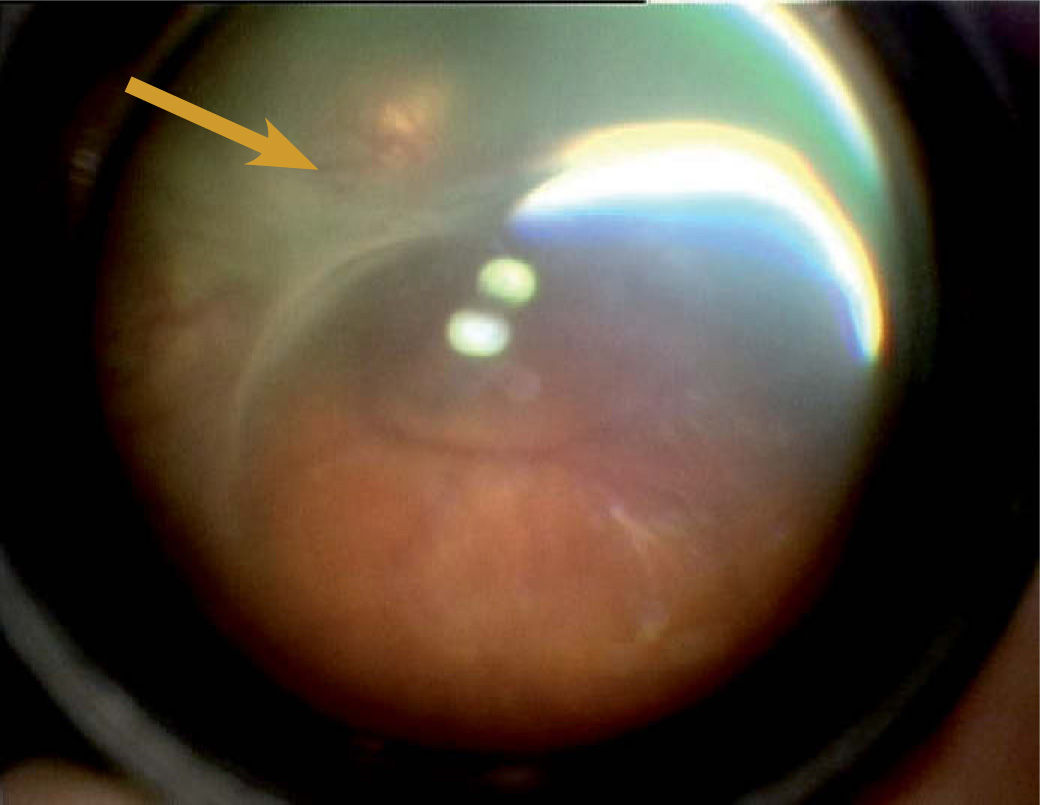
Pero, ¿por qué? La vasculatura inmadura del prematuro recibe una información equivocada antes de terminar su desarrolllo, de modo que realiza un crecimiento hipertrófico hacia el interior del ojo (fig. 1), el humor vítreo o la propia retina. La vasculatura anómala tiene gran fuerza traccional y si evoluciona lo suficiente puede desprender la retina.
Puntos clave
La RP ha dado origen a cientos de artículos y estudios acerca de los factores patogénicos implicados hipotéticamente. Sin embargo, el papel de ninguno de ellos no se ha establecido de forma clara, si bien la oxigenoterapia ha logrado reproducir en cierta medida una retinopatía similar en modelos experimentales3, pero con variantes importantes.
OxigenoterapiaLa primera hipótesis, y la más estudiada, acerca de la etiología de la RP fue la hiperoxigenación retiniana. Kinsey4 encontró una asociación entre RP y la duración de la oxigenoterapia en un estudio multicéntrico y controlado realizado durante el año 1953 y siguientes. Lanman5 publicó por separado los resultados obtenidos en uno de los hospitales participantes, y concluyó que había una relación entre concentración de oxígeno inspirado e incidencia de RP. Ello contribuyó a extender la creencia según la cual el oxígeno es causa única de la retinopatía y la práctica de reducir la oxigenoterapia para prevenir la RP, con un incremento grave en la mortalidad neonatal.
A lo largo de los años, varios autores describieron un aumento de la incidencia de RP, a pesar de la restricción en la oxigenoterapia6. De hecho, se desarrolló una línea de investigación que proponía el uso del oxígeno para tratar la neovascularización, lo cual originó un estudio prospectivo, con resultados favorables, aunque poco alentadores7.
En la actualidad, vivimos nuevamente una tendencia restrictiva del oxígeno, en la que se limitan las saturaciones en sangre al intervalo del 85-95%, al publicarse el artículo de Chowet al8, en el que con esta metodología se lograba reducir la indicación de fotocoagulación al 0% en 3 años. Recientemente se han publicado resultados similares9.
Bajo peso/inmadurezLa relación de la RP con el bajo peso es una de las asociaciones más estudiadas10. El bajo peso parece estar ligado a la inmadurez retiniana de una manera muy directa. La inmadurez sería una condición necesaria, pero no suficiente, para la RP, y debería unirse a otro/s factor/es para desencadenar el proceso, como puede ser la oxigenoterapia.
Otros factoresSe resumen en la tabla 1.
Otros factores implicados en la etiología de la retinopatía del prematuro, según los diferentes estudios
| Hematológicos | Transfusiones y exanguinotransfusiones; anemia |
| Gasométricos | Hipercarbia, hipocarbia, acidosis |
| Respiratorios | Enfermedad pulmonar crónica, distrés respiratorio del recién nacido, ventilación mecánica, episodios de apnea, anestesia general |
| Cardiológicos | Ductus arterioso permeable |
| Intestinales | Enterocolitis necrotizante |
| Cerebrales | Hemorragia periventricular |
| Infecciosos | Septicemia |
¿Cómo relacionar el papel del oxígeno y otros factores etiológicos hipotéticos en la RP con los conocimientos actuales sobre factores de crecimiento vasculares? En la actualidad, se supone que la RP es bifásica11: en la fase I se produce una isquemia retiniana por vascularización insuficiente. En la fase II esta retina produce factores vasoproliferativos que pueden conducir al desprendimiento retiniano. Los factores que controlan la vascularización pueden regularse con oxígeno (principalmente el vascular endothelial growth factor [VEGF])12 o no (principalmente el insulin-like growth factor [IGF-1])13. Un nivel bajo de IGF-1 en suero es un marcador de RP en las etapas iniciales posnatales, la fase I. Este factor es necesario para un desarrollo normal de la vasculatura retiniana, con un efecto permisivo en el VEGF. Ello significa que en la fase I la retina necesita IGF-1 para así permitir el efecto del VEGF y llegar a una vascularización normal. La lactancia materna aportaría el IGF-1. Por el contrario, en la fase II, se trataría de evitar estos factores, ya que se está produciendo una vascularización anómala, hacia el vítreo, como queda dicho.
ClasificaciónEn el tratamiento de la RP es fundamental comprender sus manifestaciones oftalmoscópicas, para valorar su gravedad e indicar el tratamiento según ella. En 1984, se publicó la Clasificación Internacional de la RP14, que supuso un hito en el tratamiento clínico de esta enfermedad, y que se ha revisado recientemente15. Se valoran 3 factores:
- 1.
La localización de la enfermedad, según 3 zonas concéntricas retinianas, y centradas en la papila (fig. 2):
- a)
La zona I es la más interna, tiene un radio de 2 distancias papila-centro de la mácula.
- b)
La zona II es concéntrica a la anterior y externa, y abarca hasta la ora serrata nasal.
- c)
La zona III comprende el creciente de retina temporal periférico a la zona II.
- a)
- 2.
La extensión de la enfermedad, contabilizada en sectores horarios de retina afectada o, lo que es lo mismo, en grados de circunferencia.
- 3.
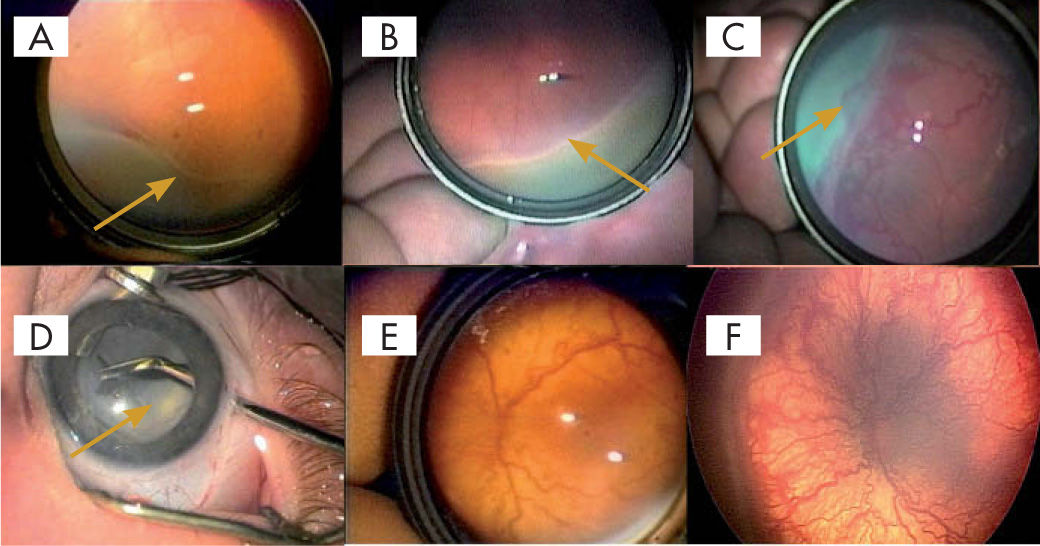
El momento evolutivo de la enfermedad, según una serie de grados activos (fig. 3). Suponen un incremento cuantitativo y cualitativo de la proliferación extrarretiniana, hasta el desprendimiento retiniano. La enfermedad plus (+), que puede combinarse con cualquiera de los otros grados, consiste en una dilatación y tortuosidad de la vasculatura en el polo posterior y denota la existencia de un shunt arteriovenoso importante, lo cual indica una enfermedad activa y, por tanto, potencialmente peligrosa.
Figura 3.A. Grado 1 de retinopatía del prematuro (RP) (línea de demarcación, flecha). La línea separa la retina inmadura (gris) de la madura y vascularizada. Hasta ella llegan los vasos. B. Grado 2 de la RP. Cresta monticular (flecha), hiperplasia de la línea de demarcación. C. Grado 3 de la RP. Se desarrolla una proliferación fibrovascular desde la cresta monticular (flecha), frecuentemente acompañada de hemorragias vitreas y/o retinianas. D. Leucocoria en un grado 5. Detrás del cristalino se identifica una membrana (flecha) seccionada parcialmente por la tijera de microcirugía. Se trata del tejido fibrovascular retrolental. E y F. Enfermedad “plus”. Dilatación y tortuosidad de los vasos en el polo posterior. Denota la existencia de un shunt arteriovenoso importante, y viene a indicar la presencia de una enfermedad activa.
(0.1MB).
La Academia Americana de Pediatría, la de Oftalmología y la Asociación Americana de Oftalmología Pediátrica y Estrabismo16 han elaborado un protocolo de exploración para la RP. Proponen que un oftalmólogo especializado examine a:
- —
Los menores de 1.500g o 30 semanas de edad gestacional al nacimiento.
- —
Los de peso comprendido entre 1.500 y 2.000g, con inestabilidad clínica, a criterio del pediatra.
Se propone que los niños nacidos con menos de 27 semanas de edad gestacional se revisen a las 31 semanas de edad posconcepcional, y a los mayores de 27 semanas, a la 4.a semana de vida17.
La midriasis exploratoria se consigue mediante instilación una hora antes del examen de una gota de ciclopentolato 0,25% + fenilefrina 1%18 o de tropicamida 0,5% + fenilefrina 2,5%19, repetidas a los 10min. Estas concentraciones farmacológicas se han considerado seguras en la práctica neonatológica. Respecto al material exploratorio, es obligatorio el uso del oftalmoscopio binocular indirecto y muy recomendable el empleo de blefarostatos para pretérminos e indentadores esclerales (fig. 4).
Tratamiento de la retinopatía del prematuro previo al desprendimiento retiniano. Crioterapia y fotocoagulaciónYa que no es posible prevenir el desarrollo de la RP, tal como ha quedado demostrado, es necesario tratarla en sus grados iniciales. El objetivo es la destrucción de la retina periférica inmadura productora de los hipotéticos factores vasoproliferativos y fibroproliferativos. Asimismo, la retina queda unida por medio de una cicatriz a la coroides subyacente, con lo que adquiere mayor resistencia al desprendimiento frente a una hipotética tracción sobre ella. El tratamiento de los grados iniciales de la RP tiene, por tanto, como finalidad, prevenir el desprendimiento retiniano típico de los grados más avanzados, unidos tradicionalmente a un pronóstico visual pobre. Como criterio aceptado tradicionalmente, se indicaba cuando había una proliferación fibrovascular vitreorretiniana (grado 3) que había alcanzado una extensión importante, con probabilidad alta de inducir un desprendimiento retiniano. Se denomina enfermedad “umbral”, tal como se la define en el estudio multicéntrico para la crioterapia en la RP20, y comprende la existencia de 5 sectores retinianos de 30° contiguos u 8 acumulativos con un grado 3 “plus” (+) en la zona I o II. Sin embargo, esta indicación está hoy sujeta a revisión.
El estudio multicéntrico para la crioterapia en la RP ha demostrado la eficacia del tratamiento “umbral” en un total de 291 niños incluidos en el protocolo y utilizando la mitad de los ojos como testigo. Recientemente, se ha publicado la eficacia del tratamiento frente a la observación a los 15 años tras la selección. No obstante, a principios de la década de 1990, y conociéndose ya la utilidad de la crioterapia en la RP tras el estudio multicéntrico, volvió a renacer el interés por la fotocoagulación (láser) en la RP.
Mediante la aplicación del láser unido al oftalmoscopio binocular indirecto, se trata de realizar una ablación de la retina periférica avascular en los casos que serían indicación de tratamiento según el protocolo para la crioterapia. Posteriormente, se introdujo el láser de diodo (semiconductores), de gran versatilidad y fácil manejo, comenzando a compararse la fotocoagulación con este tipo de láser frente a la crioterapia. La eficacia parecía similar o mayor en la fotocoagulación, pero con menos complicaciones. A partir de entonces, ha reemplazado de forma progresiva a la crioterapia como tratamiento de elección en esta enfermedad (fig. 5) debido a:
- —
Su facilidad de aplicación al ser un sistema portátil y adaptable a un oftalmoscopio binocular indirecto.
- —
El acceso a la RP posterior es sencillo y no requiere apertura conjuntival.
- —
Las complicaciones son muy infrecuentes y, por lo general, leves.
- —
Los resultados con la RP en zona I parecen superiores.
- —
Parece originar menos efectos negativos en la agudeza visual21 y la refracción final (miopía)22.
A. Fotocoagulación retiniana del pretérmino en la unidad de cuidados intensivos neonatales. B. Impactos del láser de diodo sobre la retina inmadura (avascular). C. Retina inmadura fotocoagulada, inmediatamente tras el proceso. D. La misma retina, 1 mes después del proceso (cicatriz coriorretiniana).
Por otra parte, la estrategia de la indicación “umbral” mostró una efectividad menor y una peligrosidad potencial en el tratamiento de la RP de zona I23. Para este tipo de RP varios autores recomendaron un tratamiento “preumbral”, que se demostró eficaz y carente de complicaciones. Se imponía una redefinición de enfermedad “umbral”. De este modo, surgió un estudio multicéntrico para el tratamiento temprano de la RP, el ETROP24, que identificó factores de “riesgo alto” en la RP “preumbral”. En este estudio, se definió una RP tipo 1 (de riesgo alto), en la que estaría indicado el tratamiento temprano (en menos de 48h) y que comprende los grados siguientes:
- —
Zona I: grados 1, 2 y 3 unidos a enfermedad “plus” o el grado 3 sin “plus”.
- —
Zona II: grados 2 y 3 unidos a enfermedad “plus”.
Siguiendo el protocolo, se redujeron las evoluciones anatómicas desfavorables del 15,6 al 9% (p < 0,001), y las visuales del 19,5 al 14,5% (p = 0,01).
Actualmente, es el criterio de tratamiento más extendido y el nuevo método de referencia en el tratamiento de la RP.