La fiebre es, sin duda, la causa más frecuente que requiere atención médica en niños. Se considera que hasta la cuarta parte de visitas a la urgencia infantil1 lo es por este motivo. En gran parte de las ocasiones se obtiene una causa identificable del aumento de temperatura, o bien éste obedece a circunstancias banales o autorresolutivas, pero en un 20% de las veces2 no es posible encontrar el foco por el que se presenta dicho síntoma. Hay una gran discusión acerca del manejo de esta especial situación en el niño pequeño, y durante décadas no se ha alcanzado un acuerdo común. Todavía hoy persisten enormes controversias3 a la hora de solicitud de exploraciones complementarias, uso de antibióticos o ingresos hospitalarios hasta mejoría clínica u obtención de resultados de analítica. El mayor desafío para el pediatra será encontrar el equilibrio entre la minimización de riesgos y la utilización excesiva de estrategias diagnosticoterapéuticas a la hora de tomar decisiones.
Puntos clave
La fiebre es un fenómeno adaptativo de los vertebrados que forma parte de la fase aguda de la respuesta inmune. Consiste en la elevación de la temperatura corporal de 1 a 4° Celsius por encima de la basal. El mecanismo íntimo obedece a una disregulación del termostato interno ubicado en el hipotálamo que pone en marcha los procesos habituales de conservación de calor, tanto conductuales (reducción de superficie expuesta, búsqueda de ambiente cálido) como fisicoquímicos (disminución de la sudoración, redistribución del flujo sanguíneo desde piel a zonas profundas). El punto de inicio de esta sucesión de procesos coordinados es la estimulación de las células del sistema mononuclear fagocítico por agentes infecciosos o no (pirógeno exógeno) que liberan citocinas (fundamentalmente interleucina [IL] 1) al torrente sanguíneo, que a su vez estimulan la síntesis de prostaglandina E2 (pirógeno endógeno), lo que conduce a la pérdida de regulación del núcleo preóptico hipotalámico responsable del control de la temperatura del individuo.
Definiciones específicas. Abordaje inicialEn primer lugar, se establecerán determinados conceptos comúnmente aceptados para realizar un adecuado desarrollo del tema.
- –
Fiebre4–7. Temperatura superior a 38°C medida en área rectal7, que es la que semeja más la temperatura real del núcleo hipotalámico.
- –
Hipertermia. Aumento de temperatura en ausencia de cambios en termorregulación, bien por aumento de producción de calor (feocromocitoma) o como déficit en la eliminación (golpe de calor).
- –
Hiperpirexia. Elevación de temperatura por encima de 41°C. Cuando alcanza cifras cercanas a 42°C se producen cambios en la síntesis proteica, permeabilidad vascular y pH intracelular que provocan despolarización de miocitos cardíacos y neuronas, lo que pone en serio peligro la vida del individuo.
- –
Fiebre sin foco. Fiebre de menos de 3 días8 en la que no se encuentra causa que la justifique.
- –
Bacteriemia oculta (BO). Presencia de bacterias en sangre del individuo etiquetado de fiebre sin foco pero con cuadro clínico sin apariencia séptica.
- –
Infección bacteriana grave (IBG). Diagnóstico confirmado de bacteriemia, sepsis, meningitis, neumonía, artritis, celulitis bacteriana, infección urinaria grave o enterocolitis invasiva.
Dado que la fiebre es una molestia para el niño y un motivo de angustia para los padres o familiares que piensan que el niño sanará cuando desaparezca la elevación térmica, el profesional sanitario se encuentra ante una situación crucial magnificada tanto por factores cientificotécnicos —principio de beneficiencia para el paciente, evitar conductas agresivas o ineficientes—, como por presiones sociocultares —mitos que impregnan la sabiduría popular sobre el daño que causaría la fiebre mantenida, errores conceptuales que sobre el síntoma fiebre persisten instalados en nuestro tiempo y entorno, “fiebrefobia” por parte de padres9 y familiares—. A ello se suma la posibilidad de temperatura normal a la llegada del niño al lugar de atención médica, bien por uso de antipiréticos con anterioridad, bien por medición inadecuada en domicilio10. Toda esta constelación de variables lleva a los pediatras a sobredimensionar en no pocas ocasiones el comienzo de actuación asistencial, no sólo para aliviar al niño sino también por motivos medicolegales11 si se pasa por alto una BO o IBG diagnosticadas posteriormente.
Consideraciones epidemiológicas. MicrobiologíaHay multitud de microorganismos causantes de infección febril oculta12. Su distribución varía según la epoca del año y la edad del niño.
En menores de 1 mes: Streptococcus agalactiae y enterobacterias , principalmente Escherichia coli, son responsables de la mayoría de infecciones. Otros gérmenes con riesgo vital son Listeria monocytogenes y virus (entero y herpesvirus13). Bacterias típicas de otros grupos de edad son testimoniales en la infección neonatal.
En niños de 1 a 3 meses: Streptococcus pneumoniae, Neisseria meningitidis y Haemophilus spp. han venido representando la práctica totalidad de los casos de BO. E. coli y otros gramnegativos entéricos son específicos de infección urinaria febril en este subconjunto de pacientes.
En lactantes mayores y niños pequeños (3 meses a 3 años), los agentes infecciosos del grupo anterior + Salmonella spp. copan la mayor parte del porcentaje de BO, sin olvidar que la infección de tracto urinario (ITU) en menores de 1 año aparece hasta en un 8% de las fiebres sin causa aparente, tasa que se eleva en determinados grupos4,14, alcanzando un 16% en mujeres de raza blanca14 o niños no circuncidados4,5. Para añadir más confusión, conociendo la extrema facilidad de contaminación accidental en la recogida de muestra por métodos tradicionales y que hasta un 20% de urocultivos de orina positivos5,15,16 presenta sedimento normal, convendremos en la necesidad de solicitar siempre en lactantes muestra para cultivo obtenida por procedimientos estériles.
Abundando en el estudio etiológico es fundamental no olvidar que, en cualquier caso y a cualquier edad, las infecciones virales constituyen el grueso9,12,13 de las fiebres infantiles y que los tests rápidos disponibles para determinados agentes específicos (virus sincitial, influenza, adenovirus) resultan de gran utilidad en niños de corta edad donde la pobreza sintomática es la norma. No obstante, estudios recientes16,17 revelan coinfección bacteriana hasta en el 5% de ocasiones.
En último término, y pese a los condicionantes descritos, insistiremos en la necesidad de afrontar la fiebre sin foco en niños menores de 3 años inspirando nuestro proceder en los pilares de la semiología clínica, esto es, anamnesis adecuada, exploración física minuciosa y recogida de datos orientada que consigan “enfocar” convenientemente el origen del proceso y eviten la realización de pruebas analíticas costosas, innecesarias o agresivas5,18.
Lectura rápida
El síndrome febril sin foco en menores de 3 años continúa siendo en nuestro tiempo uno de los grandes “caballos de batalla” a los que la pediatría debe responder de forma unánime y eficaz.
La mayoría de las veces la fiebre sin foco será un proceso febril mal enfocado, por ello, la anamnesis dirigida, la búsqueda de antecedentes detallada, la exploración física minuciosa y la aproximación clínica juiciosa serán las que conducirán a su oportuna resolución.
No obstante, en algunas ocasiones, sobre todo en niños muy pequeños en los que la sintomatología es escasa, deberemos extremar las cautelas y contemplar todos los factores implicados (demográficos, epidemiológicos, etc.) en el proceso a fin de solicitar las mínimas y menos agresivas pruebas complementarias que, a su vez, ofrezcan la máxima rentabilidad diagnóstica.
Aunque la mayor parte de los cuadros febriles en niños pequeños se deben a infección viral autolimitada habitualmente banal, el gran interrogante4,5 para el clínico será identificar las situaciones19, por infrecuentes que sean, en las que, a pesar de una detenida exploración fisica no se objetiven signos localizadores y nos encontremos ante una infección “escondida”, incluso con aparente buen estado general12,19.
Por este motivo, desde hace más de 20 años, se han realizado numerosos estudios con el fin de catalogar los factores, clínicos o analíticos, asociados a IBG para reconocer el grupo de pacientes con mayor riesgo de presentarla. Se diseñaron diversas escalas con puntuación de gravedad o criterios de graduación de riesgo de enfermedad amenazante que se describen a continuación.
- –
Criterios de Rochester20. Primer estudio de relevancia con carácter predictivo de BO/IBG. Aplicable a individuos menores de 2 meses. Incluye síntomas clínicos y parámetros de laboratorio (tabla 1). Pertenecerían al grupo de bajo riesgo los niños previamente sanos sin evidencia de infección en diferentes órganos y aparatos, y con analítica sanguínea compatible con la normalidad. Trabajos posteriores llevados a cabo para validar21–23 dichos criterios han mostrado valores predictivos negativos cercanos al 100%21, algo inferiores en niños menores de 30 días22,23.
Tabla 1.Criterios de bajo riesgo de enfermedad infecciosa grave en lactantes de hasta 60 días de edad con fiebre
Criterios de Rochester20. Bajo riesgo de infección bacteriana grave - •
El niño tiene buen aspecto
- •
El niño ha estado previamente sano
Nacido a término (> 37 semanas de gestación)
No recibió tratamiento antibiótico en el período perinatal
No recibió tratamiento para hiperbilirrubinemia no explicada
No recibe ni recibió tratamiento antibiótico
No haber estado previamente hospitalizado
No tiene enfermedad crónica o de base
No estuvo hospitalizado más tiempo que la madre
- •
Sin evidencia de infección de piel, tejidos blandos, articulación u oído
- •
Valores de laboratorio
Recuento glóbulos blancos de 5.000–15.000/μl
Recuento absoluto de formas inmaduras < 1.500/μl
Sedimento de orina con menos de 10 leucocitos/campo
Si hay diarrea, menos de 5 leucocitos/campo en extendido fecal
- •
- –
Criterios de Philadelphia24y Boston25. Discreta modificación de la escala anterior, incluyendo la realización de análisis de líquido cefalorraquídeo (LCR) y considerando leucocitosis por encima de 20.000/μl. Diferencian entre sí por la aplicabilidad (1–3 meses y menores de 60 días, respectivamente) y el uso de antibioticoterapia posterior (siempre en el caso de utilizar el modelo Boston).
- –
Criterios de Baraff26. Célebre trabajo de 1993 que estratifica en categorías por edad y riesgo. La valoración de éste es similar al Rochester, incluyendo además la realización de punción lumbar (PL) que resulte normal y la ausencia de aspecto séptico (alteraciones del color, de perfusión y neurológicas) como pilar básico para establecer la baja probabilidad de IBG (tabla 2). Metaanálisis realizados por el mismo autor en menores de 3 meses27 mostraron una tasa de infección invasiva < 2% en los que cumplían criterios de bajo riesgo.
Tabla 2.Criterios de bajo riesgo para presentar infección potencialmente grave en niños febriles menores de 3 años de edad
Criterios de bajo riesgo de infección bacteriana grave26 - •
Buen aspecto general
- •
Previamente sano
Nacido a término (> 37 semanas de gestación)
No recibió terapia antimicrobiana en el período perinatal
No recibió tratamiento para hiperbilirrubinemia de origen no claro
No recibió terapia antimicrobiana previa
No hay antecedentes de hospitalización
No estuvo hospitalizado más que la madre
No tiene evidencia de infecciones focales (piel, tejidos blandos, otitis)
- •
Resultados de laboratorio
Recuento de leucocitos de 5.000–15.000/μl
Recuento absoluto de bandas < 1.500/μl
< 10 leucocitos/campo en microscopia y orina con tinción gramnegativa
< 5 leucocitos/campo en examen de materia fecal si tiene diarrea
- •
- –
Escala de Yale28. Evaluación de diferentes signos clínicos (llanto, respuesta a estímulos, color, hidratación, estado neurológico y sociabilidad) en el niño febril sin apariencia séptica otorgando puntuación subjetiva de 1, 3 o 5 a discreción del observador (tabla 3). Puntuaciones mayores de 16 asociarían alta sospecha de enfermedad invasiva.
Tabla 3.Escala de puntuación de riesgo de enfermedad invasiva para niños de hasta 36 meses de edad con fiebre
Escala de observación de Yale28 Item de observación 1 punto: normal 3 puntos: deterioro moderado 5 puntos: deterioro severo Calidad del llanto Fuerte con tono normal o contento, no llora Sollozante o quejumbroso Débil o lamento o agudo Reacción al estímulo materno o paterno Llora y luego para o contento y no llora Llora y deja de llorar sucesivamente Llora continuamente o responde difícilmente Alerta Si está despierto permanece despierto o si está durmiendo y es estimulado despierta rápido Ojos brevemente cerrados y despierta o despierta con estimulación prolongada Cae en sueño o no quiere despertar Color Rosado Extremidades pálidas o acrocianosis Pálido o cianótico o moteado o ceniciento Hidratación Piel normal, ojos normales y mucosas húmedas Piel y ojos normales, boca ligeramente seca Piel pastosa o con pliegue, mucosas secas y/u ojos hundidos Respuesta a estímulo social (hablarle, sonrisa) Se ríe o se pone alerta (< 2 meses) Leve sonrisa o leve alerta (< 2 meses) No se ríe, facies ansiosa, embotada, sin expresión o no se pone alerta Puntuación: <10, baja probabilidad de infección grave; > 16, alto riesgo de enfermedad invasiva. Sensibilidad 77%, especificidad 88%, valor predictivo positivo 56%. - –
Escala YIOS29 (Young Infant Observation Scale). Adaptación de la puntuación anterior para menores de 2 meses que únicamente valora respiración, perfusión y respuesta social (tabla 4).
Tabla 4.Escala de valoración de riesgo para lactantes de menos de 3 meses de vida con fiebre
Escala de observación del lactante de corta edad (YIOS)29 - •
Actitud
Sonríe o no está irritable (1)
Irritable pero consolable (3)
Irritable no consolable (5)
- •
Estado/esfuerzo respiratorio
No hay deficiencia y está vigoroso (1)
Deterioro leve-moderado (taquipnea, retracciones, ronquidos) (3)
Dificultad respiratoria o esfuerzo inadecuado (apnea, insuficiencia respiratoria) (5)
- •
Perfusion periférica
Extremidades de color rosa y con temperatura normal (1)
Extremidades frías, moteadas (3)
Niño pálido y/o en estado de shock (5)
Puntuación = 7; sensibilidad y especificidad: 75% y valor predictivo negativo: 96% para descartar infecciones bacterianas graves. - •
Lectura rápida
Durante el período 1980–1997 se elaboraron diferentes criterios de puntuación de gravedad ideados para menores de 2–3 meses basados en signos clínicos y valoraciones cualitativas o semicuantitativas. Aunque resultan de cierta utilidad en el manejo decisorio inicial, ninguna de estas escalas ha presentado una validación significativa.
Los parámetros analíticos: hematimetría, reactantes, tests rápidos de laboratorio aportan datos de interés para la toma de posición pero no sustituyen en sensibilidad y especificidad a los cultivos selectivos de muestras biológicas cuyo tiempo de espera no permite retrasar las decisiones terapéuticas, de ahí la dificultad de abordaje.
Aceptando de entrada que la leucocitosis acompaña casi invariablemente a la bacteriemia, el valor más rentable lo da el recuento absoluto de neutrófilos como células blancas específicas y, aún más, el porcentaje de formas jóvenes (neutrófilos “en banda” o cayados). Para algunos autores la ratio neutrófilos inmaduros/neutrófilos totales > 0,2 es un excelente indicador de BO30.
Reactantes de fase aguda- –
Velocidad de eritrosedimentación. Ha mostrado escaso valor predictivo en la infección.
- –
Proteína C reactiva (PCR)31–33. Algunos autores31,32 avalan su validez, para otros no resulta más rentable que el recuento absoluto de neutrófilos33. Cifras > 50mg/l son indicativas, pero si superan 70mg/l serán altamente predictivas de infección invasiva34.
- –
Procalcitonina (PCT)35–39. Se ha convertido en el marcador más fiable a la hora de diferenciar entre IBG e infección viral o bacteriana leve en menores de 3 años. Valores > 2ng/ml incrementan 4 veces el riesgo de presentar enfermedad grave35. Usada de forma exclusiva arroja porcentajes de sensibilidad y especificidad mayores del 90%36 en estudios multicéntricos, pero el rendimiento aumenta de forma notable al analizarlo conjuntamente con PCR4,37,38.
- –
Citocinas. Sólo IL-638,39 se ha estudiado de forma reglada, y aunque aisladamente alcanza el 98%39 de especificidad comparada con otros reactantes no llega al valor predictivo de PCR, PCT o ambas juntas38.
- –
Novedosos. Estudios recientes con los receptores de complemento40 de C1 (CD35) y C3 (CD11b) en membrana de neutrófilos revelan una futura utilidad en la distinción entre infección bacteriana y viral. Comparado con los parámetros clásicos, parece ser el que más se eleva y más precozmente lo hace9.
Conocida la alta prevalencia de ITU4 en lactantes febriles menores de 1 año, la tira reactiva se convierte en un excelente método de detección precoz8,14, aunque el patrón oro continúe siendo, como ya se ha mencionado, el urocultivo con recogida estéril15.
Lectura rápida
En el mundo occidental, donde la gran mayoría de la población infantil está inmunizada frente a gérmenes potencialmente letales (meningococo C, neumococo, H. influenzae), la tasa de infección bacteriana grave o bacteriemia oculta que se manifiesta como fiebre exclusiva ha disminuido notoriamente.
Los virus y la infección urinaria silente en menores de 1 año han reemplazado el espacio porcentual que previamente ocupaban los microorganismos para los que ya existe vacuna comercializada y ampliamente difundida.
La neumonía en menores de 36 meses se acompaña de cortejo sintomático respiratorio que la hace predecible. No obstante, un estudio demuestra que la presencia de foco neumónico aparece en el 25% de las ocasiones en niños de hasta 3 años con fiebre > 39°C de más de 3 días sin motivo justificado y leucocitosis > 20.000/μl41.
Lectura rápida
Aun así no deberíamos olvidar que la bacteriemia oculta y su posterior traducción en infección generalizada siguen estando presentes y, si bien su porcentaje ha descendido de forma acusada, no ha desaparecido en su totalidad, lo que justifica continuar en estado de alerta permanente ante el niño con fiebre elevada.
Tradicionalmente, los menores de 36 meses con fiebre sin foco se han estraficado en subgrupos distintos que requerirán diferentes evaluaciones iniciales. Esta clasificación, presumiblemente arbitraria se debe a 2 fenómenos relacionados con la edad: la función inmunológica, tanto menor cuanto más joven es el individuo, y la semiología clínica, habitualmente inespecífica.
- –
Neonatos (conceptualmente, niños de 0 a 28 días de vida). Cuando presentan fiebre, el riesgo global de IBG asciende al 12%42, los gérmenes habituales se recogen en el apartado de microbiología. Los virus, patógenos frecuentes en este grupo etario, poseen una mayor capacidad para asociar meningitis5,13, aunque la posibilidad de generar secuelas está francamente disminuida en Europa occidental debido a la mayoritaria incidencia de infección por enterovirus. En las recomendaciones norteamericanas la mayor presencia de virus herpes en infecciones neonatales obliga a una estrategia de actuación más agresiva.
Esta peculiar forma de evolucionar supone la necesidad ineludible de solicitar pruebas complementarias numerosas y, ocasionalmente, cruentas, ya que la obtención de líquido cefalorraquídeo (LCR) resulta inexcusable43, junto a la muestra de sangre y orina estéril para analítica y cultivo. La radiografía de tórax y el estudio de heces tendrán sentido si aparecen síntomas específicos respiratorios o digestivos.
- –
Lactantes pequeños (de 28 a 90 días). Hasta la década de los noventa los gérmenes habituales fueron neumococo, Haemophilus y meningococo, y el riesgo de bacteriemia oculta era del 1-2%44,45. Tras la implantación de vacunación universal contra H. influenzae B45 este germen ha desaparecido prácticamente en todas las clasificaciones etiológicas de sepsis en este grupo de niños. Por otra parte, Streptococcus beta-hemolítico del grupo B, frecuente en neonatos, está adquiriendo un papel emergente como causante de sepsis neonatal de inicio diferido (desde 1 hasta los 3 meses de edad), que clínicamente cursa con meningismo o celulitis cutánea. Su presentación tardía nos hace incluirla en ésta y no en la anterior categoría.
En la primera evaluación será obligado recoger muestras de sangre para hemograma, cultivo y medición de reactantes en los niños con altas puntuaciones en escala de gravedad o criterios de alto riesgo. La punción lumbar (PL), aún recomendada en todos los pacientes con fiebre elevada5,43 podría reservarse a niños con aspecto tóxico o alteraciones analíticas sanguíneas muy sugerentes, sabiendo no obstante que la meningitis podría estar presente hasta en el 0,4%46 de niños de esta edad con criterios de bajo riesgo.
La presencia de tos, disnea o cianosis conllevará la petición de placa de tórax y la detección rápida de antígenos de virus respiratorios característicos en esta época de la vida.
- –
Lactantes mayores y niños pequeños (de 3 a 36 meses de vida). El panel microbiológico descrito en el punto consideraciones epidemiológicas ha presentado un sensible cambio con el inicio del nuevo milenio merced a la introducción progresiva de vacuna neumocócica conjugada heptavalente47,48 (VNC7) contra serotipos responsables de enfermedad invasiva, consiguiendo tasas de descenso de infección neumocócica del 65-80%5, lo que unido al hecho de una mayor facilidad exploratoria se traduce en una enorme reducción de solicitud de exámenes complementarios. Tan sólo en situaciones con criterios de gravedad o signos sugerentes de IBG se hará así. La mayor parte de cuadros clínicos serán fácilmente identificables; sin embargo, algunas infecciones ocultas (ITU en < 1 año, BO, neumonías) deben ser razonablemente descartadas.
Es en esta clase de pacientes donde la analítica de sangre ofrece una mayor rentabilidad predictiva: la neutrofilia con reactantes aumentados serán buenos marcadores de BO. Teniendo en cuenta el gran descenso de la tasa de bacteriemias atribuibles a gérmenes típicos y conociendo que meningococo y Salmonella son más sintomáticos es bastante probable que los niños febriles con pauta VNC7 finalizada y buen aspecto no sean sometidos a exploraciones complementarias48.
La decisión de tratar o no la fiebre continúa siendo tema de discusión. Reconociendo el beneficio del descenso de temperatura para reconfortar al niño y tranquilizar a los padres10, es preciso aclarar que no hay estudios suficientes que establezcan una correlación directa entre la respuesta a los antitérmicos y la causa potencial de la fiebre, contraviniendo la creencia popular de que la fiebre que desciende lentamente se debe a una infección más grave. Sin embargo, es importante incidir que en niños muy pequeños la persistencia de fiebre elevada a pesar de su tratamiento sintomático presenta una discreta asociación estadística con el riesgo de bacteriemia en algunos trabajos49.
AntipiréticosLos antipiréticos más empleados en el arsenal terapéutico por vía oral4 son paracetamol, a dosis de 15mg/kg/dosis hasta cada 4h, e ibuprofeno, a 10mg/kg/dosis con un máximo de 30–40mg/ kg/día. Como alternativa, y por vía rectal, se dispone de paracetamol en 2 únicas presentaciones de 150 y 300mg y metamizol magnésico a dosis de 500mg, productos que hay que utilizar cuando no hay posibilidad para vía oral y se pretende evitar o no se puede tener acceso a la administración parenteral.
El análisis de eficacia comparada y la conveniencia de alternancia entre unas u otras sustancias escapa del objeto de este artículo.
Lectura rápida
Los pacientes febriles a los que un pediatra atenderá se subdividen, de forma teórica, en 3 categorías virtuales:
- a)
neonatos (0–28 días);
- b)
lactantes pequeños (1–3 meses), y
- c)
lactantes extendidos (3–36 meses). Esta, aparentemente caprichosa, clasificación obedece a criterios clínicos y epidemiológicos, ya que las consideraciones específicas según edad ayudan a la realización de recomendaciones distintas y diferencias sutiles en los algoritmos de decisión comúnmente aceptados, más aún, las bacterias responsables y el comportamiento al enfermar varían de forma sustancial en los 3 subgrupos antes mencionados.
Seguiremos empleando el modelo estratificado.
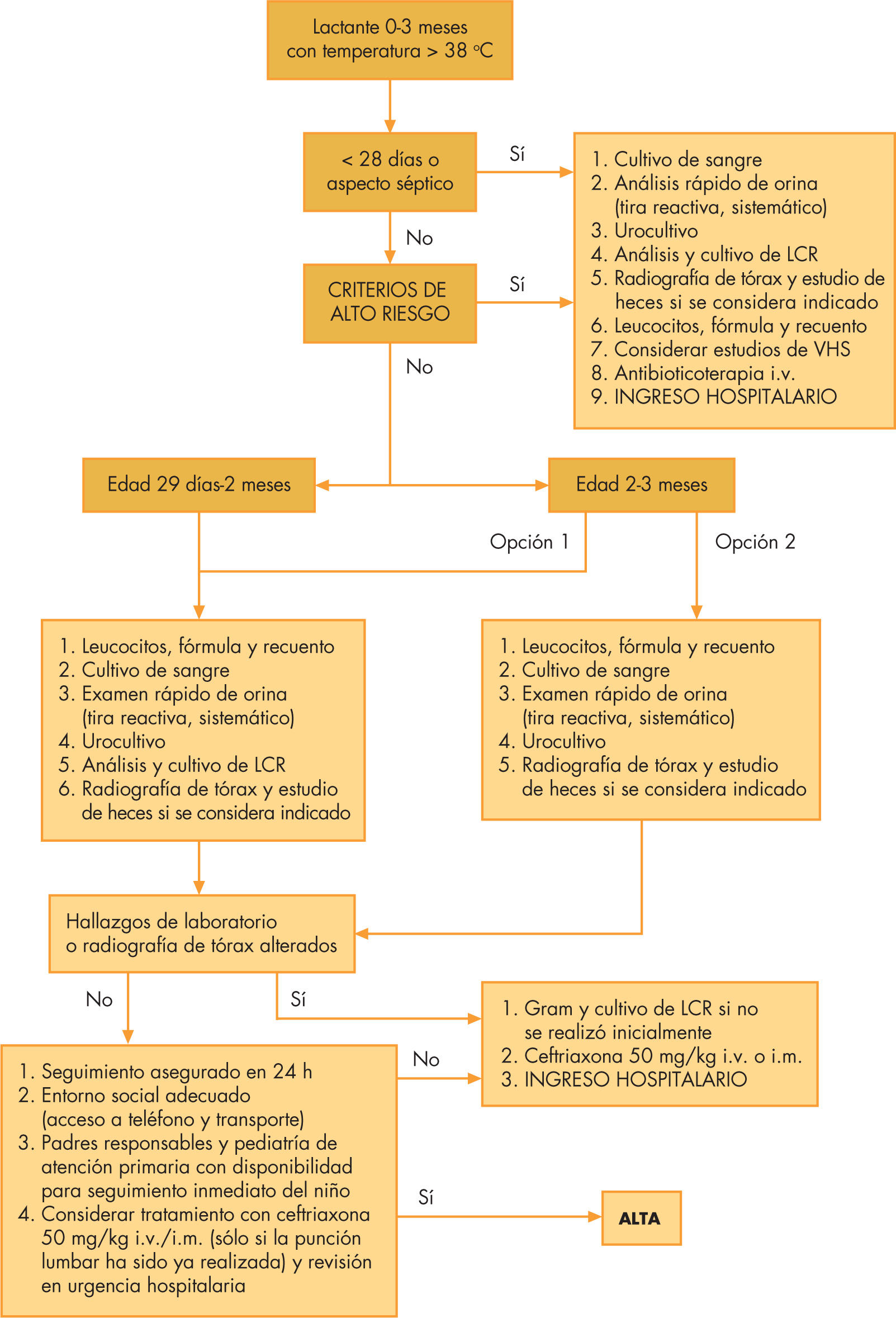
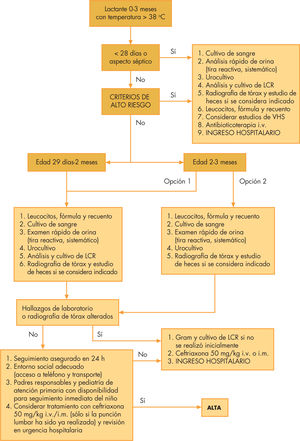
Neonatos. Clásicamente se ha dado por sentado que el menor de 28 días con fiebre precisará ingreso hospitalario, independientemente del origen del aumento térmico y de la cuantificación del riesgo según la escalas anteriormente explicadas. Se investigará el posible proceso séptico (repertorio completo de exploraciones complementarias incluyendo PL) y recibirá antibioticoterapia empírica26 con ampicilina (para cubrir posibilidad de Listeria) más gentamicina o cefotaxima dependiendo de la edad, la sospecha etiológica y la ecología geográfica (fig. 1). En caso de presunción de infección meníngea por herpesvirus se postula el uso precoz de aciclovir.
En los últimos tiempos se está evaluando de forma insistente la posibilidad de aplicar criterio de ingreso obligado sólo a niños menores de 7 días, individualizando el riesgo en mayores de esta edad según las escalas cuantitativas disponibles y reservando la admisión en hospital para aquellos con aspecto séptico inicial5,43 y criterios de riesgo presentes. Se añade un nuevo escenario de debate para aquellos a quienes se envía a domicilio desde el departamento de urgencias, ya que algunas guías de actuación27,43 recomiendan la administración de antibioticoterapia en todo menor de 1 mes al que se haya realizado PL por el riesgo de infección tras manipulación del canal vertebral.
Lactantes pequeños (fig. 1). En niños de 1 a 2 meses, teniendo en cuenta el escaso valor predictivo para meningitis que los estudios sanguíneos ofrecen, se determinará estudio de sepsis en toda su amplitud contemplando el análisis LCR entre las peticiones5. Para pacientes de 60 a 90 días con buen estado general inicialmente bastará con recogida de muestras de sangre y orina para análisis básico y cultivo. En pacientes con signos indicadores de riesgo y, en virtud de los resultados analíticos, se decidirá la pertinencia de realizar PL. El antibiótico de elección dependerá de la infección sospechada, oculta o no, aunque cefalosporinas como cefotaxima y ceftriaxona son los de empleo más habitual.
El uso de ceftriaxona intramuscular profiláctica a dosis de 50mg/kg y evaluación posterior en 24h concediendo alta tras la inspección en urgencias es una tema cuya controversia persiste desde hace décadas. Hace casi 20 años niños con criterios de Boston25 (v. apartado “Escalas de gravedad”) de bajo riesgo (menos de 20.000 leucocitos/μl, análisis de orina y LCR normales) recibían 1 dosis de dicho fármaco y eran dados de alta con el compromiso de visita revaluadora. La versión “conservadora” de esta óptica la presentaron los criterios de Philadelphia de bajo riesgo24, similares a los de Boston excepto en la consideración de glóbulos blancos (< 15.000/μl); en este caso los pacientes volvían a su domicilio sin prescripción de antibiótico alguno.
Hoy en día, este proceder resulta altamente infrecuente debido, en gran medida, al enorme descenso de la IBG por H. influenzae B desde la introducción de la vacuna45. Como norma general, y a pesar de criterios cuantitativos de bajo riesgo, una actitud de minimización de riesgos recomendada50 consistiría en realizar estudio completo de sepis, excepto punción lumbar, e ingresar para observación en hospital sin antibioticoterapia. En caso de valoración de muy bajo riesgo en función de datos clinicoanalíticos, la “arriesgada” decisión de no ingreso sólo se tomará si se cumple cada una de las siguientes premisas5,8: comprensión del proceso por parte de padres o cuidadores; disponibilidad en vivienda de termómetro para toma de temperatura; teléfono para solicitud de información; automóvil o medio de transporte sencillo, y cercanía relativa a un centro hospitalario.
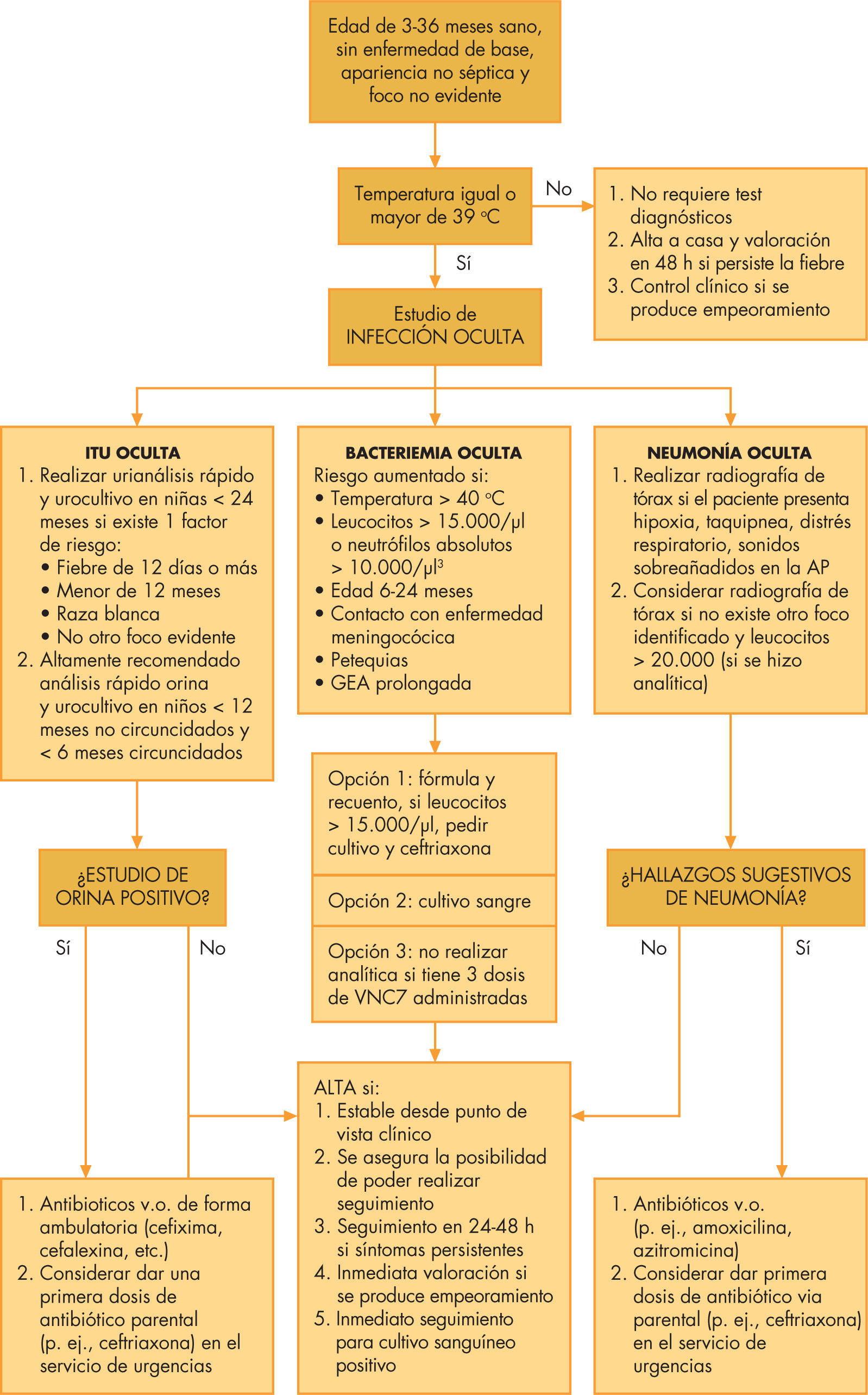
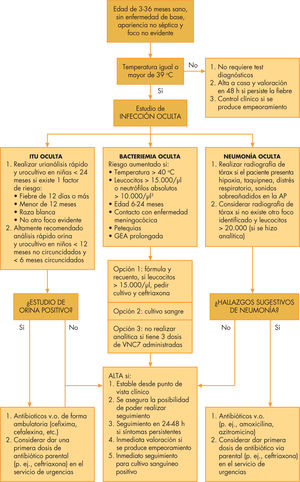
Niños de 3 meses a 3 años (fig. 2). Se tomará muestra sanguínea en niños con fiebre > 39°C, mal estado general o inmunización VCN7 incompleta. Se solicitará recogida de orina por método aséptico para sedimento y urocultivo en individuos seleccionados. El estudio de LCR quedará confinado a casos con clínica sugerente y/o pacientes no vacunados contra meningococo C. La radiografía de tórax51 se realizará en función de las alteraciones respiratorias presentadas, fiebre prolongada o leucocitosis manifiesta41,50,51.
El ingreso en hospital y los antibióticos que se deban utilizar dependerán de la sintomatología evidenciada y los resultados de las pruebas complementarias, aunque cefalosporinas de segundatercera generación son los fármacos empleados con mayor asiduidad. En multitud de casos, no se requerirá hospitalización y el paciente será dado de alta sin prescripción antibiótica y seguido de forma ambulatoria, aunque ocasionalmente, si las pruebas complementarias dejan un mínimo resquicio al riesgo de bacteriemia (leucocitosis > 15.000, PCR elevada y fiebre > 39°C) la utilización de amoxicilina a altas dosis puede ser una opción perfectamente plausible5,43.
Lectura rápida
Abundando en esta circunstancia, se reconoce tanto mayor riesgo de complicaciones graves cuanto menor es la edad del individuo. Por ello, el subconjunto neonatal, y, dentro de éste, los pacientes de 0 a 7 días serán el grupo diana en el que las múltiples y variadas exploraciones complementarias estén justificadas “de facto”.
Los serotipos no incluidos en la vacuna antineumocócica heptavalente disponible en la mayoría de países de nuestro entorno sanitario, están adquiriendo un papel preponderante en enfermedades invasivas ocultas (sepsis, neumonías complicadas con derrame, etc.) en niños febriles. Es extremadamente importante no caer en el fácil error de considerar la ausencia de riesgo por atender a una población con alta tasa de coberturas vacunales que no protegen ante determinados serogrupos bacterianos.
Por último, resulta de interés advertir que este paisaje aparentemente sosegado que se plantea en infantes jóvenes se ve favorecido por el hecho de que un elevado porcentaje de BO neumocócicas se resuelven espontáneamente44; pero, a su vez, queda empañado por el hecho concomitante del fenómeno de “reemplazo ecológico” que los subtipos no incluidos en la vacuna están provocando en la etiología de la enfermedad invasiva5. Por ello, aunque el ingreso hospitalario no figura en el manejo habitual de muchos de estos niños, incluso en infección confirmada (neumonía o ITU pueden tratarse ambulatoriamente) no se debe caer en la imprudencia de considerar que nos encontramos cercanos al riesgo cero, lo que hará que en determinadas circunstancias actuemos de forma relativamente agresiva.
Queda patente, por tanto, que nos hallamos ante un tema de permanente debate en el que los avances en el conocimiento científico nos sorprenderán en años venideros con interesantes revisiones de las recomendaciones actuales.
Lectura rápida
El uso de dosis única de antibioticoterapia parenteral (habitualmente ceftriaxona intramuscular 50mg/kg/dosis) y revaluación posterior en 24h en niños pequeños con criterios de bajo riesgo de infección grave y punción lumbar realizada, se está sometiendo a debate permanente y se trata de una decisión que de forma paulatina se va abandonando en los servicios de urgencia pediátrica; probablemente, debido a los condicionantes reflejados en los puntos anteriormente comentados.