Las hepatitis virales son una de las principales hepatopatías del niño, se trata de procesos crónicos con un importante efecto nocivo a largo plazo. El tratamiento de estas patologías es complejo y controvertido, siendo la indicación de tratar uno de los puntos más conflictivos. Aunque existen múltiples medicamentos para el tratamiento de la hepatitis B y C, no todos los estudios en población pediátrica aportan datos concluyentes. El objeto de este artículo es hacer una revisión de la evidencia publicada acerca del tratamiento actual en niños.
Puntos clave
Hepatitis B:
- •
Aunque el 90% seroconvierte el HBeAg, el 4% desarrolla cirrosis y el 2% carcinoma hepatocelular.
- •
Se recomienda tratar a pacientes con elevación persistente de transaminasas, alta carga viral y fibrosis hepática.
- •
El tratamiento de elección es el interferón, durante 24 semanas, la forma pegilada permite su administración semanal.
- •
La lamivudina y el adefovir están aprobados en niños pero su eficacia es menor y presentan problemas de resistencias.
- •
El entecavir y el tenofovir son alternativas esperanzadoras a falta de más estudios en niños.
Hepatitis C:
- •
En niños presenta un curso prolongado en el que hasta el 25% aclaran el virus.
- •
El tratamiento está indicado en mayores de 3 años, con elevación persistente de transaminasas y fibrosis hepática.
- •
El genotipo, las características del individuo y la respuesta viral condicionan la elección y la duración del tratamiento.
- •
El tratamiento de elección es interferón pegilado + ribavirina.
- •
Los inhibidores de proteasa están en fase de ensayo clínico.
El virus B de la hepatitis (VHB) es un virus encapsulado ADNA de la familia Hepadnaviridae. Existen 8 genotipos (A-H) diferenciados entre sí por una divergencia de al menos un 8% de la secuencia completa de nucleótidos. El virus tiene 3 antígenos útiles en el diagnóstico y el seguimiento: HBeAg, HBsA y HBcAg, frente a los cuales se crean anticuerpos.
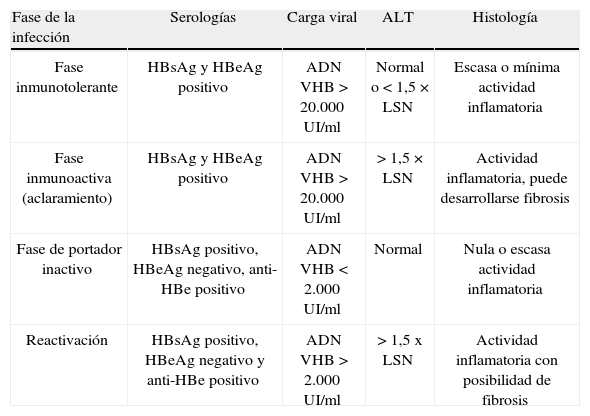
Evolución natural de la infección en niñosLa infección crónica por VHB, definida por un HBsAg-positivo durante más de 6 meses, puede mostrar varias fases que es necesario conocer para valorar la indicación de tratamiento (tabla 1).
Fases de la hepatitis crónica B
| Fase de la infección | Serologías | Carga viral | ALT | Histología |
| Fase inmunotolerante | HBsAg y HBeAg positivo | ADN VHB > 20.000UI/ml | Normal o < 1,5 × LSN | Escasa o mínima actividad inflamatoria |
| Fase inmunoactiva (aclaramiento) | HBsAg y HBeAg positivo | ADN VHB > 20.000UI/ml | > 1,5 × LSN | Actividad inflamatoria, puede desarrollarse fibrosis |
| Fase de portador inactivo | HBsAg positivo, HBeAg negativo, anti-HBe positivo | ADN VHB < 2.000UI/ml | Normal | Nula o escasa actividad inflamatoria |
| Reactivación | HBsAg positivo, HBeAg negativo y anti-HBe positivo | ADN VHB > 2.000UI/ml | > 1,5 x LSN | Actividad inflamatoria con posibilidad de fibrosis |
LSN: límite superior normalidad.
En niños la fase de inmunotolerancia (inmunotolerante) puede durar años, hasta 10, y suele cursar de manera asintomática. A largo plazo, el 90% de los niños no tratados consiguen la seroconversión HBeAg; sin embargo, hasta el 4% de los pacientes desarrolla cirrosis y el 2% carcinoma hepatocelular incluso en edad pediátrica1.
Indicaciones de tratamientoEl objetivo de tratamiento en la hepatitis B es prevenir la fibrosis y cirrosis hepática, el fallo hepático y el carcinoma hepatocelular. La resolución de la infección crónica se mide por la pérdida y/o seroconversión del HBsAg.
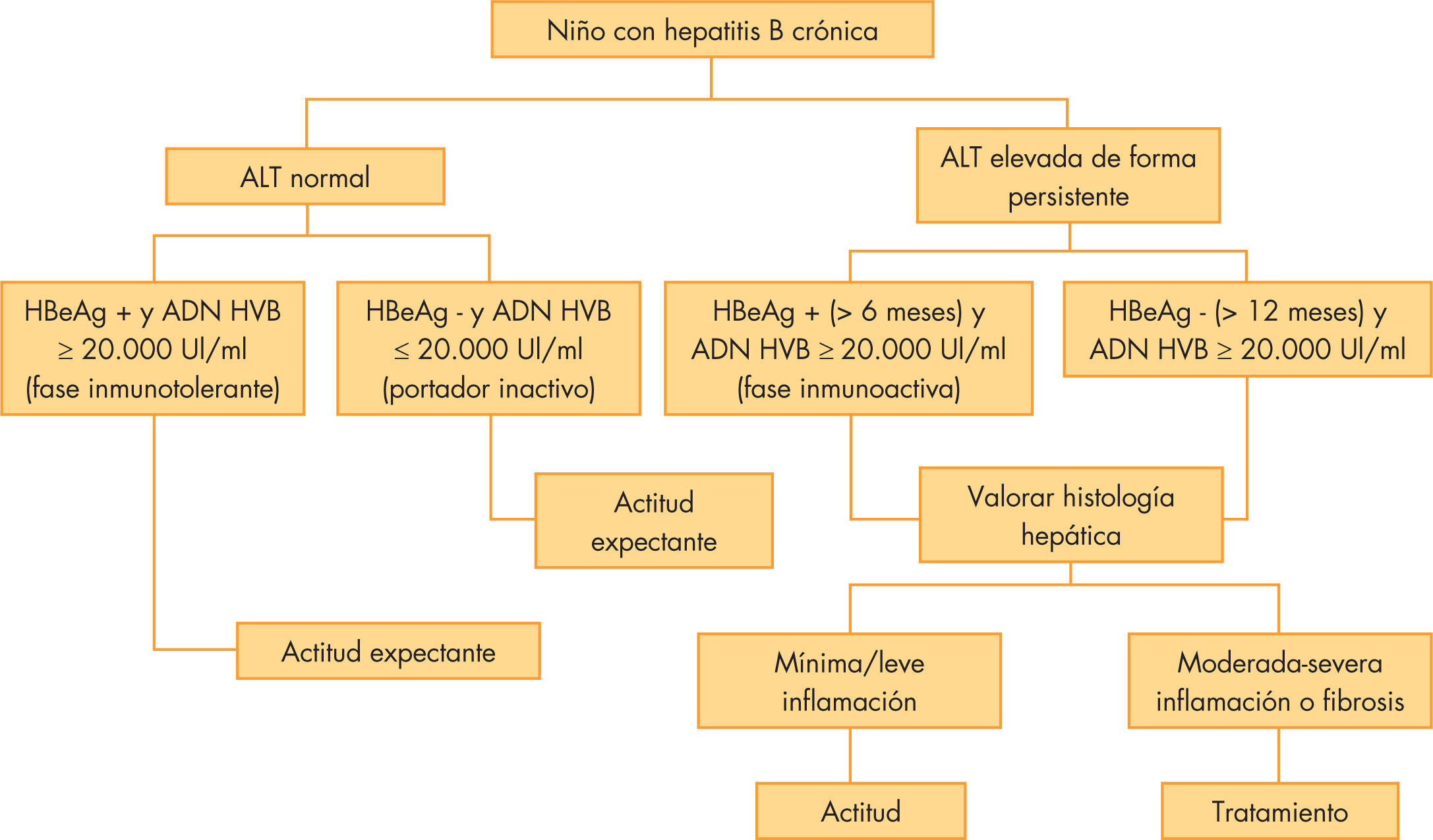
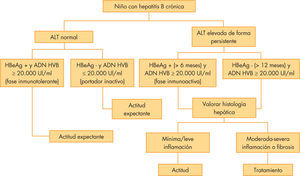
Se recomienda una actitud conservadora, pero está indicado iniciar tratamiento en pacientes con elevación mantenida de transaminasas, elevada carga viral y evidencia de fibrosis hepática (METAVIR > 2), así como valorar el tratamiento en pacientes con patología grave2,3. El algoritmo propuesto para el tratamiento de la hepatitis B se recoge en la figura 1.
Algoritmo de decisión en hepatitis B. Modificado de Jonas et al2.
ALT: alanino aminotransferasa; ; VHB: virus de hepatitis B.
- –
Interferón (IFN). Es un agente inmunomodulador implicado en la respuesta inmunitaria antiviral. La adición a la molécula de polietilenglicol (IFN pegilado [IFN-PEG]) prolonga la vida media, permitiendo su administración semanal. Se administra por vía subcutánea a una dosis de 100–180μg/1,73m2/semana para el INF-PEG-2a y de 1,5μg/kg/semana para el INF-PEG 2b. En un estudio a largo plazo4 se observó la negativización del HBeAg4 en el 31% de los pacientes tratados a los 12 meses de finalizado el tratamiento con IFN, frente a un 13,5% en el grupo control. Las cifras elevadas de alanino aminotransferasa (ALT), una actividad histológica mayor y una carga viral baja son predictores de respuesta al tratamiento. En el seguimiento a 5 años, los pacientes no respondedores negativizaron el HBeAg en un 29% y los no tratados en un 49%, por lo que el tratamiento con IFN acelera el proceso espontáneo de aclaramiento de HBeAg. El IFN favorece la pérdida del HBsAg en pacientes con mayor predisposición a responder al tratamiento (un 25% de esos pacientes).
Entre los efectos secundarios asociados al IFN, el cuadro seudogripal tras la administración es el más frecuente, otros más importantes son la neutropenia (que se maneja con descenso de dosis o suspensión si es menor de 750 leuc/μl), el descenso de la velocidad de crecimiento y de ganancia ponderal, y hasta un 20% muestran alteraciones analíticas de las hormonas tiroideas. Se suelen resolver tras la finalización del tratamiento.
- –
Lamivudina. Es un análogo de nucleósido que se administra por vía oral a 3mg/kg/día en dosis única. El 23% de los niños tratados con lamivudina durante 12 meses consiguen negativizar el HBeAg y el ADN-VHB. Un 55% normaliza los niveles de ALT de forma mantenida. El tratamiento con lamivudina no aumenta la seroconversión HBsAg5. Niveles altos de ALT (> 2 × LSN) pretratamiento son predictores de buena respuesta. El tratamiento hasta 2 años aumenta la eficacia hasta el 32%, pero desciende al 21% a los 36 meses de tratamiento6, por la aparición de resistencias, un 19% en los tratados durante un año hasta un 64% en los tratados durante 36 meses. No se han descrito efectos adversos graves con este fármaco.
- –
Adefovir. Es un análogo de nucleósido aprobado para su uso en edad infantil. Su administración es oral, a la dosis de 0,3mg/kg/día en niños de 2 a 6 años, 0,25mg/kg/día en niños hasta 11 años y 10mg/día a partir de 12 años. En el mayor ensayo publicado en niños7, tratados durante 48 semanas, se demostró una eficacia en forma de negativización del ADN-VHB y normalización de los valores de transaminasas del 23%, solo en pacientes mayores de 12 años. La seroconversión del HBeAg ocurrió en el 16% de los pacientes tratados. No se describieron efectos adversos ni mutantes resistentes durante el periodo de observación, pero sí en adultos con tratamientos más prolongados.
- –
Tenofovir. Es un análogo de nucleósidos; la dosis en adultos es de 245mg/día; recientemente se ha publicado un ensayo clínico con adolescentes8 mayores de 12 años tratados con 300mg/día por vía oral durante 72 semanas. Se observó una respuesta virológica (ADN-VHB < 400 UI/ml al final del tratamiento) del 89%. El 74% de los pacientes con elevación de ALT normalizaron su valor al final del tratamiento. No aumentó la tasa de seroconversión HBeAg. El 85% presentó algún efecto adverso, elevación de ALT y acné; no se describieron osteoporosis ni cepas resistentes. No se dispone todavía de datos a largo plazo y la dosis y duración del tratamiento en niños aún no está establecida.
- –
Entecavir. Otro análogo de nucleósidos utilizado en adultos pero sin ensayos clínicos publicados en población pediátrica. A los 3 años de tratamiento, el 92% presenta carga viral indetectable y un 43% seroconversión HBeAg. Presenta una tasa muy baja de resistencias, 1,25% a los 3 años sin efectos adversos descritos9.
Actualmente, el tratamiento de elección en niños es el IFN alfa-2 durante 24 semanas. Las opciones de segunda línea (lamivudina y adefovir) aprobadas en niños tienen escasa eficacia y/o problemas de resistencias, por lo que los nuevos análogos de nucleósidos, a espera de más resultados, son una opción terapéutica off label.
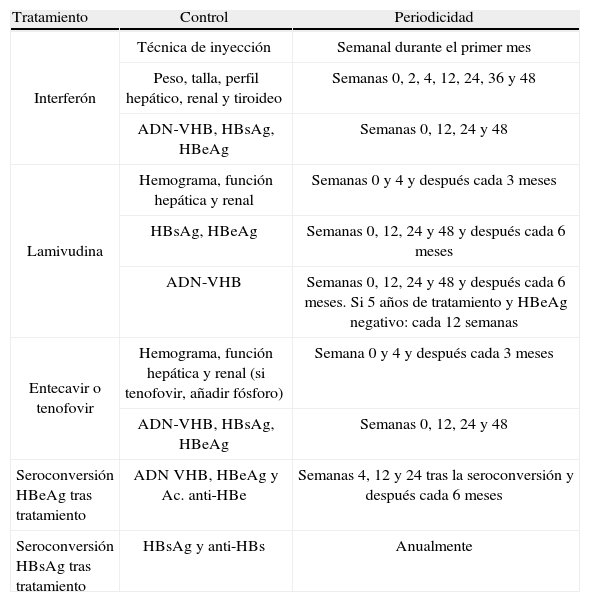
Controles durante el tratamientoLas guías NICE 2013 recomiendan los controles reflejados en la tabla 2.
Controles en pacientes con hepatitis B en tratamiento
| Tratamiento | Control | Periodicidad |
| Interferón | Técnica de inyección | Semanal durante el primer mes |
| Peso, talla, perfil hepático, renal y tiroideo | Semanas 0, 2, 4, 12, 24, 36 y 48 | |
| ADN-VHB, HBsAg, HBeAg | Semanas 0, 12, 24 y 48 | |
| Lamivudina | Hemograma, función hepática y renal | Semanas 0 y 4 y después cada 3 meses |
| HBsAg, HBeAg | Semanas 0, 12, 24 y 48 y después cada 6 meses | |
| ADN-VHB | Semanas 0, 12, 24 y 48 y después cada 6 meses. Si 5 años de tratamiento y HBeAg negativo: cada 12 semanas | |
| Entecavir o tenofovir | Hemograma, función hepática y renal (si tenofovir, añadir fósforo) | Semana 0 y 4 y después cada 3 meses |
| ADN-VHB, HBsAg, HBeAg | Semanas 0, 12, 24 y 48 | |
| Seroconversión HBeAg tras tratamiento | ADN VHB, HBeAg y Ac. anti-HBe | Semanas 4, 12 y 24 tras la seroconversión y después cada 6 meses |
| Seroconversión HBsAg tras tratamiento | HBsAg y anti-HBs | Anualmente |
VHB: virus de la hepatitis B.
El virus de la hepatitis C (VHC) es un virus ARN de cadena simple positiva del género Hepacivirus, de la familia Flaviviridae. Existen 6 genotipos, numerados del 1 al 6; en nuestro medio el genotipo más prevalente es el 1, seguido del 2 y 3, mientras que los genotipos 4 a 6 son infrecuentes. La prevalencia de infección crónica en niños varía entre el 0,1 y el 2%. Las vías de transmisión en niños son la parenteral y la vertical, si bien tras 1992 la vía parenteral disminuyó drásticamente, de manera que la mayoría de los casos pediátricos actualmente se deben a la transmisión vertical10.
Evolución natural de la infección en niños11La forma más frecuente de presentación de la infección al diagnóstico es asintomática, diagnosticándose por lo general en un cribado familiar en hijos de madres infectadas.
La mayoría muestra un hepatitis mínima o leve en la biopsia hepática, siendo frecuente la hepatitis moderada; la hepatitis severa y cirrosis son raras (1% de afectados). El índice de fibrosis en la biopsia tiende a incrementarse en pacientes adolescentes y jóvenes adultos.
Entre un 21 y un 25% de los niños con VHC de transmisión vertical consiguen aclarar el virus, con una edad media de 14,9 meses.
Indicaciones de tratamientoDada la evolución de la enfermedad, en niños existe controversia en qué momento tratar la enfermedad. Se consideran candidatos a tratamiento a los pacientes mayores de 3 años con infección crónica y elevación persistente de transaminasas o aquellos con progresión de la enfermedad12 (desarrollo de fibrosis).
Elección del tratamientoEl objetivo del tratamiento es erradicar el virus del organismo y evitar la progresión de la enfermedad hepática. A la hora de elegir el tratamiento y la duración del tratamiento, hay que tener en cuenta:
- –
Genotipo viral: los genotipos 2 y 3 responden mejor al tratamiento que el genotipo 1. La duración del tratamiento también es mayor para el genotipo 1 (48 semanas) que para el 2 y 3 (24 semanas).
- –
Características del individuo: determinados polimorfismos del receptor de IL28B son predictores de respuesta al tratamiento.
- –
Respuesta viral: véase la tabla 3.
Tabla 3.Definiciones de respuesta viral
Parámetro Definición Respuesta viral rápida Niveles séricos de ARN VHC indetectables a las 4 semanas de inicio de tratamiento Respuesta viral precoz Carga viral indetectable o caída de 2 logaritmos decimales a las 12 semanas de iniciado el tratamiento Ausencia de respuesta Carga viral detectable a las 24 semanas de iniciado el tratamiento. Es indicación de finalización del tratamiento Respuesta parcial Caída de 2 logaritmos en la carga viral pero sin ser indetectable a la semana 24 de inicio de tratamiento Respuesta viral sostenida Carga viral indetectable a las 24 semanas después de haber concluido el tratamiento equivale a curación de la infección VHC: virus de la hepatitis C.
- –
IFN alfa: estudios en adultos con INF-PEG-2b muestran una respuesta viral sostenida del 14% en el caso del genotipo 1 y del 49% para los genotipos 2 y 3, sin encontrarse diferencias significativas con el INF-PEG-2a13.
- –
Ribavirina: análogo de nucleósido (guanosina), con actividad antiviral e inmunomoduladora. La vía de administración es oral, a una dosis de 15mg/kg/día dividida en 2 dosis. En niños, la ribavirina muestra eficacia al asociarse a IFN, alcanzando una respuesta viral sostenida del 53% para el genotipo 1 y hasta del 93% en genotipos 2,314. El principal efecto adverso de la ribavirina es la hemólisis, causando caída de las cifras de hemoglobina en todos los pacientes, debiendo reducir dosis si aparece anemia. La dosis debe disminuirse en caso de disminución del filtrado glomerular y su uso está contraindicado en pacientes con insuficiencia renal.
- –
Inhibidores de la proteasa NS3/4A: utilizados en el genotipo 1 y actualmente en fase de ensayo clínico en pacientes pediátricos, moléculas como el telaprevir o boceprevir han demostrado eficacia en adultos. Se utilizan en combinación con INF-PEG y ribavirina debido a la aparición de cepas mutantes resistentes al tratamiento en monoterapia. Ambos se administran por vía oral y son metabolizados por el CYP3A. En cuanto al boceprevir, parece más eficaz iniciar el tratamiento con una fase inicial de tratamiento convencional de 4 semanas e introducir en ese momento el inhibidor si se alcanza una carga viral baja, consiguiendo una respuesta viral sostenida del 67%15. Sin embargo, hay que determinar la duración y momento del tratamiento con estos fármacos, aunque parece que pueden disminuir la duración del tratamiento hasta 24–28 semanas en pacientes respondedores y no cirróticos16. Los efectos secundarios más importantes son anemia, rash cutáneo y efectos gastrointestinales.
Actualmente, es la combinación INF-PEG + ribavirina durante 48 semanas para el genotipo 1 y 24 semanas para los genotipos 2 y 3.
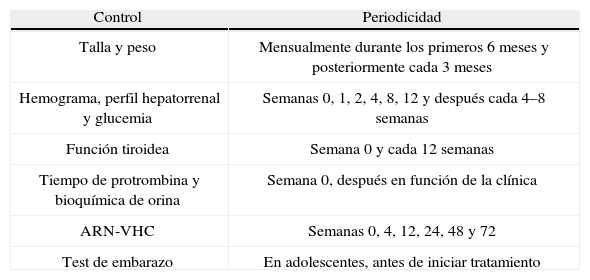
Los controles durante el tratamiento se recogen en la tabla 4.
Controles en pacientes en tratamiento para VHC
| Control | Periodicidad |
| Talla y peso | Mensualmente durante los primeros 6 meses y posteriormente cada 3 meses |
| Hemograma, perfil hepatorrenal y glucemia | Semanas 0, 1, 2, 4, 8, 12 y después cada 4–8 semanas |
| Función tiroidea | Semana 0 y cada 12 semanas |
| Tiempo de protrombina y bioquímica de orina | Semana 0, después en función de la clínica |
| ARN-VHC | Semanas 0, 4, 12, 24, 48 y 72 |
| Test de embarazo | En adolescentes, antes de iniciar tratamiento |
VHC: virus de la hepatitis C.
Los autores declaran no tener ningún conflicto de intereses.