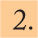Puntos clave
La trombopoyesis es el proceso de formación de las plaquetas. A partir de las colonias formadoras de unidades megacariocíticas, se forman promegacarioblastos y megacarioblastos, que se transforman en megacariocitos maduros cuyas proyecciones membranosas se fragmentan para formar plaquetas (entre 1.000 y 3.000 por megacariocito)1.
La trombopoyetina (Tpo) tiene un papel destacado como regulador principal ya intraútero2,3 y está involucrada en la diferenciación a líneas plaquetarias específicas de las células madre hematopoyéticas, proliferación de células progenitoras, diferenciación de megacarioblastos a megacariocitos y producción de plaquetas a partir de megacariocitos3–6. La concentración sanguínea de Tpo depende de la cantidad de receptores c-Mpl en plaquetas y megacariocitos plasmáticos. En la trombocitosis, aumenta la cantidad de receptores, incrementando el consumo de Tpo y reduciendo su concentración plasmática, disminuyendo así la megacariopoyesis; lo contrario pasa en la plaquetopenia1,3,4.
Otro mediador importante en la trombopoyesis es la interleucina 11 (IL-11) que estimula la diferenciación de megacariocitos y la producción de plaquetas4.
DefiniciónLos precursores hematopoyéticos se encuentran en el saco vitelino, desde allí migran al principal órgano hematopoyético fetal, el hígado, a las 6 semanas de gestación (SG)7–9. Entre las 16-18 SG, empieza la migración de precursores hacia la médula ósea que será el principal órgano hematopoyético en la vida posnatal7–9. Las primeras plaquetas morfológicamente reconocibles aparecen en la circulación fetal entre las 5-9 SG3,7. Se ha objetivado que el recuento plaquetario aumenta a medida que avanza la edad gestacional2,10 y parece que hacia las 18 SG es similar al de los adultos7–9.
Así pues, según la literatura, al final del primer trimestre de gestación el recuento plaquetario oscila en torno a 150 × 109/l9 y al final del segundo trimestre en torno a 175-250 × 109/l8, por lo que se puede definir la trombocitopenia neonatal como un recuento plaquetario inferior a 150 × 109/l, independientemente de la edad gestacional4,11; no obstante, algunos autores consideran que el recuento plaquetario normal puede ser inferior a 150 × 109/l dependiendo de la edad pre y posconcepcional2,10. Se considera trombocitopenia grave cuando el recuento plaquetario es inferior a 50 × 109/l12.
IncidenciaLa prevalencia de la trombocitopenia oscila entre el 1-5% de todos los recién nacidos, aunque el porcentaje varía según la población estudiada11–15. En los neonatos ingresados en las UCIN hasta el 22-35% presenta plaquetopenia, por lo general de carácter leve-moderado y más frecuente a menor edad gestacional y en pacientes con retraso del CIR11–13,16. No obstante, un 5-10% de este grupo presenta trombocitopenia grave (<50 × 109/l)11. Hay que tener en cuenta que son frecuentes recuentos plaquetarios entre 100-150 × 109/l en neonatos sanos, sobre todo en las primeras 24h de vida15; en esta situación se puede mantener una actitud expectante14,17.
Clasificación y causasExisten diferentes maneras de clasificar la trombocitopenia neonatal. Una de las más importantes es la que divide las diferentes causas según su patogenia. Así, tendríamos la trombocitopenia secundaria a una disminución en la producción de plaquetas (el mecanismo más importante durante el período neonatal que en un 75% de los casos tiene lugar en las primeras 72h de vida, por ejemplo en CIR), la secundaria a un aumento del consumo (por ejemplo, en la enterocolitis necrosante [ECN]), por hiperesplenismo o la causada por mecanismos combinados (por ejemplo, en un prematuro con sepsis)13,18.
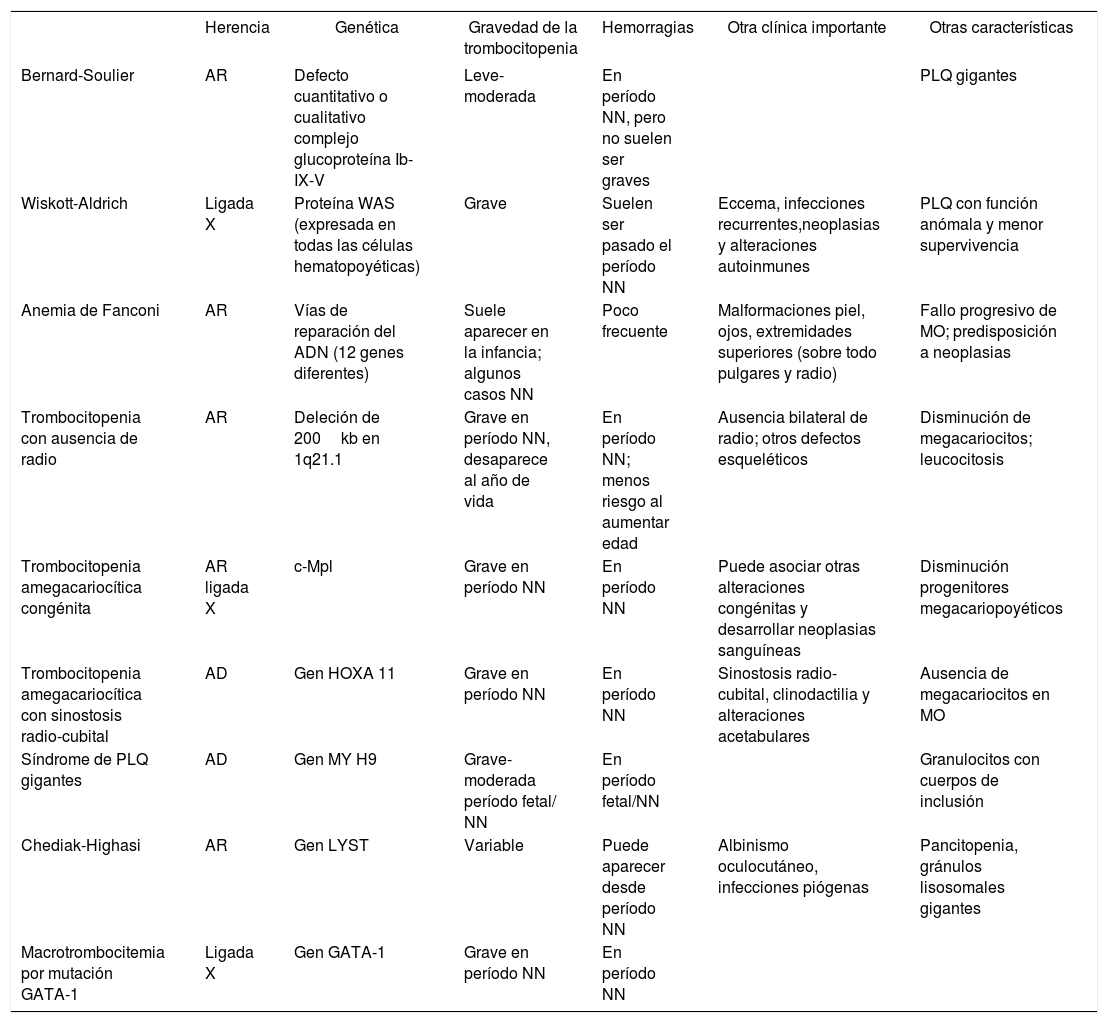
Pero quizá la forma más práctica de clasificar la trombocitopenia es según el momento cronológico en que se presenta (tabla 1). Por lo tanto, podemos dividir la trombocitopenia en fetal, precoz (en las primeras 72h de vida) y tardía (pasadas las primeras 72h)13,19.
Clasificación de la trombocitopenia fetal y neonatal
| Momento de presentación | Categoría | Subtipo | Entidades | Gravedad |
|---|---|---|---|---|
| Fetal | Inmune | Aloinmune | Grave | |
| Autoinmune | Moderada-grave | |||
| Genética | Cromosomopatías | Trisomía 13, 18, 21;Turner | Variable | |
| Congénita | Familiar | TAR, síndrome PLQ gigantes | Variable | |
| Infecciosa | Viral | CMV, VIH, rubeóla | Variable | |
| Parásitos | Toxoplasma | Variable | ||
| Precoz (< 72h) | Insuficiencia placentaria | Hipoxia fetal crónica (preeclampsia, CIR) | Leve-moderada | |
| CID | Asfixia | Grave | ||
| Sepsis | Grave | |||
| Infecciosa | Bacteriana | Perinatal: SGB, E. coli… | Variable | |
| Viral | CMV, enterovirus, VIH, VHS | Variable | ||
| Parásitos | Toxoplasma | Variable | ||
| Inmune | Aloinmune | Grave | ||
| Autoinmune | Moderada-grave | |||
| Genética | Metabólica | Acidemia propiónica, acidemia metilmalónica | Leve-moderada | |
| Familiar | Wiskott-Aldrich, TAR, Fanconi | Variable | ||
| Miscelánea | Tumoral | Síndrome de Kasabach-Merrit | Moderada | |
| Trombótica | Trombosis vena renal | Moderada | ||
| Infiltrado medular | Leucemia congénita | Moderadagrave | ||
| Tardía (> 72h) | Miscelánea | ECN | Grave | |
| Infecciosa | Sepsis bacteriana o fúngica tardía | Grave | ||
| Viral | CMV, enterovirus, VIH, VHS | Variable | ||
| Parásitos | Toxoplasma | Variable | ||
| Genética | Metabólico | Academia propiónica, acidemia metilmalónica | Leve-moderada | |
| Familiar | Wiskott-Aldrich, TAR, Fanconi | Variable | ||
| Miscelánea | Tumoral | Síndrome de Kasabach-Merrit | Moderada | |
| Farmacológica | Antibióticos | Penicilina, derivados vancomicina, metrodinazol | Variable | |
| Heparina | Variable | |||
| Anticonvulsivantes | Fenitoína, fenobarbital | Variable | ||
| Antagonistas receptor H2 | Variable | |||
| Mixta | ECMO | Variable |
CIR: crecimiento intrauterino retardado; CMV: citomegalovirus; ECMO: oxigenación por membrana extracorpórea; ECN: enterocolitis necrosante; PLQ: plaquetas; PTI: púrpura trombocitopénica inmune; SGB: estreptococo del grupo B; TAR: trombocitopenia con ausencia de radio; VHS: virus del herpes simple; VIH: virus de la inmunodeficiencia humana.
En cursiva se destacan las causas más frecuentes.
La causa más frecuente de trombocitopenia precoz es la hipoxia fetal crónica secundaria a una insuficiencia placentaria y la más grave es la trombocitopenia neonatal aloinmune (TNA) 11,17. Un pequeño porcentaje es secundario a infecciones prenatales, asfixia perinatal, alteraciones cromosómicas o trombocitopenias hereditarias11 por lo que los datos perinatales, la exploración física en busca de otros signos clínicos y los antecedentes familiares de trombocitopenia nos ayudarán a guiar la orientación diagnóstica inicial17.
En más de un 80% de los casos, la sepsis y ECN son responsables de la trombocitopenia tardía11–13. Una vez descartadas estas 2 entidades se pueden considerar otros factores etiológicos como infecciones virales, trombosis, fármacos, enfermedades metabólicas, causa inmunitaria (generalmente empeoran los primeros días y, en ocasiones, se manifiestan después de las 72h de vida)11,17. Este grupo se caracteriza por el rápido desarrollo (1-2 días) de una trombocitopenia grave (menos 30 × 109/l plaquetas) y prolongada que persiste hasta que el proceso se controla, seguida de una recuperación lenta de entre 1-2 semanas y que suele precisar transfusión de plaquetas11–13,19,20. Este patrón de trombocitopenia tardía se desarrolla en el 6% de todos los neonatos admitidos en UCIN18,20.
A continuación se desarrollan las distintas causas de trombocitopenia.
Lectura rápida
El recuento plaquetario aumenta a medida que avanza la edad gestacional y a partir de las 18 semanas de gestación es similar al de los adultos. Al final del primer trimestre de gestación está en torno a 150 × 109/l plaquetas y al final del segundo trimestre se encuentra en torno a 175-250 × 109/l. Se define la trombocitopenia neonatal como un recuento plaquetario inferior a 150 × 109/l, independientemente de la edad gestacional, y se considera grave cuando es inferior a 50 × 109/l. Una de las más importantes formas de clasificación divide la trombocitopenia según su patogenia: secundaria a una disminución en la producción de plaquetas (el mecanismo más importante durante el período neonatal); secundaria a un aumento del consumo o la causada por mecanismos combinados. Pero la forma más práctica de clasificación es según el momento cronológico de presentación: fetal, de inicio precoz (en las primeras 72h de vida) y tardía (pasadas las primeras 72h).
La principal causa de trombocitopenia precoz es la hipoxia fetal crónica secundaria a una insuficiencia placentaria en hijo de madre afectada de preeclampsia o en el CIR11,12,19,20 que ocasiona una disminución en la producción de plaquetas18,21. En estos pacientes se ha objetivado la reducción de la megacariopoyesis y de las células progenitoras junto a la disminución de la Tpo18–20.
El problema principal en el espectro de patología hipertensiva del embarazo es un defecto en la placentación secundario a la incapacidad del trofoblasto para invadir la decidua y sus paredes arteriales de manera efectiva, lo que condiciona un aporte sanguíneo insuficiente al feto21. Las anomalías hematológicas se hallan frecuentemente en el feto con CIR y su gravedad parece proporcional al grado de insuficiencia placentaria21. Se caracteriza por ser una trombocitopenia levemoderada (entre 50-100 × 109/l plaquetas), autolimitada y que se suele recuperar en los primeros 7-10 días de vida11,13,22. Asimismo se acompaña de otras alteraciones hematológicas como una neutropenia transitoria, un aumento de la eritropoyesis con mayor número de células nucleadas circulantes e incluso hipoesplenismo11,12 y se caracteriza por presentar un bajo riesgo de hemorragia12,19. Por lo tanto, una duración superior a 10 días o recuentos de plaquetas inferiores a 50 × 109/l nos obligará a descartar procesos infecciosos, congénitos o trombocitopenia neonatal autoinmune17,23.
Trombocitopenia secundaria a sepsis y/o ECNEstas entidades son la causa más frecuente de trombocitopenia tardía12,13,20, y llegan a ser responsables de hasta el 89% de las trombocitopenias graves en neonatos pretérmino22. Respecto a los procesos infecciosos, la incidencia de la trombocitopenia varía en función del microorganismo implicado; en las sepsis fúngicas la incidencia alcanza el 80% (debemos recordar que la trombocitopenia en prematuros menores de 27 SG es un indicador de infección fúngica)4, en las secundarias a gramnegativos la incidencia llega al 70% y en las causadas por grampositivos es menor del 50%4,12,17. Además, las sepsis por hongos y por bacterias gramnegativas presentan una plaquetopenia más grave desde el inicio, un límite inferior y mayor duración de la trombocitopenia4. Se sospecha que la patogenia es la combinación de una disminución de la megacariopoyesis y un aumento del consumo plaquetario13. Se ha demostrado un incremento en las concentraciones de Tpo, aunque no está claro si se debe a un aumento en la producción de Tpo o a una disminución en el número de megacariocitos secundaria a una supresión de la megacariocitopoyesis causada por la sepsis4,20. En un estudio llevado a cabo por Sola et al a 20 neonatos con sepsis/ ECN se encontró un aumento de la Tpo y de los progenitores megacariocíticos circulantes, lo que sugería una sobrerregulación de la trombopoyesis mediada por la Tpo20.
Lectura rápida
La principal causa de trombocitopenia precoz es la hipoxia fetal crónica secundaria a una insuficiencia placentaria en un hijo de madre afectada de preeclampsia o en el crecimiento intrauterino retardado (CIR). Se caracteriza por ser una trombocitopenia leve-moderada (entre 50-100 × 109/l plaquetas), autolimitada y que se recupera en los primeros 7-10 días de vida. Una duración mayor a 10 días o recuentos inferiores a 50 × 109/l obliga a descartar otros procesos. La sepsis y la enterocolitis necrosante (ECN) son las causas más frecuentes de trombocitopenia tardía y constituyen la causa de hasta el 89% de las trombocitopenias graves en neonatos pretérmino. Con relación a los procesos infecciosos, la incidencia de la trombocitopenia varía en función del microorganismo implicado. Las sepsis por hongos y por bacterias gramnegativas presentan una plaquetopenia más grave desde el inicio.
La TNA es la causa más frecuente de trombocitopenia grave en el feto y en el neonato24,25 y está clasificada dentro de las de inicio precoz. La incidencia es de 1:1.500-2.000 embarazos25,26. Se considera que representa el 3% de las trombocitopenias y el 27% de las trombocitopenias graves25,27.
Lectura rápida
La trombocitopenia neonatal aloinmune es la causa más frecuente de trombocitopenia grave en el feto y en el neonato. Es el resultado del paso transplacentario de anticuerpos maternos frente a antígenos plaquetarios humanos (HPA) paternos presentes en las plaquetas y ocurre durante el primer embarazo en el 50% de los casos. Los 3 HPA más frecuentes son HPA-1a (80%), HPA-5b (10-15%) y HPA-15b. La trombocitopenia no se corrige de forma espontánea a medida que avanza el embarazo y se presenta en el neonato con aparición de púrpuras y hematomas en las primeras horas de vida sin otra sintomatología asociada. La complicación más grave es la hemorragia intracraneal (HIC).
El diagnóstico de certeza se consigue al demostrar el antígeno paterno incompatible con su correspondiente anticuerpo materno. La importancia del manejo prenatal radica en minimizar el riesgo de HIC fetal/neonatal grave. Aunque su manejo es controvertido, la tendencia es tratar a estas pacientes mediante la administración de inmunoglobulina intravenosa (IgIV).
La fisiopatología de la TNA es comparable a la enfermedad hemolítica del recién nacido y es el resultado de un proceso inmunológico que se caracteriza por el paso transplacentario de anticuerpos maternos frente a HPA paternos presentes en la plaquetas fetales26–28. La gran diferencia con la enfermedad hemolítica es que la TNA ocurre durante el primer embarazo en el 50% de los casos12,25,27. Las plaquetas expresan en su superficie los HPA desde el primer trimestre de la gestación24,25. Durante el embarazo las plaquetas fetales atraviesan la placenta y acceden a la circulación materna; así, si el feto presenta HPA paternos que no tiene la madre y por lo tanto incompatibles, se generarán los anticuerpos específicos, los cuales llegan a la circulación fetal a partir de las 14 SG, dando lugar a la trombocitopenia27,29 que es secundaria a un doble mecanismo: aumento en la destrucción y afectación de la producción plaquetaria29. Se han identificado un total de 16 HPA incompatibles, pero de estos hay tres que son los más frecuentes: HPA-1a (80%), HPA-5b (10-15%) y HPA-15b12,13,18,30. Los valores de HPA-1 se elevan entre las 21-34 SG y se considera que es un factor predictivo del grado de trombocitopenia neonatal pero no hay consenso sobre si también lo es de la trombocitopenia fetal27,31,32. Se ha observado que aquellas mujeres isoinmunizadas, en las siguientes gestaciones, presentan menos anticuerpos HPA-1 y que no se relaciona con la formación de anticuerpos idiotípicos33 lo que podría explicar la menor incidencia de trombocitopenia en los siguientes embarazos32,33.
Debemos tener en cuenta que el 2% de la población caucásica es HPA-1a-negativa pero la prevalencia de TNA es mucho menor. Esto se debe a que el contexto inmunogenético de la mujer tiene un papel muy importante28. Parece que la capacidad de una mujer HPA-1a-negativa para formar anti-HPA-1a está controlada por el alelo HLA DRB3*0101, de tal modo que las pacientes HLA DRB3*0101 positivas tienen un riesgo de formar anti-HPA-1a 140 veces mayor que las HLA DRB3*0101 negativas28.
Manifestaciones clínicasLa enfermedad varía en grado de intensidad, desde una leve-moderada que se resuelve sin secuelas en las primeras semanas a hemorragias intracraneales (HIC) masivas fetales o neonatales que provocan la muerte o secuelas neurológicas graves a largo plazo13 y que suelen asociarse a trombocitopenia grave (< 20 × 109/l)27,29. Se ha observado que la trombocitopenia puede iniciarse a partir de la 21 SG y que no se corrige de forma espontánea a medida que avanza el embarazo27,29. En un 10-20% de los embarazos sin tratamiento antenatal se producirá una HIC12,30, por lo que deberá sospecharse esta entidad en aquellos fetos con HIC, ventriculomegalia, hidrocefalia, alteraciones de la migración neuronal, siderosis superficial y porencefalia25,34. Se debe tener en cuenta que el 80% de las HIC ocurren intraútero y que, de éstas, el 40% se producen antes de las 30 SG28,29.
La forma habitual de presentación en el neonato es la aparición de púrpuras y hematomas en las primeras horas de vida sin otra sintomatología asociada (es infrecuente la afectación visceral)25,35, cuya madre está sana y sin antecedentes de enfermedades autoinmunes, trombocitopenia ni ingesta de fármacos causantes de trombocitopenia durante el embarazo24,35,36. De todos modos, los neonatos también pueden presentar clínica secundaria a una HIC (más frecuentemente intraparenquimatosa que intraventricular)24,37 que, si se produce en el período posnatal, aparecerá en los 2-3 primeros días (coincidiendo con el nadir en la plaquetopenia). La HIC tiene una mortalidad aproximada de un 10% y en un 20% habrá secuelas neurológicas27.
DiagnósticoExisten hallazgos clínicos que nos ayudarán a diferenciar la TNA de otras causas de trombocitopenia (tabla 2) 36,38. El diagnóstico de laboratorio se basa en la identificación de los aloanticuerpos maternos dirigidos contra los HPA fetales29 y la determinación del genotipo HPA materno y paterno mediante técnicas moleculares. En caso necesario (padre heterocigoto o dudas sobre la paternidad) se puede realizar en el feto o el neonato12,24,39. El diagnóstico de certeza se consigue al demostrar el antígeno paterno incompatible con su correspondiente anticuerpo materno23. Se debe tener en cuenta que en un 10% de los casos no se detectan dichos anticuerpos durante el embarazo y que aparecen semanas después del parto o incluso en el siguiente embarazo18,28,39.
Hallazgos clínicos para distinguir trombocitopenia neonatal aloinmune de otras causas de trombocitopenia neonatal
|
La mayoría de los pacientes con recuentos plaquetarios inferiores a 20 × l09/l están afectados de TNA, pero usando este corte sólo se identifican la mitad de las TNA, si utilizamos un corte a 50 × 109/l plaquetas, se identifica casi el 90% de los pacientes35.
La importancia del manejo prenatal de la TNA radica en minimizar el riesgo de hemorragia fetal/neonatal grave25,27. Actualmente el manejo es controvertido y está abierto a debate: la última revisión Cochrane concluye que es insuficiente el número de estudios aleatorizados para determinar cuál es el tratamiento prenatal óptimo de esta patología40 y cuándo se debe iniciar el mismo27,34,39. Es fundamental la realización de ecografías fetales para valorar la presencia de hemorragia intracraneal12,34. Existen tres propuestas de tratamiento:
- —
No invasiva: se basa en monitorización fetal mediante ecografía y administración materna semanal de IgIV en dosis de 1-2g/kg/semana en función de los antecedentes39 asociada a corticoterapia en gestantes de alto riesgo o que no hayan respondido a otros tratamientos28,34.
- —
Medianamente invasiva: tratamiento con IgIV y determinaciones puntuales poco frecuentes de recuento plaquetario fetal para monitorizar la respuesta al tratamiento12.
- —
Invasiva: monitorización semanal del recuento plaquetario fetal y transfusión de plaquetas HPA compatibles según valores mediante cordocentesis12,35. Aunque disminuye el riesgo de HIC en casos graves, hay riesgo de pérdida fetal (1% por cada cordocentesis). Actualmente, la tendencia es manejar a estas pacientes (independientemente del riesgo) mediante tratamiento farmacológico sin monitorización plaquetaria fetal27,41,42.
En los embarazos con TNA se suele emplear de manera rutinaria la cesárea25,27,34. Las guías de práctica clínica refieren que se podría realizar parto vaginal si el recuento fetal plaquetario fuera superior a 50 × 109/l, aunque no hay evidencia de aumento de riesgo de HIC en partos vaginales con fetos cuyo recuento plaquetario es inferior a este límite27. Los partos instrumentados y la obtención de muestras de cuero cabelludo deben evitarse27.
Tratamiento neonatalSi al nacer presenta hemorragia activa, un recuento plaquetario menor de 30 × 109/l en la primera semana o una HIC con menos de 100 × 109/l plaquetas, se debe transfundir29,39. En casos graves se puede asociar IgIV, pero nunca en monoterapia ya que empieza a actuar a las 24-48h desde su administración13,24,29. Es fundamental la realización de ecografías transfontanelares seriadas para descartar HIC los primeros días del cuadro11,29.
Para la transfusión se puede utilizar:
- —
Plaquetas de donante HPA 1 y HPA 5 negativas irradiadas13,29,39 que producen un mayor y más prolongado aumento en el recuento plaquetario12,35.
- —
Plaquetas maternas lavadas (para eliminar los anticuerpos antiplaquetarios) e irradiadas (para prevenir la enfermedad de injerto contra huésped), que no es una práctica habitual en nuestro medio.
- —
Plaquetas con tipificación HLA compatible.
- —
Plaquetas de donante “al azar”: actualmente, se consideran de primera elección asociadas a IgIV, puesto que son más accesibles y se ha demostrado aumento en el recuento plaquetario36,39. Parece que su efectividad se debe a que al administrar una gran cantidad de plaquetas antígeno-positivas se saturan los aloanticuerpos circulantes26.
En todos los casos, la monitorización debe ser frecuente hasta que las plaquetas se hallan en una “zona segura” para determinar la necesidad de añadir otros tratamientos o la necesidad de más transfusiones36. En ausencia de sangrado el recuento plaquetario vuelve a la normalidad en 8-10 días29.
CribadoLa limitación es sobre todo que no existe un consenso en el manejo prenatal de estos fetos, aunque hay algunos trabajos a favor de su realización29,41.
Consejo prenatalPara determinar el riesgo de recurrencia en embarazos posteriores, se debe determinar si el padre es homocigoto o heterocigoto28. La historia de un hermano previo afectado es el factor predictor más importante, sobre todo si existió HIC28,34.
Lectura rápida
La trombocitopenia autoinmune se debe al paso de autoanticuerpos maternos (sobre todo en lupus eritematoso sistémico y púrpura trombocitopénica). Cuando la trombocitopenia es grave (plaquetas < 30 × 109/l) se recomienda tratamiento con IgIV. El riesgo de HIC fetal/ neonatal se halla en torno al 1%.
Las principales causas de trombocitopenia secundaria a infecciones congénitas son la infección por citomegalovirus (10%) y la toxoplasmosis (40%). Ésta puede estar presente en el nacimiento o desarrollarse en los primeros días de vida. La hipotermia inducida es una estrategia neuroprotectora en los neonatos a término con asfixia perinatal. Entre sus complicaciones se ha observado trombocitopenia que no suele requerir tratamiento.
La trombocitopenia fetal/neonatal secundaria al paso de autoanticuerpos maternos ocurre principalmente en gestantes afectadas de lupus eritematoso sistémico o de púrpura trombocitopénica11,12. Unicamente ocurre en el 10% de los neonatos con madres con autoanticuerpos y la incidencia de HIC es del 1%12. La gravedad de la enfermedad materna, el recuento plaquetario de la gestante durante el embarazo y el antecedente de un neonato previo afectado son los mejores indicadores de trombocitopenia fetal/neonatal11. Independientemente del recuento plaquetario no existe indicación de realización de transfusiones fetales o parto mediante cesárea11. Se recomienda la realización de un recuento plaquetario en sangre de cordón o periférico al nacimiento y a las 24h de vida11,22. En los neonatos trombopénicos, se debe repetir diariamente durante los 4 días siguientes (normalmente el límite se da durante estos primeros días y luego va recuperándose espontáneamente hasta la normalidad dentro de la primera semana)13. Sólo se recomienda tratamiento en aquel neonato con trombocitopenia grave (plaquetas < 30 × 109/l) con IgIV (una dosis total de 2mg/kg durante 2-5 días)11,22.
Trombocitopenia asociada a infecciones congénitasEn el ambiente inmunológico hiporreactivo del útero materno, la transmisión vertical de patógenos suele atacar al citotrofoblasto y la decidua con lo que se altera el desarrollo de la placenta21. Las alteraciones hematológicas son frecuentes en las infecciones congénitas21. La trombocitopenia puede estar presente en el nacimiento o desarrollarse en los primeros días de vida22. Son varias las infecciones congénitas que producen trombocitopenia: rubéola, enterovirus, adenovirus, dengue, virus de la inmunodeficiencia humana (VIH), sífilis, parvovirus20–22, pero las más frecuentes son la infección por citomegalovirus (10%) y la toxoplasmosis (40%). Los mecanismos de producción de la trombocitopenia se deben a la disminución de la producción por infección de las células progenitoras o a la destrucción periférica21.
Trombocitopenia hereditaria11,22,42Se caracteriza por una alteración en el desarrollo de los progenitores hematopoyéticos que da lugar a una disminución en la producción plaquetaria fetal y neonatal. Suelen estar asociadas a otras anomalías congénitas que nos ayudarán a establecer el diagnóstico. Son una causa poco frecuente de trombocitopenia. En la tabla 3 se resumen los principales síndromes causantes de trombocitopenia.
Enfermedades hereditarias que cursan con plaquetopenia
| Herencia | Genética | Gravedad de la trombocitopenia | Hemorragias | Otra clínica importante | Otras características | |
|---|---|---|---|---|---|---|
| Bernard-Soulier | AR | Defecto cuantitativo o cualitativo complejo glucoproteína Ib-IX-V | Leve-moderada | En período NN, pero no suelen ser graves | PLQ gigantes | |
| Wiskott-Aldrich | Ligada X | Proteína WAS (expresada en todas las células hematopoyéticas) | Grave | Suelen ser pasado el período NN | Eccema, infecciones recurrentes,neoplasias y alteraciones autoinmunes | PLQ con función anómala y menor supervivencia |
| Anemia de Fanconi | AR | Vías de reparación del ADN (12 genes diferentes) | Suele aparecer en la infancia; algunos casos NN | Poco frecuente | Malformaciones piel, ojos, extremidades superiores (sobre todo pulgares y radio) | Fallo progresivo de MO; predisposición a neoplasias |
| Trombocitopenia con ausencia de radio | AR | Deleción de 200kb en 1q21.1 | Grave en período NN, desaparece al año de vida | En período NN; menos riesgo al aumentar edad | Ausencia bilateral de radio; otros defectos esqueléticos | Disminución de megacariocitos; leucocitosis |
| Trombocitopenia amegacariocítica congénita | AR ligada X | c-Mpl | Grave en período NN | En período NN | Puede asociar otras alteraciones congénitas y desarrollar neoplasias sanguíneas | Disminución progenitores megacariopoyéticos |
| Trombocitopenia amegacariocítica con sinostosis radio-cubital | AD | Gen HOXA 11 | Grave en período NN | En período NN | Sinostosis radio-cubital, clinodactilia y alteraciones acetabulares | Ausencia de megacariocitos en MO |
| Síndrome de PLQ gigantes | AD | Gen MY H9 | Grave-moderada período fetal/ NN | En período fetal/NN | Granulocitos con cuerpos de inclusión | |
| Chediak-Highasi | AR | Gen LYST | Variable | Puede aparecer desde período NN | Albinismo oculocutáneo, infecciones piógenas | Pancitopenia, gránulos lisosomales gigantes |
| Macrotrombocitemia por mutación GATA-1 | Ligada X | Gen GATA-1 | Grave en período NN | En período NN |
AD: autosómica dominante; AR: autosómica recesiva; MO: medula ósea NN: neonatal; PLQ: plaquetas.
Lectura rápida
En la mayoría de los neonatos, la trombocitopenia será leve o moderada y no requerirá intervención; pero el 25% precisará tratamiento. El único disponible es la transfusión de plaquetas, que es una práctica común en las unidades de cuidados intensivos neonatales (UCIN). Las indicaciones se dividen en terapéuticas y profilácticas, estas últimas para prevenir la HIC. En la actualidad, las transfusiones se basan en recomendaciones de guías de práctica clínica. La dosis indicada es de 10ml/kg, pero volúmenes de 20ml/kg consiguen un aumento más duradero. Los neonatos que reciben transfusiones tienen un riesgo 10 veces mayor de muerte pero no está aclarado si se debe a la gravedad del proceso desencadenante o a la transfusión. Las complicaciones asociadas a la transfusión son: lesión pulmonar aguda, sobrecarga circulatoria y riesgo de contaminación bacteriana.
La hipotermia inducida es una estrategia neuroprotectora en los neonatos a término con asfixia perinatal. Entre las complicaciones asociadas se ha encontrado trombocitopenia que no suele precisar tratamiento.
Síndrome de Kasabach-Merritt11Se caracteriza por tumores vasculares (cutáneos y/o viscerales), trombocitopenia grave, anemia microangiopática y diferentes grados de coagulación intravascular diseminada. Suele presentarse en el período neonatal. La trombocitopenia se debe al atrapamiento plaquetario en el endotelio del hemangioma. El tratamiento se basa en el uso de corticoides, interferón y/o vincristina; puede ser necesaria la cirugía y la embolización de los hemangiomas. Su efectividad es del 50% pero presenta una mortalidad en torno al 20-30%.
Trastornos trombóticos11,22Los siguientes trastornos trombóticos se asocian a trombocitopenia neonatal: púrpura trombocitopénica, síndrome hemolítico urémico, trombocitopenia inducida por heparina, trombosis venosa renal y déficit de la proteasa segmentadota (ADAMTS13) del factor Von Willebrand que se asocia a trombocitopenia, anemia e ictericia.
Trombocitopenia secundaria a cromosomopatíasSe ha observado que la trisomía 21, la trisomía 13, la trisomía 18, el síndrome de Turner y algunas triploidías se asocian a trombocitopenia, cuya prevalencia es desconocida22. El mecanismo de la trombocitopenia en la trisomía 13 y en la trisomía 18 es desconocido, aunque parece causada por una disminución de la producción. El 10% de los neonatos afectados de síndrome de Down desarrollan un trastorno mieloproliferativo transitorio que se caracteriza por un incremento de mieloblastos, megacariocitos anormales y trombocitopenia de grado variable que, en la mayoría de los casos, se resuelve de forma espontánea; se debe tener en cuenta, no obstante, que un 30% de estos pacientes acabarán desarrollando un leucemia megacarioblástica aguda durante los 5 primeros años de vida; parece que este trastorno está asociado a mutaciones en el gen GATA-111.
Trastornos metabólicos11La trombocitopenia no es infrecuente en las metabolopatías como las acidemias propiónica, metilmalónica e isovalérica, y la enfermedad de Gaucher.
TratamientoEn la mayoría de los neonatos, la trombocitopenia será leve o moderada y no requerirá intervención; no obstante, el 25% de pacientes precisan tratamiento17. Actualmente, el único tratamiento disponible es la transfusión de plaquetas12 que es una práctica común en las UCIN (2-9,4% de pacientes)44. Las indicaciones del tratamiento se pueden dividir en terapéuticas y profilácticas, estas últimas encaminadas a prevenir la HIC44,45, ya que su morbimortalidad es elevada y llega a una incidencia del 25-31% en neonatos de muy bajo peso45. Sólo existe un estudio controlado y aleatorizado46 que demuestra que la transfusión profiláctica de plaquetas no reduce ni la incidencia ni la extensión de HIC en prematuros, pero en dicho estudio sólo se incluyen prematuros con un recuento plaquetario inferior a 50 × 109/l, ya que los que están por debajo se transfunden; así pues, en la actualidad, la administración de transfusiones se basa en recomendaciones de guías de práctica clínica. En la tabla 4 se detallan dichos criterios según diferentes publicaciones. La dosis recomendada es de 10ml/kg que ha demostrado elevar el recuento plaquetario de 50.000-100.000μl45 aunque parece que volúmenes de 20ml/kg consiguen un aumento más duradero44.
Criterios de transfusión
| Contexto clínico | Límite para transfusión |
|---|---|
| NNPT enfermo sin sangrado activo | < 5012,44,48-10049 × 109/l |
| NNPT estable sin sangrado activo | < 2047,48-5049 × 109/l |
| NNAT sin sangrado activo | < 2047-3044,49 × 109/l |
| Sangrado activo | < 5047,48-10,012,44,49 × 109/l |
| Previo a procedimientos invasivos | < 5044,48,49 × 109/l |
NNAT: neonato a término; NNPT: neonato pretérmino.
En cuanto a la morbimortalidad relacionada con la transfusión de plaquetas se ha observado que aquellos neonatos que reciben transfusiones tienen un riesgo 10 veces mayor de muerte44,45 pero no está aclarado si este aumento de mortalidad se debe a la gravedad del proceso desencadenante o a la transfusión en sí12. Las complicaciones asociadas a la transfusión son: lesión pulmonar aguda relacionada con la transfusión, sobrecarga circulatoria relacionada con la transfusión y riesgo de contaminación bacteriana45.
Otras terapiasLa Tpo humana recombinante y la IL-11 están siendo evaluadas en adultos y niños para ver su efectividad en la estimulación de la producción plaquetaria1,4,44. Nunca se han usado en neonatos.