La enfermedad meningocócica invasora (EMI) incluye diversas formas clínicas, siendo la meningitis y la sepsis los cuadros más graves. Se han identificado 13 serogrupos de meningococo, de los que 6 pueden afectar al ser humano (A, B, C, W, X e Y). En Europa, el grupo de riesgo más importante son los menores de 5 años, en los que el serogrupo B es responsable del 94% de los casos, con elevadas tasas de mortalidad (10–14%) y morbilidad (8–20%)1. El impacto económico y la carga de hospitalización generada por la enfermedad meningocócica también son importantes, suponiendo en nuestro país un coste anual de más de 5 millones de euros2.
Puntos clave
- •
La vacuna frente al meningococo B (4CMenB) es inmunógena y segura en lactantes, niños, adolescentes y adultos, e induce memoria inmunológica. Además, es compatible con el resto de vacunas incluidas en el calendario sistemático español.
- •
La cobertura potencial de la nueva vacuna 4CMenB está entre el 70 y el 80% de las cepas circulantes en Europa. En España, con la incidencia actual de enfermedad meningocócica por serogrupo B, podrían prevenirse 631 casos anuales en menores de 5 años de edad.
- •
La vacuna 4CMenB, en el momento actual, es la única estrategia disponible para prevenir la enfermedad meningocócica por el serogrupo B.
- •
La vacuna ha sido autorizada por mecanismo centralizado por la Agencia Europea del Medicamento. Tras ello, todos los países europeos, excepto España, han permitido la comercialización y distribución de la vacuna en todos los canales de dispensación.
- •
En España, la Agencia Española del Medicamento y Productos Sanitarios comunicó en abril del 2013 su decisión de establecer esta vacuna de uso exclusivamente hospitalario, por lo que no se podrá conseguir a través de las farmacias comunitarias.
En enero del 2013, la Agencia Europea de Medicamentos (EMA) autorizó una nueva vacuna de 4 componentes frente al meningococo B (4CMenB, Bexsero®), de la Compañía Farmacéutica Novartis Vaccines and Diagnostics. Obtenida mediante técnica de vacunología inversa, incluye 3 proteínas recombinantes (fHbp, NadA y NHBA) y una proteína de vesícula de membrana externa (OMVnz). Los 4 antígenos incluidos en la vacuna son importantes para la supervivencia, función o virulencia del meningococo3.
Epidemiología de la enfermedadSegún datos del European Centre for Disease Prevention and Control, la incidencia de enfermedad meningocócica en el año 2011 en Europa fue de 0,77 casos por 100.000 personas/año. Actualmente, debido al empleo sistemático de la vacuna frente al meningococo C, los casos debidos a este serogrupo han descendido notablemente. Por ello, el serogrupo B es el que actualmente predomina en Europa (73,6%)4. Hay que tener en cuenta que este serogrupo suele causar ondas epidémicas de ciclo largo y actualmente estamos asistiendo a la incidencia más baja de los últimos 20 años. En el año 2011 se apreció un descenso del número de casos del 20% respecto al 20084.
La incidencia de la enfermedad meningocócica varía con la edad. Según datos de 2011, en Europa la incidencia en menores de 1 año fue de 12,3 casos/100.000 habitantes, seguida por la de los niños entre 1 y 4 años (4,1/100.000 habitantes) y los adolescentes y adultos jóvenes de 15–24 años (1,3/100.000 habitantes).
En España, la incidencia de la EMI en 2011 fue de 0,93 casos/100.000 personas/año. El 71% de ellos fueron causados por el serogrupo B. Las tasas más altas de EMI por este serogrupo correspondieron a los menores de 5 años (13 casos/100.000 habitantes para los menores de 1 año y 4,3 casos/100.000 habitantes en el grupo de 1 a 4 años)5. El descenso del número de casos del serogrupo B que se ha observado en estos últimos años es similar al observado en otros países europeos2.
Vacuna frente al meningococo BDurante los últimos 30 años, el desarrollo y el uso de vacunas antimeningocócicas conjugadas frente a los serogrupos A, C, W e Y, formuladas contra polisacáridos de la cápsula, han significado un paso decisivo para la prevención de la enfermedad. Sin embargo, el polisacárido capsular del serogrupo B es poco inmunógeno en humanos y puede originar fenómenos de autoinmunidad. Esto ha supuesto una importante limitación en las estrategias para desarrollar una vacuna, que tuvieron que centrarse en antígenos no capsulares. Mediante una técnica novedosa, la vacunología inversa6, finalmente se ha conseguido desarrollar una vacuna frente al meningococo B, con cuatro componentes (fHbp, NadA y NHBA) y una proteína de vesícula de membrana externa (OMVnz).
Eficacia, seguridad e inmunogenicidad de la vacuna frente al meningococo BDesde el 2010, se han publicado más de 20 estudios y ensayos clínicos realizados en más de 7.000 sujetos (lactantes, niños, adolescentes y adultos), que han demostrado que la vacuna es segura e inmunógena, tanto en niños como en adultos, genera memoria inmunológica y es compatible con las vacunas sistemáticas7–11.
Con respecto a la seguridad, en lactantes y niños menores de 2 años las reacciones adversas locales y sistémicas más frecuentes fueron dolor y eritema en el lugar de inyección, fiebre e irritabilidad. En los estudios clínicos en lactantes, la fiebre aparecía más frecuentemente cuando 4CMenB se coadministraba con las vacunas sistemáticas que cuando se administraba sola3. Si 4CMenB se administraba sola, la frecuencia de aparición de fiebre era similar a la asociada a las vacunas sistemáticas. Cuando apareció la fiebre, normalmente siguió un patrón predecible y autolimitado, clínicamente poco significativo, y fácilmente prevenible con la administración profiláctica de paracetamol12.
Los ensayos clínicos realizados han mostrado una buena inmunogenicidad de la vacuna, aunque será complicada la demostración de efectividad en la población, al tratarse de una enfermedad actualmente de baja incidencia.
Coadministración con otras vacunasSegún los estudios publicados, 4CMenB es compatible con las vacunas sistemáticas, salvo con la vacuna antimeningocócica C3,11,13, aunque existe un estudio todavía no finalizado que está analizando la compatibilidad en la administración de ambas vacunas antimeningocócicas. Hay datos de coadministración con la vacuna antineumocócica 7-valente pero no con la 13-valente, dado que los ensayos clínicos se realizaron antes de la aparición de esta última, pero la Agencia Europea de Medicamentos ha extrapolado los datos y ha aceptado la coadministración con ambas vacunas. También se puede administrar simultáneamente con las vacunas frente al rotavirus14 y con las de la varicela3.
Impacto potencial de la vacuna frente al meningococo BLa enfermedad meningocócica presenta una baja incidencia, lo que impide realizar ensayos clínicos de eficacia de la vacuna por la necesidad de un gran número de participantes. Por ello, los estudios de eficacia son asumidos a través de parámetros subrogados de protección y, en el caso de la enfermedad meningocócica, a través de los resultados obtenidos en ensayos de actividad bactericida del suero (SBA por sus siglas en inglés: serum bactericidal activity). Sin embargo, la realización de ensayos clínicos para medir la eficacia protectora en general, tal y como se ha hecho con vacunas conjugadas de polisacárido, no es viable con la vacuna frente al serogrupo B15. En el caso de la evaluación de vacunas de polisacárido, el antígeno es común a todas las cepas de ese serogrupo, por lo que los sueros son enfrentados a una única cepa que expresa ese antígeno. En el caso de la vacuna 4CMenB, habría que enfrentar cada suero a cientos de cepas que expresaran todas o la gran mayoría de variantes antigénicas posibles, lo que, sin duda, es inviable16.
El Meningococcal Antigen Typing System (MATS) es un método estandarizado y reproducible, que se ha desarrollado para evaluar la cobertura potencial de la vacuna 4CMenB contra cepas individuales de meningococo, por el que se obtiene el porcentaje de muestras de meningococo que son susceptibles de ser neutralizadas por los anticuerpos inducidos por la vacuna. En un estudio realizado con un panel de 1.052 cepas de meningococo B de varios países europeos (Alemania, Francia, Inglaterra y Gales, Italia, Noruega, España y Portugal), el MATS ha permitido predecir que un 73–87% de las cepas serían cubiertas por 4CMenB17. Los datos obtenidos en España muestran una cobertura potencial del 69%16,17. Los autores del estudio señalan que estos datos son, probablemente, muy conservadores, y que la cobertura real podría ser más elevada.
Con los datos del MATS, en el informe realizado por el Ministerio de Sanidad en 2013, los autores estiman que con la vacunación sistemática frente al meningococo B podrían prevenirse 631 casos en menores de 5 años de edad y 4.784,3 años de vida perdidos ajustados por discapacidad en los próximos 5 años18.
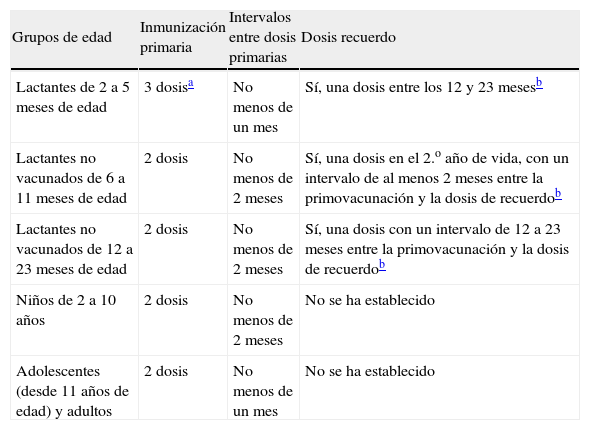
Indicaciones terapéuticas autorizadasSegún la ficha técnica aprobada actualmente en España, la vacuna Bexsero® está indicada para la inmunización activa de individuos a partir de 2 meses de edad frente a la EMI causada por Neisseria meningitidis del grupo B (tabla 1).
Esquema recomendado de administración de la vacuna frente al meningococo B (Bexsero®), según la ficha técnica actualmente aprobada
| Grupos de edad | Inmunización primaria | Intervalos entre dosis primarias | Dosis recuerdo |
| Lactantes de 2 a 5 meses de edad | 3 dosisa | No menos de un mes | Sí, una dosis entre los 12 y 23 mesesb |
| Lactantes no vacunados de 6 a 11 meses de edad | 2 dosis | No menos de 2 meses | Sí, una dosis en el 2.o año de vida, con un intervalo de al menos 2 meses entre la primovacunación y la dosis de recuerdob |
| Lactantes no vacunados de 12 a 23 meses de edad | 2 dosis | No menos de 2 meses | Sí, una dosis con un intervalo de 12 a 23 meses entre la primovacunación y la dosis de recuerdob |
| Niños de 2 a 10 años | 2 dosis | No menos de 2 meses | No se ha establecido |
| Adolescentes (desde 11 años de edad) y adultos | 2 dosis | No menos de un mes | No se ha establecido |
La vacuna, por tanto, está aprobada para la administración a personas mayores de 2 meses de edad, tanto sanos como con factores de riesgo.
Situación actual de la vacuna en España y en el resto de EuropaLa vacuna 4CMenB (Bexsero®) se autorizó por procedimiento centralizado en la Unión Europea el 14 de enero del 2013, de acuerdo con los informes positivos de su organismo evaluador oficial, la EMA3. Tras esta aprobación, las agencias reguladoras de cada país deben pronunciarse sobre las condiciones de comercialización de la misma.
- 1.
Situación en España (junio del 2014)
La Agencia Española de Medicamentos y Productos Sanitarios comunicó, el 5 de abril del 2013, su postura al respecto: «En base a la ausencia de datos de eficacia clínica con esta vacuna, con una incidencia actualmente contenida de enfermedad meningocócica por serogrupo B, y a la espera de obtener datos de efectividad postautorización, y ante la ausencia, en estos momentos, de recomendaciones oficiales de uso por parte de Salud Pública, se recomienda establecer el uso hospitalario de la vacuna Bexsero®, hasta que Salud Pública determine, en el seno del Consejo Interterritorial del Sistema Nacional de Salud, el objetivo o la política que se va a seguir con respecto al uso de esta vacuna»19.
A su vez, el 20 de junio del 2013, el Grupo de Trabajo MenB de la Ponencia de Programas y Registro de Vacunaciones del Ministerio de Sanidad, Servicios Sociales e Igualdad estableció que: «Teniendo en cuenta la información disponible y la situaciónepidemiológica, en el momento actual no se considera justificada la inclusión de esta vacuna en el calendario sistemático de vacunaciones. Se recomienda proseguir con la evaluación de la vacuna una vez que se disponga de información clave relativa, particularmente, a la protección clínica en regiones geográficas o países de nuestro entorno, así como de un sistema de seguimiento por laboratorio para conocer la efectividad de la vacunación y la evolución de las poblaciones de N. meningitidis. Las autoridades sanitarias valorarán la utilización de la vacuna en situaciones de brotes y casos aislados de enfermedad meningocócica por el serogrupo B»18.
Estas disposiciones hacen que, lamentablemente, la vacuna Bexsero® se encuentre en España en una situación totalmente diferente de la del resto de los países europeos. En nuestro país, la vacuna solo estará disponible en las farmacias hospitalarias, tanto del sector público como privado, y no se podrá conseguir a través de las farmacias comunitarias.
Según las actuales directrices del Ministerio de Sanidad, los destinatarios oficiales de esta vacuna van a ser únicamente personas con factores de riesgo de presentar EMI (personas con déficit de complemento o aquellas en tratamiento con eculizumab, asplenia o disfunción esplénica grave y personal de laboratorio que manipulen muestras que puedan contener meningococos) y en caso de brotes. En el primer caso, suponen un porcentaje muy pequeño de las personas que presentan esta enfermedad en nuestro medio, por lo que el impacto preventivo potencial se espera que sea muy reducido con la estrategia oficial.
- 2.
Situación en Europa (junio del 2014)
La situación para la vacuna 4CMenB en el resto de los países de la Unión Europa es completamente diferente. En todos los países de la Unión Europea, excepto en España, se ha autorizado la vacuna para su libre distribución, por lo que se dispondrá de ella tanto en las farmacias comunitarias como en las hospitalarias.
En algunos países, la vacuna se ha introducido ya en el calendario sistemático de vacunaciones. De especial relevancia ha sido la decisión de Reino Unido de aprobar, en marzo del 2014, la inclusión de la vacuna en su calendario de vacunaciones, comenzando con los lactantes en un esquema 2 + 1 (2, 4 y 12 meses)20.
La República Checa también la va a incluir en su calendario sistemático y Polonia lo hará, pero sin financiación. Otros países europeos, como Austria, Alemania, Francia e Italia, están actualmente estudiando los datos disponibles para valorar la inclusión en sus calendarios de vacunación.
El Comité Asesor de Vacunas de la Asociación Española de Pediatría tiene previsto pronunciarse sobre las indicaciones de esta vacuna en la población pediátrica de nuestro país una vez que esté disponible en España, aunque únicamente sea en el canal hospitalario.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.