Los procedimientos endovenosos térmicos son los procedimientos de elección en el tratamiento de las varices por incompetencia de la vena safena. Sin embargo, estas técnicas requieren anestesia tumescente, lo que aumenta las molestias y el dolor durante el procedimiento. Así mismo, el calor produce malestar postoperatorio y conlleva un riesgo de lesión neurológica y de la piel. La ablación mecánico química con el catéter ClariVein®, al no emplear anestesia tumescente ni calor, se asocia con una baja tasa de dolor durante y después del procedimiento, una vuelta rápida a las actividades normales, un menor riesgo de lesión neurológica y de la piel, con unas tasas de oclusión anatómica y de mejoría en las escalas de severidad y de calidad de vida similares a las técnicas de ablación térmica en el corto plazo.
Thermal endoluminal ablation techniques are the reference treatments of incompetent saphenous vein. However, these techniques need tumescent anaesthesia which increases pain and discomfort during and after the procedure. In addition, heat entails a risk of neurological and skin lesions. Mechano-chemical ablation with ClariVein® catheter does not require either heat or tumescent anaesthesia. Consequently, it involves a low rate of pain and disturbances during and after the procedure, as wells as a fast recovery time to normal activities with a lower risk of neurological and skin lesions. In addition, the anatomical occlusion rates and improvement in severity and quality of life scores are similar to thermal ablation techniques in the short-term.
A medida que las técnicas mínimamente invasivas han ido transformado el tratamiento de las varices con excelentes resultados en cuanto a efectividad, se ha ido poniendo más énfasis en los resultados secundarios como el dolor peri y postoperatorio, el tiempo de recuperación y la calidad de vida1–4.
Los procedimientos endovenosos térmicos, como la radiofrecuencia (RF) y el endoláser (EVLA), son los procedimientos de elección en el tratamiento de las varices, con una oclusión a largo plazo de la vena safena de más del 90%, con pocas complicaciones, mínimas cicatrices y tiempos cortos de recuperación5–7. Sin embargo, estas técnicas requieren el uso de anestesia tumescente, lo que aumenta las molestias y el dolor durante el procedimiento, se asocian con tasas moderadas de malestar postoperatorio y conllevan un riesgo de daño neurológico y de la piel3. La escleroterapia con espuma ecoguiada (EEE) es una alternativa terapéutica que no requiere anestesia tumescente, pero sí de múltiples tratamientos, y a menudo con resultados inferiores al de otras modalidades de tratamiento5,6,8–11.
En estos últimos años la atención se ha centrado en buscar métodos que, siendo igual de efectivos, no tengan todos estos inconvenientes y sean mejor tolerados por el paciente.
Uno de estos métodos es el dispositivo mecánico químico ClariVein® (Vascular Insights LLC, Addison, CT, EE. UU.) desarrollado para minimizar los aspectos negativos de la ablación térmica y de la EEE en el tratamiento de la incompetencia de la vena safena, incorporando los beneficios de ambas12. Las ventajas de este sistema híbrido consisten en ser un tratamiento endoluminal con acceso percutáneo, que se realiza con anestesia local y no requiere anestesia tumescente, y la corta duración del procedimiento. Dado que el sistema no usa energía térmica el riesgo de lesión nerviosa o de la piel disminuye.
El objetivo de este artículo es la descripción del dispositivo, su mecanismo de acción y el procedimiento, de acuerdo con las instrucciones del fabricante y la técnica empleada por los investigadores más relevantes, así como una revisión de los resultados publicados en la literatura.
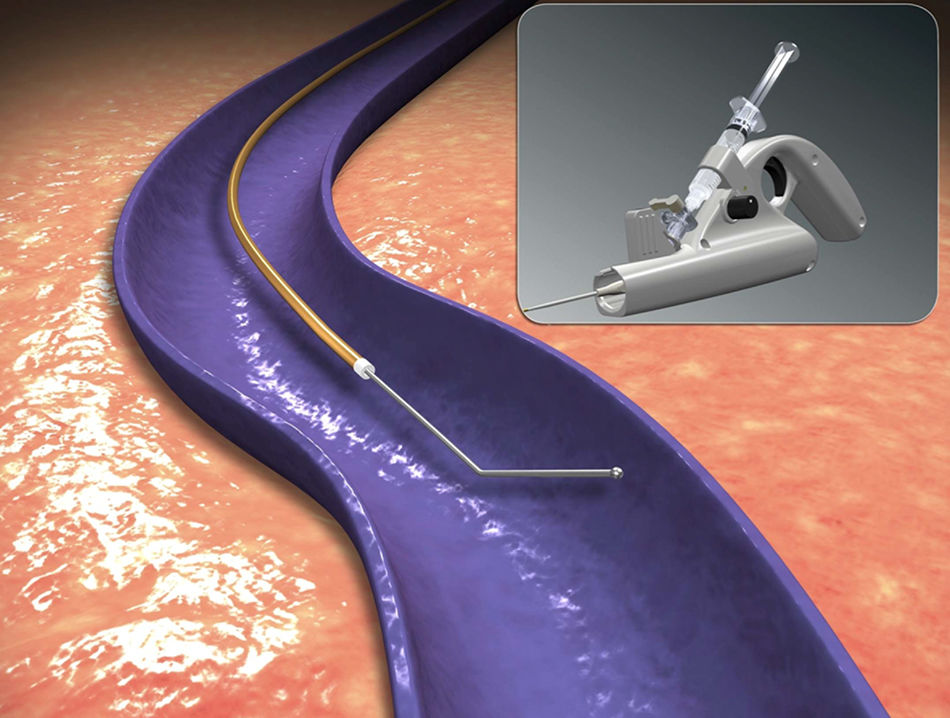
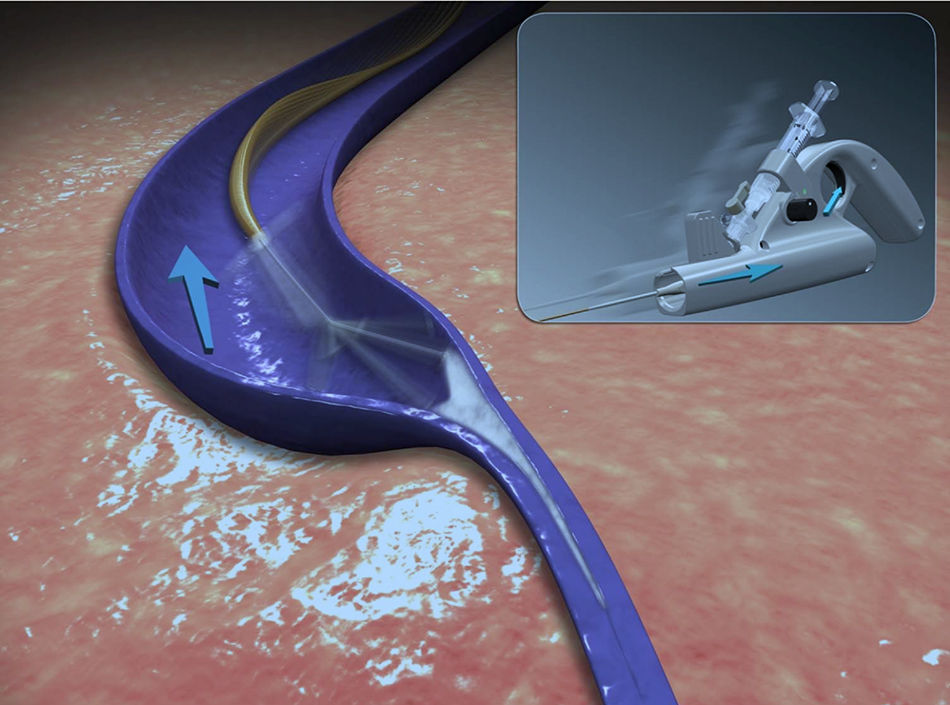
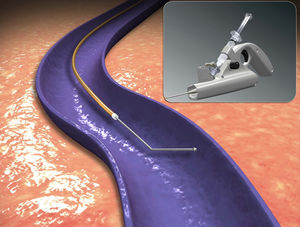
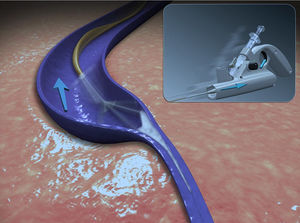
Mecanismo de acciónLa ablación mecánico química con el catéter ClariVein® ha sido diseñada para la oclusión de los troncos venosos. Combina el daño endotelial mecánico, usando un cable rotador, con el daño químico de la pared venosa logrado con la infusión de un líquido esclerosante. Un cable metálico rota en el interior de la vena a 3.500rpm, daña el endotelio, con una mayor eficacia del esclerosante que penetra mejor en la pared de la vena. Simultáneamente, se infunde un líquido esclerosante, polidocanol (POL) o tetradecil sulfato de sodio (STD), a través de una apertura situada en el extremo distal del catéter. Histológicamente se observa una completa desaparición del endotelio y una fibrosis de la pared de la vena8,13–15. Estas 2 modalidades, mecánico y química, logran una oclusión venosa similar a los métodos endotérmicos.
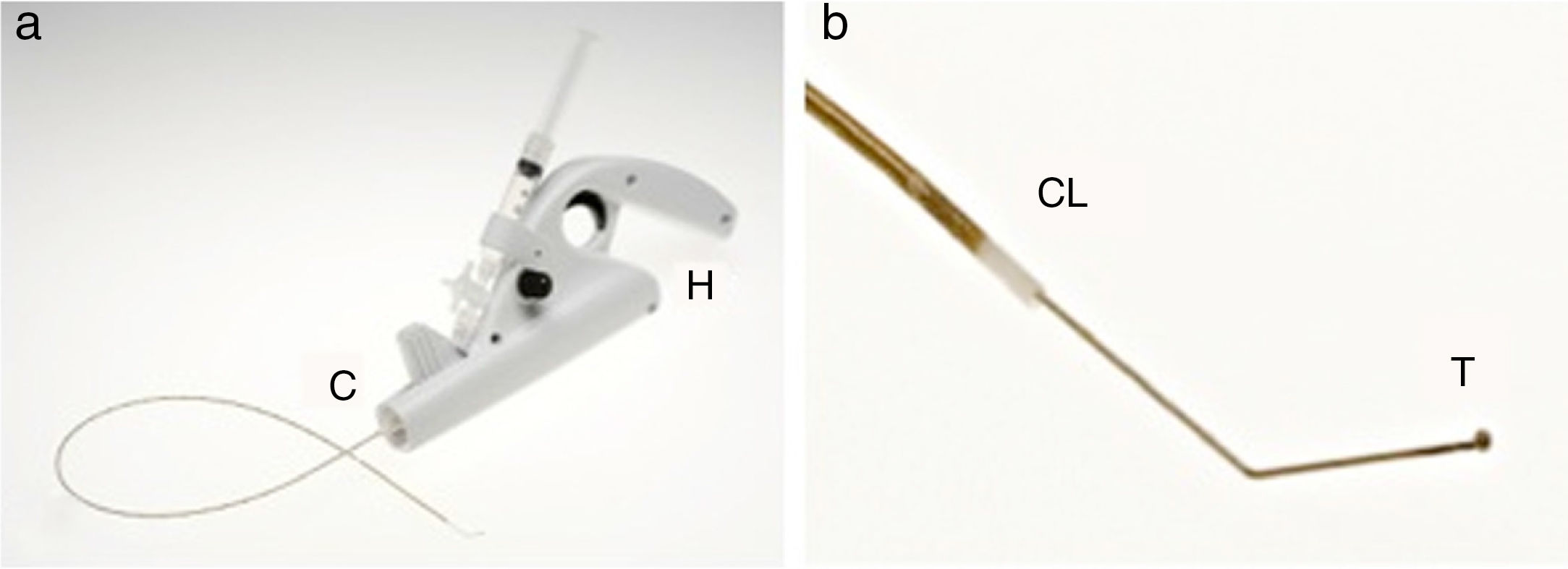
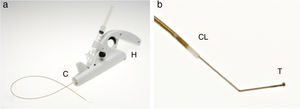
El sistema incluye un catéter de infusión, un sistema de accionamiento por motor, una llave de 3 pasos y una jeringa (fig. 1). El catéter de infusión es un catéter largo que permite administrar un líquido esclerosante a través de un orificio en su parte final. Dentro del catéter se extiende un cable metálico de hierro que termina en una parte angulada que sobresale al catéter con una pequeña bola al final (fig. 2). El catéter y el cable metálico se ensamblan a una unidad motorizada de mano (pistola), que es la que hace rotar el cable de metal. El diseño de la pistola permite apretar con el dedo índice el gatillo que acciona el motor que hace girar el cable, y al mismo tiempo, empujar el émbolo de la jeringa e infundir el líquido esclerosante12 (figs. 3 y 4).
El propósito del cable rotador es: 1) promover la activación de la coagulación a través de un daño mecánico del endotelio; 2) inducir un vasoespasmo y reducir el calibre de la vena; 3) aumentar la acción del esclerosante que penetra en la capa media de la pared venosa tras la denudación del endotelio; y 4) asegurar la distribución del esclerosante en el endotelio16.
ProcedimientoEn nuestro entorno el procedimiento se realiza normalmente en quirófano. Con menor frecuencia se realiza en hospital de día quirúrgico o consultas destinadas a la realización de técnicas que requieren anestesia local y/o sedación y/o monitorización anestésica. En líneas generales no se requiere sedación, y en su lugar se recomiendan técnicas estándar de distracción, como la música o la distracción verbal.
El procedimiento descrito a continuación sigue las recomendaciones de la guía del fabricante y los protocolos publicados por centros de referencia3,9–11,16,17, y queda recogido en la tabla 1.
Procedimiento MOCA con ClariVein®
| Revisar la evaluación clínica preoperatoria (historial clínico del paciente) y resultados de la ecografía |
| Realizar ecoDoppler venoso con el paciente de pie y evaluar troncos venosos a tratar: identificar y marcar las uniones con el sistema venoso profundo (unión safeno femoral [USF], unión safeno poplítea [USP] y perforantes) y colaterales; medir diámetros, diámetro máximo, descartando los primeros 2cm distal a la USF y USP, dilataciones, elongaciones y longitud a tratar, marcar sitio para el acceso venoso percutáneo |
| Asegurar que todos los instrumentos necesarios y fármacos estén disponibles y preparados en la sala de procedimientos |
| Todo el procedimiento se hace con material y técnica estéril |
| Todo el procedimiento se hace ecoguiado |
| Determinar la correcta dosificación, volumen y ratio de infusión del esclerosante (polidocanol o STD) según el diámetro y longitud de la vena a tratar. Calcular la dosis máxima del esclerosante según el peso del paciente |
| Seleccionar la longitud del catéter ClariVein® (45cm o 65cm), abrir el embalaje y dejar el catéter y el resto del contenido en la zona estéril |
| Ensamblar el catéter con la válvula antirreflujo |
| Dejar el sistema de micro punción de 4-5Fr en la zona estéril |
| Purgar el catéter con la válvula antirreflujo y el sistema de micropunción con solución salina |
| Colocar al paciente en decúbito supino o prono en posición anti-Trendelemburg para facilitar el acceso a la vena. Asepsia de la extremidad a tratar y preparación del campo estéril. Exploración ecoDoppler de la vena a tratar comprobando uniones con el sistema venoso profundo, dilataciones, elongaciones, trayectos y el lugar para hacer el acceso venoso percutáneo |
| Aplicar anestesia local con lidocaína al 1% en la zona del acceso venoso percutáneo |
| Canular la vena con la aguja y la guía del sistema de micropunción bajo control ecográfico |
| Insertar el micro introductor de 4-5Fr a través de la guía |
| Calcular por encima de la piel la longitud del catéter aproximada que vamos a introducir |
| Introducir y hacer avanzar el catéter a través del micro introductor bajo control ecográfico |
| Puede ser necesario introducir el catéter girándolo un cuarto de vuelta o media vuelta, pero siempre desde la unidad del mango, nunca girar con el propio cuerpo del catéter, pues podría romperse |
| Colocar la punta del catéter a 2cm de la USF en la vena safena interna o a 1cm de la USP en la curva de la fascia en la vena safena externa |
| Abrir la pistola motorizada, quitar el protector transparente de la pila y dejarla en la zona estéril |
| Apretar el gatillo y verificar que se enciende la luz verde. Si no se encendiera, habría que descartar el producto y coger otro. Hay 3 velocidades de rotación; se recomienda la alta |
| Ensamblar la unidad de catéter con la unidad de pistola motorizada, de manera que el cable de metal se desenvaine (2.ª posición) |
| Colocar la punta del cable de metal (bola de dispersión) a 2cm de la USF en la safena interna o a 1cm de la USP en la curva de la fascia en la safena externa bajo control ecográfico |
| Informar al paciente de que va a sentir una ligera vibración. Si el paciente siente dolor o molestias detener el procedimiento |
| Para venas>10mm de diámetro aplicar una leve presión manual |
| Mantener el catéter recto durante todo el procedimiento |
| Llevar a cabo solo ablación mecánica durante los 2 primeros segundos sin infundir esclerosante |
| Empezar la infusión química y la ablación mecánica simultáneamente. Retirar el catéter con un intervalo de 6-7segundos por cada centímetro, a la vez que se infunde el esclerosante. La dosificación del esclerosante depende del diámetro y longitud de la vena a tratar, del tipo de esclerosante y del peso del paciente. Se recomienda repartir el esclerosante entre 2 jeringas, y tratar con cada una de ellas la mitad de la vena safena a tratar |
| Retirar el micro introductor hacia la posición proximal del catéter, cuando quedan 15-20cm para terminar, para evitar que el cable rote dentro del introductor sin lesionar ese segmento venoso. Se suele extraer el microintroductor tras colocar la segunda jeringa |
| Continuar el tratamiento hasta que aparezca el marcador blanco en el catéter (a 7cm de la punta), continuar con el tratamiento 1-2cm más, dependiendo de la distancia desde la vena hasta la piel, y parar el motor soltando el gatillo. El tratamiento extravascular causa mucho dolor y debe ser evitado |
| Antes de sacar el dispositivo hay que reenvainar la punta de la guía (de la 2.° a la 1.ª posición). Compresión local en el sitio de punción |
| Comprobar la permeabilidad del sistema venoso profundo con el ecoDoppler |
| Comprobar que no haya ningún trombo extendiéndose hacia la vena femoral común/vena poplítea desde la USF o USP |
| Comprobar con el eco-Doppler la oclusión de la vena safena tratada |
| Aplicar un apósito simple sobre el sitio de acceso percutáneo |
| Decir al paciente que haga varias flexiones con el pie |
| Poner al paciente las medias de compresión |
| El paciente puede hacer sus actividades diarias en seguida. Recomendar al paciente caminar y llevar puestas las medias de compresión día y noche durante las siguientes 24 o 48horas. Las siguientes 2-4 semanas las tiene que llevar solamente durante el día |
| Realizar seguimiento clínico y con ecoDoppler a las 4 semanas del tratamiento, a los 3 meses y a los 2 años |
Los 2 esclerosantes líquidos con los que se puede hacer la MOCA están autorizados en España: POL (etoxiesclerol al 0,5%, 2% y 3%) y STD (VeinFibro al 0,2%, 0,5%, 1% y 3%). Para la MOCA se utilizan POL 2% o STD 1% y 1,5%.
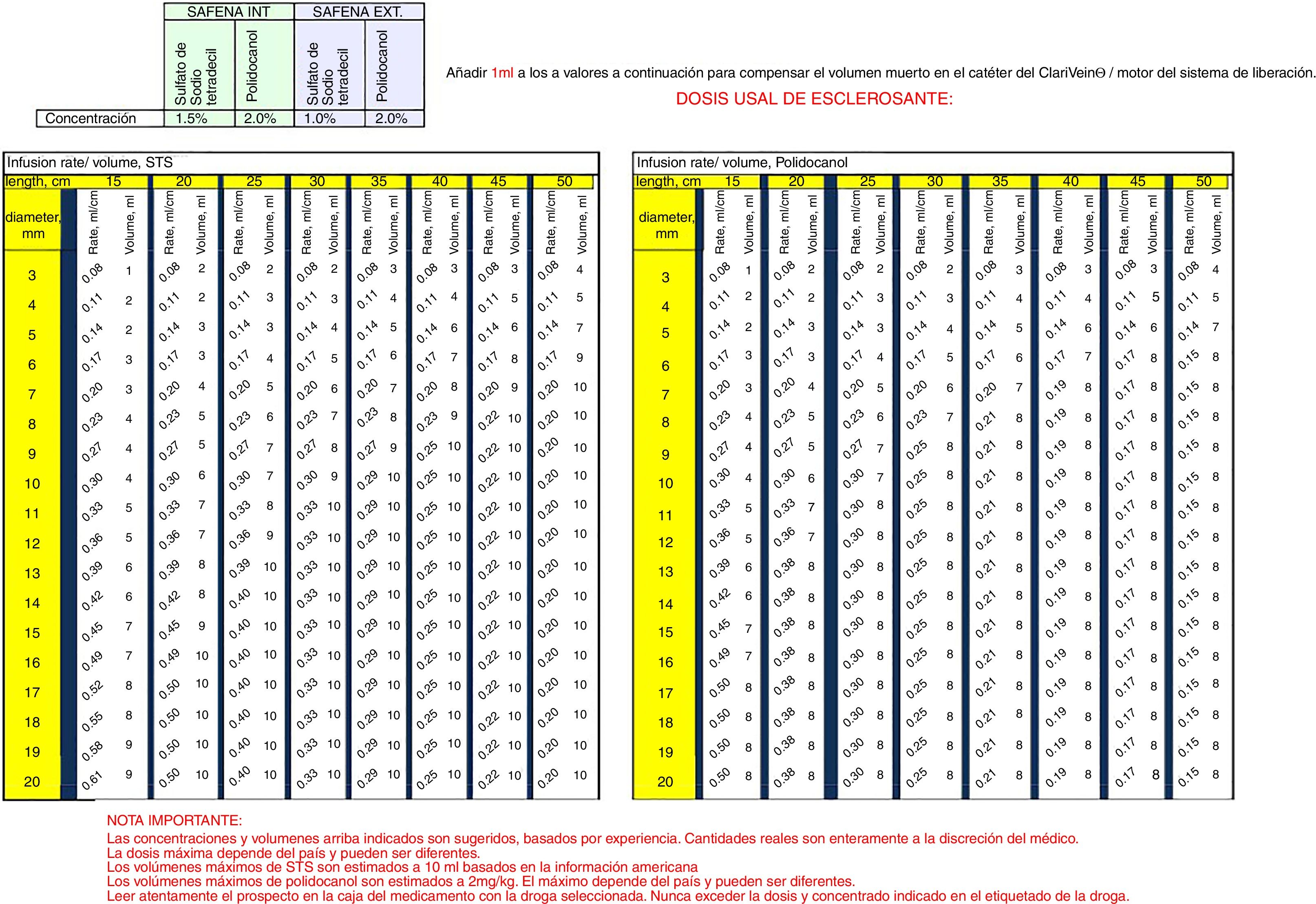
El grupo LOGSA facilita una tabla con recomendaciones generales sobre la dosis de tratamiento y la dosis máxima, tanto para el POL como para el STD, pero advierte de que se deben seguir las indicaciones de la ficha técnica del fármaco (fig. 5). Se pueden utilizar hasta 12ml de POL 1,5% o STD 1,5%.
El fabricante recomienda usar POL 2% para la vena safena grande (VSG) y vena safena pequeña (VSP), o STD 1,5% para la VSG y STD 1% para VSP (fig. 5). Algunos autores recomiendan 2ml de POL 3% para los primeros 10 a 15cm y POL 1,5% para el resto de la VSG16. Otros autores utilizan STD 2% mezclando STD 1% y 3%3,9,10.
El uso del dispositivo ClariVein® con POL 1% en forma de espuma18 se ha asociado con bajas tasas de oclusión en un estudio aleatorizado multicéntrico que compara los resultados empleando POL líquido 3%, POL líquido 1% y POL 1% en forma de espuma. En este estudio de 87 pacientes con insuficiencia de la VSG se obtuvieron tasas de oclusión a las 6 semanas del 88%, 85,7% y 30,4% respectivamente, con lo que se concluyó que concentraciones más elevadas de POL no se asociaron con una tasa más alta de oclusión, y que la MOCA usando POL 1% en forma de espuma era significativamente menos efectiva y, por lo tanto, no debería considerarse una opción de tratamiento de los troncos venosos insuficientes18.
Se define como éxito técnico inicial cuando el catéter se coloca a la distancia de seguridad y se puede tratar la vena safena sin problemas técnicos16,17.
La administración de heparina de bajo peso molecular depende de los protocolos locales de prevención de la enfermedad tromboembólica venosa.
Se aplica una media de compresión hasta el muslo de 20-30mmHg que el paciente llevará día y noche durante las primeras 24-48horas, y solo durante el día las siguientes 2-4semanas.
Se puede o no realizar flebectomía o escleroterapia concomitante. Entre los objetivos de este procedimiento se pretende que sea ambulatorio, que se realice sin analgesia ni sedación perioperatoria y con una incorporación inmediata a la actividad normal. El utilizar dosis elevadas de esclerosante en forma líquida limita el uso de escleroterapia concomitante de las ramas.
En el caso de realizar flebectomía asociada al procedimiento se recomienda colocar un vendaje encima de la media para aumentar la compresión, facilitar la hemostasia y absorber el sangrado que pueda producirse. El vendaje lo retirará el propio paciente a los 3 días dejando solo la media elástica.
Se recomienda la deambulación inmediata tras el procedimiento, y que los pacientes vuelvan a su actividad normal y al trabajo tan pronto como se encuentren preparados para ello. Se recomienda caminar diariamente por la mañana y por la tarde, y tomar paracetamol o antinflamatorios no esteroideos en caso de molestias.
Después de 4 semanas las ramas dependientes de la vena safena generalmente involucionan y se pueden tratar con escleroterapia, con menos volumen y concentración de esclerosante y en un menor número de sesiones10,16,17.
Se recomienda un seguimiento clínico y con ecoDoppler en consultas al mes y a los 2 años del procedimiento, evaluando el éxito clínico y anatómico y la seguridad del procedimiento.
La valoración de la eficacia clínica se hace con la escala CEAP, y si fuera posible con la escala Venous Clinical Severity Score (VCSS). El éxito anatómico se valora con el ecoDoppler. Se examina la vena tratada en todo su trayecto evaluando si es compresible. Se define como fallo de tratamiento: tipo 1 (no oclusión) en el que la vena tratada no se ocluye inicialmente ni durante el seguimiento y tipo 2 (recanalización) en el que la vena tratada se ocluye tras el tratamiento, pero se recanaliza durante el seguimiento, que puede ser tipo 2a con recanalización parcial (<10cm), o tipo 2b con recanalización completa (>10cm)4.
Las complicaciones postoperatorias se definen como aquellas complicaciones que ocurren en los primeros 30 días tras el tratamiento. Las complicaciones mayores incluyen trombosis venosa profunda (TVP), embolismo pulmonar (EP) y lesión nerviosa o en la piel. Las complicaciones menores incluyen: equimosis, flebitis superficial, hiperpigmentación, induración, infección en el punto de punción, dolor prolongado de más de una semana y complicaciones relacionadas con el uso de esclerosantes16.
ResultadosSe ha confirmado la eficacia y la seguridad del MOCA, con tasas de oclusión que varían del 94% al 97%1–4,8–11,16,17,19–25, no solo para la VSG, sino también para la VSP21,22, sin observarse complicaciones mayores como TVP, EP o lesión nerviosa. El tiempo de procedimiento y el dolor durante y después del procedimiento son significativamente mejores que para la RF y el EVLA9,23.
La seguridad y eficacia de la MOCA se mostró en el primer estudio humano1 en el que 30 pacientes con insuficiencia primaria de la VSG fueron tratados usando STD. El éxito anatómico a los 6 meses fue del 97%. Ningún paciente se quejó de dolor durante el procedimiento. No hubo TVP, ni lesión nerviosa o en la piel. El seguimiento medio fue de 260 días. Hubo un caso (uno de 30) de recanalización, con una tasa de cierre primario de 96,7% a los 260 días. Hubo 3 casos de equimosis1. Los autores concluyeron que el dispositivo ClariVein® era seguro y parecía ser efectivo en el tratamiento del reflujo del tronco venoso. Después de un seguimiento de 2 años 27 de las 28 VSG tratadas estaban ocluidas con un éxito anatómico del 96%2,19.
Otras publicaciones han mostrado resultados inconsistentes con respecto a la eficacia del dispositivo ClariVein®. Un estudio retrospectivo en 2 centros de Holanda de 30VSG incompetentes en 25 pacientes mostró una tasa de oclusión del 87% a las 6 semanas20. La puntuación media máxima de dolor fue 4 (rango intercuartil [IQR] 3-6) sobre una escala de 10 puntos y el dolor medio máximo el primer día postoperatorio fue 9mm de 100mm en una escala visual analógica (EVA)20. No hubo eventos adversos mayores y las complicaciones menores incluyeron 9 casos de equimosis local en el acceso y 4 flebitis. La satisfacción de los pacientes fue de 8,5 (IQR 8-9) en una escala de 10 puntos, y la puntuación media del VCSS disminuyó significativamente desde 3 a 1 (p<0,001)20.
En el estudio más grande publicado hasta la fecha3, Van Eekeren et al. evaluaron 268 extremidades con incompetencia de 210 VSG, 44 VSP y 14 tributarias anterolaterales. La tasa de oclusión fue 99% a las 6 semanas y 94% a los 6 meses. Se produjo una tromboflebitis superficial en la vena tratada y hematoma en el acceso venoso en el 21% y 26% de los casos respectivamente3.
Estudios con seguimientos más largos muestran elevadas tasas de oclusión2,4,24. El pequeño estudio de Elias2, con un seguimiento de 24 meses, obtuvo una tasa de oclusión del 97%. El estudio de cohortes publicado por Van Eekeren4 contaba con 92 pacientes (106 miembros). Se definió como fallo de tratamiento un segmento no ocluido o recanalizado en el seguimiento de>10cm de la GSV tratada. La tasa de oclusión anatómica inmediata fue del 100%, 93,2% a los 6 meses y 88,2% al año, menor si lo comparamos con las técnicas endotérmicas y la cirugía abierta, que fueron al año del 94,2% para el EVLA, 95,2% para la RFA y 95% para el stripping, y mayor que la EEE que fue 83,7% al año, según lo publicado por Rassmunssen6. La puntuación media del VCSS mejoró significativamente a los 6 meses y al año de seguimiento (p<0,001). Comparado con el valor de partida, la calidad de vida mejoró significativamente con una puntuación media de AVVQ de 6,6 a los 6 meses (p<0,001) y 2,4 al año (p<0,001). El dolor medio postoperatorio a los 14 días fue de 7,4mm utilizando una EVA de 0-100. No se observaron complicaciones mayores, aunque se registraron tromboflebitis, induraciones, hematomas localizados y una leve hiperpigmentación en el sitio de punción4.
Un estudio multicéntrico realizado en 6 centros especializados en el tratamiento venoso en EE. UU., con un seguimiento de 24 meses, obtuvo una tasa de oclusión del 92%24. Los resultados obtenidos fueron una mejoría en las escalas clínicas CEAP y VCSS en todos los intervalos de seguimiento y una tasa de oclusión de la VSG de 100% a la semana, 98% a los 3 meses, 95% a los 12 meses y 93% a los 24 meses24. Hubo un paciente con una recanalización completa y 4 con una recanalización parcial, con un rango de 7 a 12cm (medía 9cm de longitud). Se realizó tratamiento concomitante en el 14% de los pacientes (flebectomía 9%, escleroterapia 5%). Durante el seguimiento en 6 pacientes se trataron varices sintomáticas con escleroterapia. Respecto a las complicaciones hubo un 10% de tromboflebitis superficial en el trayecto de la vena tratada y ninguna complicación mayor24.
La VSP es responsable de aproximadamente el 15% de la incompetencia de tronco venoso en los miembros inferiores. El grupo investigador holandés21 evaluó 50 pacientes con incompetencia primaria de la VSP tratados con MOCA con POL 1,5%, siendo los diámetros de la vena entre 2,5mm y 11mm. El éxito anatómico se definió como la oclusión de la vena tratada, y el fallo de tratamiento se definió como la no oclusión de un segmento>10cm. La tasa de oclusión fue del 100% y del 94% a las 6 semanas y al año de seguimiento, respectivamente. Es de reseñar que se usaron diferentes concentraciones de esclerosante para tratar la porción proximal, con POL 1,5% en los primeros 15 pacientes y POL 2% en los siguientes 35 pacientes. Hubo 2 recanalizaciones en pacientes tratados con la concentración más baja, comparado con solo uno de aquellos que recibieron POL 2%. La puntuación media del EVA fue de 2cm (IQR 2-4cm) y la puntuación media de la encuesta de satisfacción fue de 8 (IQR 8-9). No hubo complicaciones mayores, incluido lesión nerviosa y TVP. Las complicaciones menores fueron fundamentalmente equimosis localizadas e induración, y tromboflebitis superficial en un 14%21.
Se puede tratar más de un tronco safeno en el mismo procedimiento, tal y como demuestran Tang et al. en su estudio25. En este estudio, realizado con 300 pacientes (371 piernas), se trataron 184 VSG, 62 VSG de forma bilateral, 23 VSP, 6 VSP bilaterales y 25 casos de VSG y VSP. Los procedimientos se realizaron con éxito con una oclusión inicial de 100% de todas las venas tratadas y de 94% a los 2 meses. Se realizaron de forma ambulatoria con anestesia local, con muy buena tolerancia, con una puntuación media de dolor de 0,8 sobre una escala de 10 durante el procedimiento. A los 2 meses 13 de las 393 venas tratadas estaban ocluidas parcialmente, requiriendo un retratamiento con espuma ecoguiada25.
La ablación mecánico-química se ha asociado con un menor dolor postoperatorio y una recuperación más rápida al compararla con las técnicas endovenosas térmicas. Se han realizado estudios comparando el dispositivo ClariVein® con la RFA en cuanto a mejoría de la calidad de vida y el dolor experimentado durante y después del procedimiento, siendo los resultados mejores para la MOCA3,9,23.
Van Eekeren et al.3 compararon el dolor postoperatorio a los 14 días y la calidad de vida evaluada de forma temprana entre la MOCA y la RFA en un estudio observacional prospectivo de 68 pacientes consecutivos tratados por reflujo sintomático de VSG unilateral sintomática, siendo el dolor postoperatorio significativamente menor en el grupo MOCA (4,8mm en el MOCA versus 18,6mm en la RFA en la EVA, p<0,001). Esto se correlacionó con una vuelta antes al trabajo y a la actividad normal. No hubo diferencias significativas en las características de los pacientes. La puntuación media del dolor durante el procedimiento fue similar en ambos grupos (p<0,16). Los pacientes operados con MOCA tuvieron menos dolor comparado con la RFA durante los 3 primeros días (6,2mm vs. 20,5mm; p<0,004) y durante los primeros 14 días tras el tratamiento (4,8mm vs. 18,6mm; p<0,001)3. También necesitaron menos analgesia comparados con el grupo de la RFA. Los pacientes de ambos grupos que desarrollaron tromboflebitis e induración tuvieron unas puntuaciones de dolor más altas. Los tiempos de procedimiento fueron más cortos en el grupo MOCA (p<0,02). El tiempo de vuelta a la actividad normal y al trabajo fue significativamente más corto en el grupo MOCA. Los autores concluyeron que el dolor postoperatorio fue significativamente más bajo tras la MOCA comparado con RFA, y que MOCA se asociaba con una vuelta más rápida a la actividad normal y al trabajo. Este fue el primer estudio que mostró evidencia directa sobre un menor malestar y una recuperación más rápida con MOCA, pero se trataba de un estudio no aleatorizado y no quedaban claros los criterios para seleccionar los pacientes. Más aún, no hubo diferencias en la puntuación del dolor durante el procedimiento en ambos grupos, aunque los autores achacan este hecho a que la muestra era muy pequeña para detectar las diferencias y sugirieron realizar un estudio aleatorizado3.
Bootun et al. realizaron un ensayo clínico aleatorizado multicéntrico que comparaba la MOCA con RFA en el tratamiento de la GSV o SSV evaluando el dolor durante el procedimiento y la mejoría de la calidad de vida al mes y a los 6 meses, y los resultados finales han sido publicados recientemente9,10. Los investigadores definieron 4 clasificaciones ecográficas para el seguimiento: oclusión completa de la vena safena, oclusión proximal (oclusión proximal>5cm, con permeabilidad distal>5cm), oclusión distal (oclusión distal>5cm, con permeabilidad proximal>5cm) y safena permeable. El grupo investigador agrupó los resultados de oclusión completa y oclusión proximal a la hora de comparar las 2 técnicas. De un total de 170 pacientes con insuficiencia primaria de la VSG (86%) y de la VSP (14%), 87 pacientes fueron aleatorizados a MOCA y 83 a RFA, con una tasa de oclusión al mes del 92% para MOCA (83% una oclusión completa y 9% una oclusión proximal>5cm) y 92% de oclusión completa y proximal para RFA, y a los 6 meses de 87% para MOCA y 93% para RFA, sin encontrar diferencias significativas. No hubo diferencias entre MOCA y RFA en la mejoría de la escala VCSS, en la mejoría de la calidad de vida genérica y específica para la enfermedad, ni en el número de días que tardaron en volver a sus actividades diarias y al trabajo, que fue de 2 días de media. Pero sí hubo diferencias significativas en el dolor experimentado durante el procedimiento de ablación del tronco venoso, siendo significativamente menor en el grupo MOCA. No se evaluó el dolor durante la flebectomía. Hubo una TVP en cada grupo, siendo la del grupo MOCA una extensión del trombo de la vena safena grande dentro de la vena femoral común (VFC) y ocupando<50% de la luz de la VFC, y la del grupo de RFA, una trombosis de venas de la pierna. Hubo 3 casos de tromboflebitis en el trayecto de la vena safena tratada en el grupo MOCA y 2 en el grupo de RFA. Los autores concluyeron que, a igualdad de mejoría clínica, anatómica, en calidad de vida y en vuelta al trabajo, el procedimiento MOCA tenía como ventaja un menor dolor durante el procedimiento9,10.
El estudio Mechanochemical endovenous Ablation versus RADiOfrequeNcy Ablation (MARADONA) en el tratamiento de la incompetencia primaria de VSG es un estudio controlado aleatorizado multicéntrico en el que 460 pacientes han sido aleatorizados a tratamiento con MOCA o RFA16. Los resultados principales del estudio son el éxito anatómico y clínico a un año y 5 años, y el dolor postoperatorio. Los resultados secundarios son el éxito técnico, las complicaciones, el tiempo de cirugía, el dolor durante el procedimiento, la calidad de vida específica de la enfermedad venosa, el tiempo de vuelta al trabajo y a las actividades diarias y el análisis de coste-eficiencia tras RFA o MOCA16. Los pacientes serán seguidos durante 5 años y los resultados se esperan para 2020. De forma similar, Boersma et al. están realizando un estudio aleatorizado multicéntrico comparando MOCA en la vena safena menor comparado con la RFA con un seguimiento de 5 años, con una metodología y variables similares17.
Un pequeño estudio de 6 pacientes con úlceras persistentes, a los que se les había realizado una RFA de la VSG del muslo, encontró mejoría en la tasa de cicatrización de las úlceras tras la MOCA de la VSG por debajo de la rodilla26. Se entró por la VSG infragenicular, se condujo el catéter hasta el maléolo y se infundió esclerosante líquido en las colaterales localizadas en el lecho de la úlcera. El cierre de la úlcera se produjo con una media de 28 días, mucho más rápido que el tiempo habitual con la terapia estándar con compresión de 5 meses, y no hubo recurrencias durante el seguimiento. No se produjo ninguna neuropatía.
Las complicaciones de este procedimiento incluyen la tromboflebitis venosa superficial, la induración a lo largo del trayecto de la vena tratada, el hematoma localizado y la hiperpigmentación ligera en el sitio de la punción4. No ha habido publicaciones de necrosis de la piel, TVP, EP, ni lesión nerviosa1–4,8–11,16,17,19–25.
Un efecto adverso es el enganche de la punta del cable. Esto puede producir equimosis y malestar y/o resistencia a la retirada del catéter1,27. Raramente, tal y como publicaron Lane et al., el catéter puede quedarse atrapado sin posibilidad de desengancharlo, con consecuencias dramáticas como el stripping invertido de la vena safena pequeña28.
Limitaciones de la técnicaEsta técnica presenta la limitación de la dosis de esclerosante, con la recomendación de la Guía europea de escleroterapia29 de un máximo de 10ml de STD líquido al 3% o 2mg/kg de POL. La técnica conduce a una dosis variable de esclerosante por centímetro tratado, dependiendo del diámetro de la vena de acuerdo al protocolo y guía de uso de Vascular insights MOCA. Por el contrario, las técnicas tumescentes no tienen esa limitación. Son necesarios estudios que evalúen los límites de volumen para guiar tanto la MOCA como las técnicas de escleroterapia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.