Los aneurismas de arteria iliaca aislados constituyen una entidad especial, no solo por su infrecuencia (0,4-1,9% de la patología aneurismática) sino también por la demostrada mayor complejidad de su reparación, respecto a los aneurismas de aorta abdominal, especialmente cuando aquellos se extienden a la arteria iliaca interna. La aparición de las técnicas endovasculares, con su menor morbimortalidad, ha supuesto un cambio en el paradigma de tratamiento de los aneurismas de arteria iliaca, desplazando en los últimos años a la cirugía abierta como principal forma de reparación. Además, la preservación de la arteria iliaca interna se ha convertido en un objetivo prioritario, añadiéndose nuevas estrategias endovasculares, como la técnica «bell-bottom», la técnica sándwich, el «iliac branch device»… El objetivo de este artículo es actualizar el manejo y tratamiento quirúrgico de los aneurismas de arteria iliaca y exponer con claridad, en forma de algoritmos, la multitud de opciones terapéuticas para su reparación mediante cirugía abierta o endovascular.
Isolated iliac artery aneurysms constitute a special case, not only for being extremely rare, 0.4% to 1.9% of all aneurysmal diseases, but also as their repair is more challenging, compared to that of abdominal aortic aneurysm, especially if the internal iliac artery is involved. The onset of endovascular techniques, with decreased morbidity and mortality, has led to a paradigm shift, replacing open surgical repair as the primary means of treatment. Furthermore, preserving internal iliac artery has become a critical issue, leading to newer endovascular techniques being used, such as bell-bottom technique, sandwich technique, the use of iliac branch devices, etc. The aim of this article is to update the management and treatment of iliac artery aneurysms in order to clearly demonstrate, using algorithms, the variety of open and endovascular surgical options.
Un aneurisma de arteria iliaca (AAI) es una dilatación permanente, focal de la arteria, que mide más del 50% del diámetro normal del vaso (>1,5cm de diámetro máximo). Una arteria iliaca interna con un diámetro>8mm se considera aneurismática.
EpidemiologíaLos AAI aislados son extremadamente raros, siendo lo más frecuente y característico su asociación a un aneurisma de aorta abdominal (AAA). En la población general se estima una incidencia de AAI aislados del 0,03%1, representando el 0,4-1,9% de la patología aneurismática2. El 70% de los aneurismas iliacos corresponden a aneurismas de la arteria iliaca común (AIC) y el 25% a aneurismas de la arteria iliaca interna (AII); los aneurismas de la arteria iliaca externa (AIE) son excepcionales3. El 15-40% de los AAA se asocian a un aneurisma iliaco4,5.
Los AAI son mucho más frecuentes en el sexo masculino, en una proporción 7:1. Su incidencia se incrementa con la edad, siendo máxima en la 7.a-8.a décadas de la vida.
EtiopatogeniaLa mayoría de los AAI son aneurismas verdaderos y su causa más frecuente es la enfermedad aterosclerótica. Otras causas incluyen seudoaneurismas secundarios a sífilis, tuberculosis y osteomielitis. Se han descrito casos de AAI infecciosos con aislamiento de Salmonella, Staphylococcus aureus, Klebsiella y Candida6.
Además, pueden asociarse a síndrome de Behcet, displasia fibromuscular, arteritis de Takayasu, otras enfermedades del tejido conectivo (síndromes de Marfan y Ehlers-Danlos), enfermedad de Kawasaky…
La historia natural de los AAI consiste en el crecimiento continuo con el tiempo y su potencial rotura; la tasa de crecimiento depende del diámetro basal de la arteria iliaca en el momento del diagnóstico, y aumenta con el mismo.
ClínicaAunque la presentación clínica de los AAI es variable, la mayoría de los pacientes son asintomáticos y el aneurisma constituye un hallazgo incidental en pruebas de imagen realizadas por otros motivos.
En AAI sintomáticos, las manifestaciones clínicas dependen de su tamaño y localización. Aneurismas grandes (>5cm) se manifiestan con síntomas compresivos o rotura con colapso hemodinámico. La compresión de estructuras adyacentes incluye uréter (hidronefrosis), colon (obstrucción intestinal), plexo lumbar (parestesias, dolor radicular) o vena iliaca (edema, trombosis venosa).
Más del 30% de los AAI aislados se presentan con rotura, describiéndose tasas de mortalidad de hasta el 60%7,8.
Los síntomas por trombosis o tromboembolismo con isquemia de miembros inferiores son mucho menos frecuentes.
DiagnósticoLa exploración física comprende palpación abdominal, tacto rectal y exploración vascular periférica. La palpación de una masa abdominal pulsátil confirma el diagnóstico pero una exploración negativa no lo excluye. Las pruebas de imagen son esenciales para el diagnóstico de certeza. El eco-doppler es la prueba inicial de elección aunque puede estar limitada si las arterias iliacas son tortuosas o profundas o si existe gas intestinal. El angio-TAC es de gran precisión para el diagnóstico y en la definición de las características anatómicas del aneurisma. La angio-RM aporta la misma precisión que el angio-TAC pero su alto coste y otros factores (implantes metálicos, fibrosis sistémica nefrogénica secundaria a gadolinio) limitan su uso. No es útil la arteriografía al falsear el verdadero diámetro del aneurisma.
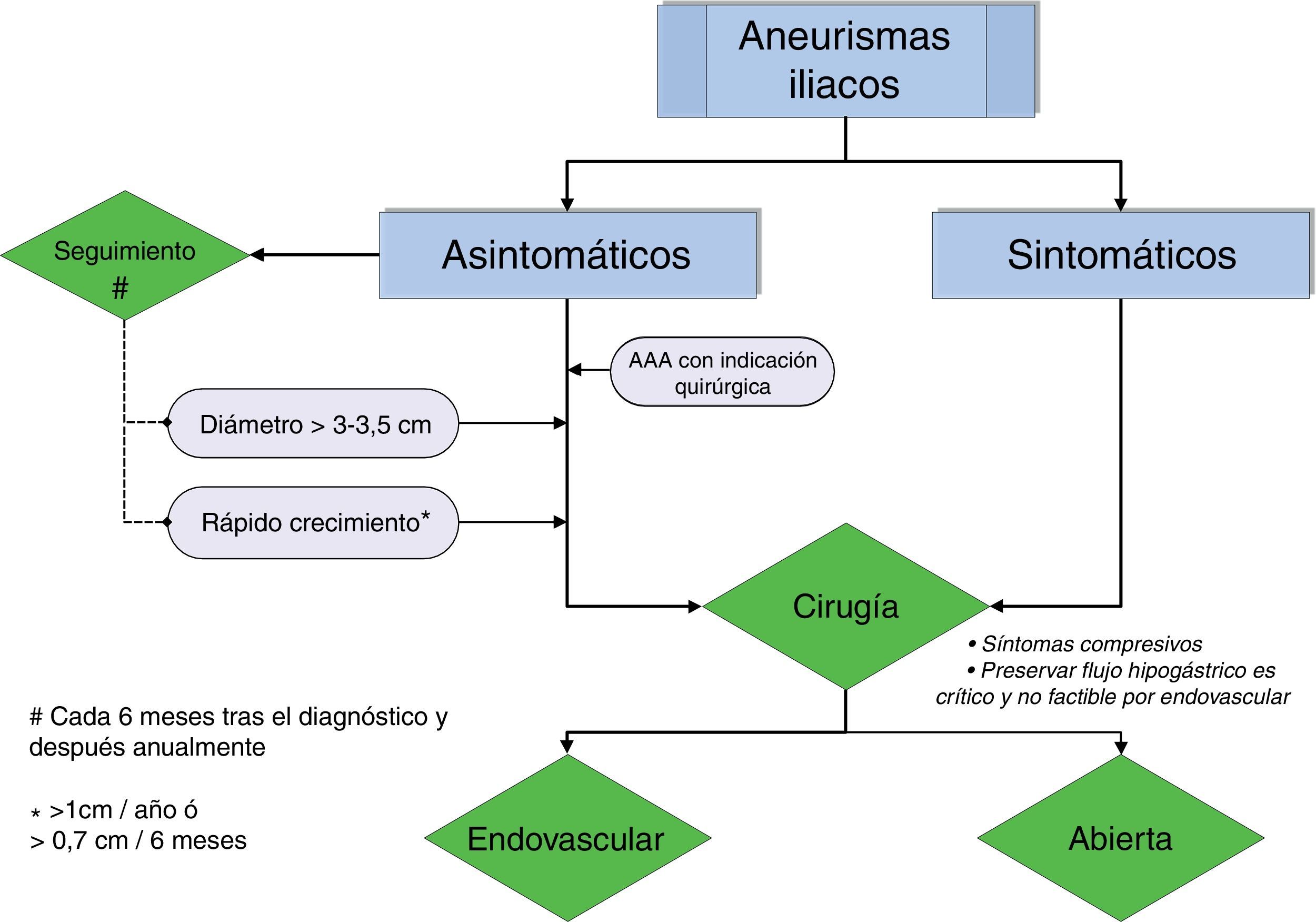
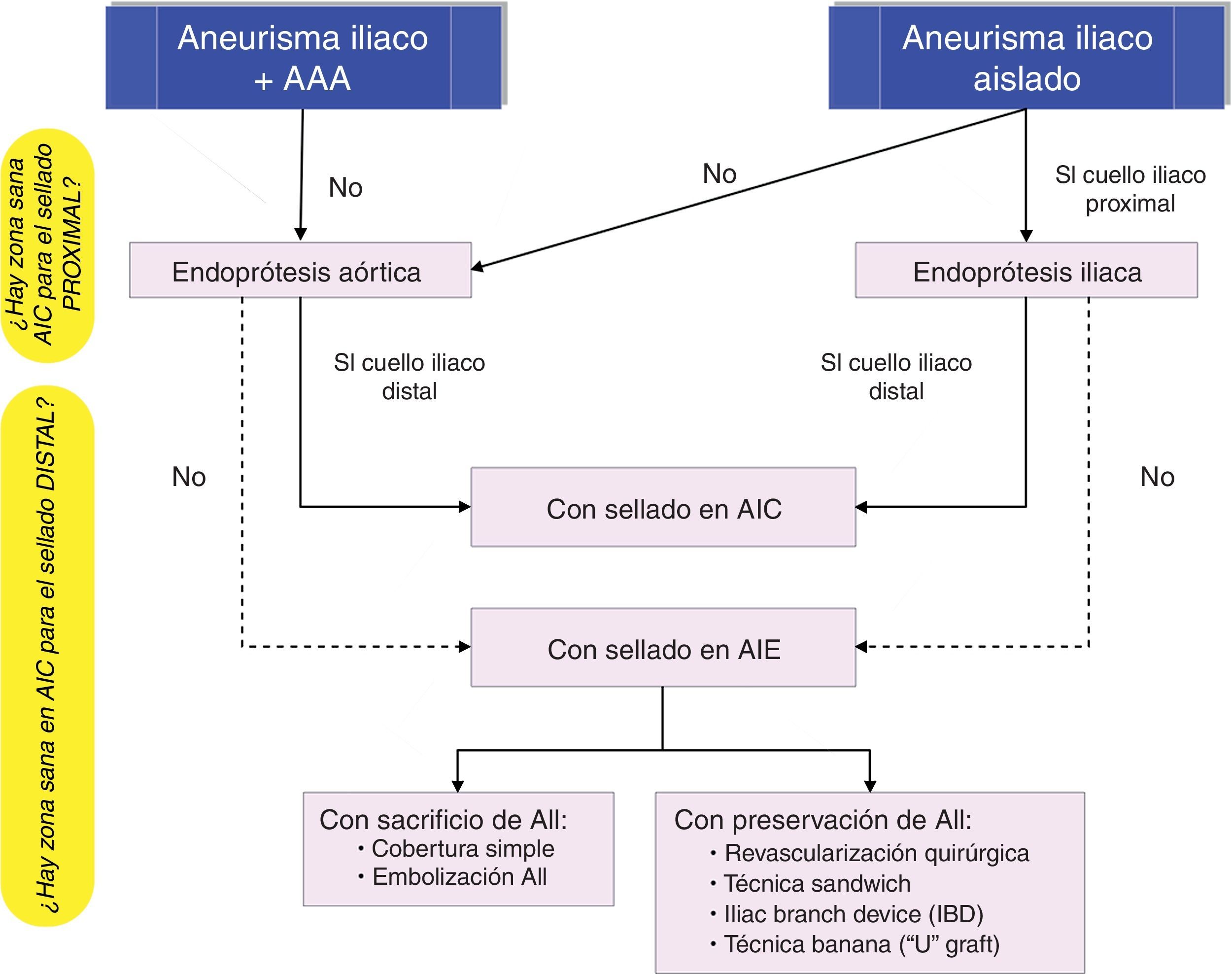
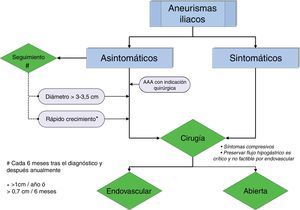
Actuación ante un aneurisma de arteria iliaca (ver algoritmo en la figura 1)El algoritmo de decisión está basado en el riesgo de rotura del AAI, que depende a su vez del diámetro aneurismático y del ritmo de crecimiento. La mortalidad de la cirugía electiva de los AAI se sitúa en torno al 1%, en contraste con la altísima mortalidad quirúrgica de la cirugía urgente por rotura (20-55%)9–11.
Santilli et al.12 indicaron que el crecimiento de los AAI es relativamente lento (1mm/año para diámetros<3cm y 2,5mm/año para diámetros>3cm), además concluyeron que la rotura de un aneurisma de AIC<3,5cm es un hecho excepcional. A partir de este trabajo se estableció en 3-3,5cm de diámetro el umbral de reparación quirúrgica13–15. Para los aneurismas hipogástricos se ha propuesto, recientemente, en base a un estudio observacional, diferir su tratamiento hasta que alcancen los 4cm16.
La presencia de un AAA concomitante, con su riesgo de rotura independiente, así como la expectativa de vida del paciente también influyen en el algoritmo de actuación.
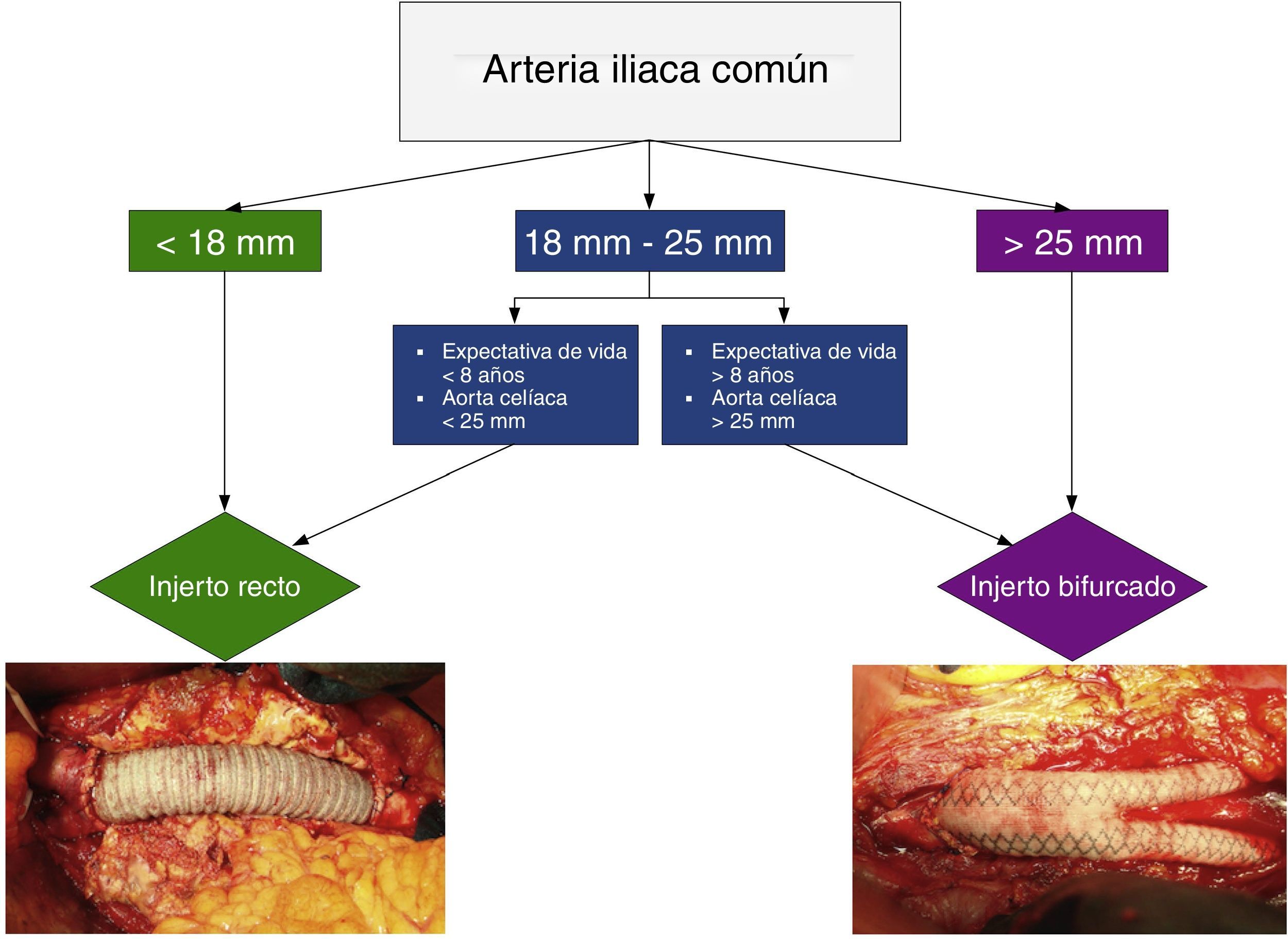
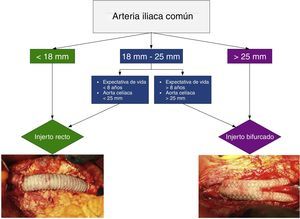
En la reparación conjunta de un AAA y un AAI mediante cirugía abierta, la elección de un injerto recto o bifurcado está determinada por el diámetro de la arteria iliaca. Si el diámetro preoperatorio es>25mm está indicado un bifurcado; si es<18mm, un injerto recto; con diámetros comprendidos entre 18 y 25mm la decisión se basa en la expectativa de vida del paciente y en el diámetro de la aorta celíaca (ver algoritmo en la figura 2).
El algoritmo engloba las indicaciones de cirugía:
- 1.
AAI roto
- 2.
AAI sintomático, que generalmente es de mayor tamaño y presenta un alto riesgo de rotura
- 3.
AAI asintomático≥3-3,5cm
- 4.
Ritmo de crecimiento rápido (>1cm/año o>7mm en 6 meses)
- 5.
AAA con indicación quirúrgica
Un AAI asintomático sin indicación quirúrgica debe ser seguido con exploración física y angio-TAC, a intervalos de 6 meses. Si permanece estable el seguimiento se efectúa anualmente. El eco-doppler es una excelente alternativa si aporta una buena imagen.
Tratamiento de aneurismas de arteria iliacaNo hay estudios aleatorizados comparando la cirugía abierta con la endovascular, pero las recomendaciones actuales, si la anatomía aortoiliaca es favorable, se inclinan hacia el tratamiento endovascular. La cirugía abierta es de elección en 2 situaciones: cuando preservar la arteria hipogástrica es crítico para el mantenimiento de la circulación pélvica, y no factible mediante procedimientos endovasculares, o si un aneurisma de gran tamaño provoca compresión de las estructuras adyacentes.
Aunque no hay diferencias significativas en términos de permeabilidad o mortalidad, la cirugía endovascular se asocia a una menor morbilidad perioperatoria, lo cual es un punto clave dada la edad y comorbilidad de los pacientes.
Varios estudios observacionales concluyen que el tratamiento endovascular frente a la cirugía abierta está asociado a un menor tiempo quirúrgico, menor estancia hospitalaria (uno vs. 5-10 días) y menor pérdida hemática con necesidad de transfusión (6 vs. 47%)17–19.
En los AAI rotos la mortalidad es más baja con el tratamiento endovascular, sin embargo, el sesgo de selección derivado de intervenir mediante cirugía abierta a los pacientes con inestabilidad hemodinámica, resta valor a esta observación17.
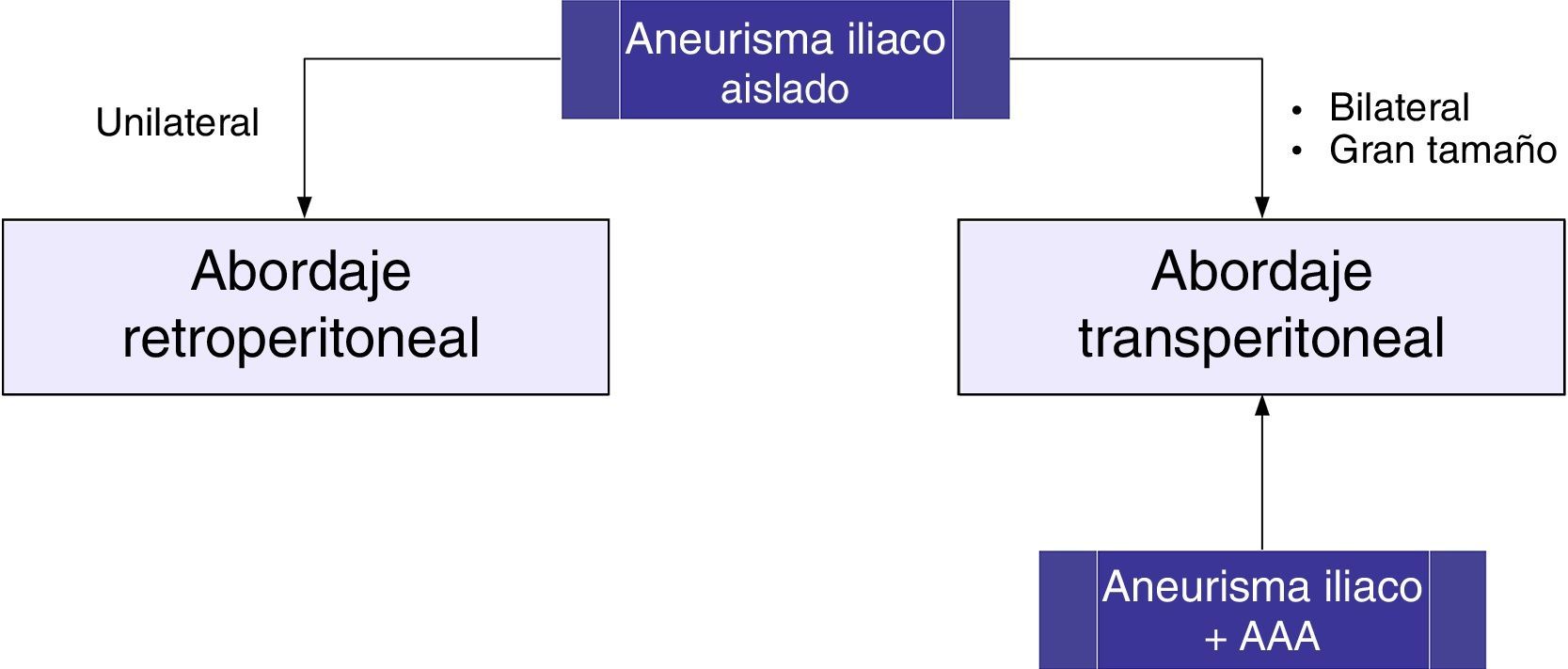
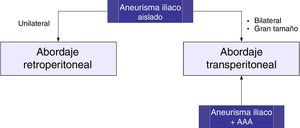
Cirugía abierta de aneurismas de arteria iliacaLa estrategia quirúrgica tradicional la determinan la localización y extensión del aneurisma iliaco, así como la presencia concomitante de AAA. Puede realizarse abordaje transperitoneal o retroperitoneal. En pacientes con un AAI aislado unilateral se prefiere la vía retroperitoneal, aunque en los de gran tamaño el acceso puede estar limitado. Un abordaje transperitoneal puede ser preferible en AAI bilaterales o asociados a AAA, ya que el control de la arteria iliaca distal contralateral puede ser muy dificultoso con el abordaje retroperitoneal (fig. 3).
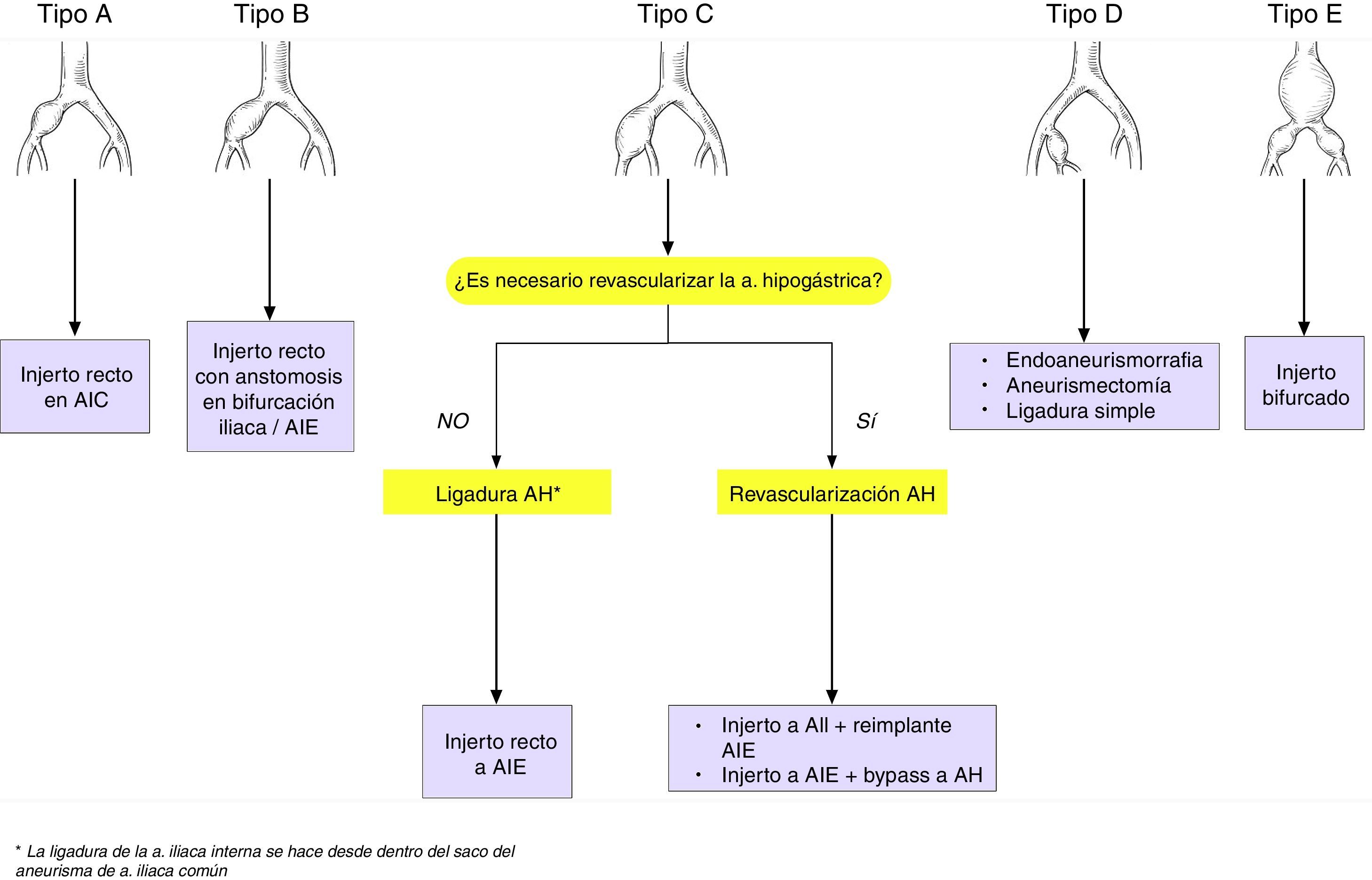
Sandhu y Pipinos20 han propuesto una clasificación anatómica según el segmento iliaco aneurismático:
- •
Tipo A: aneurisma de AIC con cuello proximal y distal
- •
Tipo B: aneurisma de AIC con cuello proximal que alcanza la bifurcación iliaca
- •
Tipo C: aneurisma de AIC con cuello proximal que afecta la bifurcación y se extiende a la AII
- •
Tipo D: aneurismas aislados de AII
- •
Tipo E: aneurisma de AIC sin cuello proximal, aneurismas de AIC bilaterales o combinación de aneurisma iliaco y AAA
La técnica quirúrgica general para la reparación de los AAI es la endoaneurismorrafia con interposición de injerto, mejor que ligadura con bypass.
Es imperativo evitar disecciones innecesarias con objeto de reducir el riesgo de lesiones iatrogénicas de estructuras vecinas. No es aconsejable la resección del saco debido al riesgo de sangrado y de lesión de estructuras próximas como el uréter.
Cuando el AAI tiene cuello proximal y no está calcificado es preferible no disecar ni pinzar la aorta, con esto se suprime la posibilidad de isquemia contralateral, y el riesgo de complicaciones cardiológicas y pulmonares
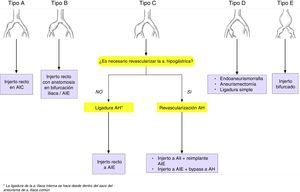
Las opciones quirúrgicas según el tipo de aneurisma iliaco son (fig. 4):
- •
Tipo A: interposición de injerto recto, con anastomosis a iliaca sana proximal y distalmente; aunque se han descrito reintervenciones tardías hasta en el 29% de los casos, a causa de degeneración aneurismática de la aorta con el tiempo
- •
Tipo B: interposición de injerto recto, con anastomosis distal en la bifurcación iliaca o en la AIE, ligando en este caso la AIC proximal a bifurcación para permitir la perfusión retrógrada de la hipogástrica
- •
Tipo C: se debe valorar la revascularización de la arteria hipogástrica, aunque convencionalmente puede ser ligada, sobre todo cuando la contralateral y/o la arteria mesentérica inferior están permeables. Cuando se preserva la arteria hipogástrica hay 2 opciones de reconstrucción:
- -
Interposición de injerto recto en T-T desde AIC a la AIE, con bypass corto a hipogástrica o transposición de la misma) o
- -
Interposición de injerto recto desde AIC a la AII, con reimplante de la externa
- •
Tipo D
- -
Endoaneurismorrafia con interposición de injerto
- -
Aneurismectomía
- -
Ligadura simple, en situaciones de riesgo vital, aunque lo recomendable es la ligadura proximal y distal
- •
Tipo E: injerto bifurcado (aortobiiliaco o aortobifemoral). En aneurismas iliacos bilaterales, incluso en ausencia de AAA, el injerto se debe anastomosar a nivel infrarrenal, debido al riesgo de degeneración aneurismática. Además, es mandatorio preservar al menos una arteria hipogástrica, especialmente si la arteria mesentérica inferior está obstruida, para minimizar el riego de isquemia cólica.
Desde la introducción de las técnicas endovasculares la reparación de los AAI se ha incrementado de forma exponencial. A día de hoy la reparación endovascular es la forma predominante de tratamiento de los AAI, y su hegemonía se justifica por su menor morbimortalidad21.
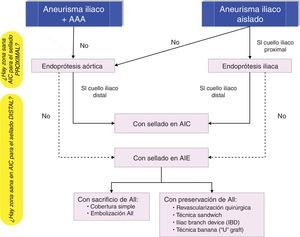
De forma análoga a la cirugía abierta, los factores que condicionan el tipo de procedimiento endovascular incluyen: la presencia o ausencia de AAA concomitante, la afectación de la AII, la longitud de arteria iliaca sana por encima y por debajo del aneurisma (zona de sellado proximal y distal), la bilateralidad frente a la unilateralidad de la enfermedad aneurismática22.
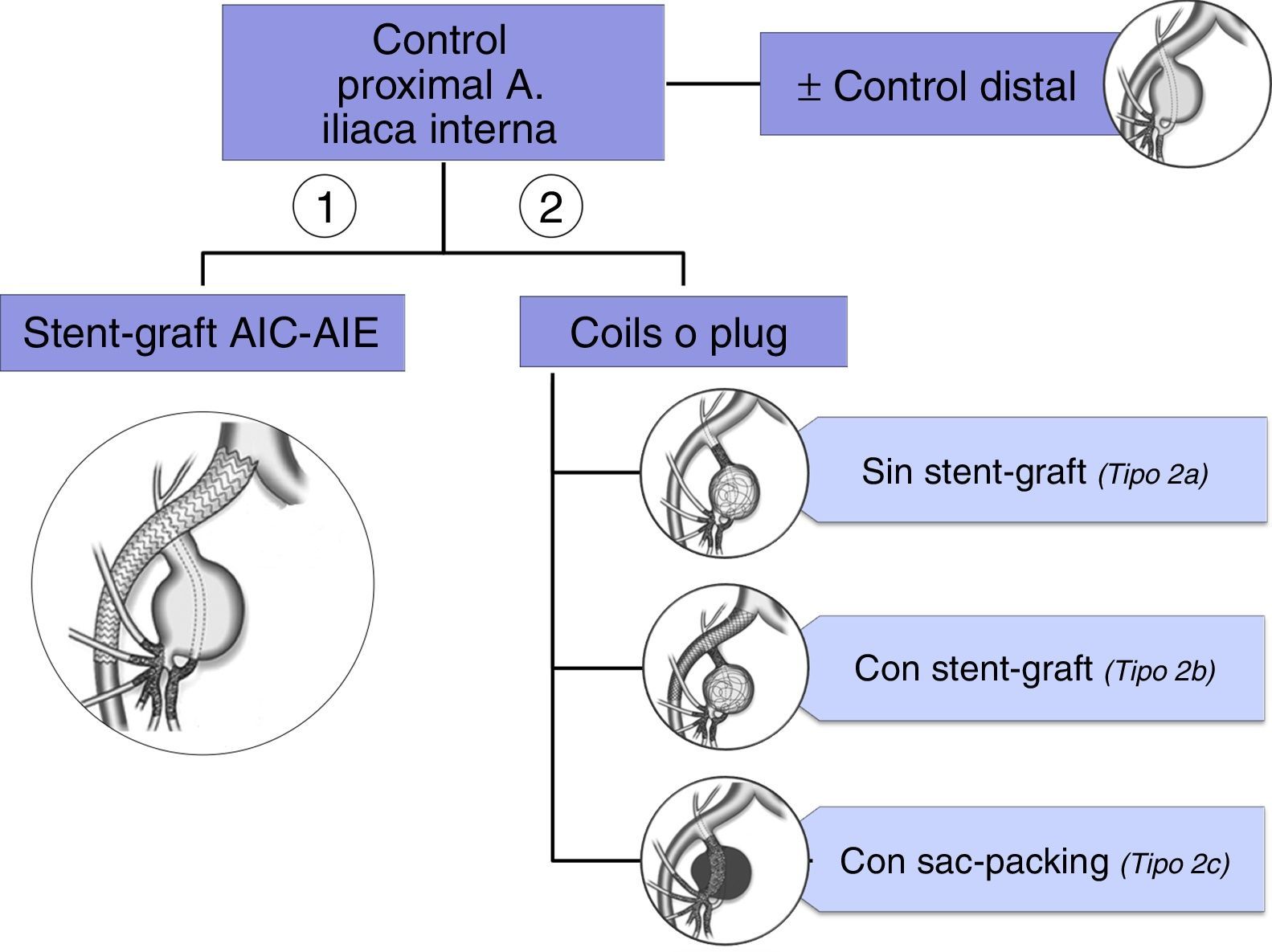
Cuando el aneurisma iliaco se asocia a un AAA se realiza una reparación conjunta mediante una endoprótesis bifurcada con sellado distal en AIC. Si esta es aneurismática a nivel del ostium de la arteria hipogástrica, el sellado ha de extenderse a la AIE. En este caso hay varias opciones endovasculares, en relación con el manejo de la AII: A. Técnicas que sacrifican la AII: cobertura simple, embolización de la hipogástrica (selectiva y no selectiva23), B: Técnicas que preservan la AII: ligadura con revascularización quirúrgica, técnica sándwich, «iliac branch device»…
Históricamente, la AII ipsilateral se ocluía (mediante coils o un plug) para extender la endoprótesis hasta la AIE y asegurar el anclaje («técnicas de ocluir y extender»). Sin embargo, la aparición de complicaciones derivadas del sacrificio de la AII no es despreciable. El riesgo de claudicación glútea es del 16-50% pero cuando la oclusión de la arteria hipogástrica es bilateral este se eleva a un 80%24. Otras complicaciones más infrecuentes, aunque algunas de consecuencias catastróficas, son: isquemia medular o del plexo lumbosacro, isquemia cólica, disfunción eréctil, etc. Con este escenario la preservación de la arteria hipogástrica se ha convertido en un objetivo relevante dentro de la reparación endovascular de los AAI, con objeto de evitar las complicaciones de isquemia pélvica. La revascularización quirúrgica de la AII, mediante abordaje retroperitoneal, como complemento de la técnica endovascular de exclusión aneurismática, ha demostrado pocas ventajas sobre la cirugía abierta total, pero debe formar parte del armamento terapéutico del cirujano vascular25.
En la reparación combinada de un AAA y un AAI de pequeño tamaño (<32mm) puede realizarse la técnica bell-bottom manteniéndose permeable la AII. Esta técnica consiste en implantar una endoprótesis corta («cuff») de mayor calibre por dentro del extremo final de la rama iliaca. En cualquier caso, se requiere una zona final de la AIC «aceptable» y de longitud suficiente para garantizar el sellado distal26, siendo su principal limitación que la AIC no puede ser>32mm. En cuanto a los resultados, en comparación con las técnicas endovasculares de «ocluir y extender», su tasa de complicaciones es inferior (6 vs. 38%)27, pero tiene el riesgo, durante el seguimiento, de aparición de endofugas Ib por crecimiento de la AIC, asociándose a una mayor tasa de reintervenciones (14 vs. 2%)28.
Con la técnica sándwich 2 stent-grafts, dispuestos en paralelo y por dentro de la parte final de la rama iliaca endoprotésica, se extienden, uno hacia la AIE, y el otro hacia la AII; la endoprótesis principal termina en la AIC, inmediatamente por encima de la bifurcación. Aunque existen pocas series publicadas y con seguimientos cortos los resultados de esta técnica en términos de permeabilidad son más que aceptables29.
Recientemente, se ha introducido el «iliac branch device» (IBD), como técnica alternativa en el tratamiento endovascular de los AAI cuando es imperativo mantener permeable la arteria hipogástrica. Este dispositivo presenta un cuerpo principal que se extiende hasta la AIE con una rama lateral que encaja en la arteria hipogástrica, de modo que se mantiene el flujo anterógrado a la AII pero excluyéndose del saco aneurismático. A diferencia de otras técnicas que también preservan la AII, como bell-bottom o técnica sándwich, no compromete la zona de sellado en la AIC, siguiendo el principio vascular de extender la reparación de arteria sana proximal a arteria sana distal30. Su principal limitación es la aplicabilidad, ya que requiere múltiples requisitos anatómicos (longitud de AIC>50-55mm, diámetro a nivel de bifurcación>18mm, ausencia de tortuosidad iliaca excesiva, etc.
Verzini et al.31 compararon la técnica IBD con la embolización, obteniendo resultados similares en términos de éxito técnico y reintervenciones, pero con una proporción de endofugas y claudicación glútea significativamente superior en el grupo embolización. En una revisión de 162 IBD para el tratamiento de AAI, el éxito técnico fue del 96,9%. En 15 pacientes (9,3%) se produjo oclusión de la rama hipogástrica durante el seguimiento. Aunque menos del 10% de los pacientes necesitaron una reintervención en el seguimiento, esta se hizo mayoritariamente con técnicas endovasculares32. Otro estudio de 130 pacientes encontró una tasa de éxito del procedimiento del 94% con una permeabilidad de rama a los 5 años del 81,8%; además, estableció que esta técnica es factible para el tratamiento de aneurismas de AIC asociados a aneurismas hipogástricos33.
En la actualidad hay 3 dispositivos IBD disponibles: el Zenith Bifurcated Iliac Side Device-ZBIS, de Cook® (Cook Medical, Bloomington IN); el E-liac de Jotec® (Jotec GmbH, Hechingen, Germany); y el Excluder Iliac Branch de Gore® (W.L. GORE & Associates, Flagstaff, AZ).
La técnica banana, «U» graft, endobypass AIE-AII establece un flujo retrógrado en la AII contralateral. En el lado del aneurisma se implanta una endoprótesis aortouniiliaca que sella en la AIE. Se complementa con un bypass fémoro-femoral y el implante de un stent altamente flexible en el lado contralateral, desde la AIE a la AII34.
En AAI solitarios, la reparación endovascular depende de la longitud de la arteria iliaca sana por encima y por debajo del aneurisma (cuello proximal y cuello distal), y de la proximidad del aneurisma a la salida de la hipogástrica.
Una endoprótesis iliaca es de elección cuando existe un segmento de AIC sana de 10-15mm por encima del aneurisma y de 10-15mm por debajo del mismo.
Si no hay zona de sellado proximal o la anatomía es angulada se implanta una endoprótesis aortoiliaca bifurcada35; en este caso se ha de tener especial cuidado para que las ramas de la endoprótesis no queden comprimidas en una aorta distal no dilatada. Esto podría conducir a la trombosis endoprotésica con isquemia de miembros inferiores.
Si lo que no es adecuado es el anclaje distal se implanta una endoprótesis iliaca que sella en AIE con sacrificio de la hipogástrica (cobertura simple o embolización) o revascularización de la misma, con las opciones técnicas descritas de: revascularización quirúrgica, técnica sándwich o IBD.
Tratamiento de los aneurismas de arteria iliaca interna (arteria hipogástrica)El umbral de 3cm de diámetro para la reparación electiva de un aneurisma de AII fue originalmente propuesto por McCready et al.36, fundamentándose en que su serie no incluía ninguna rotura por debajo de este diámetro. Actualmente, se propone (nivel de evidencia 4) diferir el tratamiento quirúrgico de los AAII hasta los 4cm, al menos en pacientes añosos. En un estudio publicado en 2017 con 63 pacientes intervenidos por rotura de un aneurisma de AII, solo un aneurisma roto medía<3cm, y únicamente 4 medían<4cm, lo que representa el 6,3% del total de aneurismas rotos16; además, se han encontrado cifras de mortalidad quirúrgica más bajas que las referidas en publicaciones antiguas7,37.
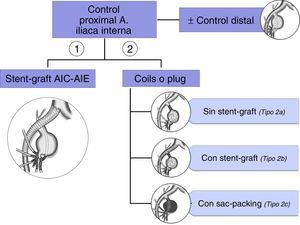
La forma más frecuente de reparación de los aneurismas de AII consiste en combinar una endoprótesis (stent-graft) desde AIC a AIE con la embolización del saco. En ocasiones, se efectúa únicamente embolización, sin embargo esta técnica puede fracasar, por compactación de los coils, y repermeabilizarse el aneurisma38. Se requiere embolizar proximalmente, mediante coils o un plug, para interrumpir el flujo de entrada, y además la embolización de las ramas de salida. Para reducir el riesgo de isquemia pélvica esta ha de ser tan cerca del saco como sea posible.
En resumen, el tratamiento endovascular se basa en el control proximal y distal del aneurisma, aunque este último puede no ser imprescindible39 (ver algoritmo en la figura 6)
La embolización de la AII se asocia a un riesgo de claudicación glútea del 12-55% y de disfunción eréctil del 1-13%40. Si la embolización bilateral es necesaria, y no se realiza revascularización, puede hacerse simultáneamente o en 2 etapas, con un intervalo de 1-2 semanas, con objeto de minimizar las complicaciones de isquemia pélvica.
Un aneurisma hipogástrico podría constituir una limitación anatómica para la implantación de un IBD, debido a la ausencia de zona de sellado distal32. Para que la técnica IBD sea factible el componente iliaca interna tiene que extenderse en una arteria divisional, como la arteria glútea superior, a fin de que el sellado sea apropiado41. Austermann et al. describen un abordaje particular para el tratamiento del aneurisma hipogástrico con IBD. Su estrategia consiste en el despliegue, en primer lugar, de un stent cubierto balón-expandible en la parte proximal de la AII, seguido del despliegue distal de un stent cubierto autoexpandible, con un solapamiento mínimo entre ambos del 50%. Finalmente, se coloca un tercer stent, libre y autoexpandible, por dentro de los anteriores, para obtener una transición suave de los stents recubiertos hasta el tronco posterior de la arteria hipogástrica, y, simultáneamente, mejorar la fijación de los mismos34,42.
Seguimiento postoperatorio de aneurismas de arteria iliacaEl TAC es la prueba de imagen inicial que confirma la exclusión del aneurisma.
Se realiza una revisión anual para controlar la permeabilidad así como para detectar endofugas, crecimiento de saco o migración de la endoprótesis. Con la reparación endovascular se debe realizar angio-TAC e ITB a los 30 días, 6 meses y un año. Si al año no han surgido complicaciones, el seguimiento se hace con angio-TAC o eco-doppler anual. La arteriografía puede estar indicada en caso de detectarse crecimiento del saco.
Responsabilidades éticasProtección de personas y animalesLa autora declara que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLas autora declara que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLa autora declara que en este artículo no aparecen datos de pacientes.
Conflicto de interesesNo existe conflicto de intereses.