Los aneurismas infecciosos, pese a su escasa prevalencia, suponen un desafio para el cirujano vascular que se enfrenta a ellos, dado que el diagnóstico precisa de un índice de sospecha muy elevado, habitualmente ante un paciente comprometido con sepsis, rotura arterial y localizaciones atípicas. Son cuadros que no permitan normalmente la simple escisión como tratamiento satisfactorio, que se mantiene actualmente en controversia. Se realiza una discusión acerca de los métodos diagnósticos y los tratamientos más contrastados, incluyendo el manejo endovascular.
Infected aneurysms, despite their low prevalence, are a great challenge for the vascular surgeon. Thus, its diagnosis is made under a high index of suspicion, usually when faced with septic patient with arterial rupture located in atypical sites. Their treatment still remains controversial as there is no single or simple treatment. The most well-known diagnostic methods and treatments are discussed, including the endovascular point of view.
Se define un aneurisma como una dilatación focal y persistente del diámetro de una arteria igual o mayor al 150% respecto a los segmentos arteriales adyacentes no afectados. La clínica de estos aneurismas es diversa y frecuentemente específica y relacionada con la localización anatómica.
A pesar de las mejoras en el diagnóstico y tratamiento de esta afección en las últimas décadas, los aneurismas arteriales todavía siguen siendo una causa importante de morbimortalidad vascular.
Aproximadamente el 1% de todos los aneurismas están asociados con una infección arterial. Estos aneurismas, inicialmente denominados micóticos desde que, en 1885, Osler1 describió el primer caso de aneurisma infeccioso en el siglo XIX, engloban varias entidades nosológicas, denominadas en la actualidad aneurismas infecciosos.
Los aneurismas infecciosos pueden ocurrir en cualquier segmento arterial y, si bien representan un porcentaje mínimo de todos los aneurismas, son los más difíciles de tratar, ya que el cirujano vascular suele encontrarse ante un paciente comprometido con sepsis, rotura arterial y localizaciones atípicas, que no permiten normalmente la simple escisión como tratamiento satisfactorio, que se mantiene actualmente en controversia.
La degeneración aneurismática en el contexto de la infección resulta de la destrucción focal de la pared arterial, bien directamente por acción de las enzimas bacterianas, bien indirectamente por la actividad de la proteasa sérica como consecuencia de la infiltración por neutrófilos2.
La evolución natural de los aneurismas infecciosos conduce a la rotura aórtica o a la embolización arterial, sin que guarde relación pronóstica el diámetro del aneurisma con la posibilidad de rotura. Ocasionalmente se instaura un pseudoaneurisma estable y actúa como foco de embolización séptica hacia los miembros inferiores.
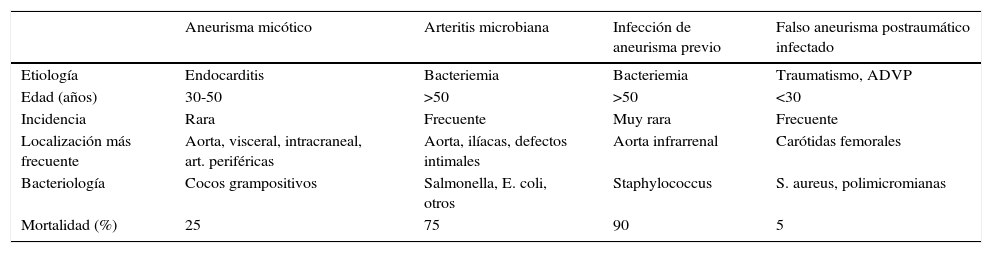
Dependiendo del mecanismo de producción, existen 4 tipos de aneurismas infecciosos, a saber: los aneurismas micóticos procedentes de émbolos sépticos arteriales, la arteritis microbiana con formación de aneurisma, la infección de aneurismas preexistentes, sobre todo debidos a la mayor utilización de técnicas invasivas y yatrogenia3 y los falsos aneurismas postraumáticos infectados4 (tabla 1).
Características clínicas de los aneurismas infecciosos
| Aneurisma micótico | Arteritis microbiana | Infección de aneurisma previo | Falso aneurisma postraumático infectado | |
|---|---|---|---|---|
| Etiología | Endocarditis | Bacteriemia | Bacteriemia | Traumatismo, ADVP |
| Edad (años) | 30-50 | >50 | >50 | <30 |
| Incidencia | Rara | Frecuente | Muy rara | Frecuente |
| Localización más frecuente | Aorta, visceral, intracraneal, art. periféricas | Aorta, ilíacas, defectos intimales | Aorta infrarrenal | Carótidas femorales |
| Bacteriología | Cocos grampositivos | Salmonella, E. coli, otros | Staphylococcus | S. aureus, polimicromianas |
| Mortalidad (%) | 25 | 75 | 90 | 5 |
ADVP: adicción a drogas vía parenteral.
Fuente: Tomada parcialmente de Weaver y Reddy4.
Se desarrollan cuando émbolos sépticos procedentes de las vegetaciones valvulares cardiacas que ocurren durante una endocarditis se alojan en la luz de los vasa vasorum o sobre una lesión intimal de arterias periféricas. Pueden darse en arterias normales o patológicas de cualquier parte de la economía. En la era preantibiótica aproximadamente el 90% de todos los aneurismas infecciosos eran aneurismas micóticos. Tras el desarrollo de las técnicas de identificación microbiológicas y la aparición de los antibióticos, así como el desarrollo de la cirugía cardiaca abierta que permiten el recambio valvular, ha disminuido drásticamente la prevalencia del aneurisma micótico respecto del resto de aneurismas infecciosos, si bien en fechas más recientes y en relación con las endocarditis relacionadas con abuso de drogas vía parenteral, esta incidencia ha aumentado y suelen encontrarse en localizaciones atípicas, sobre todo en pacientes portadores de VIH5.
Si bien este tipo de aneurismas pueden ocurrir en múltiples lugares, predominan en ciertas localizaciones anatómicas, sobre todo en la aorta y arterias intracraneales, mesentérica superior y femoral. Esta predilección se relaciona con su patogénesis. En arterias grandes como la aorta, los émbolos infectados se localizan en los relativamente grandes vasa vasorum y pueden causar isquemia de la pared e infección. La capa media se destruye por este proceso y se forma el aneurisma. En arterias de menor calibre los émbolos infectados microscópicos se localizan en la pared arterial e inician un proceso patológico similar. Los lugares predispuestos para el desarrollo de estos aneurismas suelen ser las bifurcaciones, las fístulas arteriovenosas y las coartaciones. Existen casos documentados en tronco tibioperoneo, arteria hepática común, aorta ascendente, carótida y en las arterias cerebrales.
Una característica diferencial de los aneurismas micóticos es su localización múltiple. Hasta en un 78% de los pacientes existe más de un aneurisma de forma simultánea, lo que hace recomendable el estudio de los territorios arteriales en los que más frecuentemente asientan estas dolencias, como el territorio cerebral, visceral y de miembros inferiores6,7.
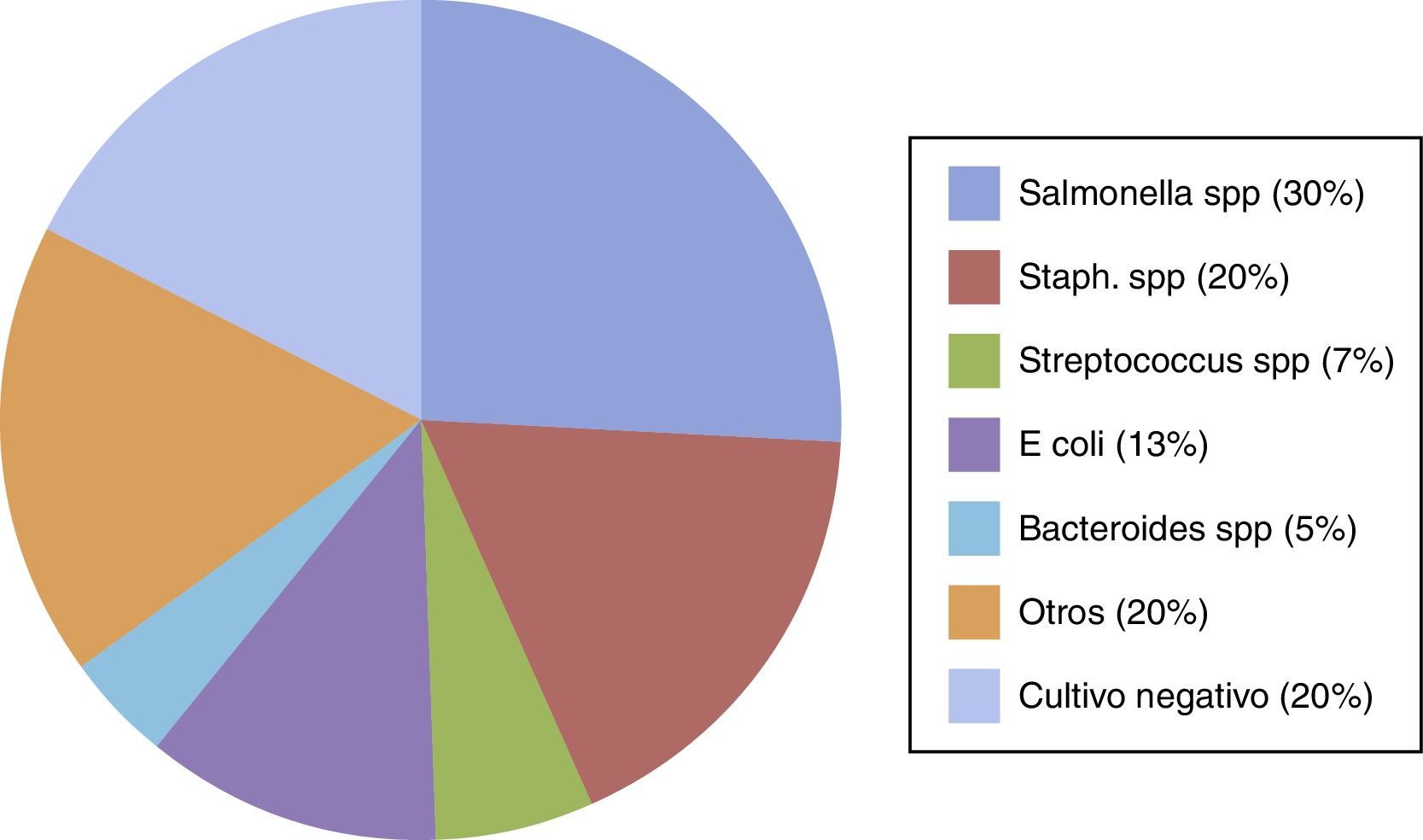
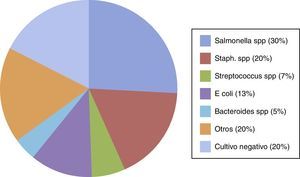
BacteriologíaDesde 1923 se reportó que los gérmenes implicados en la aparición de aneurismas micóticos eran básicamente estreptococos no hemolíticos, neumococos y estafilococos. Estudios posteriores han determinado que los microorganismos predominantes en pacientes con endocarditis sin abuso previo de drogas son Streptococcus viridans (22%), Staphylococcus aureus (20%), Streptococcus faecalis (14%) y Staphylococcus epidermidis (1%). En pacientes drogodependientes predominaban Staphylococcus aureus (36%) Pseudomonas sp. (16%), infecciones polimicrobianas (15%), Streptococcus faecalis (13%) y Streptococcus viridans (11%). Si bien una recopilación de los estudios que abarcan exclusivamente la aorta abdominal arrojan otras cifras (fig. 1).
Microorganismos recogidos de varias series en 210 aneurismas infecciosos aortoilíacos.
Otros incluyen: Clostridium spp., enterococos, Acinetobacter spp., Enterobacter spp., Listeria monocytogenes, Pseudomonas spp., Campylobacter fetus, Corynebacterium spp., Aspergillus, Coccidioides immitis, Candida spp., Mycobacterium avium, Haemophilus influenzae, Mycobacterium tuberculosis, Clostriduim perfringens, Proteus mirabilis y Eikenella corrodens.
Fuente: Tomada parcialmente de Weaver y Reddy4, Reddy et al.9 y de Kan20.
En la era preantibiótica, esta entidad nosológica ocurría en aproximadamente el 14% de los pacientes con diagnóstico de aneurisma. Con la menor prevalencia de fiebre reumática y endocarditis bacteriana consiguiente, la arteritis microbiana es más frecuente que el aneurisma, debido al envejecimiento de la población y al incremento consiguiente de la arteriosclerosis, factor que predispone a la infección de la pared.
La prevalencia en adultos de aneurismas infecciosos se estima entre el 0,06 y el 0,65%8,9, la mayor parte de ellos localizados en la aorta, lugar donde la arterioesclerosis es más frecuente.
Los pacientes en hemodiálisis son especialmente vulnerables a bacteriemias por Staphylococcus y la arteritis subsecuente. Otros posible factores predisponentes son arteritis por radiación en la arteria subclavia tras cáncer de mama, infección aórtica tras una endoscopia digestiva en pacientes inmunodeprimidos, o en apendicitis u osteomielitis de vértebras lumbares. Está descrito que existe algún grado de inmunosupresión hasta en el 70% de los pacientes.
BacteriologíaLa mayor parte de los casos son producidos por Escherichia coli, Salmonella typhi y Staphylococcus sp. Hasta un 25% de los cultivos tomados en estos pacientes son negativos, ya que algunos gérmenes son anaerobios, y no se procesan de forma adecuada.
La diseminación hematógena de la Salmonella sp., más frecuentemente asociada con la ingesta de aves de corral, huevos y otros productos agrícolas, crudos, poco cocinados o insuficientemente desinfectados, son la causa de hasta el 10% de los aneurismas arteriales diagnosticados en mayores de 50 años. Así como la Sifilis era la mayor productora de aortitis en la era preantibiótica, la Salmonella es el microorganismo más comúnmente asociado con los aneurismas micóticos hoy10,11.
Infección en aneurismas previamente existentesFue estimada por Sommerville et al.12 en un 3,4%.
Varios autores han estudiado de forma prospectiva a enfermos a los que se les realizó aneurismectomía con cultivos de la pared y líquidos colindantes. Hasta el 1% de los cultivos son positivos, alcanzando la cifra del 38% en rotos, 9% en asintomáticos y 13% en sintomáticos, pero no parece que la contaminación de la pared arterial en estos pacientes intervenidos sea una amenaza para ellos. Ya que el lugar más frecuente para el desarrollo de aneurismas es la aorta abdominal, este es el lugar más predispuesto para desarrollar una infección secundaria o por extensión directa de una infección extravascular adyacente, como puede ocurrir en abscesos paravertebrales en aorta o por contaminación en regiones inguinales de ganglios afectados por una infección más distal.
BacteriologíaMuchos autores refieren que el índice de sospecha para la infección de un aneurisma de aorta abdominal es normalmente bajo, y puede que esta enfermedad quede poco reportada. El estudio de Jarrett et al.13 documentó un predominio de gérmenes grampositivos (59%) sobre los gramnegativos (35%). El microorganismo más prevalente fue el Staphylococcus (41%), si bien las infecciones por gramnegativos eran más virulentas (producían un 84% de rotura frente al 10% de grampositivos y una mayor mortalidad (84 vs. 50%).
Tras el aumento de los procedimientos percutáneos y la terapia mínimamente invasiva, la infección en aneurismas previamente existentes puede aumentar, especialmente, cuando se utilizan prótesis sintéticas. Asimismo, pueden realizarse implantes en zonas previamente contaminadas de forma no intencionada, si bien parece no ser muy frecuente14 (menos de un 1% en seguimientos de endoprótesis).
Falsos aneurismas postraumáticos infectadosEsta entidad nosológica ha llegado a ser la presentación más prevalente en las últimas décadas, relacionadas básicamente con la adicción de drogas por vía parenteral, con predominio de la región inguinal, arterias ilíacas y subclavias principalmente.
En otras ocasiones la infección se asienta en líneas de sutura protésicas vasculares, lo que puede conllevar la rotura de las anastomosis con formación de falsos aneurismas.
Asimismo, otro factor que incrementa la incidencia de estas lesiones es la proliferación de test invasivos, cateterizaciones y terapéutica agresiva, especialmente en pacientes inmunodeprimidos. Del mismo modo, el uso de cierres percutáneos tras la terapia endovascular ha incrementado la incidencia de falsos aneurismas infectados.
BacteriologíaEl S. aureus se encuentra en el 65-76% de los cultivos de pacientes drogadictos, siendo hasta el 35% MRSA15.
DiagnósticoPresentación clínicaEl diagnóstico debe basarse inicialmente en una sospecha clínica, ya que en un alto porcentaje de los casos los hallazgos iniciales son bastante inespecíficos y dependen bastante de la localización de la arteria afectada, ya que pueden deberse a compresión nerviosa o afectación local, además de fiebre, sudoración nocturna, artralgias, escalofríos, fatiga y malestar general.
La mayor parte de los pacientes presentan un síndrome constitucional con cuadro febril hasta en el 70% de los aneurismas aórticos infectados. Cabe reseñar que muchos casos pueden permanecer con fiebre mantenida a pesar de estar con tratamiento antibiótico específico.
Puede asociarse en afectación aórtica con dolor lumbar o centroabdominal y con asociación de masa pulsátil abdominal en el 50% de los pacientes, lo que debe hacernos pensar en el diagnóstico. En caso de aneurismas infecciosos en otras localizaciones la palpación puede ser fácil si afecta a extremidades, o prácticamente imposible en casos intracraneales o torácicos. Una peculiaridad es el rápido crecimiento de estos aneurismas.
En ocasiones existen en la exploración lesiones petequiales o artritis séptica asociadas a embolismos procedentes de los aneurismas infectados más proximales.
Hasta el 60% de los casos de aneurisma infeccioso aórtico puede presentarse como rotura16, sin que se puedan diferenciar de la clínica de un aneurisma no infeccioso salvo por la sospecha de los antecedentes que, en casos de urgencia, pueden ser difíciles de obtener. En caso de afectación de una arteria más superficial, el hematoma siguiente a la rotura podría erosionar la piel y producir una hemorragia importante.
Analítica/microbiologíaEl cuadro clínico suele asociarse a leucocitosis con aumento de reactantes de fase aguda. El hemocultivo suele ser positivo en un 40-70% de los pacientes, si bien la negatividad no excluye el diagnóstico.
Deben realizarse múltiples extracciones de sangre para realizar hemocultivos, positivos tan solo en el 60% de los casos en las mejores series. Pueden tener mayor índice de positividad si tomamos la muestra en un punto más distal a la infección arterial, en aumentando el porcentaje de la misma pacientes con sintomatología más florida. En un porcentaje de casos superior al 25% los cultivos pueden ser negativos17 pero en otros18, el cultivo puede ser positivo a más de un germen.
Ciertos patógenos, si se detectan en hemocultivos, deben hacernos pensar en infección arterial, como la Salmonella spp. y, en menor grado, Staphylococcus spp., por su mayor ubicuidad.
La importancia del hemocultivo preoperatorio es capital, incluso si el resultado se demora algunos días, ya que la información que proporciona es muy valiosa para el manejo posterior del paciente.
Los cultivos de pared arterial, en caso de poder obtenerlos, y que sean positivos, nos aseguran el diagnóstico de infección arterial, que es más difícil de realizar en pacientes con hemocultivos negativos. Esto contrasta con los pacientes sintomáticos, que tienen mayor índice de hemocultivos positivos que de cultivos positivos de pared arterial19.
Diagnóstico mediante gammagrafía con leucocitos marcadosEsta prueba llegó a tener un papel preponderante en el diagnóstico de los aneurismas infecciosos, pero no tiene capacidad para detectar infecciones arteriales primarias. Su ventaja es el bajo riesgo que supone al paciente y la facilidad de realización. Su principal desventaja es que puede resultar difícil el diagnóstico diferencial con muchas otras lesiones inflamatorias, y su interpretación debe encuadrarse dentro de un contexto clínico. Permite, eso sí, la localización del proceso infeccioso.
Aunque la validez diagnóstica de esta prueba está en controversia, en ausencia de traumatismo o infección conocida, el uso de radiomarcadores como el indio o el galio puede permitir el diagnóstico de infección arterial, si bien la especificidad de la gammagrafía es muy baja para los aneurismas infecciosos, aunque hay autores que defienden su realización por si existen focos infecciosos cercanos o si existe osteomielitis en vecindad20.
Diagnóstico por imagenComo primera prueba, en screening, la ecografía nos señalará la presencia de un aneurisma, su tamaño y localización pero no tiene especificidad alguna. Es muy útil para el diagnóstico de enfermedad intraabdominal asociada.
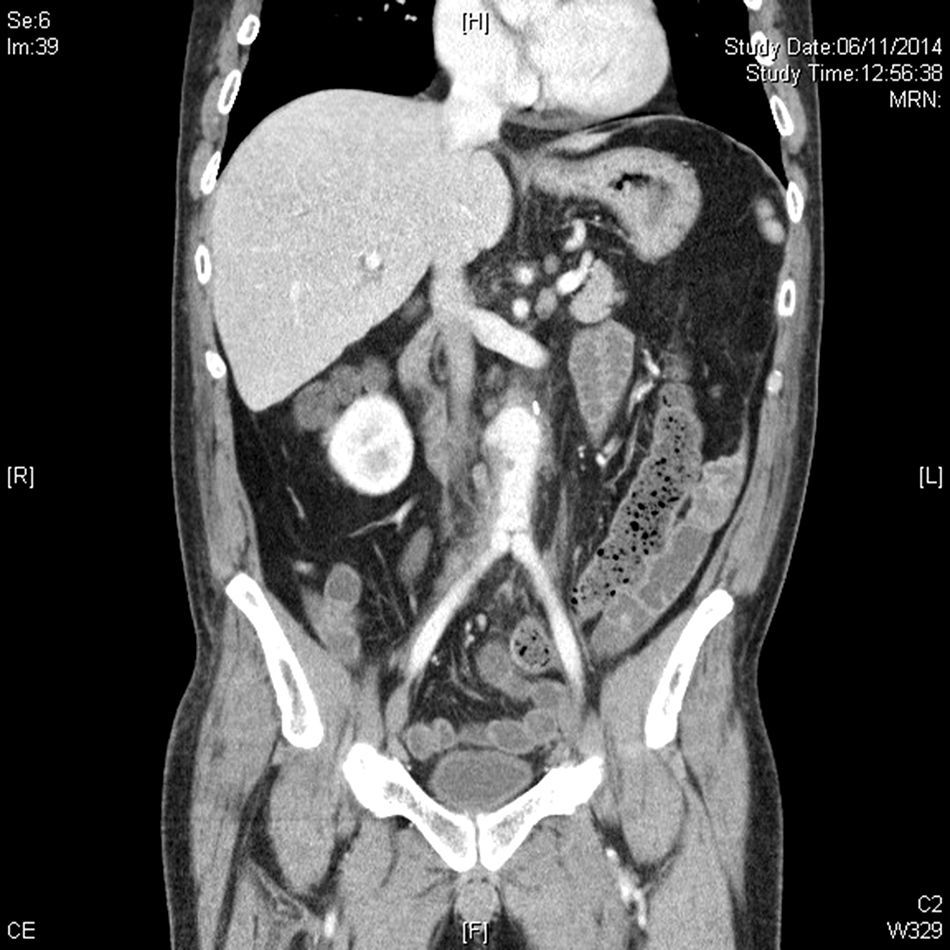
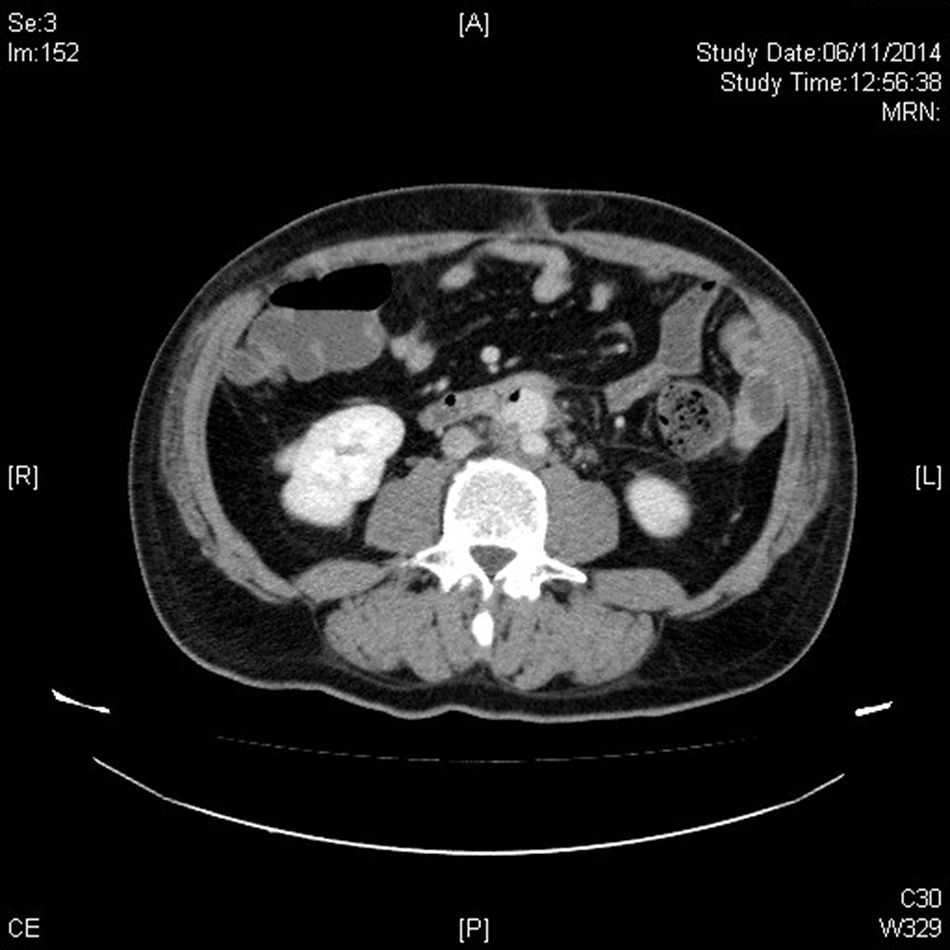
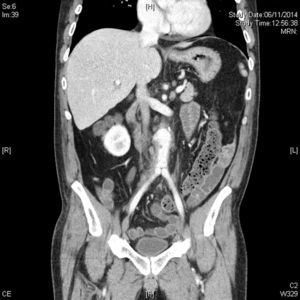
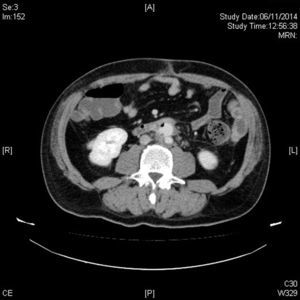
La tomografia computarizada (TC) nos ofrecerá mucha mayor definición anatómica en cuanto a extensión y relación de vecindad, especialmente en cuadros de infecciones por vecindad como osteítis lumbar o abscesos retroperitoneales21. Cabe tener en cuenta una serie de características diferenciales. La primera, suelen tener una localización infrecuente22,23. La segunda, suelen presentar morfología sacular, con contornos irregulares, que puede coexistir con una masa de partes blandas perianeurismática, no captante, como representación de tejido inflamatorio y sangre de una rotura contenida (fig. 2). La tercera característica importante suele ser la ausencia de calcificaciones murales significativas23,24, si bien tiene mayor valor para sospechar un aneurisma micótico en pacientes con ateromatosis la disrupción del anillo cálcico, donde los importantes cambios inflamatorios producen una destrucción focalizada de la placa ateromatosa calcificada. La cuarta es la presencia de burbujas de gas entre las capas del aneurisma o en tejidos periaórticos, para algunos autores patognomónica (fig. 3), lo que junto a la presencia de colecciones retroperitoneales debe hacernos pensar en el diagnóstico25.
Otro signo que puede hacer pensar en la posibilidad de aneurisma micótico es una rápida progresión, si bien esto solo podríamos confirmarlo si tenemos estudios repetidos.
Quizá la TC es el método diagnóstico más capaz de realizar una aproximación temprana, ya que en fases precoces se pueden encontrar cambios incipientes en la grasa perivascular, así como la disrupción del anillo de calcio, facilitando una aproximación a esta dolencia de forma más precoz e, incluso, previniendo una posible rotura21, a la vez que, con las nuevas técnicas de angio-TC y las reconstrucciones 3D, tiene cada vez un valor más preponderante en el manejo de esta dolencia, ya que sustituye en ocasiones a la arteriografía.
Otros métodos como la RMN nos permiten hallazgos similares a la TC, pero no tan específicos, si bien en pacientes con alergia o intolerancia al contraste iodado es muy útil.
Mas recientemente se ha testado la posibilidad de realizar PET inyectando fluorina-18-fluorodesoxiglucosa asociado a la realización de TC, consiguiendo en casos positivos una captación el doble de la normal en un aneurisma no infeccioso, con sensibilidad muy alta26,27.
La arteriorafía es el estudio que se ha considerado durante muchos años como el gold standard en cuanto al planteamiento quirúrgico, ya que nos ofrecerá una imagen precisa de la arteria y sus colaterales. Es la prueba que, no solo identifica, sino que define las características de estas lesiones28, proporciona información del defecto en la pared arterial, el pseudoaneurisma contiguo y la morfología de la arteria adyacente, así como de la relación con la anatomía de los vasos contiguos, básica para la planificación quirúrgica. Es muy importante en la detección de aneurismas infecciosos viscerales o en el mesenterio, donde otras técnicas no alcanzan tanta definición.
Los hallazgos específicos que ofrece la arteriografía son un aneurisma sacular sobre una arteria adyacente normal, un aneurisma multilobulado o un aneurisma excéntrico con un cuello relativamente estrecho, si bien la arteriografía puede no tener diferenciación respecto a un aneurisma no infectado. Esta exploración debe extenderse hasta los miembros inferiores, por la posibilidad de detectar otros aneurismas infecciosos que puedan no haber dado clínica.
Dado que, en caso de ser precisa una resección arterial, la imagen arteriográfica posquirúrgica puede no ser de calidad y, ante el planteamiento de una revascularización posterior, la arteriografía debe ser una prueba obligatoria preoperatoria en todos los casos de aneurisma infeccioso excepto en los casos de urgencia.
TratamientoEn permanente discusión, es uno de los mayores retos para los cirujanos vasculares en el que, no solo la virulencia y tipo de la infección y el estado general del paciente sino el correcto manejo por parte de los equipos médicos influirán en la supervivencia del paciente.
Los principios básicos para el tratamiento deben ser: diagnóstico de sospecha preoperatorio, toma de hemocultivos repetidos, tratamiento antibiótico adecuado, cultivo intraoperatorio, resección amplia de tejidos infectados, revascularización anatómica o extraanatómica y seguimiento estrecho del paciente para detectar complicaciones sépticas postoperatorias.
Tratamiento médicoSi bien en la práctica diaria nos vemos auxiliados por especialistas en infecciones que nos pueden ayudar a analizar este grave problema debemos tomar como norma general, que el tratamiento estará basado en antibiótico intravenoso de amplio espectro y a dosis elevadas en el momento del diagnóstico, siempre que sea posible basado en antibiograma, para intentar disminuir la fiebre y el estado de sepsis que puede acompañar a estos pacientes y que es unos de los factores que determinarán el pronóstico de los mismos.
Hay autores como Kan29 que refieren que si es posible administrar el protocolo antibiótico de endocarditis infecciosa de forma preoperatoria en cantidad suficiente como para controlar la infección, los resultados mejoran notablemente13,30.
Tras el acto quirúrgico, abierto o endovascular, se recomienda tratamiento intravenoso durante 2 a 8 semanas31-33 que, según algunos autores, debe prolongarse de por vida con antibioterapia oral, si bien esta decisión se encuentra desde hace muchos años en discusión33,34.
Tratamiento quirúrgico convencionalEl objetivo del tratamiento quirúrgico es doble. Por una parte, erradicar la infección, previniendo la rotura del aneurisma; por otra, mantener la continuidad vascular para prevenir problemas isquémicos locales o distales.
Una vez planteada la cirugía, en casos intraabdominales, tras la realización del abordaje, debemos comprobar el grado de sepsis retroperitoneal, la extensión del aneurisma y la vascularización de pelvis y miembros inferiores. Tras el control proximal y distal a la infección, se procede a resecar el segmento afectado, la toma de múltiples muestras y la posterior decisión para la revascularización: bien la ligadura proximal y distal y posterior revascularización extraanatómica, o bien la revascularización in situ.
- •
Ligadura aórtica. Procedemos tras la resección de la zona infectada a la ligadura proximal en un área libre de infección, respetando el origen de las arterias renales, y sobre una zona de resistencia, si bien esto puede no ser siempre posible y precisar disección y pinzamiento supradiafragmático, procediendo a suturar la aorta con monofilamento doble o dispositivos mecánicos. La rotura del muñón aórtico es la causa de hasta el 43% de la mortalidad precoz y del 71% de la mortalidad tardía. Para intentar disminuir esta incidencia podemos utilizar un refuerzo de fascia prevertebral y plastia con epiplón, que permitirá mejorar la posibilidad de tratamiento de la infección local6.
Los lavados locales con povidona yodada y antibióticos también son recomendables.
La revascularización distal suele ser precisa por vía extraanatómica, a través de un campo quirúrgico libre de infección y con instrumental no contaminado por la intervención previa. El método más comúnmente utilizado es el bypass axilobifemoral, y la mayor controversia es la secuencia de la revascularización, que posteriormente comentaré.
En los casos en los que el aneurisma no está roto o complicado, la revascularización puede realizarse de forma previa, lo que disminuiría el riesgo de contaminación de la prótesis extraanatómica y el tiempo de isquemia. Este tipo de tratamiento puede ser de elección cuando sepamos que debemos evitar la vascularización in situ de la aorta, como en caso de osteomielitis en vecindad o absceso retroperitoneal. Esto no puede realizarse en casos donde exista una rotura aórtica o si el diagnóstico es incierto, por el retraso del tratamiento principal.
- •
Revascularización in situ. Los resultados obtenidos en casos de las fístulas aortoentéricas o en aneurismas infecciosos de la aorta torácica o toracoabdominal donde la revascularización extraanatómica no es posible hacen plausible la indicación de este tipo de revascularización, que tiene una serie de ventajas frente a la ligadura aórtica:
- •
Permite la cirugía en zonas donde la ligadura no es posible, como la aorta torácica o la unión toracoabdominal.
- •
Evita problemas de permeabilidad, infección y salvamento del miembro asociado al bypass extraanatómico.
- •
Reduce el riesgo de dehiscencia del muñón aórtico y evita los riesgos de lesiones de arterias renales ante ligaduras muy proximales.
- •
Disminuye el tiempo quirúrgico.
- •
Los problemas principales de este tipo de revascularización son la infección de la línea de sutura o la contaminación protésica, para lo que se recomienda el uso de material tipo PTFE por su mayor resistencia teórica a la infección, además de las medidas recomendadas anteriormente en la reparación mediante ligadura aórtica.
Otros autores35 intentaron disminuir la tasa de reinfecciones mediante la impregnación de las prótesis de dacron con rifampicina, pero la reinfección se dio hasta en el 80% de los casos, si bien muchos cirujanos realizan esta maniobra de forma empírica.
Coselli y Crawford36 aportaron, en el sector aórtico, 40 casos de los que el 83% superaron la intervención y el 70% permanecían vivos más de 42 meses. En otras series37, en los pacientes que resistieron la intervención, el 23% fallecieron en el postoperatorio tras reparación in situ y un 28% tras la reconstrucción extraanatómica. Las tasas de complicaciones sépticas aórticas fueron del 22 y 14% respectivamente, y muy superiores a posteriori en pacientes en los que se implantó un bypass axilofemoral por infecciones locales inguinales.
En general, la reconstrucción in situ suele evolucionar mejor en pacientes con infección de bajo grado o con bajo grado de sepsis retroperitoneal y en infecciones por grampositivos que parecen tener menor virulencia y son más sensibles al tratamiento antibiótico. Se recomienda la exéresis y ligadura aórtica en pacientes con infecciones por gramnegativos, colecciones purulentas adyacentes o infección por hongos, seguida de bypass extraanatómico.
Una de las posibilidades para el tratamiento in situ es el uso de homoinjertos, frescos o criopreservados, si bien la tasa de complicaciones secundarias a su uso, como degeneración aneurismática, rotura o trombosis del injerto, es bastante elevada, hasta un 24% en series de Kieffer et al.38, con reintervención posible en el 9% de los casos, y que dependen en muchas ocasiones de tener un banco de tejidos adecuado y un manejo adecuado para evitar roturas precoces y complicaciones mayores39.
Parece ser que los injertos criopreservados tienen mejor comportamiento a largo plazo que los no criopreservados, con menor reacción inmunológica y con mejor conservación de su estructura histológica, lo que parece reducir las condiciones mecánicas a medio plazo39.
En caso de que los aneurismas afecten a arterias viscerales o digestivas, hecho afortunadamente muy raro, la única alternativa posible sería, ya que no existe la posibilidad de ligadura y reconstrucción extraanatómica, la extirpación total y revascularización visceral con reimplante de troncos o bypass a las colaterales desde una prótesis de dacron o una o varias arterias criopreservadas, no exentas de complicaciones tardías, con o sin asociación a bypass hepatorrenal o esplenorrenal40.
Cuando los aneurismas se encuentra en arterias periféricas, la técnica de elección será la exéresis local e interposición de material venoso autógeno con safena invertida o vena femoral superficial, sobre todo en arterias como la carótida extracraneal, arterias viscerales y femoral, intentando evitar la exéresis seguida de ligadura por las consecuencias desastrosas que puede implicar en los 2 primeros territorios, o la pérdida de extremidad en el tercero de ellos. Ya que hasta aquí no llega el epiplón, podemos, en la región inguinal, realizar coberturas mediante rotaciones musculares para intentar evitar una reinfección41.
Manejo endovascularDesde el año 1998 Semba et al.42 describieron el primer intento de reparación de aneurisma infeccioso aórtico mediante EVAR, descripción a la que siguieron otras muchas, sobre todo en el sector intracraneal y torácico.
Tiene una serie de ventajas aparentes sobre la cirugía abierta, como evitar el abordaje quirúrgico, disminuir las dosis de anticoagulante, el pinzamiento aórtico, evitar transfusiones masivas o mejorar el estado respiratorio perioperatorio.
Esta técnica, que puede parecer una buena alternativa a la quirúrgica anteriormente comentada, deja 2 preguntas sin contestar: la primera de ellas es si desaparecerá el foco infeccioso si dejamos el tejido infectado sin extirpar tan solo con tratamiento antibiótico; la segunda es si colocar un cuerpo extraño como la endoprótesis en un lecho infectado se podrá agravar la infección previamente existente
Parsons et al.43 describieron en un modelo experimental que las prótesis infectadas implantadas quirúrgicamente evolucionaban mejor que las colocadas endovascularmente.
Fiorani et al.44 identificaron una tasa de infección de un 0,4% en EVAR, con una mortalidad de un 27,4%, significativamente superior a la derivada de la cirugía abierta sobre prótesis infectadas, un 16,3%.
Los metaanálisis revisados29,44 parecen demostrar que existen una serie de factores que pueden asociarse a una mejor evolución tras el tratamiento endovascular, como son primero, que la utilización de un tratamiento antibiótico de amplio espectro que produce la negativización de los hemocultivos previamente a la cirugía, segundo, que este tratamiento antibiotico provoca que no existan cultivos positivos en el material escindido sino entre el 25 y el 40% de los aneurismas infecciosos; tercero, el uso de implantes cubiertos o impregnados con antibiótico puede disminuir la tasa de reinfecciones, si bien este punto no parece muy claro34,45, y por último, el que sea posible realizar un drenaje percutáneo de las colecciones que rodeen el foco infeccioso33.
Existen asimismo factores que hacen pensar que la infección persistirá de manera crónica tras el tratamiento endovascular, como son la edad mayor de 65 años, el inicio de la clínica como rotura del aneurisma (incluyendo fístulas aortoentéricas o aortobronquiales) y existencia de fiebre en el momento del tratamiento quirúrgico del paciente. Además, tan solo el 39% de los pacientes en los que persiste la infección tras el tratamiento endovascular en el sector aórtico sobreviven 12 meses29.
Lee et al.33 indican, por otra parte, que tan solo la existencia de fístula aortoentérica e infección activa son los factores que predisponen a un desenlace fatal y que, ya que tanto esta primera afección como la rotura de un aneurisma son situaciones de urgencia y que, per se, conllevan una mortalidad 5 veces superior a la cirugía programada. Estos factores acarrean una mayor tasa de complicaciones.
El tratamiento endovascular en estos pacientes facilitará la estabilización hemodinámica rápida como puede ocurrir en fístulas aortoentéricas, rotura de aneurismas abdominales o torácicos, con una menor morbimortalidad inicial, si bien parece que, salvo casos muy puntuales, debe considerarse por el momento como un tratamiento inicial para, asociado a una antibioterapia prolongada, indicar un posterior tratamiento quirúrgico abierto46,47.
En conclusión, el aneurisma infeccioso es una entidad que debe ser sospechada ante una clínica de fiebre y masa pulsátil, complementada con extracción de hemocultivos y que, una vez confirmada de forma principal con angio-TC y posible arteriografía, debe tratarse de forma intensiva con antibioterapia, a ser posible específica, para mejorar el estado clínico del paciente, previamente a una terapia quirúrgica que incluya la extirpación o drenaje del material infeccioso y la preservación de la vascularización distal a la zona infectada. Como adyuvante pueden emplearse las técnicas endovasculares, por las que optaremos inicialmente en localizaciones de difícil acceso o en caso de inestabilidad hemodinámica del paciente, para un posterior tratamiento quirúrgico abierto siempre que en sea posible.
Parece haber una serie de factores que mejoran el pronóstico, como son la aparición de aneurismas infecciosos en pacientes jóvenes, la cirugía precoz y la infección por Salmonella spp.
A pesar de que los casos tratados de forma endovascular, drenaje del material infeccioso y antibioterapia intensiva parecen abrir un nuevo campo menos agresivo, tan solo la realización de estudios amplios prospectivos, muy difíciles de realizar dada la afortunadamente baja tasa de aneurismas infecciosos, nos permitirán en un futuro optar por la mejor de las posibilidades terapéuticas expuestas.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.