Los aneurismas de arterias viscerales incluyen aneurismas del territorio esplácnico y renal, tanto aneurismas como pseudoaneurismas. En general se trata de una entidad poco frecuente, pero de detección cada vez más habitual por el mayor número de pruebas de imagen realizadas en nuestros días. Además, el aumento de procedimientos endovasculares, endoscópicos y percutáneos a nivel abdominal determina una mayor incidencia de pseudoaneurismas. Este artículo pretende revisar la historia natural y características de los aneurismas viscerales en sus diferentes localizaciones, valorar las indicaciones terapéuticas y presentar los tratamientos a nuestro alcance en el momento actual.
Visceral artery aneurysms include those of the splanchnic and renal arteries, and can be either aneurysms or pseudoaneurysms. Overall this is a rare entity, but detection is increasing due to the amount of imaging tests performed nowadays. Furthermore, increased abdominal endovascular, endoscopic, and percutaneous procedures has led to a higher incidence of pseudoaneurysms. This article reviews the natural history and characteristics of visceral artery aneurysms at different locations, evaluates the therapeutic indications and presents the current treatments available to us.
Los aneurismas de las arterias viscerales (AAV) representan un grupo de lesiones heterogéneo que incluye las arterias del territorio esplácnico y las arterias renales. Incluimos los aneurismas verdaderos (AV) (dilatación que afecta a todas las capas de la arteria) y los pseudoaneurismas (PA) o falsos aneurismas (cuando se observa disrupción focal de la pared arterial).
Se trata de una entidad considerada poco frecuente, pero de diagnóstico cada vez más habitual en pacientes asintomáticos debido al mayor número de pruebas de imagen de alta resolución que se realizan en nuestros días1,2. Además, el aumento de procedimientos endovasculares, endoscópicos y percutáneos a nivel abdominal determina una mayor incidencia de PA yatrogénicos3–6.
Tanto los AV como los PA pueden comportar una situación de riesgo vital con una incidencia nada despreciable de rotura y hemorragia.
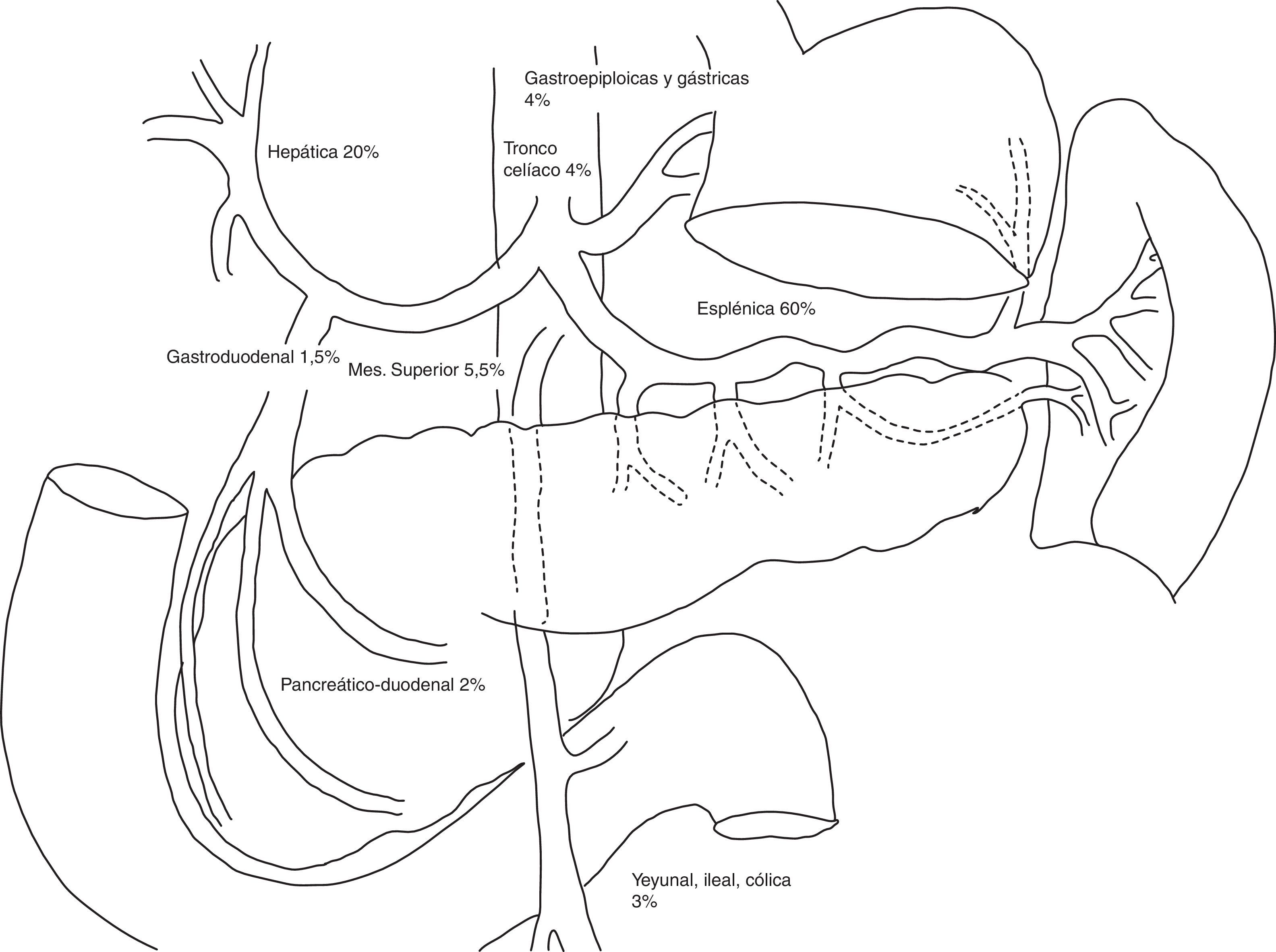
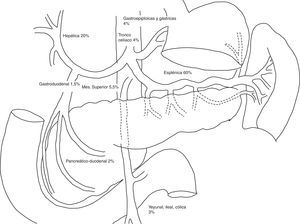
Las arterias más frecuentemente implicadas son la esplénica, la renal y la hepática1,2,7 (fig. 1). Aproximadamente un tercio de los AAV pueden estar asociados con aneurismas de otra localización8.
La indicación de tratamiento está clara en situaciones de rotura del aneurisma o presencia de PA. En los casos asintomáticos, de forma general se ha considerado indicación de tratamiento cuando el diámetro supera los 2cm, aunque las características particulares de cada caso y localización han de tenerse en consideración3,6.
Los AAV se han tratado históricamente mediante control evolutivo y cirugía. La evolución de las técnicas quirúrgicas en todos los campos, la mejoría en el manejo postoperatorio de los pacientes y el desarrollo de dispositivos endovasculares específicos puede hacer cambiar esta situación2,5,6,9.
ObjetivoEl objetivo de este artículo es revisar la historia natural y características de los AAV, tanto AV como PA, en sus diferentes localizaciones, valorar las indicaciones terapéuticas y presentar las posibilidades terapéuticas que tenemos a nuestro alcance en el momento actual.
Incidencia, etiología e historia naturalLos aneurismas viscerales son una entidad poco frecuente, con una prevalencia entre el 0,1-2%6,8–10. Esta baja frecuencia de aparición, comparada con los aneurismas de otras localizaciones, como aorta o ilíacas, puede estar en relación con la menor afectación arteriosclerosa del territorio esplácnico3. La patogénesis de los AAV está poco definida, pero se considera secundaria a arteriosclerosis (32%), degeneración/displasia (24%), traumatismos abdominales (22%), infección o enfermedad inflamatoria (por ejemplo panarteritis o poliarteritis nodosa) (10%), alteraciones del tejido conectivo (síndrome de Marfan, síndrome de Ehler-Danlos, enfermedad de Osler-Weber-Rendu, displasia fibromuscular, síndrome de Kawasaki) y situaciones de hiperaflujo (hipertensión portal o embarazo)4,8,11.
La importancia de los AAV está en relación con la posibilidad de rotura, y con el difícil diagnóstico y tratamiento cuando esto ocurre. Aproximadamente una cuarta parte de los AAV descritos en la literatura son evaluados inicialmente por rotura, con cifras de mortalidad sobre el 10%8.
En la actualidad, como indicábamos previamente, el diagnóstico de esta entidad se está realizando cada vez más en pacientes asintomáticos, permitiendo un tratamiento electivo en la mayoría de los casos. Será necesaria la valoración individualizada en función de las características del paciente, del aneurisma y de su localización para determinar qué opción terapéutica es la más adecuada.
Aneurismas de la arteria esplénicaLos aneurismas de arteria esplénica (AAE) son los más frecuentes entre los AAV, representando entre el 50-60% de los mismos3,8. A pesar de ello, dado que en la mayoría de los casos cursan de forma asintomática, se trata de una entidad a menudo infradiagnosticada. La revisión de estudios angiográficos indicaría una incidencia estimada aproximada del 0,8% en la población general12,13. Considerando la enfermedad aneurismática de forma global, serían los terceros en frecuencia después de los aórticos y los ilíacos3,10,14.
La mayoría de los AAE verdaderos son saculares, de menos de 20mm de diámetro y se observan en el tercio distal de la arteria (75%), seguidos por el tercio medio (20%)13.
La mayoría de pacientes con AAE están entre los 50-70 años de edad. Un 20% estaría entre los 20-50 años11.
Los AAE predominan en mujeres con una ratio de 4:13,13,14, detectándose sobre todo en mujeres multíparas (80%). Este hecho ha llevado a la especulación de que cambios del tejido conectivo, aumento del volumen circulatorio y congestión portal, relacionados con la gestación, podrían contribuir a una degeneración de la media arterial y la formación de aneurismas. De forma similar, situaciones de hiperdinamia a nivel de la arteria esplénica, como serían cirrosis, shunt portosistémico o trasplante hepático determinarían un mayor riesgo de desarrollar un AAE.
Aunque muchos AAE presentan calcificaciones y cambios típicos de arteriosclerosis, estos se consideran más bien como cambios secundarios a degeneración arterial y no como etiología primaria del aneurisma esplénico3,8,11–13.
Aproximadamente el 80% de los AAE cursan de forma asintomática, siendo identificados de forma incidental en estudios radiográficos, tomografía o arteriografía11,14. En algunos casos se presentan con una sintomatología abdominal inespecífica, como dolor en el hipocondrio o flanco izquierdo que irradia a la escápula izquierda, que nos indicará la necesidad de seguimiento evolutivo y control del posible crecimiento. La exploración física no acostumbra a revelar ningún hallazgo debido al pequeño tamaño y localización del AAE3,10.
La rotura del AAE puede provocar un estado de shock hipovolémico por sangrado en la cavidad abdominal o en las estructuras adyacentes como el páncreas, tracto gastrointestinal o la vena esplénica. En un 25% de los casos se presenta de forma característica dolor abdominal o torácico, seguido de inestabilidad hemodinámica tras un periodo entre 6-96h. Este lapso de tiempo está en relación con el «fenómeno de doble rotura» que resulta de la rotura inicial en la transcavidad de los epiplones y posterior sangrado intraperitoneal11,13. La mayoría de casos de rotura de AAE se producen en pacientes gestantes en el tercer trimestre del embarazo con síntomas que pueden confundir otras emergencias obstétricas8,13.
El riesgo de rotura, variable según las series revisadas, está entre el 2-10%, con una mortalidad sobre el 25% del total, llegando al 70% en pacientes embarazadas. En caso de rotura de AAE la mortalidad del feto está cercana al 95%3,11.
No existe clara base científica para determinar la indicación de tratamiento en el paciente asintomático. Basándonos en series de casos retrospectivas existe cierto consenso en la indicación de tratamiento en aquellos AAE mayores a 20mm de diámetro, siempre considerando el contexto global del paciente y valorando que la intervención electiva comporte una mortalidad inferior al 0,5%8,13,14.
Se consideraría el tratamiento independientemente del tamaño en casos de trasplante hepático o en mujeres en edad de procrear, por el elevado riesgo de rotura que presentan y la elevada mortalidad de la misma8,13.
En pacientes asintomáticos con aneurismas menores a 20mm se realizaría control mediante pruebas de imagen que permitan conocer la evolución del AAE. La historia natural del AAE de pequeño tamaño acostumbra a ser benigna, con un crecimiento inferior a 1mm anual. En series de seguimiento se ha descrito la necesidad de tratamiento en un 10% de los pacientes controlados1,8,13.
Una revisión bibliográfica publicada en 201414 permitió analizar resultados de 1.321 pacientes con AAE tratados mediante una de las 3 posibles modalidades: cirugía abierta, endovascular o tratamiento conservador. Según esta, mientras el tratamiento endovascular tiene mejores resultados a corto plazo, la cirugía abierta presenta menos complicaciones y reintervenciones a largo plazo. En los 2 grupos tratados la rotura del aneurisma comporta una mayor mortalidad perioperatoria. Además, los pacientes que se siguieron mediante tratamiento conservador mostraron una mayor mortalidad tardía, punto que puede estar en relación con una mayor comorbilidad en este grupo de pacientes14.
Los PA de arteria esplénica son menos prevalentes que los AV, tendrían mayor predominio en el sexo masculino y estarían en relación con una historia de pancreatitis, traumatismo o yatrogenia12,13. En los casos relacionados con pancreatitis generalmente se trata de un proceso crónico que incluiría la presencia de pseudoquistes pancreáticos. Son casos con mal pronóstico con un riesgo de sangrado digestivo en un 50% de los mismos con una mortalidad cercana al 50%3,13. A diferencia de los AV, pueden presentar sangrado intermitente dentro del quiste pancreático, el ductus pancreático o el duodeno. Por todo ello, el PA de arteria esplénica tiene indicación de tratamiento independientemente del tamaño del mismo, incluso en ausencia de síntomas13.
Aneurismas de la arteria hepáticaLos aneurismas de la arteria hepática (AAH) representan los segundos en frecuencia después de los AAE. La prevalencia exacta es desconocida, pero parece que podría estar sobre el 0,1% según estudios autópsicos8.
Si excluímos los de origen traumático, observamos un predominio en la sexta década de vida, más frecuente en hombres con una relación de 2:18,13. Los AAH se asocian con otros aneurismas viscerales en un 30% y en un 42% con aneurismas de otras localizaciones13.
Un 77% son extrahepáticos, en la arteria hepática común en la mayoría de los casos, un 20% tienen un componente intra y extraparenquimatoso y un 3% se localizan intrahepáticos3,13.
Históricamente eran de origen micótico en relación con endocarditis bacteriana, pero la evolución de los tratamientos antibióticos ha hecho cambiar este punto. En la actualidad la mayoría de los AAH se relaciona con degeneración de la media y secundariamente con arteriosclerosis. Los pacientes con displasia fibromuscular o panarteritis nodosa serían una población con especial riesgo de desarrollar un AAH8.
La mayoría cursan de forma asintomática, pero cabe destacar que son los AAV con mayor índice de rotura (44%) y a menudo presentan síntomas. Estos incluyen dolor epigástrico o en el hipocondrio derecho, que generalmente está relacionado con crecimiento del aneurisma11.
La indicación de tratamiento en AAH es controvertida. La mayoría de autores considerarían el tratamiento de los aneurismas mayores a 20mm8, pero otros, teniendo en cuenta el elevado riesgo de rotura y la elevada mortalidad en los casos urgentes, indicarían el tratamiento de todos los AAH diagnosticados3.
Destacar la importancia en el diagnóstico del PA hepático y de la indicación de tratamiento, independientemente del tamaño del mismo3,8,11. El número de PA en esta localización ha aumentado en los últimos años en relación con el mayor número de procedimientos percutáneos, endoscópicos o endovasculares sobre el tracto biliar y por el manejo conservador de los traumatismos hepáticos8.
Aneurismas de la arteria mesentérica superiorLos aneurismas de la arteria mesentérica superior (AAMS) representan entre un 5-8% del total de AAV, con una distribución de género similar entre ambos sexos. Son de etiología infecciosa en su mayoría (60%) y en menor número debidos a conectivopatáas y arteriosclerosis8. La predilección de los aneurismas micóticos por el origen de la AMS parece que puede ser debida a la orientación y localización del ostium de la AMS en su origen de la aorta8.
La mayoría de pacientes presentan síntomas como dolor abdominal, náuseas y vómitos, o hemorragia digestiva. La exploración física puede mostrar una masa pulsátil abdominal entre un 30-50% de los casos, diferente de la masa de un aneurisma aórtico por ser más móvil a la palpación3.
Un 50% de los casos debutan con rotura que se asocia a una elevada mortalidad (30-90%). Esta elevada mortalidad está en relación con isquemia mesentérica o con sangrado masivo intraperitoneal. Por esta razón existe consenso en la indicación de tratamiento de todos los AAMS independientemente de su tamaño3,8,11.
Mención aparte sería la degeneración aneurismática de la disección de la AMS. La disección espontánea aislada de la AMS es poco frecuente, pero es la localización más común en los vasos viscerales. En principio, cuando se detecta una disección de AMS habría indicación de anticoagulación y seguimiento evolutivo. En caso de degeneración aneurismática se plantearía el tratamiento8.
Aneurismas del tronco celíacoLos aneurismas del tronco celiaco (ATC) representan un 5% de los AAV, se asocian con otros AAV en un 40%, y con AAA en un 20%. Se detectan en hombres en un 66% de los casos8.
La etiología, al igual que en los AAH, ha cambiado desde el origen micótico (Treponema pallidum en el caso del ATC), a degeneración de la media y arteriosclerosis en el momento actual3,8.
El riesgo de rotura se cifra entre el 10-20%, con una mortalidad asociada del 50%3,8,11. Este hecho determina diferencias en la indicación de tratamiento. Algunos indican tratar los casos con 15mm de diámetro y otros todos los casos, independientemente del tamaño8,11.
Los síntomas relacionados con el ATC incluyen dolor epigástrico, shock hemorrágico, hemorragia digestiva u obstrucción biliar. En un 25% de las roturas se puede producir el fenómeno de «doble rotura» ya descrito en los AAE8.
Aneurismas de la arteria gastroduodenal y pancreaticoduodenalLos aneurismas de la arteria gastroduodenal (AAGD) y de la arteria pancreaticoduodenal (AAPD) están entre los AAV menos frecuentes, y generalmente se encuentran asociados a enfermedad pancreática o del tracto biliar. Los pseudoaneurismas ascienden hasta a un tercio del total en esta localización, y acostumbran a estar relacionados con necrosis y pseudoquistes pancreáticos3,8.
La mayoría de pacientes están sobre los 50 años, con un predominio masculino de 4:1, prevalencia que refleja la relación con pancreatitis alcohólica3.
La mayoría son sintomáticos en forma de dolor epigástrico irradiado a la espalda de aparición súbita, en relación con la rotura del aneurisma sobre el tracto intestinal o la cavidad abdominal. También en esta localización se puede observar el fenómeno de la «doble rotura». La rotura conlleva una mortalidad del 50%. Todo ello determina que la detección en pacientes asintomáticos tenga indicación de tratamiento, independientemente del tamaño de la lesión3,8.
Aneurismas de arteria renalLos aneurismas de la arteria renal (AAR) se incluyen a menudo en las revisiones de AAV por los rasgos comunes que presentan en su patogénesis y manifestaciones clínicas, pero hay determinados aspectos diferenciales a destacar.
Los AAR son poco comunes, y en su gran mayoría cursan de forma asintomática. Aunque la verdadera incidencia es desconocida, datos históricos estiman que afecta a un 0,1% de la población general. Son más frecuentes en mujeres (incluyendo la etiología de fibrodisplasia), afectan más a la AR derecha que la izquierda (pocas veces bilaterales) y son típicamente solitarios15.
La etiología del AAR es variada: secundarios a fibrodisplasia, trastornos congénitos (Ehlers-Danlos o neurofibromatosis), traumatismos, disección, infección o causas inflamatorias como panarteritis nodosa. Aunque se observan cambios arterioscleróticos en la mayoría de histologías de AAR, existe controversia en considerar esta como causa primaria o secundaria del AAR3,15,16.
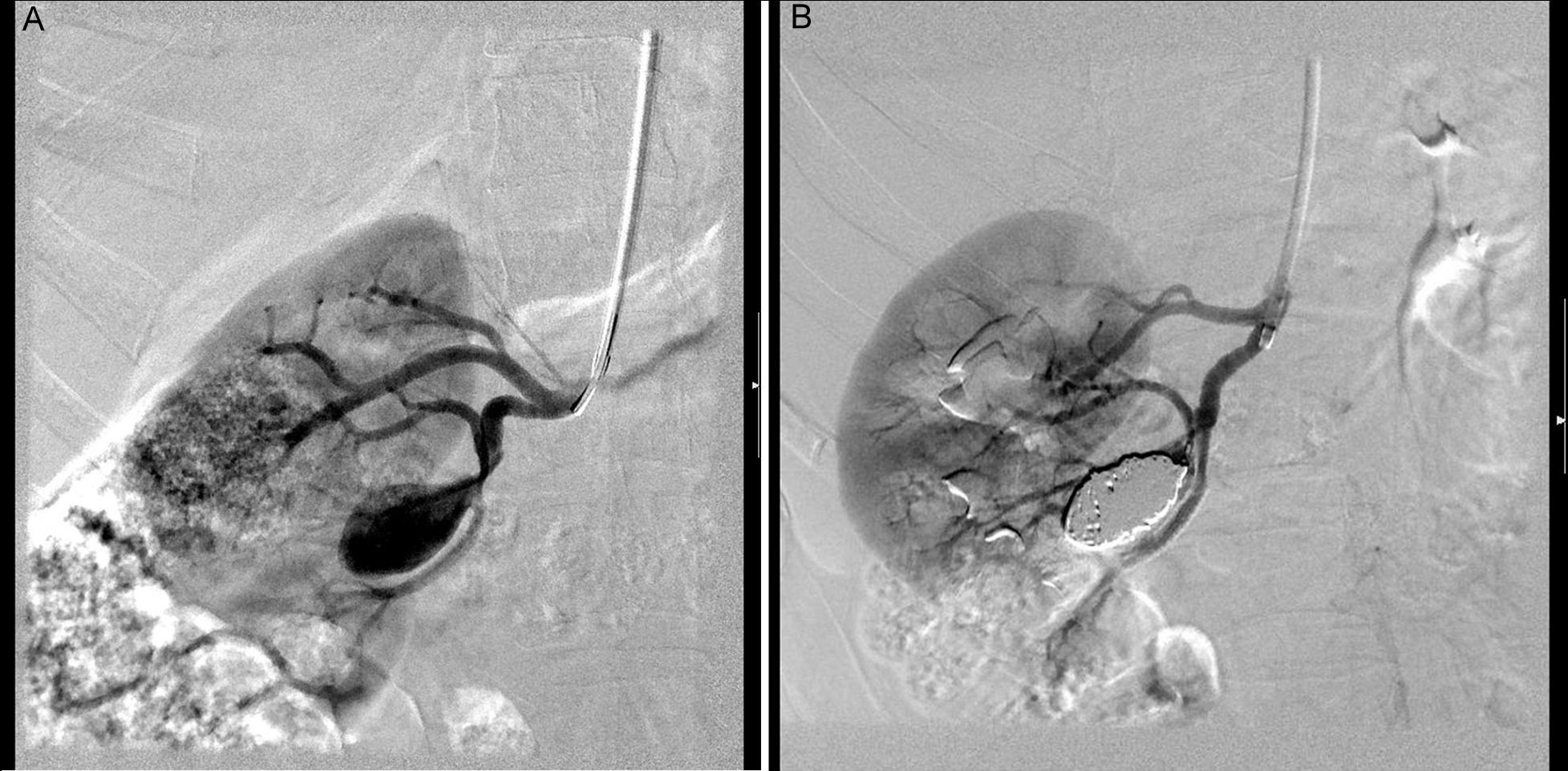
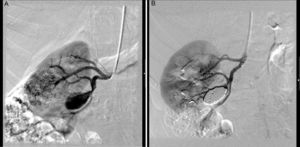
La mayoría de los AAR son extaparenquimatosos (90%), con un pico de incidencia entre los 40 y los 60 años. Las lesiones típicamente se localizan en la primera o segunda bifurcación renal, y raramente se localizan en el tronco renal principal. Aproximadamente el 75% son saculares, generalmente de menos de 5cm16 (fig. 2A y B). Los aneurismas fusiformes suelen tener etiología arteriosclerosa y estar en relación con una estenosis renal significativa que presenta una dilatación postestenótica. Generalmente los detectamos en la arteria renal principal, sobre todo en el lado derecho, y acostumbran a tener menos de 2cm de diámetro16.
En los casos secundarios a fibrodisplasia se observan múltiples estenosis y dilataciones postestenóticas en los 2/3 distales de la arteria renal, pueden ser múltiples y generalmente de pocos milímetros de diámetro16.
En determinados casos la dilatación de la arteria renal puede estar en relación con una disección de la arteria renal. La disección aislada y espontánea de la arteria renal, sin alteración en la aorta es rara, pero se ha descrito en algunos casos degenerando en aneurisma. El origen de la disección puede ser una lesión arteriosclerosa, fibrodisplasia de la arteria renal o traumatismo. La disección puede extenderse a las ramas secundarias comportando un tratamiento complejo3,16.
Menos del 10% de los AAR son intraparenquimatosos. Generalmente son múltiples y de origen congénito, asociados a alteraciones del colágeno o postraumáticos. Pueden estar asociados a fístula arteriovenosa. En casos de poliarteritis nodosa las lesiones pueden ser bilaterales y estar asociados a AAH3,16.
La mayoría de los AAR son asintomáticos (75%) y se detectan en estudios de imagen realizados para valorar otras afecciones abdominales. Cuando presentan sintomatología esta puede ser variada: hipertensión renovascular, dolor en flanco, hematuria o dolor abdominal2,15–18. El mecanismo exacto que provoca hipertensión renovascular en el contexto de AAR no se conoce, pero se especula que puede ser debido a la presencia de estenosis asociada, alteración del flujo arterial por el aneurisma, embolización distal o fístula15,16. La HTA de difícil control puede considerarse como indicación de reparación del AAR por considerarlo sintomático. En una revisión reciente, de los pacientes intervenidos por HTA de difícil control, se consideró curados un 32%, mejor control en un 26% y sin cambios en un 42%18.
La complicación más temida es la rotura, que puede manifestarse con clínica de síncope, dolor abdominal o lumbar, distensión abdominal o masa pulsátil. A veces la clínica de dolor puede estar en relación con el crecimiento aneurismático16. Probablemente menos del 3% de los AAR debutan con rotura que se asocia a una mortalidad del 10% en hombres y mujeres no gestantes16–18.
El riesgo real de rotura del AAR es desconocido, pero se han identificado ciertos factores a tener en consideración como serían la edad, el sexo, la morfología del aneurisma y las características histológicas. Hay consenso en el menor riesgo de rotura en hombres y en mujeres posmenopáusicas. En cambio, se ha observado un número de roturas inusual en gestantes, particularmente en el tercer trimestre, con una mortalidad cercana al 70% de la madre y del 100% en el feto. Probablemente, al igual que en los AAE, el estado hiperdinámico de la gestación, la influencia hormonal sobre el aneurisma y el aumento de presión intraabdominal favorecen la rotura de los mismos3,15,16.
De forma general se consideraba indicación de cirugía el aneurisma renal mayor a 15mm o el que presenta un crecimiento mayor a 5mm en un año3,15. Revisiones publicadas recientemente por Klausner indican que posiblemente el tamaño a partir del cual deberíamos plantearnos cirugía en AAR asintomáticos es >3cm, ya que raramente se rompen y tienen un ritmo de crecimiento muy lento (aproximadamente de 0,09cm/año)17,18.
Indicaciones de tratamientoLa falta de estudios prospectivos determina que no hay un consenso estandarizado en las indicaciones de tratamiento de los AAV. La evidencia se extrae de las revisiones de series de casos sometidos a seguimiento y a tratamiento de los que hemos indicado referencias en el texto.
Tal como hemos observado en la descripción de los diferentes tipos de AAV, cada uno de ellos tiene sus particularidades a tener en cuenta, pero de forma global las indicaciones de tratamiento en las que están de acuerdo los diferentes autores serían las siguientes (tabla 1):
- •
Los PA de arterias viscerales independientemente de su tamaño.
- •
Los AAV sintomáticos o rotos.
- •
Los AAE mayores a 20mm.
- •
Los AAV con un rápido crecimiento (>5mm anual).
- •
Los AAV en gestantes o en mujeres en edad de procrear.
- •
Los AAV en pacientes candidatos a trasplante hepático.
- •
Los AAH en pacientes con poliarteritis nodosa o displasia fibromuscular.
- •
Para podernos plantear la cirugía electiva debemos tener una mortalidad quirúrgica menor al 0,5% para justificar el tratamiento4,8.
- •
Hay controversia en cuanto al tamaño de AAR asintomático:>15mm3,15 o>30mm17,18 según referencias.
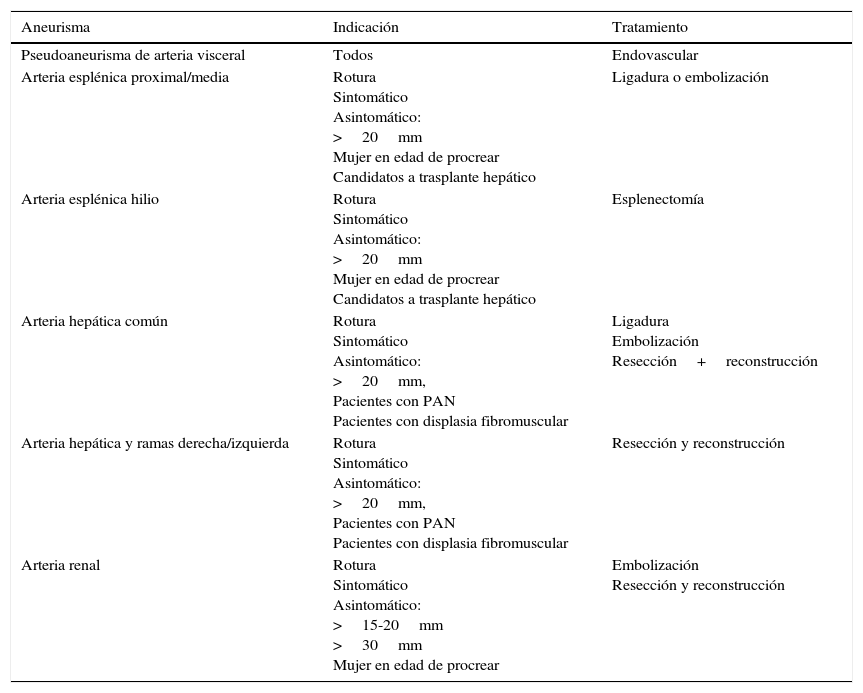
Resumen de indicaciones y posibilidades de tratamiento
| Aneurisma | Indicación | Tratamiento |
|---|---|---|
| Pseudoaneurisma de arteria visceral | Todos | Endovascular |
| Arteria esplénica proximal/media | Rotura Sintomático Asintomático: >20mm Mujer en edad de procrear Candidatos a trasplante hepático | Ligadura o embolización |
| Arteria esplénica hilio | Rotura Sintomático Asintomático: >20mm Mujer en edad de procrear Candidatos a trasplante hepático | Esplenectomía |
| Arteria hepática común | Rotura Sintomático Asintomático: >20mm, Pacientes con PAN Pacientes con displasia fibromuscular | Ligadura Embolización Resección+reconstrucción |
| Arteria hepática y ramas derecha/izquierda | Rotura Sintomático Asintomático: >20mm, Pacientes con PAN Pacientes con displasia fibromuscular | Resección y reconstrucción |
| Arteria renal | Rotura Sintomático Asintomático: >15-20mm >30mm Mujer en edad de procrear | Embolización Resección y reconstrucción |
El objetivo del tratamiento, tanto quirúrgico como endovascular, consiste en excluir el saco aneurismático de la circulación preservando el flujo a los órganos distales al mismo.
Independientemente del tratamiento escogido hemos de tener presente la localización del aneurisma y la arteria afectada: aquellos vasos sin arterias colaterales o de difícil compensación necesitan mantener la perfusión distal, por lo tanto tendremos que utilizar técnicas como el by pass o el stent cubierto. En los vasos con buena circulación colateral, como la esplénica, el tronco celíaco, la mesentérica superior proximal o la hepática común una ligadura proximal y distal al aneurisma u oclusión mediante coils puede ser lo adecuado4,6.
Tratamiento quirúrgicoEl tratamiento quirúrgico clásico incluye el abordaje abierto para exclusión del aneurisma, asociando en lo posible restablecer la continuidad vascular. En casos determinados será necesaria una esplenectomía, nefrectomía o hepatectomía parcial.
La cirugía ofrece las ventajas de una mayor durabilidad y menor necesidad de seguimiento, además de una mortalidad teórica inferior al 0,5% en la cirugía programada. Sin embargo, en casos de rotura del aneurisma, abdomen hostil (sepsis de origen intraabdominal o pancreatitis), o la localización intraparenquimatosa del aneurisma, puede ser técnicamente complicada comportando una mayor morbimortalidad4.
El abordaje de la arteria esplénica lo podemos realizar a través de una laparotomía media o una subcostal bilateral, movilizamos el colon izquierdo seccionando el peritoneo lateral del mismo, llegando al plano de la fascia de Gerota. Identificaremos la arteria esplénica en el borde superior del páncreas19. Los AAE, por su morfología sacular y localización a nivel proximal o el tercio medio de la arteria, permiten realizar una aneurismectomía y anastomosis término-terminal o parche, preservando el bazo. En determinados casos se puede realizar ligadura de la arteria esplénica, considerando que el bazo mantendrá su perfusión a través de los vasos cortos gástricos. En presencia de aneurisma a nivel hiliar o intraparenquimatoso, la reconstrucción vascular puede resultar imposible y puede ser necesaria la realización de una esplenectomía2,7.
El tratamiento del AAE mediante laparoscopia es poco frecuente y requiere de una amplia experiencia en cirugía laparoscópica. Un estudio prospectivo aleatorizado a 10 años realizado en Brescia sobre 29 pacientes con AAE mostró resultados similares entre cirugía abierta y laparoscopia, con los beneficios que la cirugía menos invasiva puede proporcionar, como es un menor número de complicaciones postoperatorias20.
Cuando la arteria afecta es la hepática, podemos realizar un abordaje mediante una incisión subcostal derecha. Deberemos desplazar el lóbulo hepático derecho hacia la parte superior de la incisión, identificar el duodeno y seccionar el ligamento hepato-duodenal, identificando a continuación la arteria hepática19. En estos casos, la ligadura proximal y distal puede ser una opción válida, pero hay que estar atentos a los cambios de coloración del parénquima hepático que nos pueden indicar signos isquémicos y la necesidad de realizar un injerto arterial. Si la localización del aneurisma es muy distal o intraparenquimatosa puede ser necesario realizar una hepatectomía parcial2,7,13.
En el caso de AAR la cirugía suele ser más complicada que en casos de estenosis, por la afectación a nivel de la bifurcación renal. La renal derecha la podemos abordar a través de una laparotomía media o subcostal derecha y abordaje transperitoneal mediante una maniobra de Kocher rechazando el colon y el duodeno medialmente. Para la renal izquierda podemos realizar un abordaje retroperitoneal a través de una incisión supraumbilical19. El método más sencillo para los aneurismas saculares será la aneurismorrafia y parche, que se podría aplicar a un tercio de los pacientes. En otros casos será necesaria la realización de un by pass utilizando la vena safena o material protésico. En los casos en que se prevea una reparación que exceda los 45min se recomienda realizar una reparación exvivo reimplantando el riñón in situ o en la fosa ilíaca15,16. Clásicamente era necesario realizar una nefrectomía en los casos de aneurismas múltiples, intraparenquimatosos o en casos de rotura. En la actualidad la evolución de las técnicas ex vivo y endovasculares ha minimizado el riesgo de pérdida del riñón15.
La introducción de técnicas laparoscópicas tiene especial incidencia en el caso de la arteria renal21–24. El manejo por vía laparoscópica con extracción del riñón permitiendo una reparación ex vivo y posterior autotransplante21,22, la aplicación de cirugía asistida por robot23 o el pinzamiento del AAR asistido por laparoscopia24 son líneas de trabajo novedosas a tener en cuenta en un futuro.
Tratamiento endovascularEl tratamiento de los AAV mediante técnicas endovasculares ha presentado una evolución al alza considerándola de elección en muchos casos. Las ventajas del tratamiento endovascular radican en que es menos invasivo, permite reducir la estancia hospitalaria y mantener una buena calidad de vida en el postoperatorio inmediato. Como puntos negativos destacar el riesgo de embolismo distal durante el procedimiento, migración de coils, infartos en el órgano diana o la rotura del aneurisma. También destacar el mayor riesgo de reintervenciones por exclusión incompleta del aneurisma y la necesidad de seguimiento mediante pruebas de imagen por el relativo desconocimiento de los resultados a largo plazo4. El seguimiento mediante exploraciones como angioTC o angioRM puede resultar difícil dado los artefactos que provocan tanto coils como otros agentes usados en embolizaciones.
El tratamiento endovascular de los AAV requiere de destreza y experiencia en cateterización selectiva mediante catéteres y microcatéteres, además de una imagen radiológica de óptima calidad.
El objetivo es excluir el aneurisma de la circulación para prevenir su rotura, intentando mantener la circulación distal. Para conseguirlo disponemos de diversas estrategias que escogeremos en función de las características del aneurisma, de la arteria, de los dispositivos con que contemos y de la experiencia del cirujano6.
La embolización con coils ha sido ampliamente utilizada como método alternativo a la ligadura del aneurisma. A través de un abordaje femoral o braquial percutáneo, con un introductor de 5F, podremos trabajar con un catéter o un microcatéter hasta conseguir una posición estable que nos permita la liberación de los coils en la localización deseada. En los casos de aneurisma sacular la técnica de coil packing del saco, insertando tantos coils como sea posible, disminuye el riesgo de recanalización posterior. En los aneurismas de mayor tamaño o fusiformes estaría más indicada la oclusión con coils o «tapones» primero de la arteria distal a la lesión y después la más proximal25. A la embolización con coils puede añadirse la inyección de agentes trombosantes como trombina o cola. La utilización de partículas puede estar asociada a un mayor riesgo de embolización del órgano diana6.
En los casos de PA la opción endovascular está siendo cada vez más utilizada, ya que permite llegar a zonas de difícil acceso quirúrgico1. Cuando realizamos una embolización de un PA a menudo será necesario asociar coils con otras técnicas, ya que la embolización solo con coils puede derivar en un continuo crecimiento del saco aumentando el riesgo de rotura6. Tendremos que realizar una buena planificación del caso y estudiar la posible asociación de más de un dispositivo, como sería coil y stent.
Otra posibilidad es el implante de stens recubiertos que permitirían mantener la circulación al órgano diana y serían una opción interesante a tener en cuenta en casos de rotura. A pesar de la evolución en el perfil de los dispositivos, las características anatómicas de las arterias viscerales, especialmente tortuosas, limitan su aplicación en muchos casos. Para liberar un stent cubierto necesitamos un introductor de 6-7F hasta la lesión, mantener la guía en una posición estable para avanzar el dispositivo, liberarlo y después avanzar un balón para expandir completamente la prótesis. En algunos casos será necesario la embolización con coils, trombina u otros agentes como Onix, para ocluir la circulación colateral que puede provocar lo que sería una endofuga tipo 2 en el saco aneurismático. Como puntos negativos hay que tener en cuenta que los stents cubiertos ocluyen la posible circulación colateral y que tienen un índice no despreciable de oclusión a largo plazo1,9.
Un dispositivo de más reciente aparición son los stents direccionadores de flujo (flow-diverting stents), diseñados para reducir la velocidad de flujo en el saco aneurismático y mejorar el flujo laminar en la arteria principal y sus colaterales. El objetivo de estos dispositivos es conseguir la trombosis del saco aneurismático mientras se mantiene permeable el tronco principal y sus ramas; este proceso no se produce de inmediato, sino que se puede observar durante el seguimiento. Existen pocos casos de AAV tratados mediante este tipo de dispositivos, con resultados prometedores hasta la fecha26–28. Las limitaciones son su aplicación en casos de rotura por razones obvias (no excluye el flujo en el aneurisma de inmediato, sino a largo plazo) y la dificultad en el implante por tratarse de un dispositivo con un perfil de 7F o más, con poca flexibilidad y que requiere del uso de guías rígidas para su liberación. Será necesario esperar los resultados a largo plazo de los casos tratados y también esperar mejoras en la flexibilidad y en el perfil de los dispositivos26.
En determinados países en los que no tenían acceso a los stents direccionadores de flujo se ha implantado el tratamiento con múltiples stents superpuestos (multiple overlapping uncovered stents) en un intento de imitar el efecto de los anteriores. La idea es superponer diferentes stents para conseguir una porosidad sobre el 65%, al parecer la necesaria para favorecer la disminución de la velocidad en el saco aneurismático acabando por trombosar el mismo. Los resultados en las series presentadas, aunque sobre un número de pacientes limitado, son prometedores29,30.
ConclusionesLos AAV son una entidad poco frecuente a tener en consideración. El tratamiento conservador y el control mediante técnicas de imagen es el indicado en la mayoría de los AAV menores a 20mm, a excepción de los detectados en mujeres en edad fértil. El tratamiento electivo puede realizarse mediante cirugía abierta o endovascular siempre y cuando tengamos una mortalidad inferior al 0,5%. La rotura del AAV representa una situación de riesgo vital que requerirá de un tratamiento urgente. La opción endovascular en manos entrenadas puede ser la mejor opción terapéutica en los casos de AAV rotos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLa autora declara no tener ningún conflicto de intereses.
Mi agradecimiento al Comité Editorial de Angiología por la invitación a realizar la revisión que les presento.