Valorar la asociación entre las concentraciones plasmáticas de la proteína C reactiva (PCR) y la evolución de los aneurismas de aorta abdominal (AAA) infrarrenal, para verificar su validez como biomarcador de crecimiento aneurismático.
Material y métodosCohorte prospectiva de AAA asintomáticos seguidos en consultas externas desde 2008. Registramos: datos clínicos, mediciones seriadas del diámetro máximo de los AAA (mediante ecografía y angio-TAC) y determinaciones seriadas de PCR ultrasensible. El seguimiento fue anual para los AAA de 30-39mm y semestral para aquellos ≥40mm. Excluimos las determinaciones de PCR >15mg/L para evitar que posibles procesos agudos pudieran actuar como factor de confusión. Calculamos las tasas del crecimiento aórtico en cada periodo de seguimiento mediante la diferencia entre los diámetros aórticos en mediciones consecutivas y los clasificamos de forma dicotómica (progresión si el crecimiento fue >2mm, estabilidad si el crecimiento fue ≤2mm). Empleamos para el análisis de datos la correlación de Pearson y los modelos mixtos lineales.
ResultadosIncluimos 218 AAA con un diámetro basal medio de 41,2mm (desviación estándar [DE] 10,3mm, intervalo 30-90mm). El seguimiento medio fue 28,8 meses (DE 13,7; intervalo 4,8-62), y la concentración basal de PCR media fue 4,1mg/L (DE 3,3; intervalo 0,5-15). Observamos una relación significativa entre los niveles basales de PCR y el diámetro basal (r=0,23; p=0,001), asociación que se mantuvo en las determinaciones seriadas a lo largo del seguimiento (p<0,0001). No detectamos asociación significativa entre las concentraciones de PCR y las tasas de crecimiento aórtico medidas como variable continua (p=0,10), pero concentraciones crecientes de PCR se asociaron a la progresión de los AAA, tomada la variable de forma dicotómica (OR=1,008; IC 95%: 1,000-1,016; p=0,04).
ConclusionesLas concentraciones plasmáticas de PCR mantienen una asociación con el diámetro aneurismático a lo largo del seguimiento y se relacionan con la progresión de los AAA.
To assess the association between high sensitivity C-reactive protein (hs-CRP) plasma levels and the prospective progression of aortic abdominal aneurysm (AAA) in order to test its value as a biomarker.
Material and methodsProspective cohort of asymptomatic AAA patients followed up in an outpatient clinic since 2008. Clinical data, serial maximum aneurysm diameter (ultrasound and CT) and hs-CRP plasma levels were recorded. Small AAA (30-39mm) were followed up annually, and large AAA (≥40mm) every 6 months. Hs-CRP levels >15mg/L were excluded from the study to avoid acute events acting as potential confounders. Aortic expansion rates were calculated in each follow up period, as well as the difference between aortic diameters in consecutive measurements. Aortic growth was also classified as a dichotomic variable (progression if the growth was >2mm, and stability if the growth was ≤2mm). The Pearson correlation and mixed linear models were used for statistical analysis.
ResultsThe study included 218 AAA with a mean baseline diameter of 41.2mm (SD 10.3mm, range 30-90). The average follow up time was 28.8 months (SD 13.7, range 4.8-62) and the mean baseline hs-CRP level was 4.1mg/dL (SD 3.3, range 0.5-15). A significant association was observed between hs-CRP levels and baseline AAA diameter (r=0.23, P=.001), and this association was maintained over serial determinations throughout the follow-up (P<.0001). No statistically significant association was observed between hs-CRP concentrations and aortic growth rates, measured as a continuous variable (P=.10). However, increasing hs-CRP levels were associated with AAA progression [(OR=1.008; 95% (1.000-1.016) P=.04)].
Conclusionshs-CRP plasma levels are consistently associated with AAA diameter throughout the follow-up of the patients, and increased levels are associated with AAA progression.
Los aneurismas de aorta abdominal (AAA) infrarrenal afectan a un 4-8% de la población masculina mayor de 60 años, siendo mucho más infrecuentes en mujeres1,2. Siguen un curso habitualmente silente, con crecimiento gradual. Aunque algunos factores, como el diámetro aórtico basal y el tabaquismo activo, se han asociado a un mayor crecimiento, mientras que otros, como la diabetes mellitus, se relacionan con mayor estabilidad, el crecimiento de los AAA es generalmente discontinuo e impredecible. La importancia de los AAA radica en su potencial rotura, asociándose este evento a un 75% de mortalidad. Los AAA constituyen la 10.ª causa de muerte y son responsables de aproximadamente un 2% de los fallecimientos anuales3. Es esencial una detección precoz para evitar este desenlace. Se indica una exclusión electiva del AAA cuando su riesgo de rotura estimado supera el riesgo quirúrgico de la intervención programada, habitualmente a partir de un diámetro máximo del AAA de 5-5,5cm y en función de su tasa de crecimiento en los últimos 1-2 años, la edad y comorbilidad del paciente y las cifras de morbimortalidad del equipo quirúrgico.
Un biomarcador se define como una proteína, péptido, gen, lípido o producto metabólico que represente un proceso biológico en el cuerpo del que procede en un momento dado4. Se han identificado varias sustancias en la sangre periférica de pacientes con AAA relacionadas con el proceso inflamatorio y la degradación de la pared arterial inherentes a la fisiopatología de los AAA, y que potencialmente podrían ayudar a estimar el grado de actividad de la enfermedad y su riesgo para el enfermo. Esto nos permitiría individualizar el manejo terapéutico de cada paciente y los intervalos de seguimiento. Entre estos potenciales biomarcadores se encuentra la proteína C reactiva (PCR), un reconocido marcador inflamatorio y reactante de fase aguda, habitualmente sintetizado por los hepatocitos en respuesta al daño tisular o a una infección, aunque también puede ser producido en el seno de placas ateroscleróticas por células musculares lisas de la pared vascular. La PCR también es un reconocido marcador de riesgo cardiovascular5–11 y se ha demostrado repetidamente como un factor de riesgo independiente para el desarrollo de AAA12. Niveles elevados de PCR se han asociado a diámetros crecientes de AAA13–15 pero su papel en la historia natural de los mismos no está claro aún.
Nuestro objetivo ha sido estudiar la asociación entre las concentraciones plasmáticas de PCR y la evolución prospectiva del AAA, para verificar su validez como biomarcador de crecimiento aneurismático.
Material y métodosSe reclutó una cohorte prospectiva de pacientes con un AAA infrarrenal fusiforme aterosclerótico asintomático seguidos en las consultas externas del Servicio de Angiología y Cirugía Vascular del Hospital de Galdakao-Usansolo (Vizcaya) desde enero de 2008 hasta junio de 2012. Se consideró el diagnóstico de AAA según la definición de McGregor: ≥30mm de diámetro máximo de aorta abdominal infrarrenal, medida en su margen externo y perpendicular al eje aórtico mediante una prueba de imagen ultrasonográfica o tomográfica16,17. Se excluyó a aquellos pacientes con AAA sintomáticos o inflamatorios, múltiples aneurismas sincrónicos asociados (torácico, femoral, poplíteo), y AAA de otras localizaciones diferentes al segmento aórtico infrarrenal (yuxtarrenal, suprarrenal, toracoabdominal). También fueron excluidos los pacientes con procesos inflamatorios activos o infecciosos agudos conocidos, intervenciones quirúrgicas o traumatismos mayores en los 60 días previos, y los que tomaban medicación crónica antiinflamatoria o inmunosupresora, para evitar que estas variables pudiesen actuar como factores de confusión sobre las concentraciones de PCR, al reflejar otro proceso agudo concomitante o al estar artificialmente atenuadas por la medicación.
El estudio fue aprobado por el Comité de Ética del Hospital de Galdakao-Usansolo y se obtuvo consentimiento informado de todos los pacientes reclutados. Tanto el plan de seguimiento como las indicaciones intervencionistas de la enfermedad de los pacientes no sufrieron modificaciones por el hecho de participar en la investigación.
Se registraron las siguientes variables clínicas:
- a)
Datos demográficos: edad (años), sexo (hombres/mujeres).
- b)
Factores de riesgo cardiovascular:
- -
Tabaquismo activo: Consideramos la presencia de tabaquismo activo cuando el paciente consumía en el momento del reclutamiento al menos un cigarillo/puro al día, o cuando había cesado el consumo menos de 6 meses antes del reclutamiento.
- -
Hipertensión arterial: Los pacientes fueron catalogados como hipertensos cuando recibían tratamiento específico (dieta o medicación) o cuando se registraron cifras de tensión arterial >140/90mmHg 2 veces consecutivas en condiciones basales.
- -
Diabetes mellitus: Se realizó un análisis de sangre a todos los pacientes. Utilizamos el criterio de consenso de 2004 para el diagnóstico de diabetes mellitus: glucemia basal en ayunas ≥126mg/dL18. También se clasificaron como diabéticos los pacientes que ya recibían un tratamiento endocrinológico específico (dieta, hipoglucemiantes orales, insulina).
- -
Hipercolesterolemia: También fueron utilizados los criterios estándares para el diagnóstico de hipercolesterolemia: la concentración sérica de colesterol total ≥200mg/dL o de lipoproteína de baja densidad (LDL-colesterol) ≥100mg/dL19. También se clasificó como hipercolesterolémicos a los pacientes que estaban siendo tratados con una dieta específica o medicación hipolipidemiante.
- -
- c)
Comorbilidad:
- -
Cardiopatía: Los antecedentes de cardiopatía isquémica incluían angina de esfuerzo o reposo, infarto agudo de miocardio, enfermedad coronaria significativa (estenosis >50% de una o más arterias coronarias) aunque silente objetivada en pruebas de imagen coronarias, así establecido por un cardiólogo, o revascularización coronaria percutánea o abierta previa. También se incluyeron la enfermedad valvular, la miocardiopatía y la arritmia, establecidas por un cardiólogo.
- -
Enfermedad pulmonar obstructiva crónica: Se diagnosticó cuando el volumen espiratorio forzado en el primer minuto (VEF1) era <80% (se incluye una espirometría basal en el estudio preoperatorio de los pacientes) o los pacientes estaban siendo tratados por dicha enfermedad por un neumólogo.
- -
Insuficiencia renal crónica: Se estableció el umbral para su diagnóstico en concentraciones de creatinina sérica ≥1,5mg/dL o una tasa de filtración glomerular <60mL/min.
- -
Enfermedad arterial periférica de extremidades inferiores: Era diagnosticada cuando el paciente refería síntomas isquémicos en una o ambas extremidades inferiores (claudicación intermitente, dolor en reposo o lesiones tróficas isquémicas) y presentaba una exploración arterial patológica (ausencia de pulsos femorales, poplíteos o distales) con índice tobillo/brazo <0,920.
- -
Enfermedad cerebrovascular: Se estableció la presencia de enfermedad cerebrovascular cuando el paciente refería una historia objetivada de accidente cerebrovascular transitorio, ictus mayor o menor, o cuando encontramos una estenosis carotídea >50% asintomática en la exploración ecográfica rutinaria que realizamos a los pacientes vasculares en nuestra consulta.
- -
- d)
Medicación habitual: Se registró la toma de estatinas por los pacientes.
Se realizaron mediciones seriadas del diámetro máximo de los AAA. Los pacientes con AAA de 3-3,9cm fueron seguidos de forma anual en las consultas externas del Hospital de Galdakao-Usansolo con una evaluación clínica y una ecografía abdominal (ecógrafo Acuson Antares, SIEMENS®, con una sonda lineal PH4-1). Los pacientes con AAA de 4-4,9cm fueron controlados clínicamente y con una tomografía axial computarizada (TAC) abdominopélvica con contraste, con periodicidad semestral. Todas las ecografías fueron realizadas por los facultativos del servicio de Angiología y Cirugía Vascular y las TAC fueron realizadas en el servicio de Radiodiagnóstico del Hospital de Galdakao-Usansolo. Los AAA con diámetro ≥5cm y los asociados a un aneurisma ilíaco ≥30mm uni- o bilateral fueron reparados de forma electiva, quirúrgica o endovascular, salvo contraindicación anestésica. En este último caso fueron seguidos de forma análoga a los AAA de 4-4,9cm. Se midieron los diámetros máximos transverso, anteroposterior y lateral de los márgenes exteriores de la aorta abdominal infrarrenal, perpendiculares al eje aórtico. La medida más elevada de las 3 fue la que se registró como el diámetro aórtico máximo en cada valoración17.
Se obtuvo una muestra de sangre periférica de cada paciente en cada control del seguimiento. La extracción se realizó por venopunción entre las 8 y 10 h de la mañana tras un ayuno nocturno de 12 h. Las determinaciones de PCR plasmática se realizaron el mismo día de la recogida de la muestra en el Laboratorio de Bioquímica del Hospital de Galdakao-Usansolo (Vizcaya) mediante aglutinación con partículas de látex recubiertas con anticuerpos monoclonales anti-PCR y determinación por inmunoturbidimetría del precipitado (Analizador Cobas711, Roche Diagnostics). El coeficiente de variacio¿n interensayo fue <3,9% y el límite de sensibilidad <0,20mg/l. Las concentraciones de PCR >15mg/l podrían reflejar algún proceso inflamatorio o infeccioso agudo y fueron excluidas de los análisis estadísticos para evitar posibles factores de confusión.
Se consideraron las siguientes variables resultado en el diseño del estudio para su posterior análisis:
- 1.
Determinaciones seriadas de PCR.
- 2.
Diámetro aórtico máximo en cada control de seguimiento.
- 3.
Crecimiento aórtico prospectivo: Calculamos las tasas del crecimiento aórtico prospectivo anual mediante la diferencia entre los diámetros aórticos en mediciones anuales consecutivas, registrándolas como una variable continua (mm/año). Esta variable fue también codificada de forma dicotómica según los criterios: estabilidad si el crecimiento fue ≤2mm en el periodo anual correspondiente; y progresión si el crecimiento fue >2mm en ese periodo anual.
Se introdujeron los datos, clínicos, analíticos y anatómicos en una base de datos y se analizaron con los programas SPSS 20.0 (www.spss.com) y SAS. El tamaño muestral calculado para el estudio, con un error α = 0,05 y un poder estadístico de 90%, fue de 50 pacientes. Suponiendo unas pérdidas de un 15-20% del total de pacientes a lo largo del seguimiento, y que es inevitable perder algunas determinaciones plasmáticas, aumentamos el tamaño muestral todo lo posible. Se realizó un primer análisis descriptivo de las variables clínicas, serológicas y anatómicas, utilizando el número y porcentaje para las variables cualitativas y la media con desviación estándar (DE) y rango para las variables cuantitativas. Posteriormente se analizó la asociación entre los niveles plasmáticos de PCR, el diámetro máximo y el crecimiento prospectivo de los AAA mediante correlación de Pearson y modelos mixtos lineales, asumiendo como significativo un valor p<0,05.
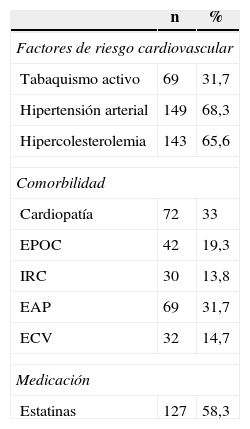
ResultadosIncluimos en el estudio a 218 pacientes con AAA, de los cuales 209 eran hombres (95,9%), con una edad media de 70,8 años (DE 8,4; rango 49-92). Las características clínicas de los pacientes se detallan en la tabla 1. El diámetro basal medio de los AAA era 41,2mm (DE 10,3mm; rango 30-90), con una distribución por grupos de tamaño de: 116 (53,2%) AAA de 3-3,9cm; 66 (30,3%) AAA de 4-4,9cm y 36 (16,5%) AAA ≥5cm.
Características clínicas de la cohorte de pacientes con AAA
| n | % | |
|---|---|---|
| Factores de riesgo cardiovascular | ||
| Tabaquismo activo | 69 | 31,7 |
| Hipertensión arterial | 149 | 68,3 |
| Hipercolesterolemia | 143 | 65,6 |
| Comorbilidad | ||
| Cardiopatía | 72 | 33 |
| EPOC | 42 | 19,3 |
| IRC | 30 | 13,8 |
| EAP | 69 | 31,7 |
| ECV | 32 | 14,7 |
| Medicación | ||
| Estatinas | 127 | 58,3 |
AAA: aneurisma de aorta abdominal; EAP: enfermedad arterial periférica de extremidades inferiores; ECV: enfermedad cerebrovascular; EPOC: enfermedad pulmonar obstructiva crónica; IRC: insuficiencia renal crónica.
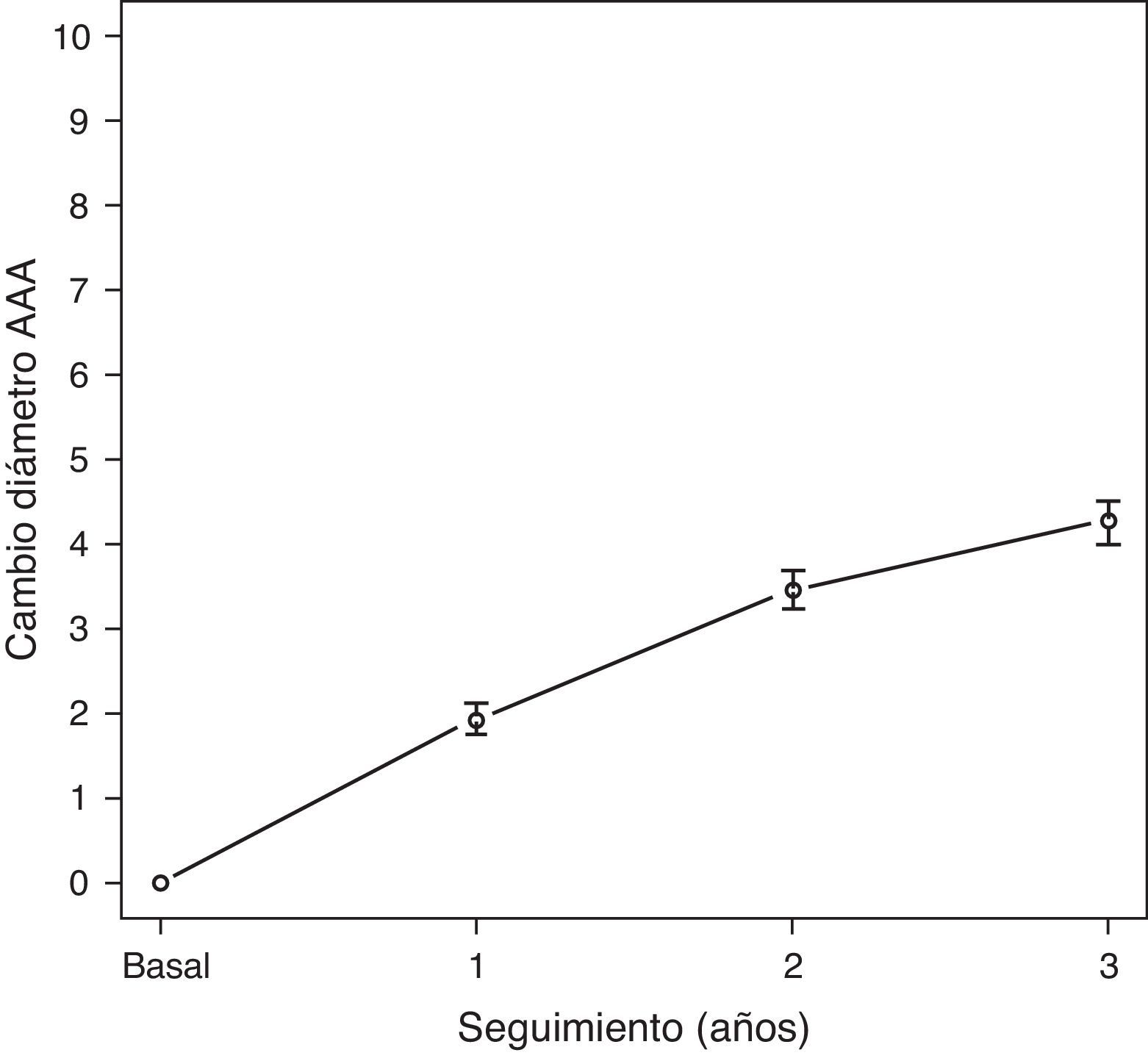
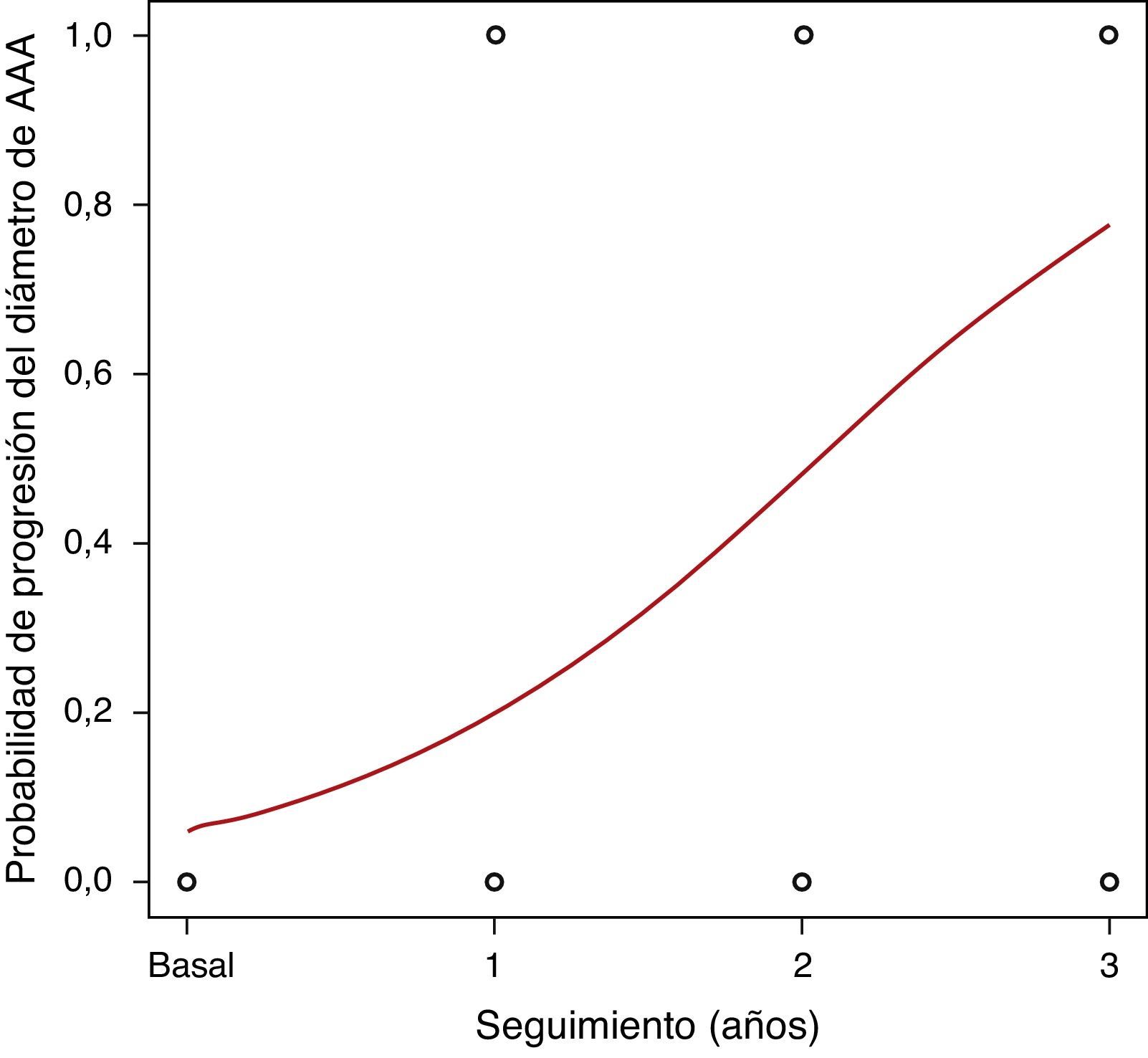
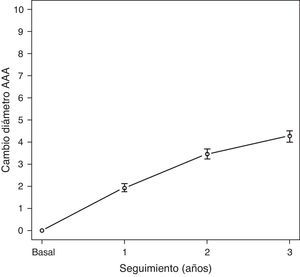
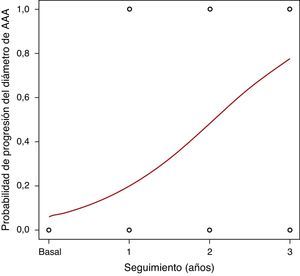
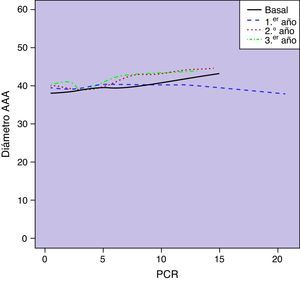
El seguimiento medio fue 28,8 meses (DE 13,7; rango 4,8-62). El diámetro medio de los AAA fue aumentando a lo largo del seguimiento. Las concentraciones plasmáticas medias de PCR se encontraban discretamente elevadas a lo largo de todo el seguimiento, con medias en torno a 4,1mg/L. El crecimiento medio de los AAA fue de 1,9mm (DE 2,9) durante el primer año de seguimiento, 3,5mm (DE 2,5) respecto del basal a los 2 años y 4,6mm (DE 1,8) a los 3 años. En la figura 1 se puede observar el crecimiento de los AAA a lo largo del seguimiento, registrado como variable continua. Clasificado este crecimiento como variable dicotómica, observamos una probabilidad de progresión de aproximadamente un 20% de los AAA de la serie al año, 50% a los 2 años y casi el 80% a los 3 años (fig. 2).
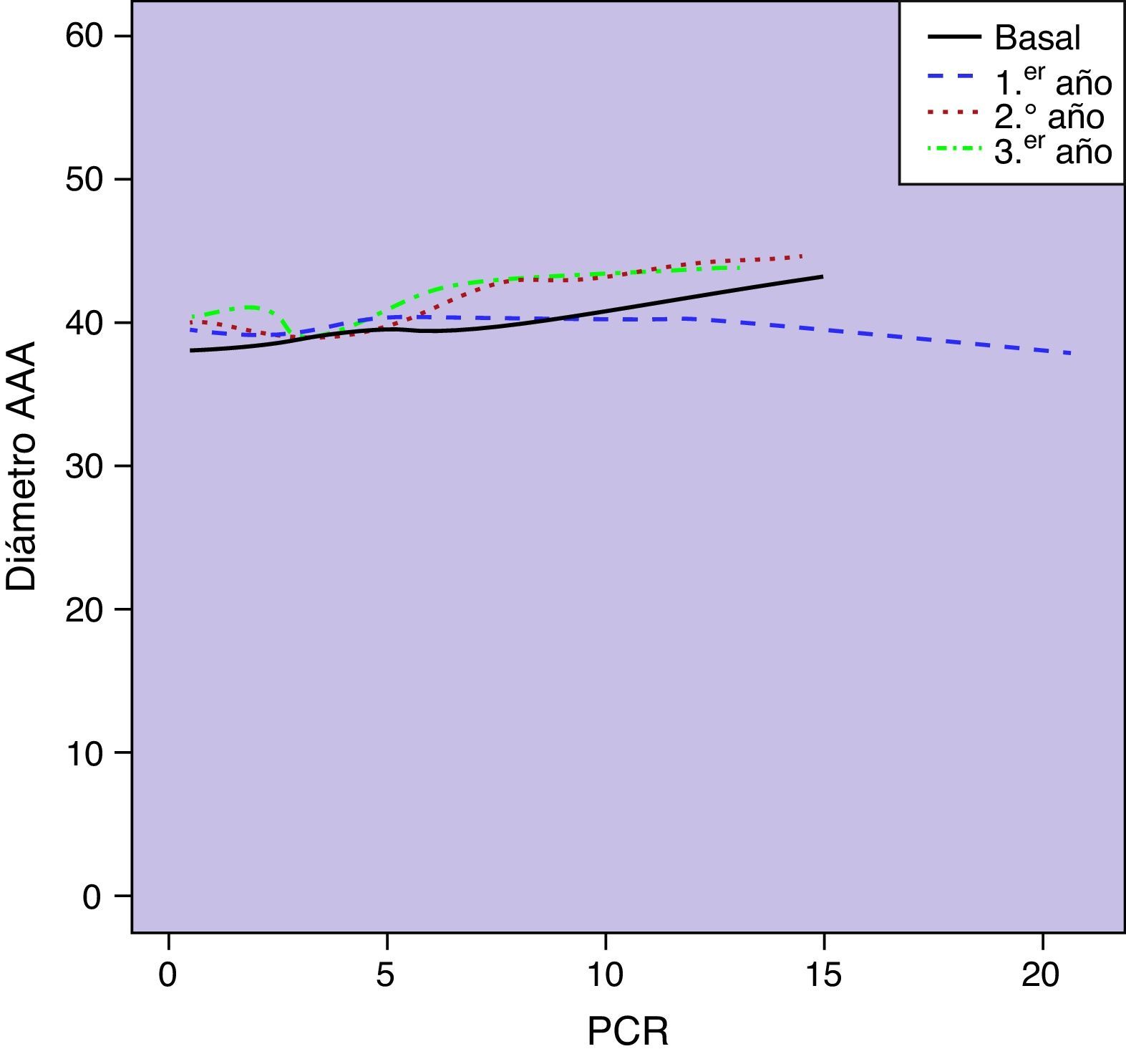
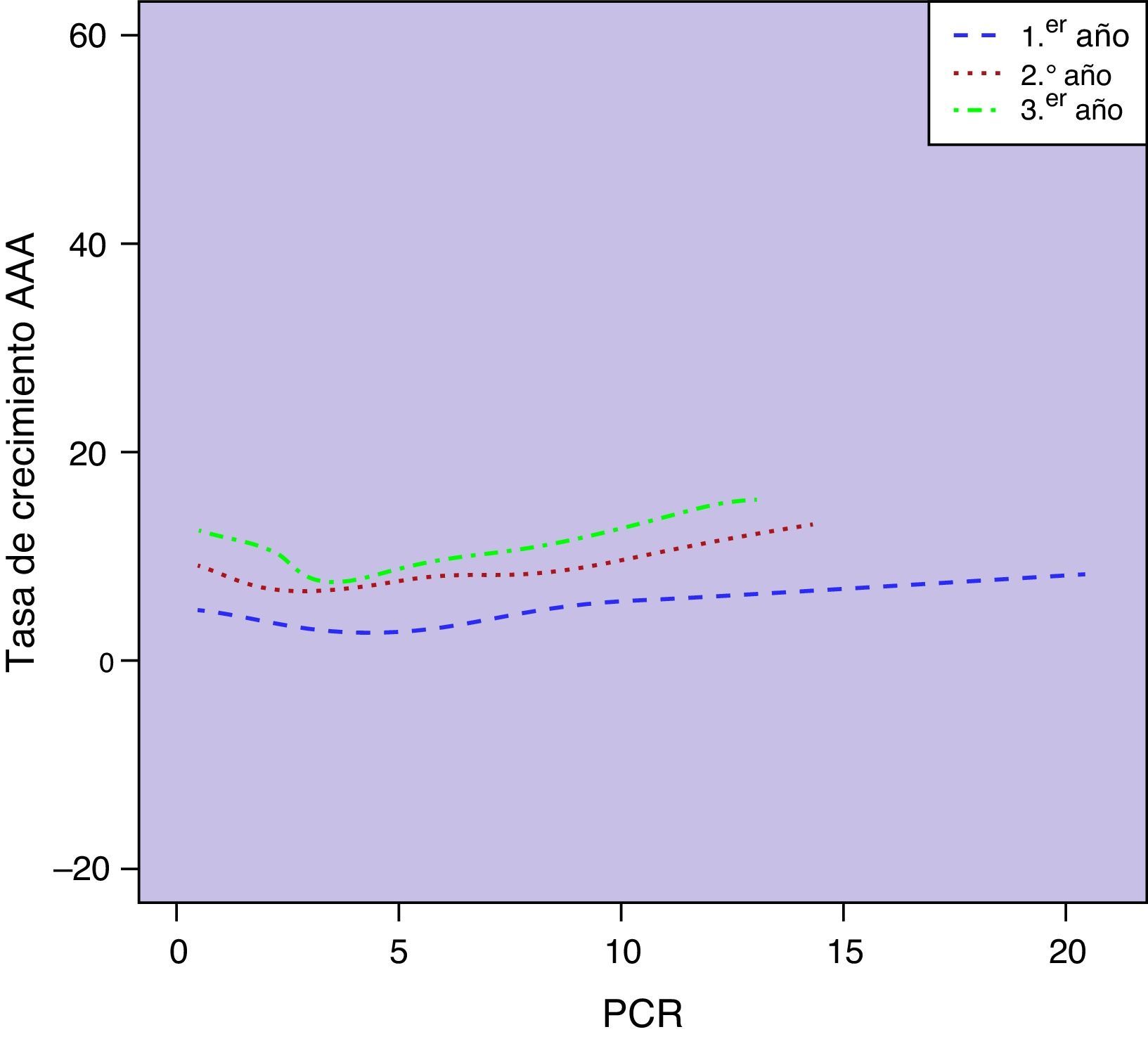
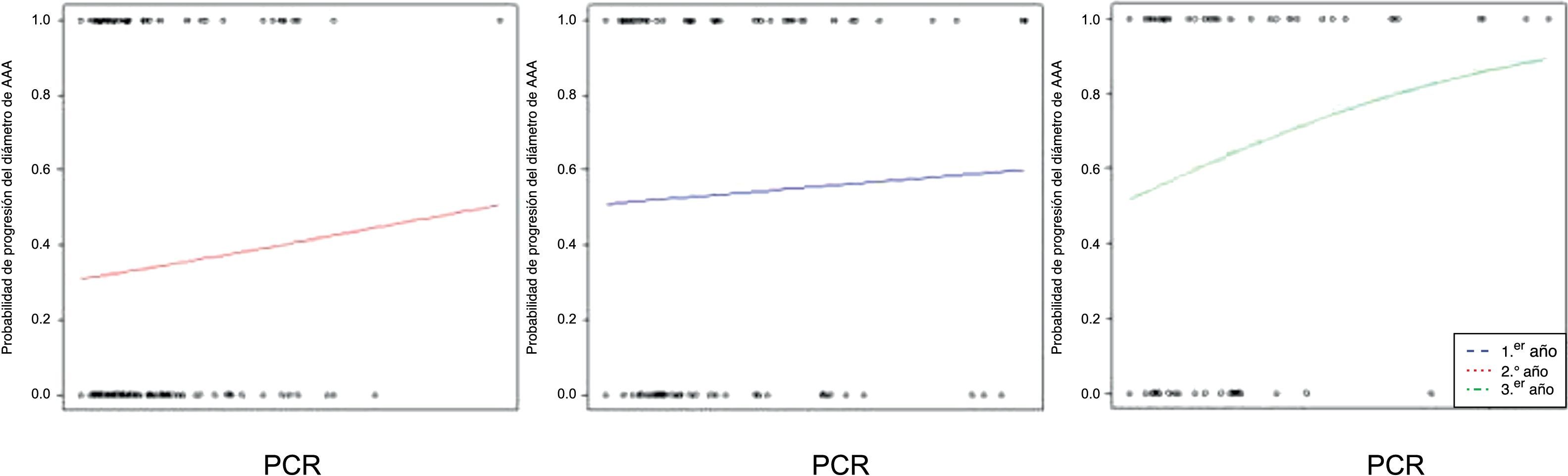
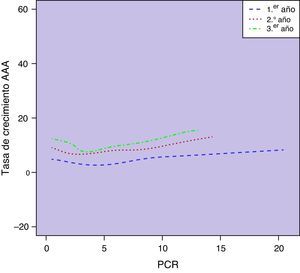
Observamos una correlación significativa entre los niveles basales de PCR y el diámetro aórtico basal (r=0,23; p=0,001). Esta asociación entre las concentraciones circulantes de PCR y el diámetro de los AAA se mantenía a lo largo de los sucesivos controles de seguimiento (p<0,0001) (fig. 3). No encontramos una asociación estadísticamente significativa entre las concentraciones plasmáticas de PCR y las tasas de crecimiento aórtico registradas como variable continua a lo largo del seguimiento (p=0,10) (fig. 4). Sin embargo, clasificado el crecimiento aórtico como variable dicotómica, observamos que concentraciones crecientes de PCR se asociaban a la progresión de los AAA (OR=1,008; IC 95% 1,000-1,016; p=0,04) (fig. 5).
La historia natural de los AAA se dirige hacia el crecimiento progresivo, con eventual rotura, pero lo realizan de forma irregular, con un crecimiento discontinuo que alterna periodos de expansión y de quiescencia, de duración variable e impredecible21. Aneurismas con el mismo diámetro pueden presentar niveles de actividad muy diferentes. De momento, las decisiones de manejo de cada paciente se basan en el diámetro máximo del AAA en cada control. Tener información fiable sobre la actividad subyacente en la pared aórtica en tiempo real podría ayudar a individualizar las decisiones y aumentar su eficacia y coste-efectividad. Para ello se busca en los últimos años un biomarcador que refleje la actividad inflamatoria y proteolítica de la pared aórtica aneurismática.
Un biomarcador ideal debe tener una relación causal con la enfermedad que señala, ser específico, debería estar implicado en todas las vías fisiopatológicas y reflejar la severidad de la enfermedad, su progresión, o ambas22. Además, debería ser rápido, simple de cuantificar y estable. La PCR plasmática es muy estable, tiene una larga vida media y mínima variación circadiana. Su cuantificación es fácil y barata y ya ha demostrado fiabilidad como marcador inflamatorio y de riesgo cardiovascular5–11. Así, está en estudio para verificar su papel en la evolución de los AAA. Hasta el momento, diferentes estudios publicados han obtenido resultados heterogéneos. Parece consistente una elevación de las concentraciones plasmáticas de PCR en pacientes con AAA respecto de sujetos control y la asociación entre dichas concentraciones y el diámetro de los AAA12–15,23,24. Sin embargo, no está claro si la elevación de PCR es inespecífica o reactiva, y aún no se ha demostrado una asociación consistente con la expansión o el riesgo de rotura de los AAA. En nuestro estudio confirmamos que las concentraciones plasmáticas de PCR mantienen una asociación con el diámetro máximo del AAA consistente a lo largo del seguimiento, lo que valida los hallazgos de grupos precedentes. Dichas concentraciones tienden a relacionarse con el crecimiento prospectivo de los AAA, medido como variable continua, pero sin alcanzar significación estadística. Esta asociación con el crecimiento aneurismático queda más en evidencia al codificar la variable de forma dicotómica, de manera que niveles crecientes de PCR marcan una mayor probabilidad de progresión de los AAA a lo largo de su seguimiento. Esta clasificación dicotómica de la evolución de los AAA resulta más intuitiva y potencialmente permite una aplicación clínica más directa que la medida continua del crecimiento aórtico. Los niveles elevados de PCR reflejan una actividad inflamatoria crónica de bajo grado inherente a la fisiopatología del AAA. Es de suponer que mayores concentraciones serán consecuencia de una mayor actividad y que esta se asocie a progresión de la enfermedad.
Existen 2 importantes limitaciones de nuestro estudio que obligan a interpretar los resultados obtenidos con precaución. El primero es un tamaño muestral limitado. Establecer una proteína como biomarcador exige confirmar los hallazgos en grandes muestras poblacionales. Los hallazgos de diferentes grupos de investigación contribuyen a identificar y enfocar las proteínas más prometedoras en el avance de la búsqueda pero el establecimiento definitivo de una como biomarcador fiable requiere de estudios poblacionales de confirmación a gran escala. La segunda limitación es la utilización tanto de la ecografía como de la TAC para la medición de los diámetros aórticos de los pacientes, mezclando las medidas de uno y otra en los análisis estadísticos. Nuestros protocolos de seguimiento de los AAA, detallados en la sección de métodos, están muy generalizados en la práctica clínica habitual, con seguimiento ecográfico de los AAA más pequeños, y tomográfico de aquellos con tamaños más cercanos al umbral quirúrgico. Realizar TAC en todos los pacientes en cada revisión, buscando la exactitud en las mediciones, sería difícil de justificar desde el punto de vista económico y ético, teniendo en cuenta la radiación acumulada a la que someteríamos a los pacientes. Además, en el consentimiento informado que firmaban los pacientes a su entrada en el estudio, se aseguraba que no verían modificado su plan de seguimiento ni las indicaciones intervencionistas de su enfermedad por el hecho de aceptar participar en la investigación. La ecografía conlleva un error en la medición del diámetro aórtico de ±2mm respecto de la TAC25. Así lo confirmamos en nuestro centro al iniciar esta línea de investigación. Teniendo en cuenta esta potencial variabilidad, diseñamos los análisis adicionales con el crecimiento aneurismático clasificado como variable dicotómica, con estabilidad definida como diferencia de diámetros ≤ 2mm/año y progresión para >2mm/año. Estas precauciones nos dan confianza en la validez y reproducibilidad de nuestros hallazgos.
ConclusionesLas concentraciones plasmáticas de PCR mantienen una asociacio¿n con el diámetro aneurismático a lo largo del seguimiento y se relacionan con la progresio¿n de los AAA. Los resultados obtenidos en nuestro estudio ofrecen nuevos datos en la valoración de la PCR como potencial biomarcador de la historia natural de los AAA. Deben ser validados por otras series y otras poblaciones, y, eventualmente, sería necesario definir un punto de corte fiable que poder aplicar en la práctica clínica habitual.
Responsabilidades éticasDerecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores quieren agradecer a los Dres. N. de la Fuente, B. Viviens, E. Bravo, R. Gómez y C. Casco del Servicio de Angiología y Cirugía Vascular del Hospital de Galdakao-Usansolo su ayuda en la recogida de datos y al Departamento de Sanidad del Gobierno Vasco y a la Unión Europea por las becas recibidas (N° Exp. 2008111019 y HEALTH F2-2008-200647) para la realización de este trabajo de investigación.