1) Analizar el riesgo de muerte, complicaciones y estancia hospitalaria en pacientes tratados mediante reparación endovascular (REV) y abierta (RA) de aneurisma de aorta abdominal roto (AAAr). 2) Comparar la precisión de distintos modelos de riesgo. 3) Identificar variables predictoras del resultado.
Material y métodosEstudio multicéntrico y retrospectivo de 167 pacientes consecutivos intervenidos por AAAr (RA: 122; REV: 45), desde 2005 a 2011. Determinaciones/variables: preoperatorias, intraoperatorias y postoperatorias. Análisis estadístico: descriptivo y univariable de variables preoperatorias e intraoperatorias agrupadas en función de las variables de desenlace; comparación entre modelos (concordance statistic); curvas receptor-operador (ROC) y área bajo la curva (AUC); análisis multivariable de variables preoperatorias e intraoperatorias y regresión logística.
ResultadosLa tasa de mortalidad precoz resultó del 53,3% en el grupo RA frente a 37,8% en el grupo REV (p=0,08). La precisión (AUC) para cada modelo de riesgo fue: Glasgow Aneurysm Scale (GAS) (0,77), Edinburgh Ruptured Aneurysm Score (ERAS) (0,66), Vascular Biochemistry and Haematology Outcome Models (VBHOM) (0,63), Early Post Acute Stroke Seizures (EPASS) (0,50), Hardman index (HARDMAN) (0,71) para el grupo RA y GAS (0,68), ERAS (0,55), VBHOM (0,50), EPASS (0,61), HARDMAN (0,51) para el grupo REV. El análisis univariante identificó como variables con mayor poder predictivo: creatinina, diuresis, transfusión de plaquetas, plasma, hipotensión, dopaminérgicos y complicaciones cardiorrespiratorias, renales e infecciosas. El análisis de regresión logística permitió elaborar un modelo predictivo mixto (RA-REV) de riesgo de muerte precoz (<30 días) con las siguientes variables: creatinina (OR=1,02/0,1mg), administración de dopaminérgicos (OR=2,901) y transfusión de plasma (OR=1,321/unidad).
ConclusionesSe observa mejor predicción del riesgo de mortalidad de los modelos en cirugía abierta que en el tratamiento endovascular. Son necesarios nuevos modelos que incorporen variables intraoperatorias y modelos mixtos que permitan identificar factores modificables tanto en cirugía abierta como endovascular.
1. To analyze the risk of death, complications and in-hospital stay in patients undergoing endovascular aneurysm repair (EVAR) and open repair (OR) of ruptured abdominal aortic aneurysms (RAAA). 2. To compare the accuracy of several risk-scoring models. 3. To identify predictors of outcomes.
Material and methodsA multicenter and retrospective study was conducted on 167 consecutive patients who had RAAA (45 EVAR and 122 OR) performed between 2005 and 2011. The following parameters were determined: Preoperative, intraoperative, and postoperative parameters were analyzed. Statistical analysis: descriptive and univariate analysis of preoperative and intraoperative variables grouped according to the outcome variables; comparison between models (Concordance statistic); receiver operator curves (ROC) and area under the curve (AUC); multivariate analysis of preoperative and intraoperative variables and logistic regression.
ResultsThe early mortality rate was 53.3% in the OR group versus 37.8% in the EVAR group (P=.08). The accuracy (AUC) for each model was: Glasgow Aneurysm Scale (GAS) (0.77), Edinburgh Ruptured Aneurysm Score (ERAS) (0.66), Vascular Biochemistry and Haematology Outcome Models (VBHOM) (0.63), Early Post Acute Stroke Seizures (EPASS) (0.50), Hardman index (0.71) for OR group, and GAS (0.68), ERAS (0.55), VBHOM (0.50), EPASS (0.61), Hardman index (0.51) for the EVAR group, respectively. Multivariate analysis of variables identified with greater predictive power included: creatinine, urine output, platelets and plasma transfusion, hypotension, dopamine and cardiorespiratory, renal, and infectious complications. Logistic regression analysis enabled a combined model to be designed (OR-EVAR) predictive model of early death (<30 days) based on the following variables: creatinine (OR=1.02/0.1mg), dopaminergic drugs (OR=2.901), and transfusion of plasma units (OR=1.321/unit).
ConclusionsBetter prediction of mortality risk models was observed in open surgery compared to that in the endovascular group. New models incorporating intraoperative variables and mixed models should be developed to identify modifiable factors in both open and endovascular surgery.
El aneurisma de aorta abdominal roto (AAAr) es una enfermedad frecuentemente fatal y conlleva la muerte de al menos 45 personas por cada 100.000 habitantes. El tratamiento quirúrgico se asocia con una elevada mortalidad y la evidencia que sugiere una mejora en el resultado con el tiempo es inconsistente, dada una gran variación interhospitalaria y entre países1.
La reparación quirúrgica continúa planteando una serie de desafíos tanto técnicos como éticos, el más difícil de los cuales es la selección del paciente para el tratamiento más adecuado. Desde un planteamiento teórico, la disyuntiva se presenta entre 3 opciones posibles: reparación endovascular, cirugía abierta o abstención terapéutica. Sin embargo, cada vez más, se realiza un enfoque selectivo a la hora de plantear un tratamiento ante un AAAr, ello implica una evaluación de los predictores de riesgo operatorio y de las comorbilidades para identificar a los pacientes con escasas expectativas reales de un resultado exitoso. El objetivo es garantizar una utilización responsable de los recursos sanitarios, en términos de coste-eficacia, y evitar intentos inútiles de intervención en pacientes con riesgo prohibitivo. Habitualmente, esta selección de los pacientes se basa en criterios subjetivos. Sin embargo, para asegurar que la selección sea objetiva, es fundamental un sistema que pueda predecir con la mayor precisión posible el resultado en los pacientes con AAAr.
Hasta la fecha, se han diseñado una serie de modelos de predicción preoperatoria del tratamiento de la enfermedad aneurismática de la aorta abdominal cuya validez sigue en evaluación. Existe mucha heterogeneidad en la naturaleza y calidad de los resultados y métodos utilizados para la presentación de resultados. Muy pocas series han ido más allá y han realizado la modelización estadística de las variables predictivas para diseñar sistemas de puntuación que puedan pronosticar el resultado.
En el particular contexto de la cirugía urgente de los AAAr, el desarrollo de la tecnología endovascular para el tratamiento de los aneurismas y la incorporación de esta misma técnica al escenario urgente han promovido la incursión de los estudios de predicción del riesgo operatorio en estas circunstancias del tratamiento de la aorta abdominal.
El presente estudio compara la precisión de distintos modelos de predicción del riesgo de muerte en pacientes tratados mediante reparación de AAAr, tanto por técnica abierta como endovascular. El objetivo final del mismo no es tanto el de valorar la utilidad predictiva de modelos individuales, o el de un modelo mixto que funcionara en ambas situaciones, sino el de identificar aquellas variables (pre-, intra- y postoperatorias) relacionadas con el resultado y, por tanto, a las que se debería prestar más atención para mejorarlo.
Pacientes y métodosSe trata de un proyecto coordinado multicéntrico en el que participaron 4 hospitales terciarios españoles: el hospital Universitari i Politècnic La Fe de Valencia, el hospital Universitari Son Espases de Mallorca, el hospital Universitari de Bellvitge de Barcelona y el hospital Universitario 12 de Octubre de Madrid. Se realizó una revisión retrospectiva de todos los pacientes consecutivos tratados mediante reparación endovascular (REV) o reparación abierta (RA) de AAAr, desde enero del 2005 hasta mayo del 2011. En total, se incluyó a 167 pacientes, de ellos 122 fueron intervenidos mediante RA, los otros 45 se trataron mediante REV. Dado que se realizó un análisis por intención de tratar, no se incluyeron en el estudio: los casos de muerte intraoperatoria previa al pinzamiento aórtico, los aneurismas yuxta- y suprarrenales, los aneurismas infecciosos o inflamatorios ni tampoco los casos con pérdida de los registros intraoperatorios. Un investigador distinto en cada uno de los centro recogió los datos de cada paciente a partir de la historia clínica, estudios radiológicos, registros operatorios y gráficas de anestesia. Las variables estudiadas (tabla 1) fueron preoperatorias (características demográficas, antecedentes patológicos categorizados, parámetros analíticos, estado hemodinámico); intraoperatorias (diuresis, sangrado estimado, administración de hemoderivados, fluidos y fármacos) y postoperatorias (mortalidad precoz a 30 días, complicaciones mayores y menores y estancia hospitalaria). Por último, se aplicaron en ambos grupos de tratamiento, las escalas de riesgo predictoras de mortalidad para pacientes con AAAr: Glasgow Aneurysm Score (GAS), Edinburgh Ruptured Aneurysm Score (ERAS), Vascular Biochemistry and Haematology Outcome Models (VBHOM), Estimation of physiologicability and surgical stress (E-PASS) e índice Hardman.
Variables de estudio
| Variables dependientes |
| Mortalidad |
| Precoz (<30 días) |
| Mortalidad relacionada con el aneurisma: |
| - 30 días del procedimiento primario |
| - Muerte debida a rotura |
| - 30 días al mes que sigue a un tratamiento secundario |
| Morbilidad. Complicaciones mayores postoperatorias: |
| 1. Fracaso multiorgánico |
| 2. Complicaciones respiratorias: insuficiencia respiratoria (SatO2 basal < 90%), atelectasia, derrame pleural, neumonía, distrés respiratorio |
| 3. Complicaciones cardíacas: cambios electrocardiográficos típicos, elevación de troponina I > 0,20μg/l o CK-MB > 0,5μg/l, síntomas que requieran intervención médica; insuficiencia cardíaca congestiva; arritmia: fibrilación auricular, bloqueo AV |
| 4. Complicaciones renales: insuficiencia renal (creatinina plasmática > 1, 5 mg/100 ml o incremento >20% sobre valores preoperatorios, hospitalización prolongada, diálisis) |
| 5. Complicaciones neurológicas: ACV confirmado por TC, AIT, isquemia medular transitoria o déficit permanente |
| 6. Complicaciones intestinales: isquemia intestinal, obstrucción intestinal, peritonitis, íleo paralítico prolongado con requerimientos de NPT > 5 días, sangrado digestivo que requiera intervención quirúrgica o endoscópica |
| 7. Complicaciones infecciosas: sepsis o infección documentada con disfunción de un órgano |
| 8. Enfermedad tromboembólica: trombosis venosa profunda, trombosis protésica precoz, trombosis arterial |
| 9. Complicaciones hemorrágicas: coagulopatía que requiera transfusión, sangrado que requiera reintervención |
| 10. Complicaciones locales: evisceración, hematoma, infección de herida quirúrgica, serosa/linfocele, dehiscencia, pseudoaneurisma |
| 11. Endovasculares: endofuga (tipos 1, 2, 3), migración, crecimiento del aneurisma, conversión a cirugía abierta, rotura, oclusión de rama o cuerpo de endoprótesis |
| 12. Estancia hospitalaria |
| Estancia en UCI mayor a 5 días |
| Estancia hospitalaria total |
| Variables independientes |
| Variables preoperatorias: |
| 1. Edad |
| 2. Sexo |
| 3. Riesgo anestésico según clasificación (ASA) |
| 4. Coronariopatía (angina, IAM, insuficiencia cardíaca congestiva, arritmia, revascularización coronaria previa) |
| 5. Hipertensión arterial medicación para control de la tensión o tensión arterial >160/95 mmHg, |
| 6. Accidente vascular cerebral (AVC): historia de ictus o de accidentes isquémicos transitorios |
| 7. Insuficiencia renal: criterios GAS, historia de episodio agudo o IR crónica o Cr > 150μmol/l o urea > 20 mmol/l (7.° informe del Joint National Committee considera a la microalbuminuria y al FG estimado < 60 ml/min/1,73 m2 como factores de riesgo CV de primer orden) |
| 8. Creatinina plasmática (mmol/l) |
| 9. Aclaramiento de creatinina |
| 10. Urea y electrolitos (mmol/l) |
| 11. Antecedentes previos de revascularización arterial o de amputación: historia de revascularización quirúrgica o endovascular o de amputación de miembros inferiores |
| 12. Tabaquismo: tabaquismo activo o consumo en los 5 años previos |
| 13. Enfermedad pulmonar: asma o enfermedad pulmonar obstructiva crónica |
| 14. Diabetes mellitus, hiperglucemia que precisa dieta, medicación oral o tratamiento con insulina |
| 15. Hiperlipidemia: concentración sérica de colesterol > 6,5 mmol/l o de triglicéridos > 2,03 mmol/l |
| 16. Leucocitos (recuento plasmático) |
| 17. Hemoglobina preoperatoria (mg/l) |
| 18. Hematocrito (%) |
| 19. Equilibrio ácido-base (pH, HCO3-) |
| 20. Shock |
| 21. Rotura intraperitoneal |
| 22. Diámetro máximo del aneurisma (mm) |
| 23. Diámetro máximo del cuello (mm) |
| 24. Longitud del cuello (mm) |
| 25. Trombosis del cuello > 180° de su circunferencia |
| 26. Calcificación del cuello > 180° de su circunferencia |
| 27. Angulación mayor de 60° del cuello |
| 28. Anatomía de ilíacas no adecuada para EVAR |
| Variables intraoperatorias: |
| 1. Pérdida estimada de sangre (ml) |
| 2. Transfusión de sangre, plaquetas y plasma (unidades) |
| 3. Cristaloides (ml) |
| 4. Inotropos |
| 5. Hipotensión mantenida |
| 6. Arritmia |
| 7. Alteración del ST |
| 8. Diuresis intraoperatoria (ml) |
| 9. Tiempo quirúrgico (min) |
| 10. Localización del pinzamiento |
| 11. Tiempo total de pinzamiento supra- e infrarrenal (ml) |
| 12. Tipo de prótesis |
| 13. Anclaje proximal y distal (EVAR) |
| 14. Anastomosis distal |
| 15. Betabloqueantes |
| 16. Halogenados |
| 17. Dopaminérgicos |
ACV: accidente vascular cerebral; AIT: accidente isquémico transitorio; ASA: sociedad americana de anestesiología; AV: accidente vascular; Cr: creatinina; CV: cardiovascular; EVAR: endovascular aneurysm repair; GAS: Glasgow Aneurysm Scale; IAM: infarto agudo de miocardio; IR: insuficiencia renal; NPT: nutrición parenteral total; TC: tomografía computerizada.
En el análisis estadístico se realizaron los siguientes cálculos: 1) Análisis univariable de variables pre- e intraoperatorias mediante comparación de medias (prueba T) y análisis de contingencias (Chi-cuadrado) de variables categóricas agrupadas en función de las variables de desenlace para los distintos grupos. 2) Comparación entre modelos: Se comparó su precisión en ambos grupos mediante el cálculo de las curvas receptor-operador (ROC) y del área bajo la curva (AUC). Sensibilidad y especificidad. 3) Análisis multivariable de variables pre- e intraoperatorias; regresión logística considerando el suceso muerte como variable dependiente.
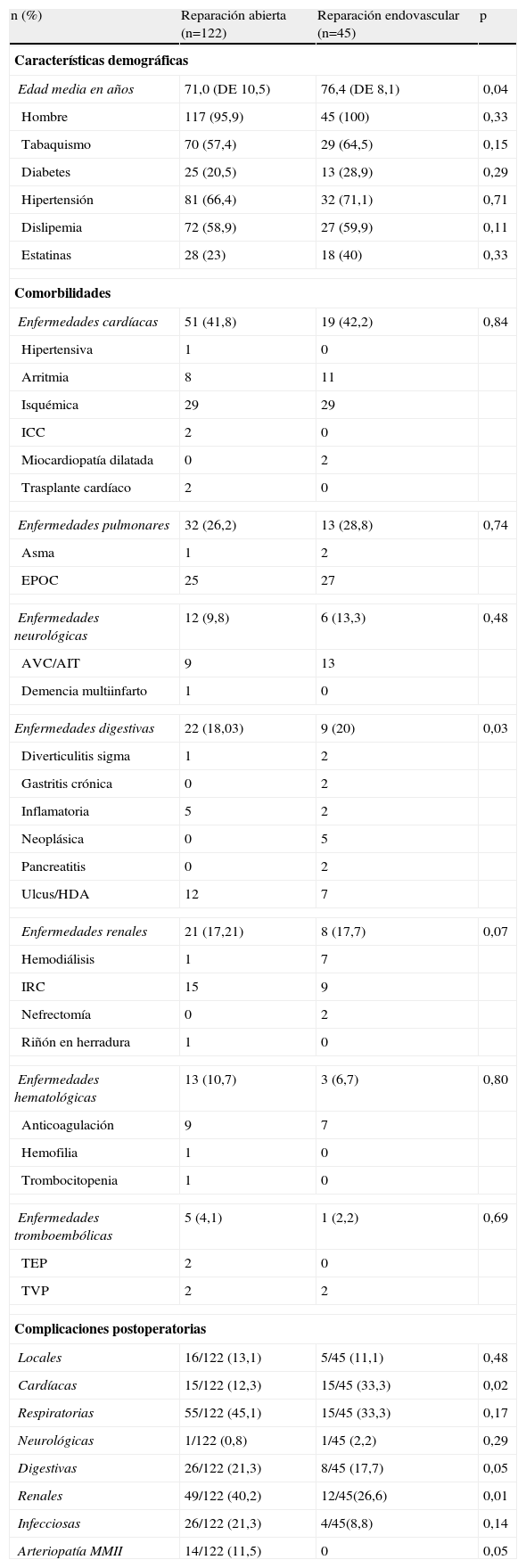
ResultadosLas características demográficas de los pacientes (tabla 2) eran similares en ambos grupos de estudio. Del total, 162 (97,01%) eran hombres, 117 en el grupo RA y 45 en el grupo REV. Se encontró diferencia estadísticamente significativa en la edad de los pacientes, con una media de edad total de 71 años (DE 10,5) en el grupo RA frente a 76,4 años (DE 8,1) en el grupo REV.
Características demográficas, comorbilidades detalladas y complicaciones postoperatorias de los pacientes de estudio
| n (%) | Reparación abierta (n=122) | Reparación endovascular (n=45) | p |
| Características demográficas | |||
| Edad media en años | 71,0 (DE 10,5) | 76,4 (DE 8,1) | 0,04 |
| Hombre | 117 (95,9) | 45 (100) | 0,33 |
| Tabaquismo | 70 (57,4) | 29 (64,5) | 0,15 |
| Diabetes | 25 (20,5) | 13 (28,9) | 0,29 |
| Hipertensión | 81 (66,4) | 32 (71,1) | 0,71 |
| Dislipemia | 72 (58,9) | 27 (59,9) | 0,11 |
| Estatinas | 28 (23) | 18 (40) | 0,33 |
| Comorbilidades | |||
| Enfermedades cardíacas | 51 (41,8) | 19 (42,2) | 0,84 |
| Hipertensiva | 1 | 0 | |
| Arritmia | 8 | 11 | |
| Isquémica | 29 | 29 | |
| ICC | 2 | 0 | |
| Miocardiopatía dilatada | 0 | 2 | |
| Trasplante cardíaco | 2 | 0 | |
| Enfermedades pulmonares | 32 (26,2) | 13 (28,8) | 0,74 |
| Asma | 1 | 2 | |
| EPOC | 25 | 27 | |
| Enfermedades neurológicas | 12 (9,8) | 6 (13,3) | 0,48 |
| AVC/AIT | 9 | 13 | |
| Demencia multiinfarto | 1 | 0 | |
| Enfermedades digestivas | 22 (18,03) | 9 (20) | 0,03 |
| Diverticulitis sigma | 1 | 2 | |
| Gastritis crónica | 0 | 2 | |
| Inflamatoria | 5 | 2 | |
| Neoplásica | 0 | 5 | |
| Pancreatitis | 0 | 2 | |
| Ulcus/HDA | 12 | 7 | |
| Enfermedades renales | 21 (17,21) | 8 (17,7) | 0,07 |
| Hemodiálisis | 1 | 7 | |
| IRC | 15 | 9 | |
| Nefrectomía | 0 | 2 | |
| Riñón en herradura | 1 | 0 | |
| Enfermedades hematológicas | 13 (10,7) | 3 (6,7) | 0,80 |
| Anticoagulación | 9 | 7 | |
| Hemofilia | 1 | 0 | |
| Trombocitopenia | 1 | 0 | |
| Enfermedades tromboembólicas | 5 (4,1) | 1 (2,2) | 0,69 |
| TEP | 2 | 0 | |
| TVP | 2 | 2 | |
| Complicaciones postoperatorias | |||
| Locales | 16/122 (13,1) | 5/45 (11,1) | 0,48 |
| Cardíacas | 15/122 (12,3) | 15/45 (33,3) | 0,02 |
| Respiratorias | 55/122 (45,1) | 15/45 (33,3) | 0,17 |
| Neurológicas | 1/122 (0,8) | 1/45 (2,2) | 0,29 |
| Digestivas | 26/122 (21,3) | 8/45 (17,7) | 0,05 |
| Renales | 49/122 (40,2) | 12/45(26,6) | 0,01 |
| Infecciosas | 26/122 (21,3) | 4/45(8,8) | 0,14 |
| Arteriopatía MMII | 14/122 (11,5) | 0 | 0,05 |
AVC/AIT: accidente vascular cerebral/accidente isquémico transitorio; EPOC: enfermedad pulmonar obstructiva crónica; ICC: insuficiencia cardíaca congestiva; IRC: insuficiencia renal crónica; TEP: tromboembolismo pulmonar; TVP: trombosis venosa profunda; Ulcus/HDA: ulcus/hemorragia digestiva alta.
En la tabla 2 se detallan las principales comorbilidades de los pacientes, que resultaron similares en ambos grupos, a excepción de las diferencias observadas en cuanto a la presencia de antecedentes de enfermedades digestivas y de arteriopatía periférica, ambas con una mayor prevalencia en el grupo REV (20 y 6,7% respectivamente, frente a 18,03 y 0,8% en el grupo RA). Se observaron similares prevalencias en cuanto a enfermedades cardíacas, pulmonares, neurológicas, hematológicas, renales y antecedentes tromboembólicos. Se registró una mayor prevalencia de úlcera gastroduodenal con antecedente de hemorragia digestiva alta en el grupo REV (3/45) frente al grupo RA (15/122). Del mismo modo, se encontró una mayor prevalencia de arteriopatía periférica, con un mayor número de pacientes con claudicación intermitente en el grupo REV (3/45) en comparación con el grupo RA (0/122).
En las variables preoperatorias relacionadas con el estado hemodinámico de los pacientes, tales como hemoglobina media, hematocrito medio y tensión arterial sistólica media, no se encontraron diferencias en ambos grupos de tratamiento.
Tampoco se encontraron diferencias en cuanto a datos analíticos bioquímicos, del hemograma y de la gasometría preoperatorios, a excepción de una diferencia significativa en el tiempo de protrombina, con un valor medio de 71,7% (DE 26,5) en el grupo RA frente a un 41,6% (DE 42,3) en el REV (p<0,001).
En cuanto a las variables intraoperatorias estudiadas, se encontraron diferencias en ambos grupos de tratamiento en el número de unidades transfundidas, con una media de 9,4 (DE 6,7) unidades de concentrados de hematíes en el grupo de RA, frente a 3,2 (DE 4,1) unidades en el grupo REV. Del mismo modo, se encontraron diferencias en el número de concentrados de plasma transfundidos, con una media de 3,2 unidades en el grupo RA y de 0,95 en el grupo REV. No se hallaron diferencias en la transfusión de plaquetas en ambos grupos de tratamiento. También se encontraron diferencias en la cantidad media de cristaloides administrados a nivel intraoperatorio (3.792,1cc [DE 2.634,2] en el grupo RA frente a 1.632,4cc [DE 1.191,9] en el grupo REV; p<0,001) y en la diuresis media intraoperatoria (632,7cc [DE 675,1] en el grupo RA frente a 339,1cc [DE 340,5] en el grupo REV; p=0,04).
Entre las variables postoperatorias, hubo diferencia en cuanto al acontecimiento de complicaciones cardíacas, digestivas, renales e isquémicas de extremidades inferiores (tabla 2). En el grupo RA, se registró una menor incidencia de infarto agudo de miocardio (1,6%), comparado con el grupo REV (11,1%; p=0,03). En cuanto a las complicaciones digestivas, se observó una incidencia de íleo paralítico de 8,8 frente a 2,2% en el grupo REV (p=0,05). Sin embargo, el síndrome compartimental tuvo una mayor incidencia en el grupo REV (8,9% frente a 0 en grupo RA; p=0,05). El fracaso renal agudo postoperatorio fue mayor en el grupo RA, con una incidencia del 33,6%, frente al 11,1% del grupo REV (p=0,01); aunque la necesidad de hemodiálisis fue mayor en el grupo endovascular (RA: 4,9 frente a REV: 15,6%; p=0,01). En el grupo RA hubo una incidencia del 4,1% de embolización distal en extremidades inferiores y del 7,4% de trombosis arterial y en el grupo de tratamiento endovascular no hubo ningún caso con estas complicaciones (p=0,05).
La tasa de reintervención en el grupo RA fue de cero, frente al 9,8% en el grupo REV, ya que 4 casos fueron reoperados. La estancia media hospitalaria global así como en la unidad de cuidados intensivos (UCI) fue menor en el grupo de tratamiento endovascular, con una media de 11,3 (DE 12,1) días de estancia media global y de 6,6 (DE 11,9) días de estancia en UCI, frente a los 15,8 (DE 24,4) días y 8,9 (DE 20,8) días respectivamente, en el grupo RA (p=0,10). Se identificaron 77 supervivientes > 30 días, 51 en el grupo RA y 26 en el de REV. La estancia media de los pacientes supervivientes >30 días fue de 25,2 días (DE 27,7) para el grupo de reparación abierta y de 11,3 días (DE 7,4) para el grupo REV (p=0,014).
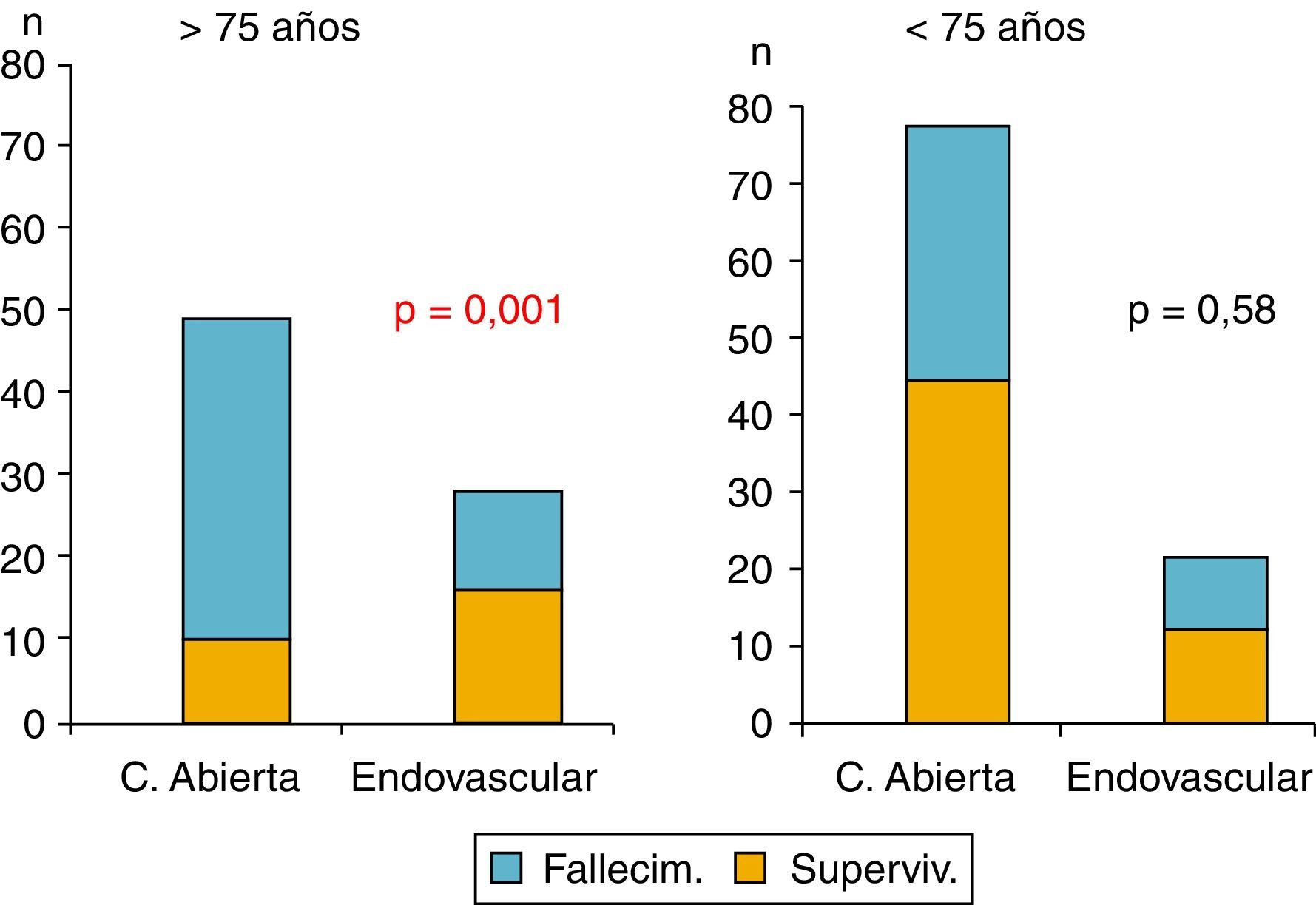
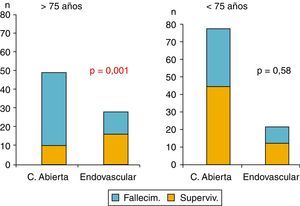
En cuanto al estudio de la mortalidad a 30 días, aunque hubo diferencias, no fueron estadísticamente significativas. La mortalidad a 30 días en el grupo RA fue del 53,3%, frente al 37,8% del grupo REV (p=0,08). Sin embargo, sí se encontró significación estadística al comparar la mortalidad en función del grupo de edad, siendo esta mayor en pacientes con edad superior a 75 años (68,5%) que en los más jóvenes (42,6%). Por otra parte, aunque esta fue similar en el grupo de RA (42,7%) y REV (42,6%) en los pacientes con edad <75 años, se registró una mortalidad significativamente mayor entre los pacientes de edad >75 años tratados mediante RA (83%) que en los que se realizó REV (42,3%; p<0,001) (fig. 1).
En el grupo RA, el análisis univariable identificó las siguientes variables con mayor poder predictivo: edad, urea, creatinina, sodio, plaquetas, tiempo de protrombina y tensión arterial sistólica preoperatorios; pérdidas hemáticas, shock, hemoperitoneo y autotranfusión, como variables predictoras intraoperatorias; como predictoras postoperatorias: complicaciones respiratorias, digestivas, infecciosas y locales. En el grupo REV, las variables predictoras de mortalidad fueron: creatinina y diuresis (preoperatorio); transfusión de plaquetas, de plasma, hipotensión mantenida y administración de dopaminérgicos (intraoperatorio); y complicaciones cardíacas, respiratorias, renal e infecciosas (postoperatorio) (tabla 3).
Variables preoperatorias, intraoperatorias y postoperatorias con mayor poder predictivo (análisis univariable)
| Supervivientes (n=51) | Fallecidos (n=71) | p | |
| Variables preoperatorias | |||
| Reparación abierta | |||
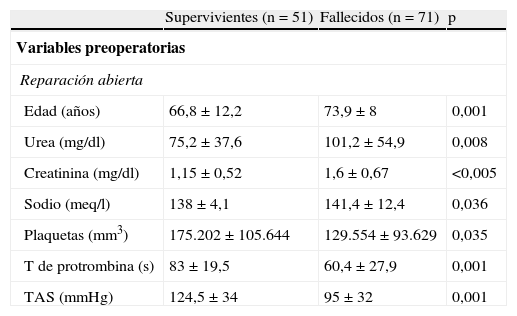
| Edad (años) | 66,8±12,2 | 73,9±8 | 0,001 |
| Urea (mg/dl) | 75,2±37,6 | 101,2±54,9 | 0,008 |
| Creatinina (mg/dl) | 1,15±0,52 | 1,6±0,67 | <0,005 |
| Sodio (meq/l) | 138±4,1 | 141,4±12,4 | 0,036 |
| Plaquetas (mm3) | 175.202±105.644 | 129.554±93.629 | 0,035 |
| T de protrombina (s) | 83±19,5 | 60,4±27,9 | 0,001 |
| TAS (mmHg) | 124,5±34 | 95±32 | 0,001 |
| Supervivientes (n=26) | Fallecidos (n=19) | p | |
| Reparación endovascular | |||
| Creatinina (mg/dl) | 1,04±0,32 | 2,00±1,45 | 0,003 |
| Diuresis (ml) | 492±376 | 144±140 | 0,005 |
| Supervivientes (n=51) | Fallecidos (n=71) | ||
| Variables intraoperatorias | |||
| Reparación abierta | |||
| Pérdidas hemáticas (ml) | 2.231±2.421 | 4.019±2.409 | 0,014 |
| Shock n (%) | 6/51 (11,8) | 30/71 (42,2) | <0,005 |
| Hemoperitoneo n (%) | 7/51 (13,7) | 27/71 (38) | 0,004 |
| Autotransfusión n (%) | 9/51 (17,6) | 0/71 (0) | <0,005 |
| Supervivientes (n=26) | Fallecidos (n=19) | ||
| Reparación endovascular n (%) | |||
| Transfusión de plaquetas | 2/21 (9,5) | 8/16 (0,5) | 0,035 |
| Transfusión de plasma | 3/21 (14,3) | 9/16 (56,2) | 0,05 |
| Hipotensión | 5/26 (19,2) | 8/19 (42,1) | 0,012 |
| Dopaminérgicos | 5/25 (20) | 9/19 (47,4) | 0,005 |
| Supervivientes (n=51) | Fallecidos (n=71) | ||
| Variables postoperatorias | |||
| Reparación abierta n (%) | |||
| Complicaciones respiratorias | 12/51 (23,1) | 29/71 (40,8) | 0,025 |
| Complicaciones digestivas | 2/51 (3,9) | 14/71 (19,7) | 0,006 |
| Complicaciones infecciosas | 4/51 (7,7) | 15/71 (21,1) | 0,004 |
| Complicaciones locales | 11/51 (21,6) | 5/71 (8,4) | 0,047 |
| Supervivientes (n=26) | Fallecidos (n=19) | ||
| Reparación endovascular n (%) | |||
| Complicaciones cardiológicas | 3/26 (11,5) | 12/19 (63,2) | 0,004 |
| Complicaciones respiratorias | 5/26 (19,2) | 10/19 (52,6) | 0,002 |
| Complicaciones renales | 3/26 (11,5) | 9/19 (47,4) | 0,003 |
| Complicaciones infecciosas | 0/26 (0) | 15/19 (79) | 0,026 |
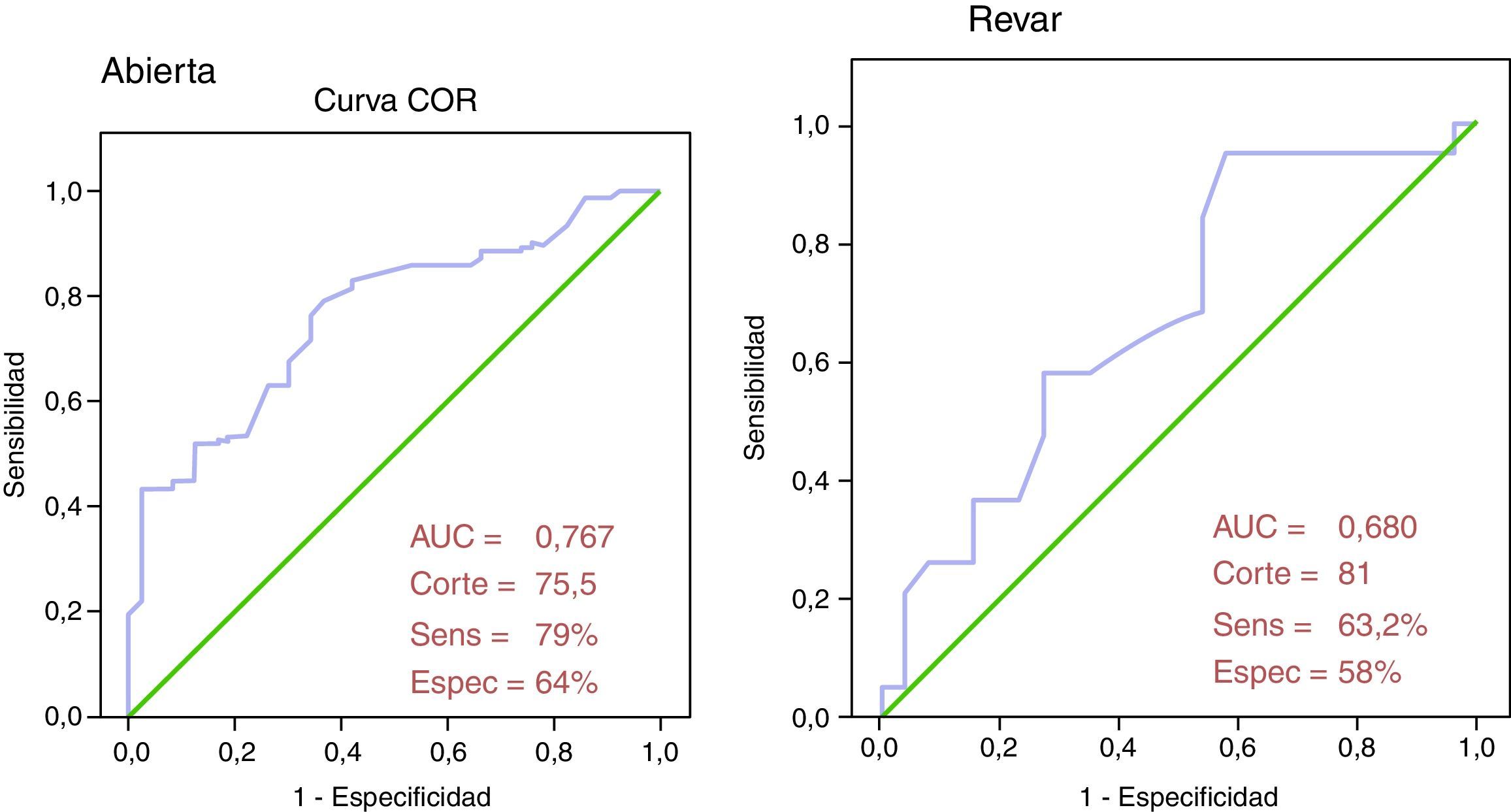
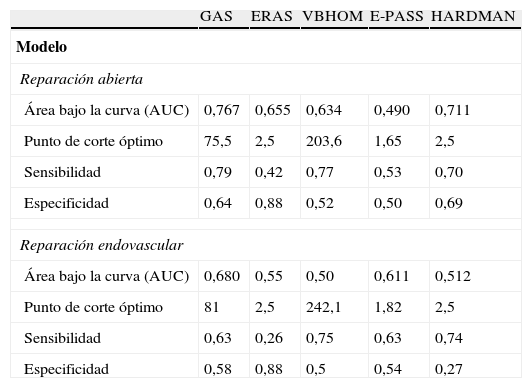
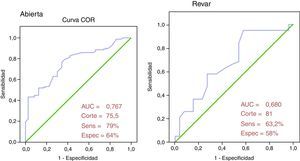
Análisis de los modelos de riesgo. La precisión de los distintos modelos predictores de riesgo, estimada a partir del AUC, sensibilidad y especificidad y los puntos de corte óptimos calculados a partir de las curvas ROC aparecen recogidos en la tabla 4. El modelo que presentó un mejor comportamiento predictivo, tanto en RA como en REV, fue el GAS (fig. 2).
Análisis de precisión en situación de RA y REV de los distintos modelos predictivos utilizados
| GAS | ERAS | VBHOM | E-PASS | HARDMAN | |
| Modelo | |||||
| Reparación abierta | |||||
| Área bajo la curva (AUC) | 0,767 | 0,655 | 0,634 | 0,490 | 0,711 |
| Punto de corte óptimo | 75,5 | 2,5 | 203,6 | 1,65 | 2,5 |
| Sensibilidad | 0,79 | 0,42 | 0,77 | 0,53 | 0,70 |
| Especificidad | 0,64 | 0,88 | 0,52 | 0,50 | 0,69 |
| Reparación endovascular | |||||
| Área bajo la curva (AUC) | 0,680 | 0,55 | 0,50 | 0,611 | 0,512 |
| Punto de corte óptimo | 81 | 2,5 | 242,1 | 1,82 | 2,5 |
| Sensibilidad | 0,63 | 0,26 | 0,75 | 0,63 | 0,74 |
| Especificidad | 0,58 | 0,88 | 0,5 | 0,54 | 0,27 |
Análisis multivariable (regresión logística). El análisis de regresión logística permitió elaborar un modelo predictivo mixto (RA-REV) de riesgo de muerte precoz (<30 días) con las siguientes variables: creatinina (OR=1,02/0,1mg), administración de dopaminérgicos (OR=2,901) y transfusión de plasma (OR=1,321/unidad). Este modelo permitió predecir el resultado con un 74,4% de clasificaciones correctas.
DiscusiónEl principal hallazgo de este estudio es la comprobación de un mayor ajuste de las actuales escalas de riesgo para la RA del AAAr frente a la REV. Esta última conlleva una reducción del insulto fisiológico2–4, ofrece un procedimiento menos invasivo para estos pacientes en situación vital grave y se ha aplicado con éxito en estas situaciones de urgencia5,6. El uso de la técnica endovascular para la reparación del AAA varía en todo el mundo, pero se ha demostrado que supone hasta el 80% de todas las intervenciones de AAA realizadas en los Estados Unidos7. A pesar de su uso generalizado en la mayoría de pacientes, todavía hay subgrupos en los que los beneficios de la REV no están claros y la interpretación de los resultados se ha visto limitada por el sesgo de selección y las restricciones anatómicas de la técnica endovascular7,8. Aunque en este estudio tan solo 45 (26,9%) de los casos fueron tratados mediante endoprótesis, el análisis de las características anatómicas del AAAr en la angio-TC (diámetro y longitud de cuello, a ilíacas y angulaciones) sugirió que al menos 72 (43,1%) habrían sido candidatos a REV según las indicaciones de los dispositivos comerciales habituales.
De forma similar a otras investigaciones previas, en el actual estudio se observó una menor tasa de mortalidad en el grupo tratado mediante técnica endovascular (37,8%), en comparación con el grupo RA (53,3%). Y analizando el subgrupo de pacientes mayores de 75 años, se demostró una supervivencia significativamente mayor en los pacientes tratados mediante REV (57,7%) frente a los tratados mediante RA (17%). De igual forma, la estancia media hospitalaria, así como en la UCI, resultó menor en el grupo REV. Otros investigadores también han demostrado la utilidad del desarrollo de un protocolo para REV. Con resultados similares al actual estudio, Aryay et al. demostraron una reducción de la mortalidad (39 vs. 59%) para AAAr después de la introducción de un protocolo REV con intención de tratar9. Mehta et al.10 mostraron una mortalidad del 18% para los pacientes tratados mediante REV solo. Un subanálisis de sus resultados globales mostró una mortalidad combinada para REV y RA del 35%. El grupo de Moore et al.8 demostró una tasa de mortalidad a 30 días del 17,9% en el grupo REV frente al 30,0% en el grupo de RA, tras la implantación de un protocolo para REV. Resultados de instituciones únicas muestran una mortalidad tras REV que oscila del 8 al 14%5,11–13.
En el tratamiento electivo de los AAA, existe suficiente evidencia de una mejoría en la supervivencia a corto plazo tras el tratamiento endovascular frente a la RA14,15. Sin embargo, en el escenario de los AAAr, el tratamiento aún sigue siendo controvertido en ausencia de evidencia suficiente basada en estudios controlados. Como hemos visto, los beneficios de la REV para pacientes con AAAr son apoyados por varios estudios observacionales que revelan una tendencia hacia la mejora de los resultados con este tratamiento, en comparación con la RA, hecho que se hace evidente con el aumento del establecimiento de protocolos de REV por varias instituciones en todo el mundo. Una reciente revisión sistemática16 reveló un sustancial beneficio en la supervivencia de la REV frente a la RA. Sin embargo, atendiendo a los ensayos aleatorizados actuales, el ensayo holandés Amsterdam Acute Aneurysm Trial17 (AJAX), que fue el primer estudio multicéntrico, aleatorizado y controlado que compara REV frente a RA en los AAAr, no demostró diferencias. De igual modo, recientemente, el estudio Immediate Management of the Patient with Rupture: Open Versus Endovascular repair aneurysm trial (IMPROVE) tampoco ha demostrado la reducción de la mortalidad a los 30 días ni del coste al utilizar la técnica endovascular18. Otro ensayo multicéntrico aleatorizado es el francés Ruptured Aorta-iliac Aneurysms: Endo vs. Surgery19 (ECAR) que se inició en enero de 2008, todavía en curso y pendiente de resultado.
En el actual estudio, todo el análisis de las variables preoperatorias, intraoperatorias y postoperatorias va enfocado a diseñar un modelo mixto de predicción de riesgo. Un modelo de predicción es una manera estandarizada y objetiva para evaluar los resultados individuales después de una intervención quirúrgica. Se han desarrollado varios modelos de predicción de muerte intrahospitalaria tras la reparación aórtica. El modelo de predicción más frecuentemente utilizado es el ya bien validado GAS, que fue desarrollado en 199420 y constituye el modelo de predicción de riesgo de referencia en pacientes tratados mediante la técnica convencional. Sin embargo, su utilidad en la REV no ha sido suficientemente ensayada.
En el contexto de los AAAr, han sido diversos los trabajos de Tambyraja et al. en los que se han evaluado diferentes modelos de predicción de riesgo21–23. En la evaluación retrospectiva de 82 pacientes con AAAr, el valor del AUC del análisis de las curvas ROC para el GAS fue de tan solo 0,61; y el índice de Hardman se mostró ineficaz para predecir la mortalidad operatoria24. En un metaanálisis realizado en 2007 para la validación del índice de Hardman y de los modelos GAS, POSSUM y Vancouver scoring system, ninguno de los modelos mostró concordancia ni validez absoluta22. Finalmente, en el análisis de un registro prospectivo de 84 pacientes con AAAr, en los que se observó una mortalidad del 44%, la evaluación de los modelos GAS, V-POSSUM, AAAR-POSSUM, ERAS y del índice de Hardman, mostró que estos no eran un buen método para la predicción de la mortalidad después del tratamiento del AAAr, a excepción del ERAS, con un valor del AUC de 0,7223. En nuestro medio, Merino et al. describieron un valor pronóstico del GAS con un AUC de 0,814 (intervalo de confianza, IC 95%: 0,725-0,883) y punto de corte en 106 puntos (sensibilidad 45,1%; especificidad 94,2%; VPP: 88,5%; VPN: 63,6%) en una serie retrospectiva de 103 pacientes25.
A diferencia de lo que ocurre en la cirugía abierta, y atendiendo a la REV electiva de AAA, los resultados de los estudios de validación que han evaluado la precisión del GAS son contradictorios26–29. La compatibilidad de la técnica endovascular según la anatomía del paciente sugiere la importancia de los factores morfológicos en la aproximación a la valoración preoperatoria del riesgo quirúrgico. El diámetro aórtico, por ejemplo, ha sido relacionado como factor predictivo de mortalidad en el tratamiento de los AAA y anatomías desfavorables conducirían, sin otra alternativa, al tratamiento convencional30. Los modelos de predicción más estudiados están basados en aspectos fisiológicos y médicos y carecen de un enfoque anatómico. Conocer si existe una influencia de la anatomía aórtica en la supervivencia puede ser de interés para identificar si existe un aumento del riesgo según el perfil aortoilíaco, y cuáles son las opciones terapéuticas más favorables en esas anatomías de riesgo31.
El estudio australiano Australian National Audit of Vascular Surgery ha sido utilizado recientemente para describir factores que puedan influir en la supervivencia a largo plazo y en los resultados relacionados con el injerto32. Se han relacionado factores fisiológicos (edad, ASA, sexo, creatinina) así como morfológicos del AAA (diámetro máximo, ángulo del cuello, diámetro y longitud del cuello infrarrenal), sin que se haya identificado significación en otros factores como la tortuosidad ilíaca o la presencia de trombo en el saco aneurismático. Pero todavía es necesaria la validación externa de este modelo.
Se han indicado factores que limitan la homogeneidad necesaria para la reproducibilidad de los modelos de predicción33. De esta manera, se debe considerar el volumen de intervenciones anual del equipo quirúrgico, así como las diferencias en los protocolos de actuación de los equipos quirúrgicos, anestesiología y cuidados intensivos34,35. Tanto la estandarización de la toma de decisiones como la identificación de factores de riesgo con una incorporación específica a los nuevos modelos de predicción preoperatoria del riesgo quirúrgico son necesarias para alcanzar fiabilidad y utilidad en la práctica clínica y en el ámbito institucional sanitario.
En la actualidad existen muy pocos estudios de validación de modelos de predicción de riesgo para AAAr tratado mediante técnica endovascular. El estudio de Karkos et al.36 analiza la utilidad del índice Hardmann en 41 pacientes con REVAR y concluye con que no resulta un modelo efectivo para la identificación de los pacientes que podrían sobrevivir tras el tratamiento endovascular.
En el actual estudio, el modelo que presentó un mejor comportamiento predictivo de mortalidad, tanto en RA como en REV, fue el GAS. Sin embargo, su precisión, como revela un AUC inferior a 0,7, al igual que en los restantes analizados, sugiere la necesidad de un modelo mixto que permita predecir el resultado en ambas situaciones.
La principal limitación de nuestro estudio es su carácter retrospectivo y un menor número de pacientes en el grupo tratado mediante REV. No obstante, sus resultados indican de nuevo una mayor supervivencia entre los pacientes tratados con REV, especialmente en los de edad más avanzada. La identificación de variables preoperatorias e intraoperatorias relacionadas con la función renal y transfusión de hemoderivados indican su papel primordial en la construcción de un modelo predictivo mixto (RA-REV). Finalmente, aunque el modelo de regresión logística preliminar mostró un comportamiento predictivo moderado, la inclusión del uso de medicación dopaminérgica requiere focalizar la atención en esta variable, tanto desde el punto de vista clínico como en la elaboración de nuevos modelos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónFinanciado en parte con ayuda a la investigación de la Fundación de la SEACV.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Expresamos nuestro agradecimiento a todos los hospitales que han colaborado en este estudio.