Resumen. Introducción. Presentamos el caso de un paciente tratado de un aneurisma de aorta abdominal (AAA) infrarrenal con una endoprótesis Excluder. Durante los años de seguimiento se objetivó un crecimiento del diámetro del saco aneurismático sin imágenes de fuga en las angiotomografías de control. Caso clínico. Varón de 69 años, obeso, con enfermedad pulmonar obstructiva crónica y cardiopatía isquémica. La morfología inicial del aneurisma presentaba un cuello de 2 cm de diámetro y al menos 3 cm de longitud. Las ilíacas no presentaban dilatación. La endoprótesis se colocó sin complicaciones. En las angiotomografías seriadas no se objetivaban fugas, el solapamiento del dispositivo era adecuado y no existía desplazamiento de éste, pero presentaba un crecimiento del saco aneurismático. Se decidió realizar un tratamiento endovascular de la endotensión mediante un dispositivo aortouniilíaco Renu y un bypass femorofemoral cruzado. Un año después del nuevo tratamiento, tuvo lugar una disminución del volumen del saco aneurismático de 234 a 219 cm3y de 1 cm en sus diámetros. Conclusión. En ausencia de fuga, la endotensión se asocia a un crecimiento del saco aneurismático en algunos pacientes que se sometieron a tratamiento endovascular con dispositivos Excluder de primera generación por la elevada porosidad de su pared. La disminución del saco aneurismático es sugestivo de tratamiento endovascular exitoso, aunque una exclusión correcta puede no acompañarse de una disminución del diámetro, lo cual se ha observado con algunos tipos de endoprótesis. Aunque la incidencia de endotensión es baja, su tratamiento requiere seguimiento y una actuación quirúrgica para solucionar la progresión aneurismática. Se optó por una nueva solución endovascular porque era un paciente de elevado riesgo quirúrgico para una cirugía convencional. [ANGIOLOGÍA 2008; 60: 425–9]
Summary. Introduction. We report the case of a patient treated for an infrarenal abdominal aortic aneurysm (AAA) with an Excluder stent. During the years of the follow-up, a growth in the diameter of the aneurysmal sac was observed with no images of leaks in the control CAT-angiography scans. Case report. We report the case of an overweight 69-year-old male with chronic obstructive pulmonary disease and ischaemic heart disease. The initial morphology of the aneurysm presented a neck with a diameter of 2 cm and a length of at least 3 cm. The iliacs were not dilated. The stent was placed without any kind of complication. Serial CAT-angiography studies showed no leaks, the overlap of the device was correct and it had not moved, but the aneurysmal sac was seen to have grown. The decision was made to treat the endotension by endovascular means using a Renu aorto-uni-iliac device and a crossed femorofemoral bypass. One year after the new treatment, the volume of the aneurysmal sac had diminished from 234 to 219 cm3 and its diameter had also decreased by 1 cm. Conclusions. In the absence of leaks, endotension is associated with a growth of the aneurysmal sac in some patients who undergo endovascular treatment with first-generation Excluder devices, owing to the high degree of porosity of their walls. The reduction of the aneurysmal sac suggests successful endovascular treatment, although a correct exclusion may not be accompanied by a decrease in diameter, which has been observed with some types of stent. Even though the incidence of endotension is low, its treatment needs to be followed up and surgery is required to resolve the aneurysmal progression. A new endovascular solution was chosen because surgical risk for conventional surgery was high for this patient. [ANGIOLOGÍA 2008; 60: 425-9]
El incremento en el uso de técnicas endovasculares en el tratamiento de los aneurismas de aorta abdominal (AAA) y su posterior seguimiento ha ido revelando complicaciones características de este tipo de intervención. Esta técnica menos invasiva ha demostrado ser segura y efectiva en el tratamiento de la patología aneurismática, aunque no está exenta de complicaciones a medio y a largo plazo.
Desde que en 1991 Parodi publicara el primer tratamiento endovascular de esta patología [1], se han desarrollado en todo el mundo una gran variedad de dispositivos con mayor o menor éxito. En el transcurso de todos estos años se han ido descubriendo múltiples aspectos acerca de la naturaleza, la incidencia y el significado de las complicaciones asociadas a él [2]. Una de las causas de fallo en el tratamiento es la presencia de endotensión.
En ausencia de una fuga detectable, el crecimiento del saco aneurismático durante el seguimiento debe levantar sospechas en esta complicación. En la bibliografía se describen diversos mecanismos para explicar la presurización mantenida del saco aneurismático; entre ellos, la trasudación o ultrafiltración a través de la pared del dispositivo [3,4].
Se ha propuesto el tratamiento endovascular de esta complicación como una alternativa segura para pacientes de alto riesgo quirúrgico. Ésta es la condición por la cual se seleccionó previamente a estos pacientes, y en ellos se consideró la opción endovascular como una solución de su patología aneurismática.
Caso clínicoVarón de 69 años, obeso, que presentaba un AAA infrarrenal de 5,8 cm en su diámetro máximo en el año 2000 y un alto riesgo para la cirugía aórtica convencional. El paciente padecía una enfermedad pulmonar obstructiva crónica moderada en las pruebas de función respiratoria, así como una cardiopatía isquémica con una fracción de eyección del ventrículo izquierdo conservada. La morfología del aneurisma en la angiotomografía axial computarizada (angio-TAC) mostraba un cuello de 2 cm de diámetro y de al menos 3 cm de longitud sin angulación. No se preveían complicaciones en el acceso a través del sector femoroilíaco. Las arterias ilíacas no presentaban dilataciones, calcificaciones ni angulaciones.
Se trató al paciente con una endoprótesis aortobiilíaca Excluder (Gore & Associates, Flasgstaff, EE. UU.) a través de ambas femorales por vía abierta. No se presentaron complicaciones durante el procedimiento. La comprobación del éxito técnico se realizó cuatro días después del implante mediante arteriografía.
En las angio-TAC seriadas de seguimiento no había fugas, el solapamiento era adecuado y sin desplazamiento del dispositivo, y las imágenes del eco-Doppler abdominal no mostraban flujo en el interior del saco aneurismático. A pesar de la ausencia de hallazgos patológicos y de considerar que el AAA estaba correctamente sellado, el saco mantuvo un crecimiento progresivo y obligó a un estrecho seguimiento.
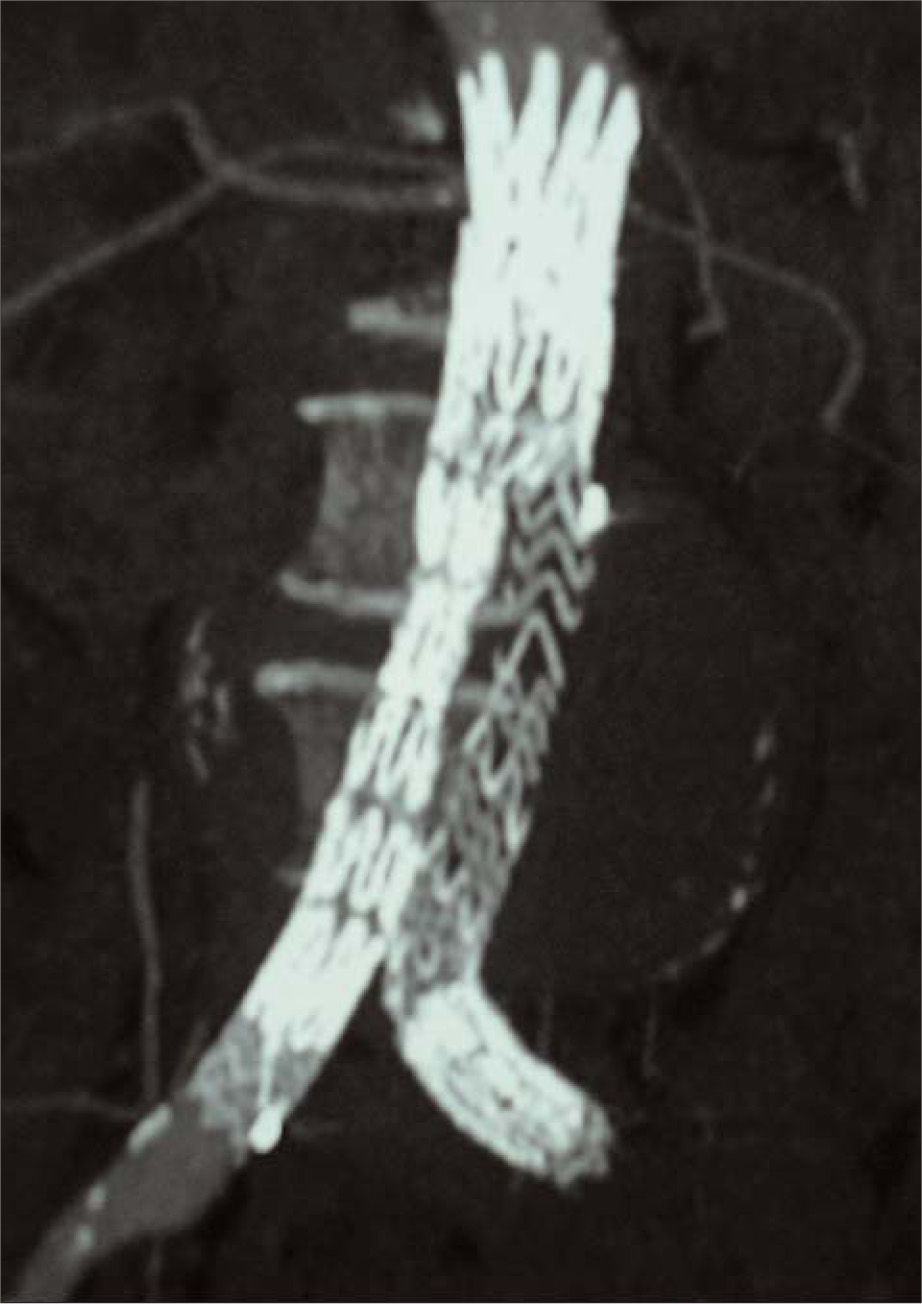
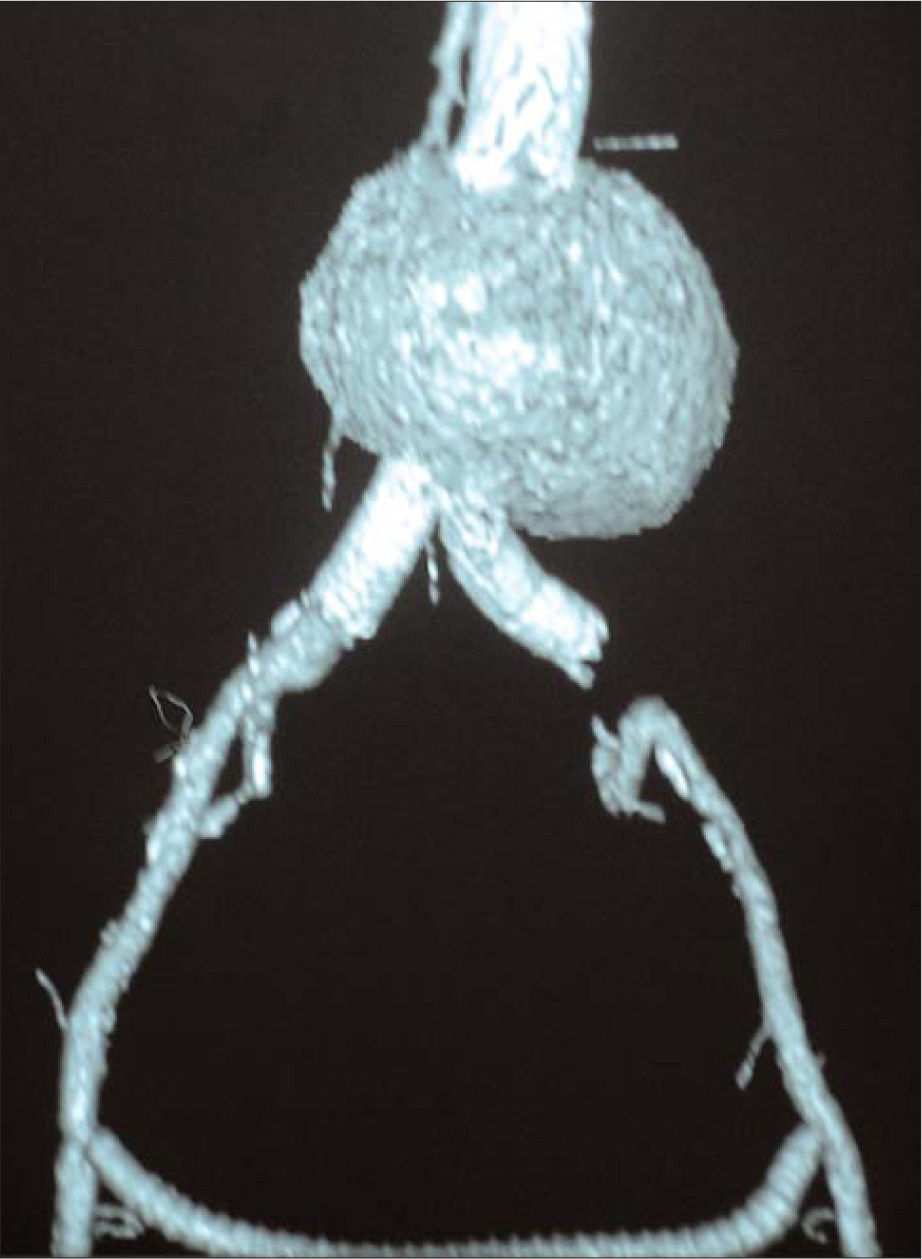
A los seis años de recibir el primer tratamiento, el diámetro máximo pasó a ser de 8,7 cm (Fig. 1), por lo que se decidió la intervención del paciente para corregir la complicación de la endotensión mediante un dispositivo aortouniilíaco Renu (Cook Medical) y oclusor izquierdo con bypass femorofemoral cruzado de politetrafluoroetileno (PTFE) de 8 mm de diámetro anillado (Fig. 2).
Nueve meses después de la implantación del segundo dispositivo, la ecografía aórtica mostró una disminución del diámetro máximo previo de al menos 1 cm, sin imágenes de fuga. La angio-TAC posterior mostró la reducción de volumen del saco de 234 a 219 cm3 y de 1 cm en sus diámetros anteroposterior y lateral.
DiscusiónEl éxito del tratamiento endovascular en el caso de los aneurismas radica en una exclusión completa de éste del flujo arterial. Una de las causas de fracaso de dicho tratamiento son las fugas, que constituyen una complicación que se produce entre el 8 y el 44% de todos los tratamientos endovasculares de los AAA [5]. El origen de las fugas es multifactorial, y en su aparición convergen causas tanto anatómicas como relativas al tipo de endoprótesis usada.
La disminución del saco aneurismático es sugestiva de tratamiento endovascular exitoso y es secundaria a una despresurización de aquél. En ocasiones, una exclusión correcta puede no ir acompañada de una disminución del diámetro, por lo que existirá una presurización del saco aneurismático sin causa aparente. Se han descrito y postulado varias teorías sobre este mecanismo conocido como 'endotensión' y se han desarrollado experimentalmente modelos animales que reproducen este fenómeno [4].
El término 'endotensión' pretende definir un estado de presión elevada dentro del saco aneurismático. Existen aspectos sobre la naturaleza, la incidencia y el significado de este problema que todavía son motivo de controversia, como también lo es la propia clasificación de los endoleaks[2]. Pero ¿cómo se transmite esa presión sin evidencia en las pruebas de imagen de una fuga? Se han planteado diversas hipótesis para explicarlo; la teoría más extendida es la de una elevada porosidad de la tela del dispositivo. Se han dado casos de reconversiones a cirugía abierta de algunos pacientes en los que no se ha podido identificar la presencia de una fuga 'oculta' que explique el crecimiento, pero sí lo ha hecho un higroma de trasudado en el saco aneurismático [6].
La bibliografía médica recoge algunas referencias sobre el comportamiento distinto del saco aneurismático en función del tipo de endoprótesis usada. En ocasiones, estos cambios tienen lugar incluso varios años después de la implantación de la endoprótesis. Parece que los aneurismas tratados mediante dispositivos con telas más gruesas experimentan una mayor disminución en su diámetro que los tratados con otros dispositivos [7]. Aunque la significación clínica de estos cambios no está clara, parece que la disminución del tamaño del saco es un marcador de éxito terapéutico [2].
La primera generación de endoprótesis Excluder se asociaba a una menor disminución del saco aneurismático en relación con otros dispositivos tras su implantación, y, en ocasiones, a un crecimiento del saco a pesar de una correcta exclusión del aneurisma. A partir del año 2004 se cambió el material del dispositivo Excluder por otro al que se llamó PTFE expandido de baja permeabilidad. Los estudios preliminares que compararon en un primer momento la primera generación de Excluder con el dispositivo Zenith, y, posteriormente, con la 'nueva' generación de Excluder de baja porosidad, mostraron resultados favorables a esta modificación del dispositivo. Se encontró un mayor porcentaje de casos con regresión del tamaño del saco aneurismático en el primer año de seguimiento tras su implantación [8]. La última revisión que compara el comportamiento del nuevo dispositivo revela diferencias significativas con respecto a la antigua endoprótesis [9] incluso en un año de seguimiento, aunque estima necesario un seguimiento a más largo plazo para evaluar si estas diferencias se mantienen a lo largo del tiempo.
La presencia de crecimiento aneurismático tras el tratamiento endovascular sin detección de fuga obliga a aumentar la vigilancia de estos pacientes y a pensar en un caso de endotensión [2]. Existen discrepancias acerca del tratamiento de los pacientes asintomáticos, ya que el crecimiento del saco aneurismático no está relacionado con una alteración morfológica del cuello del aneurisma ni con la fijación del dispositivo a nivel ilíaco, pero existe un riesgo de rotura del saco. Los autores que afirman esto trataron varios casos de endotensión. Describen un caso de dispositivo Excluder en el que se intervino al paciente por dolor abdominal agudo y en el que se encontró un líquido viscoso en la cavidad abdominal con rotura del saco aneurismático y sin hemorragia intraabdominal [6]; sin embargo, esta afirmación también resulta controvertida. Más recientemente se han descrito casos de alteración anatómica del cuello del aneurisma junto al crecimiento del saco, lo que altera la fijación del dispositivo [9].
En conclusión, nuestro objetivo era tratar al paciente para evitar una posible rotura del saco según lo descrito en la bibliografía. Al paciente se le trató con un dispositivo Excluder de primera generación y no hubo hallazgo de fuga en las pruebas de imagen; por lo tanto, consideramos que el crecimiento del saco aneurismático se debió a la permeabilidad de la tela del dispositivo. Como se trataba de un paciente con alto riesgo para cirugía convencional, decidimos reforzar la pared de la antigua endoprótesis y evitar el proceso de trasudación [10]. Un año después del nuevo tratamiento, el saco aneurismático había disminuido 1 cm en sus diámetros anteroposterior y lateral, y también en volumen (Fig. 3), por lo que consideramos que el tratamiento había tenido éxito [2,6-9].