El tratamiento de las infecciones del pie diabético es de gran complejidad por los múltiples factores que intervienen en su desarrollo, de ahí la necesidad de una atención multidisciplinaria. El grado y la calidad de la evidencia clínica no son los más deseables debido a la falta de homogeneidad de los ensayos clínicos realizados, por lo que muchas de las decisiones se basan en opiniones de expertos. A estos inconvenientes hay que añadir el incremento de las resistencias bacterianas, principalmente localizadas en las enterobacterias que producen betalactamasas de espectro extendido (BLEE) y en Staphylococcus aureus resistentes a la meticilina (SARM). Por otro lado, en los últimos años se han incorporado nuevos antibióticos al arsenal terapéutico para estas infecciones, como el ertapenem y el linezolid, que han probado su eficacia en sendos ensayos clínicos.
Esta situación, junto a la falta de estandarización del tratamiento de estas infecciones en nuestro país, ha llevado a un grupo de expertos, en representación de varias sociedades médicas, a establecer una serie de pautas basadas en la mejor evidencia encontrada encaminadas a obtener la mayor eficacia clínica.
EpidemiologíaLa diabetes mellitus tiene una prevalencia en la actualidad del 6%, aunque se estima que existe un porcentaje similar de pacientes con esta enfermedad sin diagnosticar [1]. Estas tasas aumentan con la edad, alcanzando el 11% en mayores de 65 años [2]. En los últimos 40 años se cree que se ha incrementado en seis veces el número de personas con diabetes, de los cuales el 90-95% padece el tipo 2 [1]. La diabetes es la séptima causa de muerte directa en los países desarrollados, sin tener en cuenta su papel en la mortalidad cardiovascular, que es el principal motivo de muerte precoz en los diabéticos [3].
Las principales complicaciones tardías de la diabetes (arterioesclerosis, neuropatía, retinopatía, etc.) son de etiopatogenia vascular (macro y microangiopatía) y metabólica. La úlcera en el pie es otra de las complicaciones más frecuentes en las extremidades inferiores de los diabéticos, que aparece durante el curso de la enfermedad en aproximadamente el 15% de los casos [4–6]. Su incidencia general anual es del 2-3% y del 7% en aquellos pacientes con neuropatía, y su prevalencia oscila entre el 2 y 10% [7,8].
Las infecciones del pie que afectan a la piel y los tejidos blandos, y al hueso, con o sin repercusión sistémica, son la causa más común de hospitalización de los diabéticos (25%) con estancias prolongadas [5].
La diabetes es la causa más frecuente de amputación y, en particular, de las no traumáticas (> 50%) de la extremidad inferior en Europa y EE. UU. [9]. La tasa anual de amputaciones ajustada por edad es del 82/10.000 diabéticos. Estos enfermos tienen entre 15 y 40 veces más posibilidades de requerir una amputación que los no diabéticos, y en el caso de los varones, al menos un 50% más que las mujeres [3,10]. Los diabéticos con una úlcera en el pie requerirán una amputación en el 14-20% de las ocasiones y, a su vez, la úlcera del pie es la precursora de más del 85% de las amputaciones de las extremidades inferiores en estos pacientes [11,12]. Después de la amputación de una extremidad inferior, la incidencia de una nueva úlcera y/o la amputación contralateral a los dos y cinco años es del 50% [5,13]. La supervivencia de los pacientes diabéticos amputados es significativamente peor que en el resto de la población, y menor aún si han presentado otra amputación previa [5]. Sólo el 50 y 40% de los pacientes sobreviven a los tres y cinco años de una amputación, respectivamente, y el pronóstico disminuye conforme se eleva el nivel donde se realiza la misma [13,14].
Aunque no se conocen con precisión los costes derivados de las úlceras e infecciones del pie diabético, en EE. UU. se calcula que un episodio ulceroso cuesta entre 4.500 y 28.000 dólares a los dos años del diagnóstico, con una media de 5.500 dólares por paciente y año [15,16]. A pesar de que el tiempo de hospitalización de una amputación ha disminuido, sigue siendo un procedimiento oneroso, que oscila entre 20.000 y 40.000 dólares en función del nivel de la amputación, la estancia o las comorbilidades del paciente [5,17].
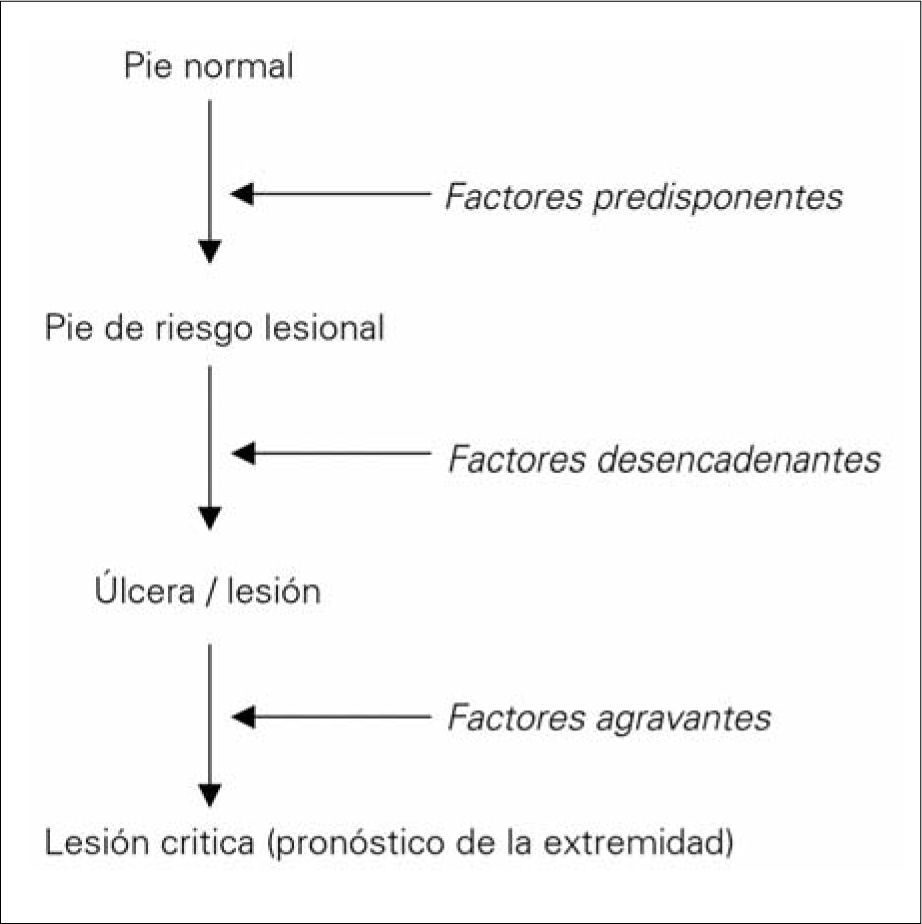
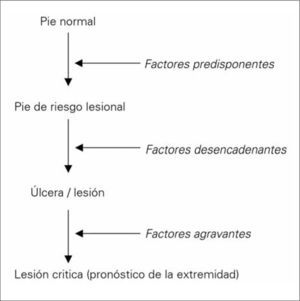
FisiopatologíaEl conocimiento de su fisiopatología es esencial para el cuidado óptimo del pie diabético, pues modificando los factores que influyen en su desarrollo se puede restaurar el pie o mantenerlo intacto para que el paciente pueda hacer una vida completamente normal.
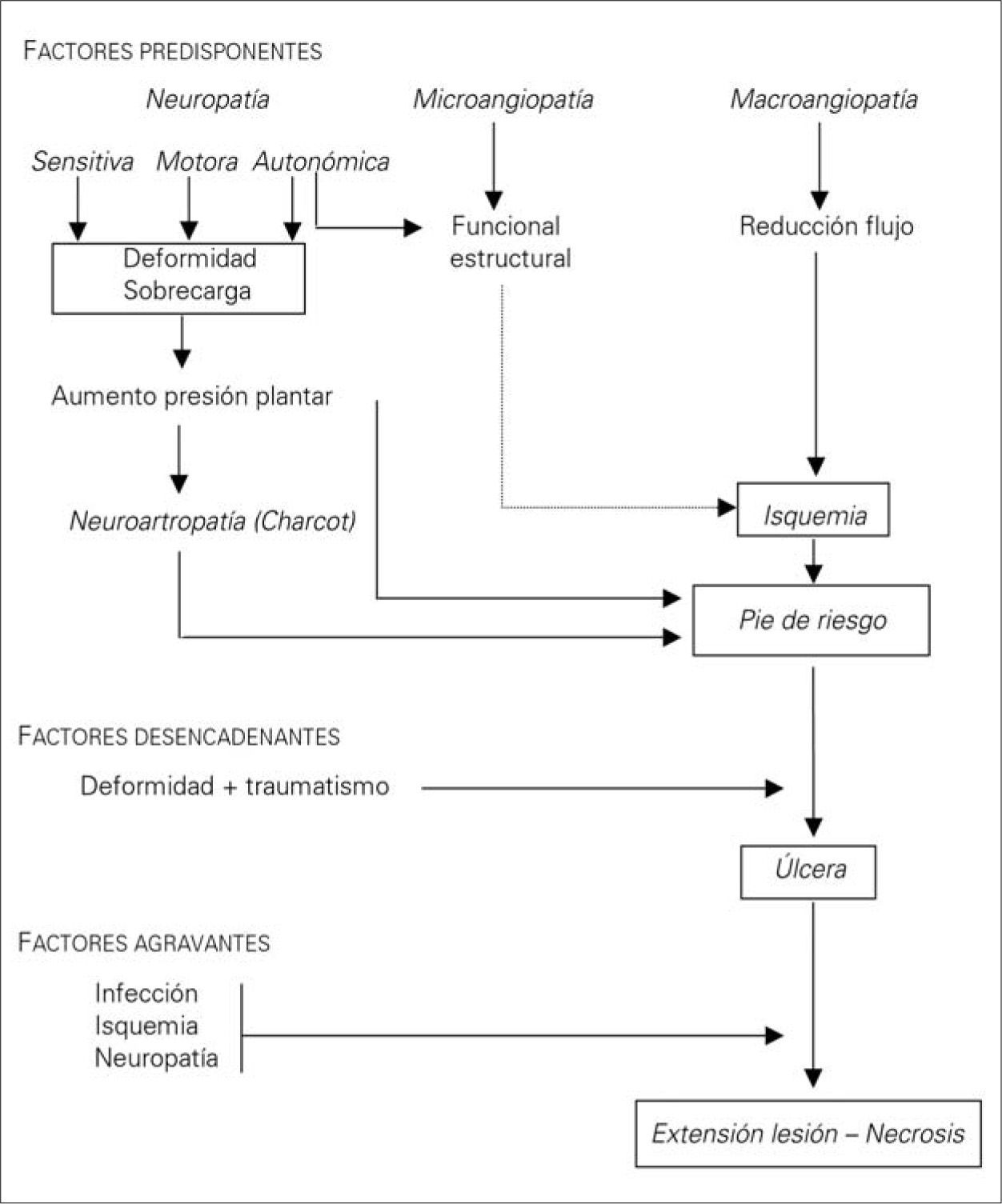
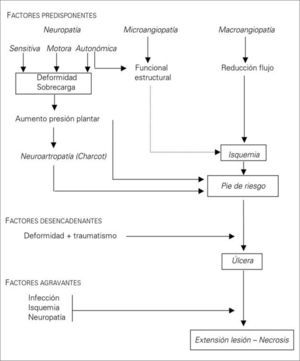
El denominado 'pie diabético' es un proceso que se desarrolla debido a la interacción de diferentes factores (Figs. 1 y 2) [18]:
Factores predisponentesSon unos factores que dan lugar a un pie vulnerable de alto riesgo. Entre los más importantes se encuentran:
Neuropatía diabéticaLa hiperglucemia mantenida es el factor de riesgo más importante para el desarrollo de la neuropatía [19]. Existen dos teorías etiopatogénicas, una metabólica y otra vascular, y es probablemente la interacción de ambas la que la provoque [20,21].
La polineuropatía simétrica distal de distribución en calcetín es la forma de neuropatía más frecuente que predispone a la aparición de úlceras en el pie. Es generalmente de aparición insidiosa y curso crónico, y su prevalencia aumenta con la evolución de la enfermedad, afectando al 10% de diabéticos en el momento del diagnóstico y hasta a casi la mitad de los casos de 25 años de evolución [22–24]. En esta neuropatía se ven afectadas las fibras somáticas (sensitivomotoras) y autonómicas. Inicialmente se alteran las fibras nerviosas pequeñas, provocando la pérdida de la sensación de dolor y temperatura, y posteriormente las fibras nerviosas grandes, disminuyendo el umbral de percepción de vibración y la sensibilidad superficial. Las alteraciones sensitivas hacen que los diabéticos no sean capaces de detectar los cambios de temperatura, el exceso de presión producido por zapatos ajustados o cualquier otro traumatismo mantenido [22]. La neuropatía motora provoca atrofia y debilidad de los músculos intrínsecos del pie con la pérdida de la función de estabilización de las articulaciones metatarsofalángicas e interfalángicas, que conduce a una contractura dinámica de los flexores y extensores largos. Como consecuencia de esta alteración aparecen dedos en martillo y en garra que favorecen la protrusión de las cabezas de los metatarsianos y una distribución anormal de las cargas en el pie [22]. La neuropatía autónoma produce:
- –
Anhidrosis con sequedad y fisuras en la piel por afección de las fibras simpáticas posganglionares de las glándulas sudoríparas.
- –
Aumento del flujo sanguíneo, en ausencia de patología obstructiva arterial, por apertura de shunts arteriovenosos que disminuyen la perfusión de la red capilar y aumentan la temperatura de la piel, lo que da lugar a un trastorno postural en la regulación del flujo y a una respuesta inflamatoria anormal a la agresión tisular [25].
- –
Edema neuropático y aumento de la presión venosa [26].
La neuroartropatía de Charcot es una de las peores consecuencias de la diabetes en el pie. La mayoría de los pacientes con este trastorno presentan úlcera en el pie [27]. En esta situación, los traumatismos repetitivos por la pérdida de sensibilidad provocan distensión ligamentosa y microfracturas, y el peso corporal genera una destrucción articular progresiva con fracturas y subluxaciones. Estos fenómenos están acelerados por el aumento de la reabsorción ósea osteoclástica, secundaria a la hiperemia causada por la denervación simpática de la microcirculación [28].
La neuropatía, con o sin isquemia asociada, está implicada en la fisiopatología de la úlcera del pie diabético entre el 85 y el 90% de los casos [29–31]. Por tanto, el pie insensible, sea perfundido o isquémico, debe considerarse como de alto riesgo de úlcera.
Macroangiopatía diabéticaLa macroangiopatía diabética no es más que una arterioesclerosis en pacientes diabéticos [32]. Los diabéticos que además presentan alguno de los factores de riesgo mayores de la enfermedad arterioesclerótica (hipertensión, hipercolesterolemia y tabaquismo) tienen mayor probabilidad de desarrollar arterioesclerosis y su mortalidad es más elevada [33–37]. Desde el punto de vista anatomopatológico, no hay diferencias entre la arterioesclerosis del diabético del que no lo es; sin embargo, en el primero la incidencia es similar entre ambos sexos, la aparición es más precoz, es más grave y la distribución es multisegmentaria y bilateral con un predominio distal (troncos infrapoplíteos, aunque también se ven afectadas la aorta, las carótidas, las coronarias, etc.) [38–41].
La macroangiopatía está implicada en la etiopatogenia de la úlcera del pie diabético entre el 40 y el 50% de los casos, generalmente asociada a neuropatía [29,30].
Calcificación de la capa media arterial o esclerosis de MonckebergEs una degeneración de la capa media de las arterias de mediano calibre con aparición de fibrosis y calcificación, producida por una denervación simpática secundaria a una neuropatía autónoma. Las arterias se vuelven más duras e incomprensibles sin que se ve afectada nada o casi nada la luz del vaso [42–44].
Microangiopatía diabéticaExiste una amplia controversia sobre la importancia real de la microangiopatía en la fisiopatología del pie diabético [45]. En los capilares no hay disminución de la luz ni anomalías funcionales, pero sí un engrosamiento de la membrana basal secundario a hiperglucemia [46]. La importancia de la microangiopatía es menor de lo que siempre se ha pensado. La idea errónea del papel preponderante de la microangiopatía en la fisiopatología del pie diabético provoca en muchas ocasiones tratamientos inadecuados que hay que evitar:
- –
La gangrena digital con pulsos distales no es secundaria a la microangiopatía, sino a trombosis por toxinas bacterianas necrosantes como las de S. aureus[47].
- –
La presencia de microangiopatía no altera el resultado de la revascularización, ya que cuando se practica consigue los mismos resultados que en aquellos que no la tienen [48].
- –
La microangiopatía diabética se implica en la patogenia de la úlcera neuropática. Sin embargo, las lesiones neuropáticas del pie diabético son iguales a aquellas que aparecen en neuropatías hereditarias en no diabéticos o en neuropatías postraumáticas donde la microangiopatía no existe [49].
- –
Factores hematológicos y reológicos: hiperfibrinogenemia, aumento de la agregación plaquetaria, disminución de la actividad fibrinolítica, reducción de la deformabilidad de los eritrocitos y leucocitos, etc. [50–52].
- –
Alteración del sistema inmunológico (alteración de la diapedesis, adherencia leucocitaria, quimiotaxis, fagocitosis y lisis intracelular de los granulocitos) que se agrava por el mal control de la glucemia [53].
- –
Glucosilación no enzimática del tejido conjuntivo periarticular que produce rigidez articular, y de las proteínas del colágeno que hacen sus fibras más rígidas y susceptibles al roce y causan un retraso de la cicatrización [54–56].
Estos factores cuando actúan sobre un pie vulnerable o de riesgo provocan una úlcera o una necrosis [57]. Entre los de origen extrínseco destacan los traumatismos mecánicos, térmicos y químicos [57,58]. Dentro de los intrínsecos se incluye cualquier deformidad del pie o limitación de la movilidad articular que condicione un aumento de la presión plantar [54,55,58–60].
Factores agravantes: infecciónLa infección no suele ser la causa de la úlcera, excepto en casos concretos de infecciones fúngicas (tinea pedis, candidiasis) en los espacios interdigitales; no obstante, va a determinar en gran manera tanto el tratamiento como el pronóstico de cualquier lesión del pie. La solución de continuidad de la piel que supone una úlcera en el pie es una puerta de entrada para los microorganismos. En los diabéticos la disminución cuantitativa y cualitativa de la respuesta leucocitaria facilita la infección y su evolución [53], y la pérdida de la sensibilidad permite que el paciente camine sobre tejidos infectados sin ser consciente de ello, así como la extensión del proceso a planos más profundos y más proximales incrementando su gravedad [60].
Las infecciones de los tejidos blandos en el pie diabético se pueden clasificar en necrosantes o no (Tabla I) y, en cualquier caso, se pueden extender al hueso causando osteomielitis.
Tipos de infección de piel y partes blandas.
| No necrosante | Erisipela |
| Celulitis | |
| Absceso | |
| Necrosante | Celulitis necrosante |
| Fascitis necrosante | |
| Mionecrosis a |
En conclusión, la compleja fisiopatología del pie diabético podría resumirse en que la hiperglucemia crónica del diabético provoca alteraciones biofísicas, bioquímicas y tisulares responsables de las complicaciones metadiabéticas. De éstas, tanto la neuropatía como la macroangiopatía, y, en menor medida, la microangiopatía, convierten al pie del diabético en un pie de alto riesgo, sobre el que unos factores desencadenantes, generalmente un traumatismo crónico y mantenido, provocan una úlcera. El pronóstico de la úlcera, y, por tanto, de la extremidad, va a estar en función de las alteraciones sensitivomotoras y autonómicas de la neuropatía, de la isquemia de la macroangiopatía y de la infección que puede acompañar a la úlcera en mayor o menor grado.
EtiologíaLos microorganismos que producen las infecciones del pie diabético proceden de la flora cutánea e intestinal del propio paciente (Tabla II). La etiología varía según el tipo de infección y determinadas situaciones del paciente (tratamiento antibiótico, manipulación u hospitalización previos).
Etiología de las infecciones en el pie diabético.
| Infección | Microorganismo |
| Celulitis | S. aureusS. pyogenes |
| Úlcera no tratada con antibióticos | S. aureusS. pyogenes |
| Úlcera tratada previamente con antibióticos y/o de larga evolución | S. aureusSARMaECN bStreptococcus spp.Enterococcus spp.EnterobacteriasP aeruginosacCandida spp.dCorynebacterium spp.dOtros bacilos gramnegativos no fermentadoresd |
| Fascitis necrosante o mionecrosis | Cocos grampositivos aerobiosEnterobacteriasBacilos gramnegativos no fermentadoresAnaerobios |
En las infecciones agudas superficiales y leves sin amenaza para el miembro como, por ejemplo, la celulitis o la erisipela, predominan S. aureus y estreptococos β-hemolíticos (especialmente del grupo B, pero también los de los grupos A, C y G, respectivamente), mientras que las infecciones que afectan a estructuras más profundas (tejido celular subcutáneo o músculo) y son más graves, con peligro para la extremidad o para la vida, suelen ser polimicrobianas con participación de cocos grampositivos (S. aureus y estreptococos), enterobacterias y anaerobios (Peptostreptococcus spp. y Bacteroides spp.), en las cuales resulta difícil asignar la causa etiológica a alguno o varios de los patógenos aislados [61–68].
Los anaerobios son habituales en presencia de necrosis y, normalmente, no suelen encontrase en solitario, sino que están formando parte de infecciones mixtas [69].
En las úlceras crónicas que han sido tratadas previamente con antibióticos o manipuladas quirúrgicamente, así como en los pacientes hospitalizados, es frecuente observar nuevos microorganismos y más resistentes a los antibióticos: SARM, enterobacterias productoras de BLEE, Pseudomonas aeruginosa, otros bacilos gramnegativos no fermentadores, estafilococos coagulasa-negativos y enterococos. S. aureus es el patógeno más comúnmente aislado y P. aeruginosa es frecuente en úlceras exudativas o tratadas con vendajes húmedos o hidroterapia [68,70,71].
La disminución de defensas en los tejidos necrosados o hueso permiten también la colonización y posterior infección por microorganismos de menor virulencia como Staphylococcus coagulasa-negativos, Corynebacterium spp. y especies de levaduras y hongos [72–74].
DiagnósticoEl diagnóstico es preciso hacerlo a varios niveles:
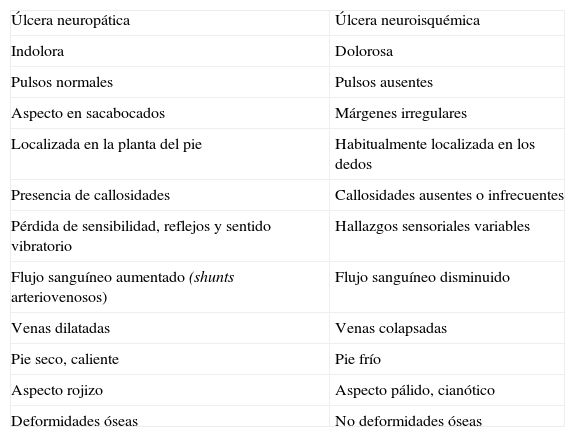
Puerta de entradaLa infección en el pie diabético ocurre casi invariablemente en pacientes que son portadores de una úlcera de mayor o menor tiempo de evolución o han presentado una lesión aguda en el pie [75]. Esto implica que casi siempre podrá identificarse cuál ha sido la puerta de entrada de los microorganismos para desarrollar la infección. La primera fase del diagnóstico es identificar la causa de la lesión inicial: neuropática, isquémica, neuroisquémica, traumática, varicosa o asociada a otras causas. El diagnóstico diferencial entre los dos tipos de úlcera más prevalentes (neuropática y neuroisquémica) en el pie diabético se muestra en la tabla III[76]. El antecedente traumático se suele obtener con facilidad en la anamnesis, mientras que la exploración de la pierna suele poner de manifiesto una insuficiencia venosa clara en las úlceras de origen varicoso. Una causa importante de infecciones, a menudo graves, de la extremidad inferior es la sobreinfección por cocos grampositivos de las grietas dérmicas de los espacios interdigitales con infección por dermatofitos [77]. El diagnóstico de la causa de la úlcera es básico para planear el tratamiento y favorecer la curación de la misma.
Diagnóstico diferencial entre úlceras neuropáticas y neuroisquémicas [76].
| Úlcera neuropática | Úlcera neuroisquémica |
| Indolora | Dolorosa |
| Pulsos normales | Pulsos ausentes |
| Aspecto en sacabocados | Márgenes irregulares |
| Localizada en la planta del pie | Habitualmente localizada en los dedos |
| Presencia de callosidades | Callosidades ausentes o infrecuentes |
| Pérdida de sensibilidad, reflejos y sentido vibratorio | Hallazgos sensoriales variables |
| Flujo sanguíneo aumentado (shunts arteriovenosos) | Flujo sanguíneo disminuido |
| Venas dilatadas | Venas colapsadas |
| Pie seco, caliente | Pie frío |
| Aspecto rojizo | Aspecto pálido, cianótico |
| Deformidades óseas | No deformidades óseas |
Ante un pie diabético hinchado y caliente con lesiones ulceradas es preciso establecer el diagnóstico diferencial entre neuroartropatía aguda de Charcot y un cuadro infeccioso agudo, incluyendo celulitis, absceso plantar y osteomielitis [78]. Otras posibilidades diagnósticas que hay que descartar serían crisis gotosa, artritis y trombosis venosa femoral/poplítea. Además de la valoración clínica, las pruebas de imagen como la radiografía simple, la tomografía computarizada (TC) y sobre todo la resonancia magnética (RM), pueden ser necesarias para establecer el diagnóstico, así como el eco-Doppler para descartar la tromboflebitis.
Presencia de infección asociadaEl diagnóstico es también clínico. Se considera que una úlcera del pie diabético está infectada cuando presenta supuración, mal olor, necrosis local, se asocia a dos o más signos de inflamación perilesional (enrojecimiento, calor, dolor, induración o sensibilidad a la presión) o se demuestra osteomielitis mediante pruebas de imagen [79–81]. Es preciso descartar otras causas de inflamación como la neuroartropatía de Charcot, fracturas, tromboflebitis, gota, lipodermatoesclerosis, etc.
Todas las heridas del pie diabético han de ser adecuadamente inspeccionadas, palpadas y sondadas con un estilete para valorar su profundidad. Se ha sugerido que la palpación del hueso en el fondo de la úlcera es muy sugestiva de osteomielitis [82]. En ausencia de los signos clínicos antes descritos, no se considera que exista una infección invasiva en la herida y tampoco es necesaria la toma de muestras para cultivo (los microorganismos que crecen son meros colonizadores) ni la antibioterapia sistémica. Una excepción puede ser aquella úlcera adecuadamente tratada durante tres semanas sin signos de mejoría.
Gravedad de la infecciónSegún la profundidad de la lesión, las infecciones se clasifican en infección superficial, que está limitada a la piel y el tejido celular subcutáneo, e infección profunda, en la que se produce la invasión de la fascia profunda, músculo, articulación o hueso.
Desde el punto de vista clínico, una clasificación que ha demostrado ser útil y resulta bastante simple es la que distingue [83]:
- –
Infecciones leves (ausencia de signos y síntomas de infección sistémica): no representan un riesgo para la extremidad: celulitis de menos de 2 cm de extensión y úlceras superficiales.
- –
Infecciones moderadas o graves que representan una amenaza para la extremidad: celulitis más extensa y úlceras profundas. Habitualmente precisan ingreso hospitalario. La coexistencia de osteomielitis es frecuente.
- –
Infecciones muy graves que amenazan la vida del paciente: celulitis masiva, abscesos profundos, fascitis necrosante y mionecrosis. Se suelen asociar a afección sistémica e inestabilidad metabólica. Casi siempre es necesaria la cirugía urgente.
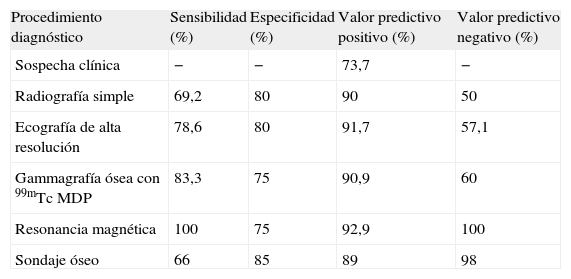
La osteomielitis del pie diabético suele producirse por contigüidad como resultado de la penetración en profundidad de una infección de los tejidos blandos. Se demuestra osteomielitis en el 10-20% de las infecciones del pie diabético clasificadas como leves o moderadas y en el 50-60% de las graves. El diagnóstico está dificultado por los cambios óseos destructivos que puede producir la neuroartropatía diabética. Las técnicas de imagen como la radiografía simple, la gammagrafía ósea con 99mTc MDP (tecnecio-99 metaestable metilendifosfonato) o con leucocitos marcados con indio-111 (111In), la ecografía de alta resolución, la tomografía por emisión de positrones y la RM, se han demostrado de gran utilidad. En la actualidad es probable que la mejor técnica diagnóstica sea la RM, ya que alcanza una sensibilidad del 90% y una especificidad del 80% [84].
La tabla IV muestra la sensibilidad, la especificidad y los valores predictivos positivo y negativo de las distintas modalidades de diagnóstico por imagen, comparadas con los resultados anatomopatológicos y los de sondaje óseo en el fondo de la úlcera [84].
Valor de las técnicas de imagen en el diagnóstico de la osteomielitis [81].
| Procedimiento diagnóstico | Sensibilidad (%) | Especificidad (%) | Valor predictivo positivo (%) | Valor predictivo negativo (%) |
| Sospecha clínica | − | − | 73,7 | − |
| Radiografía simple | 69,2 | 80 | 90 | 50 |
| Ecografía de alta resolución | 78,6 | 80 | 91,7 | 57,1 |
| Gammagrafía ósea con 99mTc MDP | 83,3 | 75 | 90,9 | 60 |
| Resonancia magnética | 100 | 75 | 92,9 | 100 |
| Sondaje óseo | 66 | 85 | 89 | 98 |
Las tres alteraciones típicas de la osteomielitis que se detectan en la radiografía simple (desmineralización, reacción perióstica y destrucción ósea) aparecen cuando se ha perdido entre el 30 y el 50% del hueso, lo cual requiere varias semanas; mientras tanto, este estudio es negativo. Además, estas alteraciones pueden coexistir en la neuroartropatía diabética [85].
Los resultados de un metaanálisis sobre el papel de la medicina nuclear para el diagnóstico de la osteomielitis del pie diabético [85] sugieren que en el antepié, cuando la sospecha clínica de osteomielitis es baja y se contempla el tratamiento médico, la gammagrafía ósea en tres fases es un estudio útil, sensible pero poco específica, es decir, un resultado negativo excluye la infección pero un resultado positivo no necesariamente confirma la osteomielitis. En este último caso sería necesaria la gammagrafía con leucocitos marcados; esta técnica también es útil para valorar los resultados del tratamiento médico. En el pie medio y el retropié el problema es diferenciar la articulación neuropática con y sin infección, para lo cual la gammagrafía con leucocitos marcados es la prueba más útil, aunque un resultado negativo es muy sugestivo de ausencia de osteomielitis y un resultado positivo requiere algún estudio complementario para su confirmación.
Los marcadores serológicos de inflamación, como un aumento de la velocidad de sedimentación globular o de la proteína C reactiva, pueden ser de utilidad para sospechar osteomielitis y, sobre todo, para valorar la respuesta al tratamiento [86].
Microorganismos implicadosLas interrelaciones entre los datos clínicos, las muestras microbiológicas y la prescripción antibiótica son importantes en el diagnóstico de la infección del pie diabético. En muchos casos, el valor de los resultados de los cultivos no es tan decisivo como en otro tipo de infección. Por tanto, parece razonable aunar criterios microbiológicos y clínicos para comenzar el tratamiento empírico con los datos clínicos de sospecha de infección y luego modificarlo de acuerdo con la respuesta de la infección del enfermo y los resultados de los cultivos. No existen estudios comparativos adecuados que evalúen razonadamente la repercusión de los estudios microbiológicos en el tratamiento de la infección, modificación del exudado y dolor, curación y desarrollo de complicaciones; no obstante, conocer los microorganismos involucrados en este tipo de infecciones y su sensibilidad a los antibióticos es un buen apoyo para los tratamientos empíricos y la redacción de guías terapéuticas.
La rentabilidad del cultivo depende de la calidad de la muestra y del medio de transporte usado para enviarla al laboratorio de microbiología. Las muestras obtenidas con torunda de la superficie de las lesiones son de muy mala calidad ya que contienen microorganismos, tanto causales como colonizantes, y, por otro lado, es un medio hostil para agentes anaerobios y otros de difícil crecimiento. Las mejores muestras son las obtenidas con jeringa en lesiones supuradas y almacenadas en medios adecuados para el crecimiento de anaerobios, y el raspado o biopsia de tejido del fondo de la úlcera, después del desbridamiento, remitiéndolas al laboratorio en un contenedor estéril con suero fisiológico [86–90].
Las muestras obtenidas se deben sembrar en medios y condiciones que permitan que crezca la mayor parte de los patógenos causantes de la infección, incluyendo los de crecimiento lento y los anaerobios. Aunque los cultivos cualitativos son orientativos y de utilidad clínica en muchas ocasiones, son mejores los cuantitativos por sensibilidad y valor predictivo positivo. Una alternativa útil a la complejidad de los cultivos cuantitativos son los semicuantitativos, más fáciles de llevar a cabo y con resultados próximos a los cuantitativos. Con el método cualitativo, en muestras tomadas con torunda, se puede escapar una de cada cinco infecciones. En los métodos cuantitativos se puede definir la infección de los tejidos blandos como la presencia de ≥ 105 unidades formadoras de colonias (UFC) por centímetro cuadrado en las muestras obtenidas con torunda, y de ≥ 105 UFC por gramo de tejido en las tomadas por biopsia [91]. En el diagnóstico microbiológico, aparte de los cultivos, cada vez se están incorporando con más fuerza las técnicas basadas en la detección, previa amplificación, de ácidos nucleicos por medio de la reacción en cadena de la polimerasa (PCR). A ellas no son ajenas las infecciones del pie diabético. Se han usado para detectar microorganismos de crecimiento lento o difíciles de cultivar, como Mycobacterium, Francisella, y también para buscar genes determinantes de resistencia bacteriana [92]. Por otro lado, hay que considerar la presencia de biopelículas tanto en las úlceras como en el hueso infectado en las cuales las bacterias sufren un proceso de adaptación que lleva consigo una menor facilidad de crecimiento en los medios de cultivo habituales y, en general, una mayor resistencia a los antibióticos, hechos que hay que tener en cuenta en el laboratorio de microbiología [93].
Los hemocultivos están indicados en las infecciones graves con síntomas sistémicos. Los cultivos del hueso ayudan a diagnosticar y tratar la osteomielitis y deben considerarse siempre que se plantee un tratamiento antibiótico prolongado [86].
TratamientoEl tratamiento del paciente diabético con una infección en el pie debe afrontarse bajo varios puntos de vista. Por un lado, aunque la antibioterapia desempeña un papel muy importante, el tratamiento quirúrgico (desbridamiento del tejido desvitalizado, drenaje de abscesos, revascularización, etc.) puede convertirse en algunos casos en un factor determinante para la curación. Otros aspectos de gran trascendencia en el tratamiento del pie diabético infectado son el adecuado control de la glucemia, la descarga de la zona del pie afectado, el uso apropiado de apósitos según el tipo de lesión y, por último, la valoración y la actuación frente a la osteomielitis cuando esté presente.
El tratamiento ideal de las infecciones del pie diabético es multidisciplinario. Resulta especialmente útil la colaboración de un equipo de especialistas (internista, infectólogo, endocrinólogo, ortopeda, cirujano general y vascular, microbiólogo, rehabilitador, etc.) en relación estrecha con otro de atención primaria, tanto a nivel médico como de enfermería, incluyendo si es posible a un podólogo.
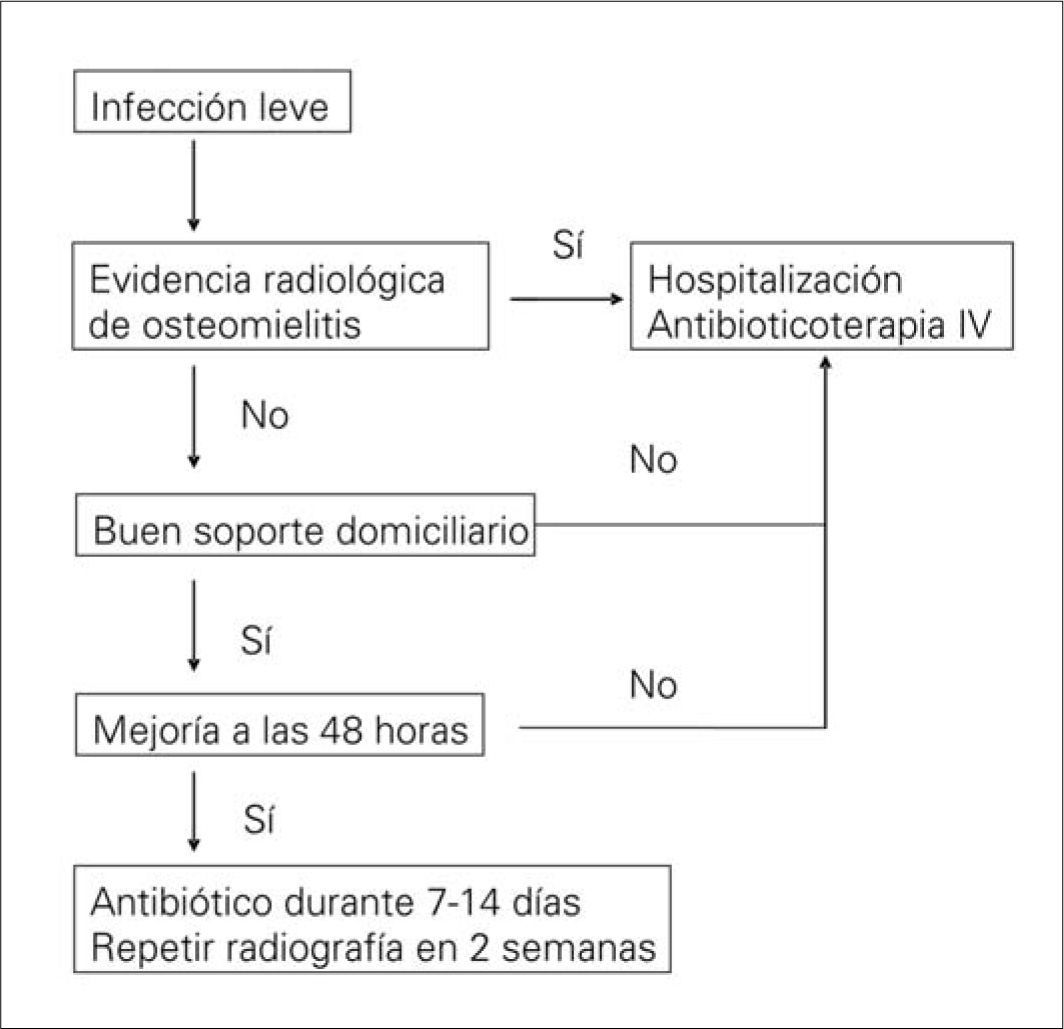
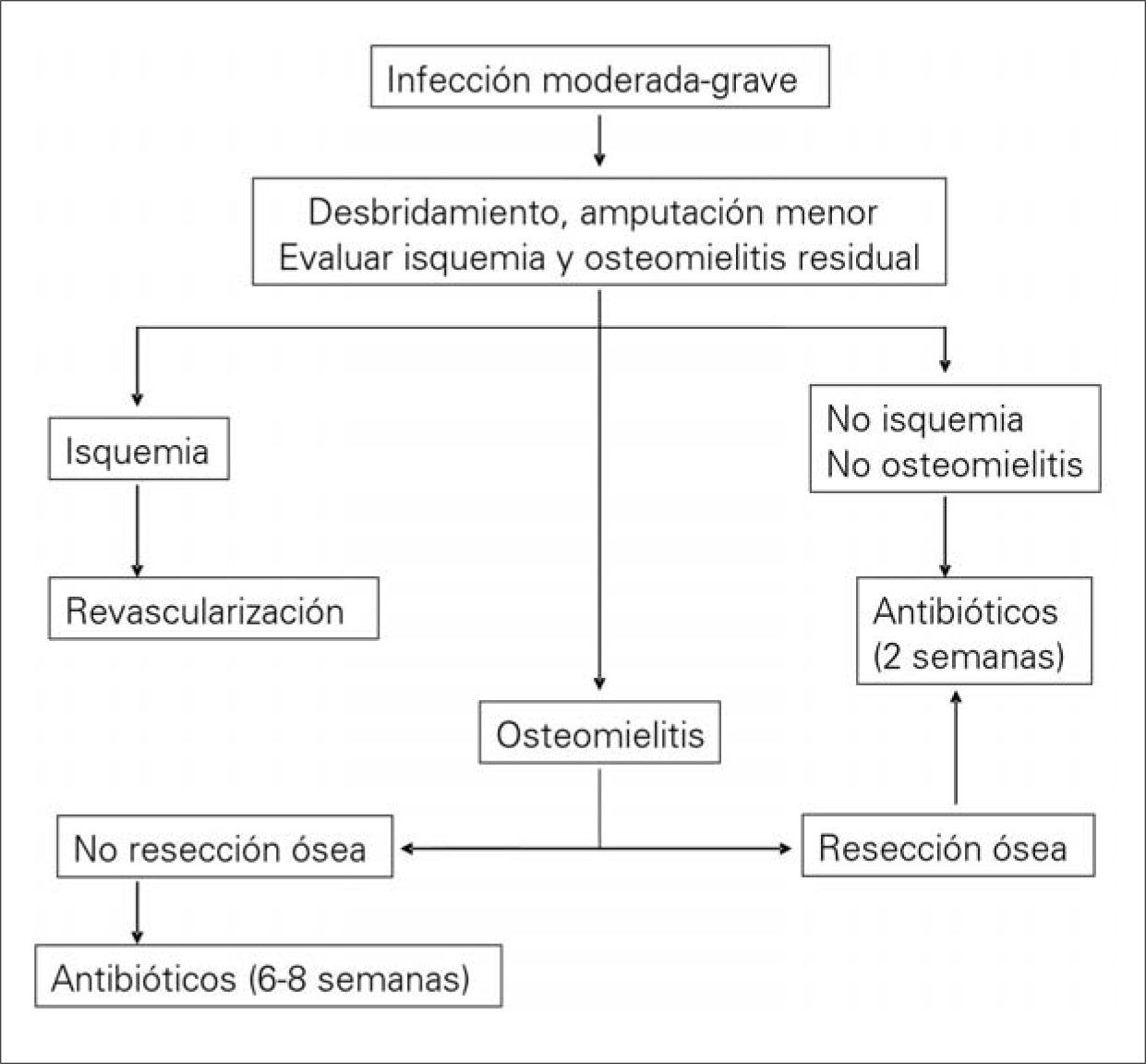
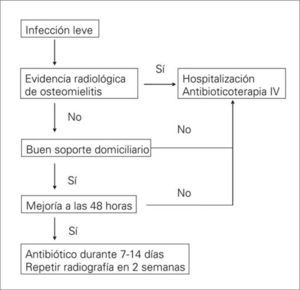
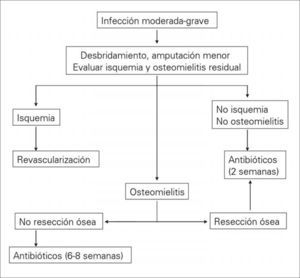
Cuando la gravedad de la lesión o las circunstancias sociofamiliares del paciente lo aconsejan, debe recomendarse la hospitalización. El objetivo del ingreso será controlar la infección (desaparición de los signos inflamatorios agudos y de la supuración) e integrar al paciente en el equipo multidisciplinario. Para ello, resulta de gran eficacia la utilización de una vía clínica [94]. Los pacientes que son dados de alta, así como los que no precisan hospitalización, deberían ser controlados en una consulta especializada, también multidisciplinaria, cuyo primer objetivo sea cicatrizar la úlcera para evitar reinfecciones y prevenir la recidiva de ésta u otras ulceraciones del pie y evitar su progresión si aparecen (consulta del pie diabético). Un esquema básico de tratamiento de las infecciones leves y moderadas-graves del pie diabético se muestra en las figuras 3 y 4, respectivamente.
Control de la glucemiaLa infección del pie diabético puede producir hiperglucemias graves. Las cifras de glucemia elevadas (> 250 mg/dL) se asocian, por un lado, a alteraciones de la función leucocitaria y un aumento de la tasa de infección postoperatoria y, por otro, cuando la glucemia excede el dintel renal de glucosa (160–180 mg/dL), a glucosuria con la consiguiente diuresis osmótica y depleción hidroelectrolítica. Cuando la glucemia supera los 250 mg/dL, debe descartarse la existencia de cetoacidosis diabéticas, mediante el cálculo del anión gap, gases arteriales en sangre y cuerpos cetónicos en orina y suero, y si se confirma esta situación, debe corregirse rápidamente [95].
Tratamiento quirúrgicoLa cirugía sigue siendo la piedra angular del tratamiento de las infecciones profundas de tejidos blandos. Cuando existen datos clínicos sugestivos de infección grave, rápidamente progresiva, profunda o necrosante de los tejidos blandos, con peligro para la vida del paciente, la exploración quirúrgica precoz no sólo es un elemento diagnóstico clínico, sobre todo en las fascitis necrosantes, y microbiológico de primer orden (obtención de muestras apropiadas), sino también una parte esencial del tratamiento para poder realizar desbridamientos [96].
El desbridamiento está siempre indicado en casi todas las úlceras infectadas del pie diabético, ya que transforma las lesiones crónicas en agudas y se ha mostrado muy eficaz en la consecución de un adecuado tejido de granulación [97]. Además, permite la obtención de muestras correctas para cultivo microbiológico del fondo de la úlcera. Puede realizarse con anestesia local en la cabecera del paciente.
En presencia de necrosis que afectan a uno o varios dedos y de abscesos plantares profundos, el desbridamiento debe ser mucho más extenso, incluyendo un amplio drenaje plantar de la infección profunda e incluso la amputación digital o del antepié cuando existe gangrena establecida en estos territorios. Esta intervención se realiza en quirófano bajo anestesia locorregional (bloqueo del tobillo o raquianestesia).
En los pacientes en los que se demuestra una perfusión arterial insuficiente del pie por medios no invasivos suele ser necesaria una arteriografía del miembro inferior con carácter urgente para valorar y realizar, si es posible, algún tipo de revascularización percutánea o quirúrgica. Cuando la revascularización no es posible, el desbridamiento del tejido necrótico o desvitalizado sigue siendo fundamental, aunque casi siempre es necesaria una amputación menor o mayor. En las afecciones graves del retropié, la mejor opción terapéutica suele ser la amputación infracondílea [76] (Fig. 4).
Tratamiento de la osteomielitisActualmente no existen protocolos terapéuticos basados en la evidencia por la carencia de rigurosos estudios clínicos prospectivos y aleatorizados para el tratamiento de las infecciones del pie diabético complicadas con osteomielitis. Las recomendaciones actuales se basan principalmente en estudios retrospectivos y en opiniones de expertos, persistiendo cierto grado de controversia.
Los principios del tratamiento de la infección en el hueso incluyen drenaje adecuado, desbridamiento extenso de todo el tejido necrótico, tratamiento del espacio muerto, cobertura con tejidos blandos adecuados y restauración de la irrigación arterial, aunque a veces resulta necesaria la amputación.
La enseñanza tradicional insiste en que es preciso resecar el hueso infectado, pero sus resultados no han sido muy satisfactorios; la amputación digital en solitario se ha asociado con tasas de curación alrededor del 40% [98,99]. El tratamiento antibiótico aislado es contradictorio, algunos autores han conseguido la curación de la osteomielitis en dos terceras partes de los casos [100,101], mientras que para otros la antibioterapia prolongada (6–12 semanas) en pacientes con osteomielitis de los dedos y/o el antepié se asoció con una peor evolución de la herida y mayores tasas de amputación, aconsejando que cuando se demuestra osteomielitis con hueso expuesto en el fondo de la úlcera, el tratamiento debe ser inicialmente quirúrgico [102].
La American Diabetes Association recomienda que se reseque todo o la mayor parte del hueso infectado si no existe compromiso para el funcionalismo del pie. Igualmente aconseja que en caso de osteomielitis extensa de las falanges o el metatarsiano se realice una amputación lo más distal posible con posibilidad de curar y devolver al paciente a una función óptima [12]. En todos los casos debe asociarse la administración de antibióticos, durante dos semanas si se extirpó todo el hueso infectado y al menos cuatro semanas si se adopta una actitud más conservadora con el hueso [86].
La osteomielitis focal puede tratarse mediante antibioterapia prolongada [103,104]. Se recomienda inicialmente intravenosa y posteriormente por vía oral. La duración debe ser de dos meses como mínimo y habitualmente entre tres y seis meses [86]. El tratamiento antibiótico inicialmente empírico se ajustará a los resultados de los cultivos óseos obtenidos en el momento del desbridamiento o por biopsia.
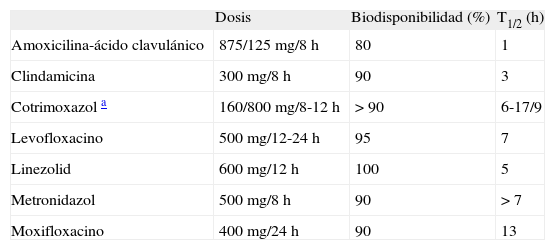
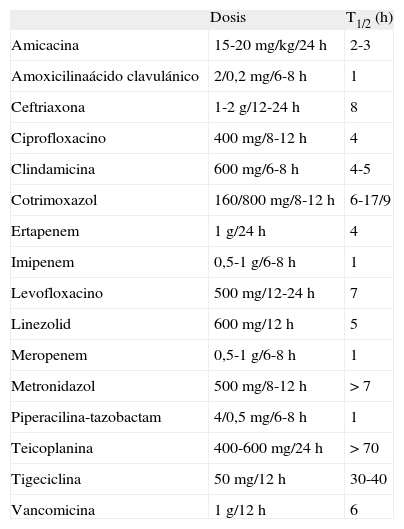
En general, el tratamiento que combina un adecuado desbridamiento de la cortical ósea, con cobertura con tejidos blandos, seguido de antibioterapia prolongada, dirigida según cultivo, se asocia con los mejores resultados (80% de respuestas óptimas) [105]. En las tablas V y VI se expresan los datos farmacocinéticos de los diferentes antibióticos orales e intravenosos.
Antibióticos orales: dosis y farmacocinética.
| Dosis | Biodisponibilidad (%) | T1/2 (h) | |
| Amoxicilina-ácido clavulánico | 875/125 mg/8 h | 80 | 1 |
| Clindamicina | 300 mg/8 h | 90 | 3 |
| Cotrimoxazol a | 160/800 mg/8-12 h | > 90 | 6-17/9 |
| Levofloxacino | 500 mg/12-24 h | 95 | 7 |
| Linezolid | 600 mg/12 h | 100 | 5 |
| Metronidazol | 500 mg/8 h | 90 | > 7 |
| Moxifloxacino | 400 mg/24 h | 90 | 13 |
Antibióticos intravenosos: dosis y farmacocinética.
| Dosis | T1/2 (h) | |
| Amicacina | 15-20 mg/kg/24 h | 2-3 |
| Amoxicilinaácido clavulánico | 2/0,2 mg/6-8 h | 1 |
| Ceftriaxona | 1-2 g/12-24 h | 8 |
| Ciprofloxacino | 400 mg/8-12 h | 4 |
| Clindamicina | 600 mg/6-8 h | 4-5 |
| Cotrimoxazol | 160/800 mg/8-12 h | 6-17/9 |
| Ertapenem | 1 g/24 h | 4 |
| Imipenem | 0,5-1 g/6-8 h | 1 |
| Levofloxacino | 500 mg/12-24 h | 7 |
| Linezolid | 600 mg/12 h | 5 |
| Meropenem | 0,5-1 g/6-8 h | 1 |
| Metronidazol | 500 mg/8-12 h | > 7 |
| Piperacilina-tazobactam | 4/0,5 mg/6-8 h | 1 |
| Teicoplanina | 400-600 mg/24 h | > 70 |
| Tigeciclina | 50 mg/12 h | 30-40 |
| Vancomicina | 1 g/12 h | 6 |
El reposo del miembro afectado, evitando la carga sobre el pie al caminar, resulta esencial para la resolución del cuadro y, posteriormente, para la curación de la úlcera. Aunque el reposo en cama es recomendable inicialmente tras el ingreso, después se facilitará un grado moderado de deambulación evitando por distintos medios el apoyo sobre la zona del pie afectada, al menos hasta dos semanas después de conseguir la curación completa [106].
En presencia de infección local es útil el zapato quirúrgico que permite el apoyo del pie sólo en la zona no lesionada. Una vez controlada la infección, el yeso de contacto total o una ortesis diseñada con los mismos principios, pero que permite la cura local diaria, serán determinantes para conseguir la cicatrización de la úlcera [106].
ApósitosEn presencia de una úlcera o herida abierta con infección asociada se recomienda mantener un ambiente húmedo sobre el lecho, una vez realizado el desbridamiento, para prevenir la pérdida de vitalidad tisular. Se ha demostrado que el medio húmedo facilita la migración celular a través del lecho de la herida y se promueve la angiogénesis y la síntesis de tejido conjuntivo [107]. El sistema clásico de gasas húmedas con suero fisiológico que se cambian cada ocho horas es el habitual en nuestros hospitales y el estándar con el que deben compararse otros apósitos más modernos, cuya eficacia en el tratamiento de la infección no está claramente definida. Por otro lado, la capacidad absorbente de muchos apósitos actuales permite mantenerlos durante 24 o 48 horas, aunque en general conviene inspeccionar la herida al menos una vez al día en presencia de infección asociada. Las características de la herida en cuanto a profundidad, infección asociada y cantidad de exudado irán variando con el tiempo, por lo que será preciso seleccionar el apósito más adecuado en cada momento [108].
Tratamiento antimicrobianoEl tratamiento antimicrobiano de las infecciones del pie diabético está condicionado por la isquemia que dificulta la llegada de los antibióticos al foco séptico, el deterioro de la función leucocitaria y la potencial insuficiencia renal en este tipo de pacientes [109]. La isquemia y las alteraciones de los leucocitos hacen que la respuesta de la infección al tratamiento sea peor en los diabéticos y haya empeoramientos rápidos, en horas o pocos días [109,110]. Los defectos funcionales de los neutrófilos en los diabéticos hacen aconsejable preferentemente el uso de antibióticos bactericidas y la prolongación del tratamiento; la isquemia condiciona el empleo de dosis de antibióticos elevadas, y la prevalencia de la insuficiencia renal conduce a evitar fármacos nefrotóxicos como los aminoglucósidos [106,109–112].
En las úlceras crónicas no está indicado, como norma general, el uso de antibióticos por un cultivo positivo, sino por criterios clínicos de infección, como se ha comentado anteriormente [112].
La gravedad de la infección condiciona la selección del tratamiento antimicrobiano empírico, el lugar donde se realiza y la vía de administración. Las infecciones superficiales y leves pueden tratarse en el domicilio con antibióticos orales con actividad sobre cocos grampositivos aerobios (S. aureus y estreptococos) y de buena biodisponibilidad [112,113]. Una opción apropiada es la amoxicilina-ácido clavulánico, y en caso de alergia a los betalactámicos puede utilizarse levofloxacino, clindamicina o, en caso de SARM, cotrimoxazol (Tabla VII).
Tratamiento antibiótico empírico de las infecciones del pie diabético.
| Infección | Primera elección | Alternativa |
| Leve | Amoxicilina-ácido clavulánico VO | Levofloxacino o moxifloxacino VOClindamicina VOCotrimoxazol VO |
| Moderadagrave | Ertapenem IV±Linezolid IV/VO o glucopéptido IV | Piperacilina-tazobactam IVoAmoxicilina-ácido clavulánico IVoCefalosporina de tercera generación IV o fluoroquinolonaa IV/VO + metronidazol IV/VO o clindamicina IV/VO±Linezolid IV/VO o glucopéptido IV |
| Muy grave | Imipenem o meropenem IVoPiperacilina-tazobactam IV+Linezolid IV o glucopéptido IV | Tigeciclina IV±Fluoroquinolonaa IV o amikacina IV |
Debe supervisarse a los enfermos a los pocos días del inicio para ver la evolución clínica y descartar una posible mala evolución de la infección. La duración del tratamiento en estos casos puede ser suficiente con 7–14 días. En las infecciones moderadasgraves que amenazan la viabilidad del miembro afectado se aconseja el tratamiento intravenoso y de amplio espectro por la naturaleza polimicrobiana de las mismas, durante 2–4 semanas. Por su gran prevalencia los antibióticos deben ser activos frente a los siguientes microorganismos: cocos grampositivos aerobios (Staphylococcus spp. y Streptococcus spp.), bacilos gramnegativos aerobios (enterobacterias) y anaerobios (Streptococcus spp., Peptostreptococcus spp. y Bacteroides spp.) [106,112,113]. En esta situación se puede emplear ertapenem [114] –una cefalosporina de tercera generación– más metronidazol [115] amoxicilina-ácido clavulánico [116] o piperacilina-tazobactam [117], este último en caso de sospecha de participación de P. aeruginosa. El ertapenem parece la primera opción por vía parenteral [114,118] debido a la facilidad de uso (monoterapia y en dosis única diaria), su adecuado espectro antimicrobiano que incluye, además, las enterobacterias productoras de betalactamasas de espectro extendido, la penetración en los tejidos blandos y la experiencia clínica favorable. La adición de linezolid o un glucopéptido (vancomicina o teicoplanina) debe considerarse ante: a) aislamiento de SARM; b) riesgo de colonización por este microorganismo -reciente infección por SARM, antibioterapia o ingreso en hospitales o residencias de ancianos con alta prevalencia de este microorganismo (≥ 15%)–; o c) cuando el paciente está lo suficientemente grave como para no permitir errores en el tratamiento empírico [116,119]. En las infecciones muy graves que amenazan la vida del paciente, las que hayan sido tratadas recientemente o en las que no responden a la terapia inicial, deben darse cobertura a microorganismos menos habituales como Enterococcus spp., estafilococos coagulasa-negativos, SARM y P. aeruginosa, para lo cual es útil emplear un betalactámico antipseudomonas asociado a linezolid o un glucopéptido (Tabla VII) [116,117,120]. En caso de alergia a betalactámicos puede usarse tigeciclina asociada a una fluoroquinolona (levofloxacino o ciprofloxacino) o a amicacina para abarcar a P. aeruginosa[121].
En la actualidad no se puede precisar el significado clínico del hallazgo de ciertos microorganismos como Enterococcus spp., S. epidermidis, estreptococos del grupo Viridans y Corynebacterium spp. En muchas ocasiones se comportan como meros contaminantes, pero también se ha sugerido que, solos o de forma sinérgica con otros agentes claramente patógenos, podrían ser los elementos causales del proceso, sobre todo si se tiene en cuenta la disminución de la actividad local de las defensas en estos enfermos y, en particular, cuando se aíslan repetida y persistentemente en las muestras obtenidas [112].
El fracaso del tratamiento antibiótico bien dirigido puede deberse a un cambio etiológico (desarrollo de resistencias o sobreinfección) o a la extensión de la infección al hueso, lo cual obliga a un nuevo desbridamiento y a hacer más cultivos, incluidos los del tejido óseo [112].
Desde un punto de vista terapéutico hay que tener en cuenta que los enfermos hospitalizados o los que hayan recibido tratamientos prolongados con antibióticos de amplio espectro pueden estar predispuestos a la infección por bacterias resistentes a los antibióticos, como SARM o Enterococcus spp. resistentes a los glucopéptidos [71]. En el caso de S. aureus, con sensibilidad intermedia a los glucopéptidos, es de interés hacer notar que los dos primeros casos descritos en la bibliografía científica estaban asociados a enfermos diabéticos con úlceras crónicas infectadas y politratadas [122]. Por otro lado, si bien antes el SARM era patrimonio de los enfermos hospitalizados, ahora cada vez es más común en la comunidad [123,124].
Este documento ha contado con el apoyo de Merck Sharp and Dohme de España S.A. para su realización.