Introducción. La pared vascular se encuentra en remodelación constante por las metaloproteinasas de matriz (MMP) y sus inhibidores TIMP-1 y TIMP-2. Las estatinas han demostrado que modifican la expresión de varias de estas proteínas. Objetivo. Determinar, en muestras de aneurismas de aorta abdominal (AAA) humanos, los efectos de la pravastatina sobre las concentraciones de MMP-9, TIMP-1 y TIMP-2. Materiales y métodos. Se seleccionaron 13 pacientes con AAA infrarrenal que iban a ser intervenidos de forma convencional, y se recogieron muestras de tejido aórtico durante la cirugía. Estas muestras fueron incubadas in vitro con pravastatina o sin ella (en concentración de 10-6mol/L) durante 48 horas, y después se analizaron las concentraciones de MMP-9, TIMP-1 y TIMP-2. Resultados. No se hallaron diferencias en la cantidad de MMP-9 total contenida en las biopsias de AAA incubadas con pravastatina o sin ella. Las concentraciones de TIMP-1 aumentaron de manera significativa en las muestras incubadas con pravastatina. Sin embargo, la producción de TIMP-2 no se vio modificada. Conclusión. La pravastatina produjo un incremento en la producción de TIMP-1 en muestras de AAA humanos, sin modificación de la actividad de MMP-9 ni de TIMP-2. [ANGIOLOGÍA 2009; 61:13–9]
Introduction. The vascular wall is constantly being remodelled by matrix metalloproteases (MMP) and their inhibitors TIMP-1 and TIMP-2. There is evidence to show that statins modify the expression of several of these proteins. Aim. To determine the effects of pravastatin on concentrations of MMP-9, TIMP-1 and TIMP-2, using samples of human abdominal aortic aneurysms (AAA). Materials and methods. Thirteen patients with infrarenal AAA who were going to undergo conventional surgery were selected and, later, aortic tissue samples were collected during the operation. These samples were incubated in vitro with pravastatin or without it (in a 10-6mol/L concentration) for 48 hours, and then MMP-9, TIMP-1 and TIMP-2 concentrations were analysed. Results. No differences were found in the total amount of MMP-9 contained in the biopsy samples of AAA incubated with or without pravastatin. TIMP-1 concentrations increased significantly in the samples incubated with pravastatin. The production of TIMP-2, however, remained unchanged. Conclusions. Pravastatin triggered an increase in TIMP-1 production in human AAA samples, without altering MMP-9 or TIMP-2 activity. [ANGIOLOGÍA 2009; 61: 13–9]
En las últimas décadas nuestra especialidad ha experimentado un enorme desarrollo, y en la actualidad se cuenta con mejores métodos diagnósticos y con nuevos fármacos y técnicas quirúrgicas. Sin embargo, aún queda mucho por investigar acerca de la etiopatogenia de las enfermedades del sistema vascular en general. Es a este ámbito al que deberíamos destinar más esfuerzos para lograr lo que pretendemos, que es la prevención, como primer paso y, cuando ésta no es posible, la realización de un tratamiento eficaz, duradero y cada vez menos agresivo para el paciente.
Esta tesis se ha centrado en una de estas áreas todavía objeto de estudio: la enfermedad aneurismática. En este artículo se expondrá parte del trabajo realizado en ella. Asimismo, éstos y otros datos han servido como base para otra publicación de nuestro grupo [1].
La forma más frecuente de enfermedad aneurismática son los aneurismas de la aorta abdominal (AAA), con una prevalencia estimada comprendida entre el 1,3 y el 8,9% en hombres y entre el 1 y el 2,2% en mujeres [2].
Entre las potenciales complicaciones de estos aneurismas es el peligro de rotura, con la consiguiente muerte por shock hipovolémico, lo que hace que se conviertan en una condición patológica extremadamente importante. Se estima que la rotura de los AAA produce unas 15.000 muertes todos los años en los Estados Unidos, y se trata de la décima causa de muerte en hombres mayores de 55 años.
En la actualidad se acepta que los pacientes con aneurismas asintomáticos con un diámetro superior a 5–5,5cm o que se encuentran en rápido crecimiento, así como todos los pacientes con aneurismas que produzcan síntomas, deben ser intervenidos si el riesgo quirúrgico y las enfermedades concomitantes lo permiten. El tratamiento de elección actual es el quirúrgico, y el endovascular se reserva para los casos de riesgo elevado. No se ha encontrado todavía un tratamiento médico que pueda frenar el crecimiento o hacerlos involucionar.
A pesar de la importancia de esta entidad, quedan aún muchas cuestiones por determinar. En los últimos años, sin embargo, se han producido algunos avances en el conocimiento de su fisiopatología. A grandes rasgos, un estímulo inicial (desconocido en el momento actual) produciría una reacción inflamatoria en la pared arterial. A continuación, la secreción de mediadores inflamatorios desencadenaría la liberación de metaloproteasas y sus inhibidores [3]. Estudios realizados durante la última década han demostrado la importancia de las metaloproteinasas (MMP), enzimas remodeladoras de la matriz extracelular, en la formación de los AAA, ya que alteran los patrones de colágeno y de elastina [4]. Entre los distintos tipos de MMP, la MMP-9 desempeña un papel primordial en el desarrollo de los aneurismas: es la gelatinasa más abundante en el tejido aneurismático y se encuentran concentraciones elevadas de ella en biopsias de AAA [5].
Las MMP están reguladas por una serie de mecanismos intracelulares y extracelulares, entre los que se encuentran los inhibidores tisulares de metaloproteinasas (TIMP). Entre los inhibidores, TIMP-1 es un inhibidor específico de la MMP-9 [6], mientras que TIMP-2 actuaría como cofactor en la activación de otra metaloproteasa, MMP-2 [7]. Como ya se ha comentado, la liberación exagerada de metaloproteasas que se produce en la formación de los AAA no se compensa con una liberación suficiente de sus inhibidores, lo que lleva a la destrucción del colágeno y de la elastina de la pared arterial.
Los fármacos inhibidores de la 3-hidroxi-metilglutaril coenzima A reductasa (estatinas) han demostrado que reducen la morbimortalidad en pacientes con enfermedad cardiovascular [8], no sólo mediante la reducción de las concentraciones de colesterol, sino también gracias a otros efectos independientes del colesterol entre los que se incluyen la mejoría de la función endotelial, la disminución de la inflamación en la pared arterial y la estabilización de la placa de ateroma [9]. En este sentido, existen trabajos que demuestran que las estatinas producen un descenso de las concentraciones de MMP-9 [10]. En estudios realizados en modelos animales también se ha comprobado que las estatinas disminuyen la formación de AAA experimentales [11]. Además, en pacientes en tratamiento con estatinas se ha observado que, en los que presentan AAA, el tratamiento con este tipo de fármacos se asocia con un descenso de la velocidad de expansión del aneurisma [12].
La hipótesis de este trabajo, basándose en las evidencias mencionadas hasta ahora, es que una estatina, la pravastatina, podría ser capaz de reducir la reacción inflamatoria sobre la pared aneurismática en muestras de AAA humanos. Para ello, se estableció el objetivo de determinar en cultivos de aorta abdominal aneurismática humana el efecto de la pravastatina sobre las concentraciones de MMP-9, TIMP-1 y TIMP-2.
Materiales y métodosPacientesLas muestras fueron obtenidas de 13 pacientes con AAA infrarrenal que fueron intervenidos de forma programada mediante cirugía abierta. El número de pacientes elegido se basó en estudios previos [13], en los que se habían obtenido resultados significativos.
De estos enfermos, ninguno presentaba un aneurisma inflamatorio o infeccioso. Tampoco habían recibido tratamiento previo con estatinas. El estudio fue aprobado por el Comité Ético Institucional del Hospital Clínico San Carlos. Se informó a los pacientes y se entregó un consentimiento informado realizado específicamente para este fin.
Obtención de muestrasLas muestras se recogieron durante la intervención quirúrgica del aneurisma. Se obtuvieron porciones de tejido aórtico en la zona dilatada de unos 2×2cm. Se mantuvieron en tampón salino fosfatado del tipo Dulbecco hasta su fragmentación y cultivo.
Incubación de células aórticasLas piezas fueron fragmentadas e incubadas durante 48 horas a 37°C bajo condiciones estériles en medio RPMI 1640 sin rojo fenol (que contenía un 1% de suero fetal bovino), tanto con pravastatina como sin ella (10-6mol/L). Las concentraciones del fármaco elegidas se basan en trabajos previos que demuestran que rangos similares pueden afectar a la funcionalidad vascular [13]. Tras la incubación se tomaron tanto el sobrenadante como el tejido aórtico cultivado, de modo que se pudieran medir tanto las proteínas secretadas como las almacenadas intracelularmente. Estas muestras fueron congeladas de inmediato para realizar las determinaciones bioquímicas.
Determinación de las concentraciones de MMP-9, TIMP-1 y TIMP-2Las proteínas fueron extraídas de las muestras de aorta mediante homogeneización en tampón Tris a un pH de 7,5 que contenía 75mmol/L de NaCl y 1mmol/L de fenilmetil sulfonil fluoruro. Las concentraciones de TIMP-1 y TIMP-2, así como las de MMP-9 total y activa, se determinaron mediante la técnica ELISA (enzyme linked immunosorbent assay) usando anticuerpos específicos. Los equipos empleados son de Amersham Biosciences (Buckinghamshire, Reino Unido). La técnica empleada para MMP-9 reconoce tanto la proenzima como la forma activa y no posee reactividad cruzada con otras MMP o TIMP. La sensibilidad de los análisis ELISA fue de 0,5ng/mL para MMP-9, de 1,25ng/mL para TIMP-1 y de 3ng/mL para TIMP-2. Los análisis se realizaron por duplicado según lo indicado en el protocolo de los equipos, y se empleó la media aritmética para el análisis de los datos.
Análisis estadísticoLos resultados se expresaron como la media±desviación estándar. Para determinar la significación estadística se empleó el test de Mann–Whitney, considerándose como significativo un valor de p<0,05. Se empleó el paquete estadístico SPSS versión 10.0.
ResultadosCaracterísticas de los pacientesLas características y factores asociados de los 13 pacientes de los que se obtuvieron las muestras fueron los propios de esta enfermedad y se resumen en la tabla I.
Características clínicas de los 13 pacientes sometidos a reparación de aneurisma de aorta abdominal (AAA).
| Muestra | |
| Edad media, años (rango) | 69±5 (60–76) |
| Sexo (hombre) | 11 (85%) |
| Diámetro del AAA, mm (media±DE) | 63,8±17,1 |
| Factores de riesgo cardiovascular | |
| Hipertensión arterial | 8 (61,5%) |
| Diabetes | 0 |
| Hipercolesterolemia | 8 (61,5%) |
| Fumadora | 10 (76,9%) |
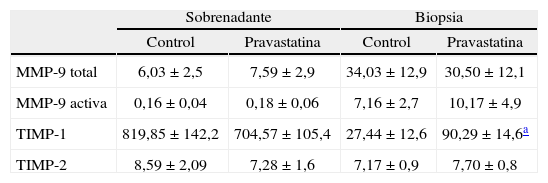
No se hallaron diferencias significativas en el contenido de MMP-9 total en los fragmentos de tejido aórtico (biopsias) incubados tanto con pravastatina como sin ella. Tampoco se modificaron las concentraciones de MMP-9 total encontradas en los sobrenadantes al incubar las muestras con pravastatina. El valor de la fracción activa de MMP-9 contenida tanto en el tejido de AAA como en el sobrenadante no se vio modificado de forma estadísticamente significativa al incubarlo con pravastatina (Tabla II).
Concentraciones de MMP-9, TIMP-1 y TIMP-2 en aneurismas de aorta abdominal (AAA) humanos incubados con pravastatina y sin ella (10-6mol/L).
| Sobrenadante | Biopsia | |||
| Control | Pravastatina | Control | Pravastatina | |
| MMP-9 total | 6,03±2,5 | 7,59±2,9 | 34,03±12,9 | 30,50±12,1 |
| MMP-9 activa | 0,16±0,04 | 0,18±0,06 | 7,16±2,7 | 10,17±4,9 |
| TIMP-1 | 819,85±142,2 | 704,57±105,4 | 27,44±12,6 | 90,29±14,6a |
| TIMP-2 | 8,59±2,09 | 7,28±1,6 | 7,17±0,9 | 7,70±0,8 |
Los valores se representan como media±DE en ng/mL.
La concentración de TIMP-1 aumentó de forma significativa tras la incubación con pravastatina en las muestras de tejido, aunque no en el sobrenadante (Tabla II). La producción de TIMP-2 no se vio modificada por la pravastatina ni en el sobrenadante ni en el tejido (Tabla II).
DiscusiónEn los últimos años se ha avanzado en el conocimiento de la etiopatogenia de los AAA: la degeneración aneurismática incluye la remodelación/destrucción de la matriz celular de la pared aórtica, lo que se asocia con inflamación crónica y sobreproducción de MMP. En este sentido, estudios previos han demostrado valores elevados de metaloproteinasas y, en especial, de MMP-9 en pacientes con AAA [5]. Se ha propuesto que la MMP-9 sería un potencial predictor de la historia natural del aneurisma [14]. Se ha observado que las concentraciones elevadas de MMP-9 detectadas en pacientes con AAA disminuyen de manera significativa tras la reparación quirúrgica [15]. En los trabajos realizados en modelos animales también se ha constatado el papel fundamental de la MMP-9 en el desarrollo de los AAA, de modo que la supresión de este gen puede evitar la formación de aneurismas experimentales [16].
Dada la evidente implicación de la MMP-9 en la patogenia de los aneurismas, conseguir su reducción en pacientes con AAA podría llevar a disminuir la progresión de éstos o incluso a lograr su desaparición. En esta línea de estudio, se ha demostrado que las estatinas reducen la expresión de diferentes proteínas, entre ellas las MMP [5, 10]. También en estudios realizados con modelos animales se ha observado que el tratamiento con estatinas disminuye el crecimiento de aneurismas experimentales [11].
Entre las estatinas, la pravastatina no se une a la albúmina y tampoco es metabolizada por el citocromo P450, por lo que son menos probables las interacciones medicamentosas. Dado el bajo perfil de riesgo de este fármaco, y ante la evidencia precedente en cuanto a los efectos de las estatinas sobre MMP y los AAA, el presente trabajo partía de la hipótesis de que la pravastatina podría disminuir la producción de MMP-9 en cultivos de AAA humanos y, así, tener un potencial efecto terapéutico en esta enfermedad. Sin embargo, los hallazgos obtenidos no han confirmado esta suposición inicial, ya que la pravastatina no alteró ni la MMP-9 total ni la activa.
Es importante mencionar que no se disponía de fragmentos de aorta normal, no aneurismática, con los que comparar, por lo que no pudo determinarse si la actividad de MMP-9 estaba aumentada en nuestras muestras. En este sentido, se ha descrito que la actividad de MMP-9 es significativamente menor en AAA de gran tamaño. Por lo tanto, el efecto de las estatinas, y de la pravastatina en este estudio, sobre la MMP-9 podría ser menos evidente en este tipo de aneurismas. Esto estaría relacionado con el trabajo de Mosorin et al [17], en el que se demostró que los pacientes en tratamiento con estatinas presentaban una mayor supervivencia libre de rotura o reparación de su AAA y que este efecto era más evidente en pacientes con un diámetro basal del aneurisma inferior a 40mm.
La interacción entre MMP-9 y TIMP-1ha surgido como un mediador potencialmente importante de la degradación de la elastina y del colágeno en la pared aórtica [6]. Los datos hallados en esta tesis han demostrado que la pravastatina aumenta las concentraciones de TIMP-1 de forma estadísticamente significativa en las muestras de tejido de AAA, pero no en el sobrenadante. Esto indicaría que la pravastatina actuaría aumentando la expresión y la síntesis de TIMP-1.
En este sentido, varios trabajos han demostrado previamente un aumento de la actividad de MMP-9 en muestras de tejido de AAA en condiciones basales, sin alteración en las concentraciones de ARNm de TIMP-1 [6]. En cambio, otros autores han indicado que se produce una disminución de TIMP-1 en los AAA, lo que predispondría a la formación de aneurismas [18]. Como ya se ha comentado, en este trabajo no se realizaron análisis en grupos control respecto a pacientes con AAA, por lo que no podemos obtener conclusiones a este respecto. Independientemente de que TIMP-1 se encuentre disminuido o no basalmente en los AAA humanos, los datos obtenidos en nuestro estudio señalan que la pravastatina aumentó el contenido de TIMP-1 en las muestras de AAA.
El hecho de que la pravastatina incremente las concentraciones de TIMP-1, sin modificar las de MMP-9, podría parecer paradójico. En el estudio realizado por Nagashima et al [13] en el que se evaluó el efecto de otra estatina, la cerivastatina, sobre cultivos de aorta, se encontraron datos opuestos: una disminución de las concentraciones de MMP-9 sin modificaciones de las de TIMP-1. Aparte de lo ya comentado sobre las concentraciones de MMP-9 en aneurismas de gran tamaño, otra explicación añadida a esta aparente contradicción podría encontrarse en el modo de actuación de cada estatina sobre la supresión del fenómeno inflamatorio en el interior del AAA. Los resultados publicados en relación con el marcador inflamatorio proteína C reactiva [19] en pacientes con AAA son una muestra de la participación de la inflamación en la etiopatogenia de éstos. Sin embargo, el proceso inflamatorio es un proceso complejo en el que interactúan múltiples factores, de modo que la modificación en alguna de sus fases o vías de activación puede conllevar cambios a distintos niveles. Así lo han interpretado Shiraya et al [20] en el trabajo realizado sobre modelos animales de AAA. Han observado que la atorvastatina no disminuye de forma significativa la expresión de MMP-2, MMP-3 o MMP-9. En cambio, sí se observa una disminución en MMP-12, así como una inhibición de la expresión de ICAM y MCP-1 y una supresión de la migración de macrófagos a la pared aórtica, lo que estaría relacionado con la disminución del diámetro aneurismático en las ratas tratadas con el fármaco.
En este trabajo, las concentraciones de TIMP-2 no se modificaron con la administración de pravastatina. En los estudios publicados [11, 13] se han analizado los valores de MMP-9 y de TIMP-1 en el tratamiento con estatinas, sin que se hayan evaluado los de TIMP-2. Este inhibidor de las MMP posee una alta afinidad por MMP-2. El efecto de TIMP-2 es algo más complejo debido a las interacciones con MT1-MMP. Se ha observado que, a altas concentraciones, TIMP-2 inhibe selectivamente la actividad de MMP-2 in vitro. Sin embargo, en bajas concentraciones, TIMP-2 aumenta pro-MMP-2 y activa MMP-2 mediante la formación de un complejo trimolecular compuesto por MT1-MMP, TIMP-2 y pro-MMP-2 [7].
Por tanto, TIMP-2 actuaría como un cofactor en la activación de MMP-2, por lo que, a pesar de pertenecer a la familia de los inhibidores de las metaloproteasas, favorecería la formación de los aneurismas. En nuestro caso no hemos observado cambios de las concentraciones de TIMP-2. Son necesarios aún más estudios en los que se evalúe la respuesta de la TIMP-2 al tratamiento con estatinas.
Entre las limitaciones de este trabajo, como ya hemos reflejado, no se ha incluido grupo control de pacientes, con muestras de aortas sanas o patología oclusiva. Sin embargo, la finalidad principal del trabajo era estudiar el efecto de la pravastatina específicamente sobre la enfermedad aneurismática, aunque la comparación con tejido aórtico distinto de AAA podría haber aportado datos complementarios.
Tampoco se realizó un estudio histológico o inmunohistoquímico, que podría haber sido útil para observar morfológicamente los cambios en células de músculo liso o para localizar la producción de MMP-9, TIMP-1 o TIMP-2 en distintos tipos celulares.
Finalmente, el estudio se realizó sobre cultivos de células de aorta abdominal aneurismática, por lo que hay que contar con la limitación intrínseca que supone un estudio in vitro, que no refleja las distintas interacciones que tendrán lugar en el conjunto del organismo.
En esta tesis se ha planteado el estudio del efecto de una estatina, la pravastatina, sobre distintos parámetros relacionados con la inflamación y la patogenia de los AAA, en cultivos de células de aorta abdominal aneurismática humana. Por primera vez se establece in vitro el efecto de la pravastatina en este contexto: la pravastatina aumenta las concentraciones de TIMP-1 en las biopsias de AAA humano, sin modificar las concentraciones de MMP-9 ni de TIMP-2.
Tesis leída en la Facultad de Medicina de la Universidad Complutense de Madrid, en julio de 2007. Premio Servier a la mejor tesis doctoral, 54.° Congreso Nacional de la SEACV Barcelona, junio de 2008.
Agradecimientos. A los Dres. G. Moñux, F.J. Serrano y A. López Farré, directores de esta tesis, y a los miembros del Servicio de Cirugía Vascular y del Laboratorio del Instituto Cardiovascular del Hospital Clínico San Carlos de Madrid.
Este trabajo recibió para su realización una beca de Sankyo España.