La angioplastia de troncos distales es una intervención segura y eficaz, y puede ser de elección en el tratamiento de la isquemia crítica. La estrategia revascularizadora siguiendo el modelo angiosoma puede demostrar superiores beneficios en la curación de las lesiones y en el rescate de las extremidades isquémicas. Este concepto propone dedicar los esfuerzos para llevar flujo arterial a las áreas específicas del pie que presentan isquemia o pérdida tisular, ya sea de forma directa o indirecta. Pero aún necesitamos estudios amplios, prospectivos y comparativos que permitan validar su real aplicabilidad y utilidad. Junto a la revascularización el control agresivo de los factores de riesgo y los cuidados directos sobre las lesiones representan un papel fundamental en el éxito del tratamiento. Esta revisión analiza las más recientes publicaciones que comparten el modelo angiosoma en el tratamiento de la isquemia crítica.
Angioplasty is a feasible, safe, and effective procedure, and can be the procedure of choice for treatment of critical limb ischemia. Targeted primary angioplasty following the angiosome model may prove beneficial in terms of better wound healing and subsequent limb salvage. This concept may allow deliberately focusing arterial flow reconstruction in specific limb ischemia areas that exhibit tissue loss and fluctuating “rescue-vessels” supply. Further technical improvements and large comparative studies and prospective data are also needed to make a proper clinical validation. As well as appropriate revascularization, aggressive control of concurrent risk factors in wound healing also play an important role. The present paper proposes a review of the main contemporary publications that share this theory on the treatment of critical limb ischemia.
Las recientes publicaciones acerca del tratamiento endovascular (TEV) en la isquemia crítica (IC) de los miembros inferiores aportan resultados óptimos sobre la curación de las lesiones isquémicas, preservación de la extremidad y recuperación funcional comparándolas con la cirugía convencional1–4. Pero las lesiones isquémicas del pie que pueden conducir a pérdida de la extremidad tienen pocas posibilidades de curación, a pesar de revascularizaciones quirúrgicas o endovasculares exitosas, si las arterias que irrigan las «zonas-diana» donde asientan las lesiones no se revascularizan5.
Taylor y Palmer6 desarrollaron en 1987 un modelo de división anatómica del cuerpo en territorios vasculares tridimensionales que denominaron «angiosomas», concepto aplicado inicialmente al estudio de la vascularización de la piel y de los colgajos cutáneos.
Su incorporación al lenguaje de los cirujanos vasculares y de otras especialidades que trabajan en el territorio de las arterias distales (angiorradiólogos y cardiólogos hemodinamistas) ha sido paulatina desde hace una década, a partir de los trabajos de Attinger7.
La IC está causada por arteriopatía en múltiples niveles, pero invariablemente afecta a las arterias más distales de la extremidad. Aunque la angioplastia distal ofrezca una tasa de permeabilidad moderada a medio plazo, la baja tasa de complicaciones y de morbimortalidad, el poderla ofrecer a pacientes añosos o de alto riesgo y la posibilidad de repetir los procedimientos parecen razones de peso para indicar como primera opción el TEV8,9.
La tendencia actual es el aumento exponencial de las técnicas de TEV en detrimento de las técnicas de derivación arterial10,11. El TEV puede ser la primera indicación, sobre todo si la expectativa de vida del paciente es baja o convive con severa comorbilidad, si hay severa arteriopatía distal o si no hay vena safena adecuada para injerto12. La angioplastia distal ofrece la posibilidad de recanalizar múltiples arterias (lo que no consigue la cirugía) con tasas de rescate de extremidad comparables o mejores a la revascularización quirúrgica, pero siendo menos «invasiva» y con estancias hospitalarias más cortas13–16. Otros autores siguen defendiendo la superior respuesta a la revascularización directa de arterias distales si es anatómicamente posible17,18.
En la IC los objetivos de la revascularización (tabla 1) pretenden aumentar el flujo arterial global a la extremidad, evitar el dolor de reposo, mejorar la curación de las lesiones, reducir el nivel de amputación, disminuir la duración y el número de hospitalizaciones y mejorar la movilidad, la calidad de vida y la supervivencia19. Es más importante el salvamiento de la extremidad que demostrar una mayor o menor duración de la permeabilidad a largo plazo. Como se precisa menos flujo arterial para mantener la integridad tisular que para curar una herida, la reestenosis no siempre provocará nuevos episodios de IC, salvo que reaparezca una lesión en el pie.
Objetivos del tratamiento endovascular en isquemia crítica
| Aumentar el flujo arterial al miembro isquémico |
| Conseguir al menos un flujo pulsátil |
| Mejorar la curación de la úlcera isquémica |
| Mejoría o desaparición del dolor en reposo |
| Evitar o reducir el nivel de amputación |
| Reducir la duración y el número de hospitalizaciones |
| Mejorar la movilidad |
| Mejorar la calidad de vida |
| Mejorar la supervivencia |
El modelo angiosoma (MA), a pesar de los pocos años de su vigencia, ha experimentado un interés inusitado, aunque la recopilación de todo lo publicado hasta ahora apenas supera la veintena de trabajos en los últimos 3 años (tabla 2).
Publicaciones que relacionan el modelo angiosoma con la revascularización en isquemia crítica
| Autor | Publicación |
| Alexandrescu26 | J Endovasc Ther 2008;15: 580-593 |
| Neville44 | Ann Vasc Surg 2009;3: 367-373 |
| Iida45 | Catheter Cardiovasc Interv 2010;75:830-836 |
| Bazan69 | Catheter Cardiovasc Interv 2010:75:837 |
| Setacci27 | J Cardiovasc Surg 2010;51:223-231 |
| Varela49 | Vasc Endovascular Surg 2010;44:654-60 |
| Clemens72 | Foot Ankle Clin N Am 2010;15:439-464 |
| Terashi59 | Plast Reconstr Surg. 2010;126:215e-218e |
| Manzi28 | Radiographics 2011;31:1623-36 |
| Alexandrescu43 | Diabetes Metab Syndr Obes 2011;4:327-336 |
| Iida47 | JACC 2011;57:14 |
| Alexandrescu51 | J Endovasc Ther 2011;18:376-387 |
| Alexandrescu52 | Cardiovascular Revascularization Medicine 2011,12:10-19 |
| Utsunomiya56 | J Vasc Surg. 2012;55:113-21 |
| Iida46 | J Vasc Surg 2012;55:363-370 |
| Alexandrescu70 | J Cardiovasc Surg 2012;53:3-12 |
Con esta revisión se pretende poner al día este novedoso concepto y su importancia real en la estrategia revascularizadora de la isquemia crítica.
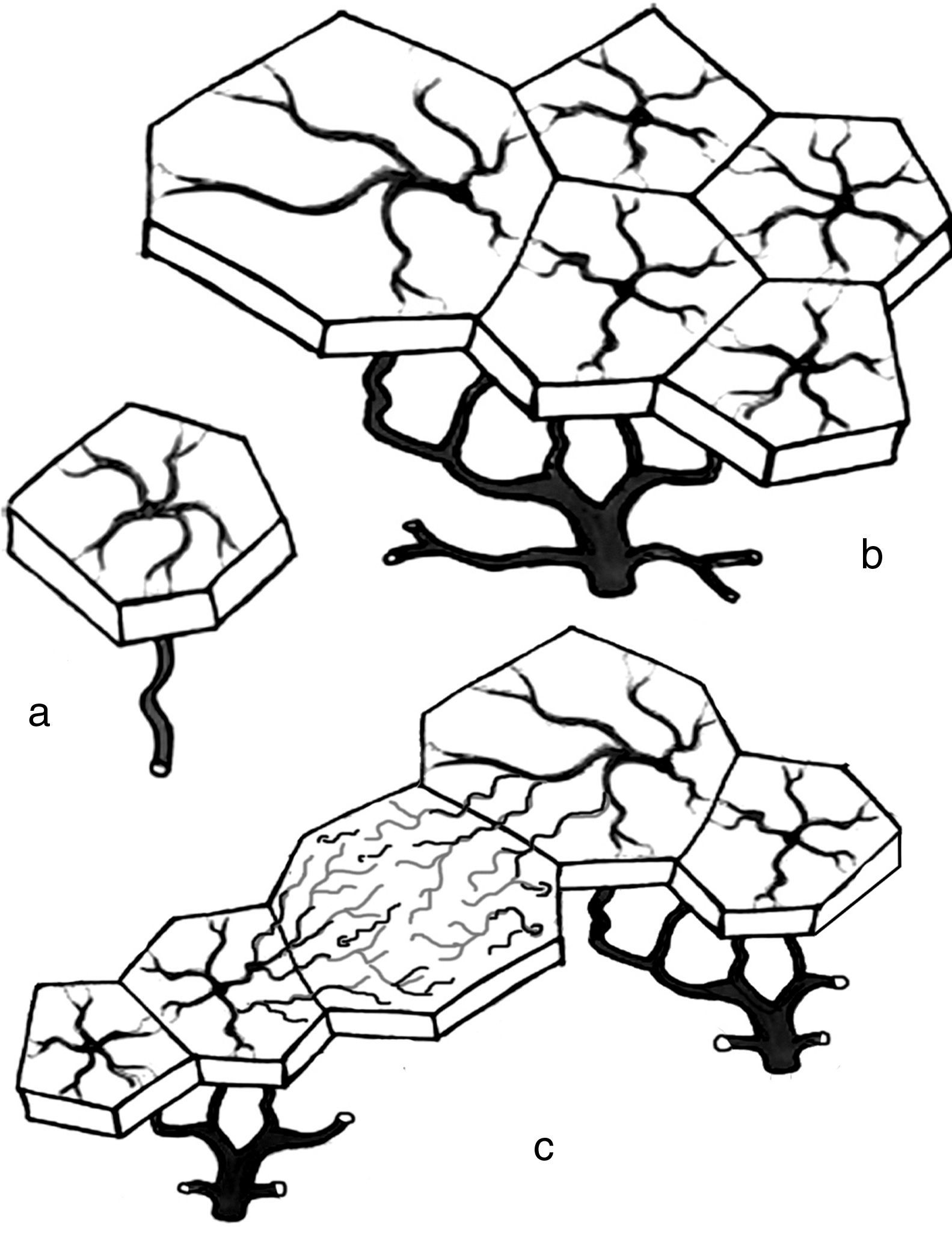
Vascularización, colateralización y angiosomas del pieA partir de los estudios de Manchot y Salmon20, Taylor y Palmer describieron los angiosomas, concepto que corresponde a cada territorio cutáneo que está irrigado por una arteria principal de aporte, segmentaria o distributiva21 (fig. 1A y B). Ese territorio puede expandirse o retraerse a partir de su territorio anatómico, dependiendo de condiciones fisiológicas o patológicas determinadas.
La teoría del angiosoma explica las variaciones que existen en los aportes de sangre arterial a la piel y estructuras adyacentes entre las diferentes regiones del cuerpo, permite mapear los territorios vasculares para planificar las incisiones y los colgajos, y proporciona la base para interpretar muchos procesos fisiológicos y patológicos, incluyendo el retardo de la cicatrización o las necrosis de los flaps cutáneos.
El pie tiene como importantes funciones la sustentación del peso corporal, la postura bípeda, el equilibrio y la locomoción, condiciones indispensables para la mayoría de las actividades del ser humano22. La vitalidad de sus estructuras depende de su sistema arterial, cuyo elemento central es el arco plantar profundo, del que se originan las arterias metatarsianas plantares, fundamentales para la irrigación de los dedos y de la región plantar profunda. En el paciente sano el flujo arterial al pie es redundante, pero no es así en el paciente isquémico. Como el pie es un órgano terminal, el sistema arterial establece numerosas anastomosis arterioarteriales que permiten rutas alternativas a la sangre cuando el camino directo está enfermo o comprometido23.
En 1998 Taylor y Pan24 describieron por primera vez los 5 angiosomas de la pierna, sin mencionar para nada los angiosomas del pie. Fue Attinger, en el 2001, quien dividió el pie en 5 angiosomas con el fin de evaluar su vascularización y colateralización antes de planificar amputaciones o reconstrucciones7. El mismo autor, en el 2006, redescribe y divide el pie en 6 angiosomas25, y por primera vez plantea las implicaciones de este concepto con la IC y con el salvamiento de la extremidad.
Pero no es hasta el año 2008 cuando se incorpora el MA en la estrategia de revascularización de los miembros inferiores a partir de la primera publicación de Alexandrescu26.
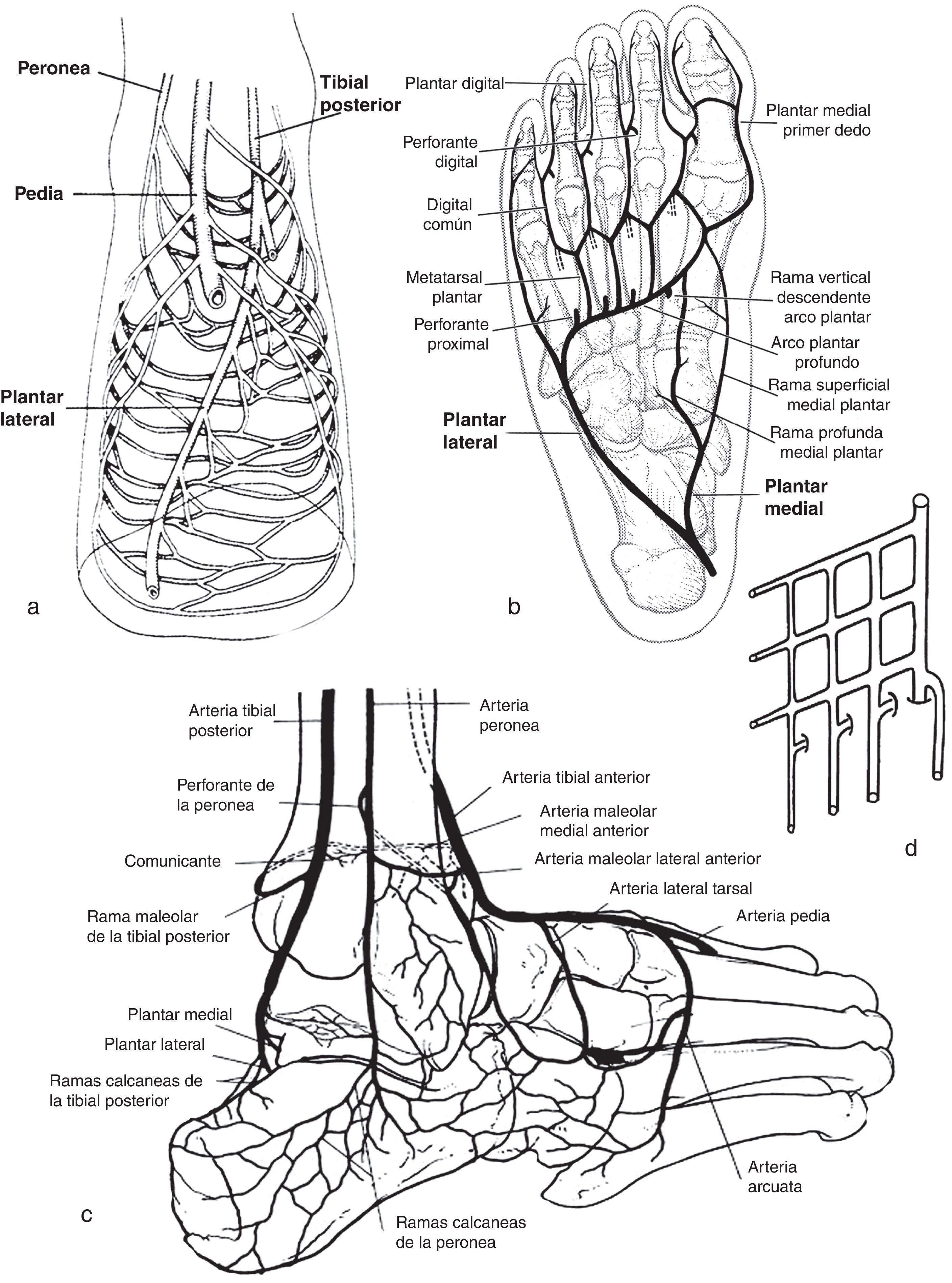
Los angiosomas del pie son continuación natural y final de los angiosomas de la pierna (tabla 3). Así, la arteria tibial posterior irriga la zona plantar de los dedos, los espacios interdigitales, la planta del pie y la cara interna del tobillo y el talón a través de sus ramas calcánea, plantar medial y plantar lateral. La arteria tibial anterior-pedia irriga el dorso del pie. La arteria peronea irriga la cara anterolateral y externa del tobillo y del talón a través de sus dos ramas, perforante anterior y calcánea (fig. 2 A-C).
Relación anatómica de la topografía lesional y arteria a revascularizar
| Topografía lesional | Arteria a revascularizar |
| Lesiones cara anterior de la piernaLesiones dorso de pie | Arterias tibial anterior y pediaRamas maleolares medial y/o lateral |
| Lesiones territorio aquíleoLesiones talón | Arteria peronea (rama calcánea)Arteria tibial posterior (rama calcánea) |
| Lesiones proximales y distales de la planta del pie | Arteria tibial posterior y ramas calcánea, plantar medial y/o lateral |
| Lesiones distales del antepiéLesiones de dedos | Medial plantar y lateral o conectar anastomosis entre plantar medial y pedia |
| Lesiones posterolaterales del pie | Arteria peronea o sus ramas más distales |
Las ramas de la pedia que profundizan forman la principal anastomosis con el sistema plantar. El sistema plantar se forma por la división de la arteria tibial posterior en arterias plantares medial y lateral. Dependiendo de la dominancia del sistema plantar o dorsal, los dedos reciben su aporte arterial principalmente de la arteria plantar lateral o de la arteria pedia.
El talón recibe flujo a partir de dos arterias distributivas: la rama calcánea de la tibial posterior y la rama calcánea de la peronea, respectivamente dirigidas a sus caras medial y lateral. No hay conexiones anatómicas entre estas arterias, y casi siempre una predomina sobre la otra.
Los angiosomas27 están delimitados y a la vez unidos a otros angiosomas adyacentes por anastomosis verdaderas (vasos del mismo calibre que las arterias principales) y por «vasos de choque», anastomosis de reducido calibre que conectan angiosomas entre sí en el seno de los tejidos, sobre todo musculares, formando una red continua compensatoria entre diferentes territorios del pie. Las anastomosis al nivel del tobillo y del pie son complejas, con frecuentes variaciones anatómicas, y deben tenerse en cuenta para conocer en cada caso qué vías están enfermas y las vías de compensación, si existen. Esto permitiría planificar la revascularización quirúrgica o endovascular a la arteria que esté irrigando predominantemente una zona lesional (angiosoma) o tallar los colgajos correctos en caso de amputaciones del antepié.
Un conocimiento detallado de la anatomía vascular del pie ayuda al cirujano vascular a tomar decisiones28. Por ejemplo, antes de indicar una cirugía revascularizadora o endovascular es imprescindible conocer si el flujo al dorso del pie procede de la arteria tibial anterior, tibial posterior o peronea; si el flujo al talón procede directamente de la rama calcánea de la tibial posterior o de la rama calcánea de la peronea, o indirectamente desde la arteria tibial anterior a través de ramas maleolares.
La conexiones más importantes a evaluar son las que tienen lugar entre la circulación plantar y dorsal (fig. 2 D). Si el flujo al pie depende de una sola arteria, entonces el flujo global a la planta o al dorso del pie dependerá de la permeabilidad y calidad de las interconexiones. La interconexión final está formada por un delicado plexo subdérmico arteriolar, que une la arteria pedia con las arterias plantares, medial y lateral, arropando circunferencialmente a toda la planta del pie. Este plexo formado por arterias de fino calibre desempeña un papel importante permitiendo la recuperación de esta zona de los traumas diarios al caminar, o si hay una alteración del aporte arterial.
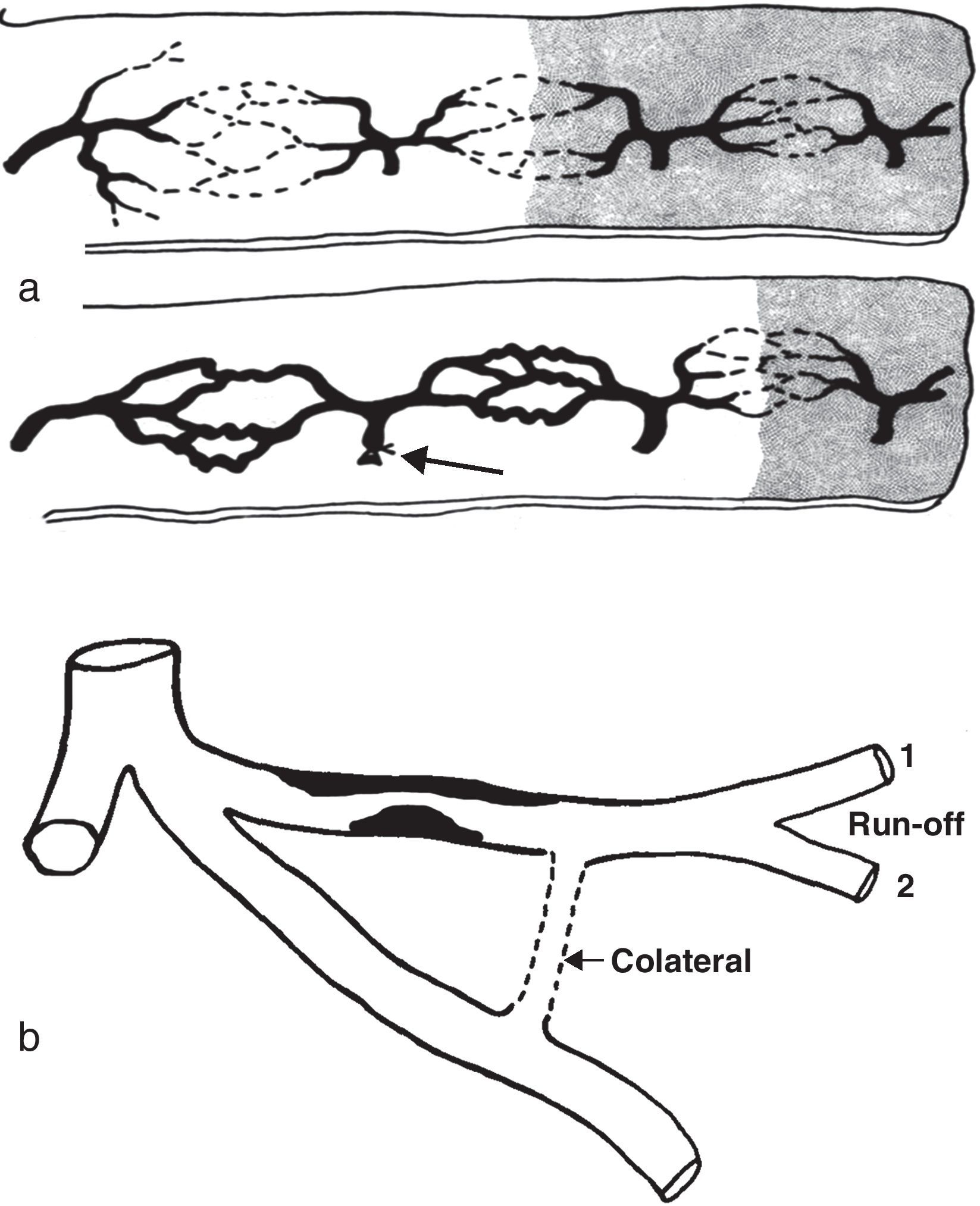
Los vasos de choque permanecen «dormidos» o colapsados cuando las arterias están sanas, pero se «despiertan» paulatinamente en situaciones de isquemia crónica y compensan notablemente la clínica, evitan la aparición de lesiones isquémicas y favorecen su cicatrización cuando aparecen. Estos vasos de choque son importantes circuitos de seguridad. Cuando un angiosoma adyacente alcanza condiciones de isquemia, el gradiente de presión provoca que el flujo, a través de los vasos de choque, se derive hacia el territorio isquémico. Con el paso del tiempo esos vasos de choque se convierten en auténticas colaterales (fig. 1 C).
Los límites y número de los angiosomas del pie, aunque quizá no sea lo fundamental, no están aún claramente definidos en la literatura que aborda el MA. Es una primera dificultad para intentar ponernos de acuerdo. De hecho, se han descrito diversos modelos, con diferencias territoriales en zonas críticas, como son el talón, los maléolos y los dedos. En este contexto, familiarizarse con la técnica angiográfica, con la anatomía vascular normal del pie, con las variantes anatómicas más frecuentes y con la distribución angiosómica es esencial para obtener resultados clínicos óptimos28.
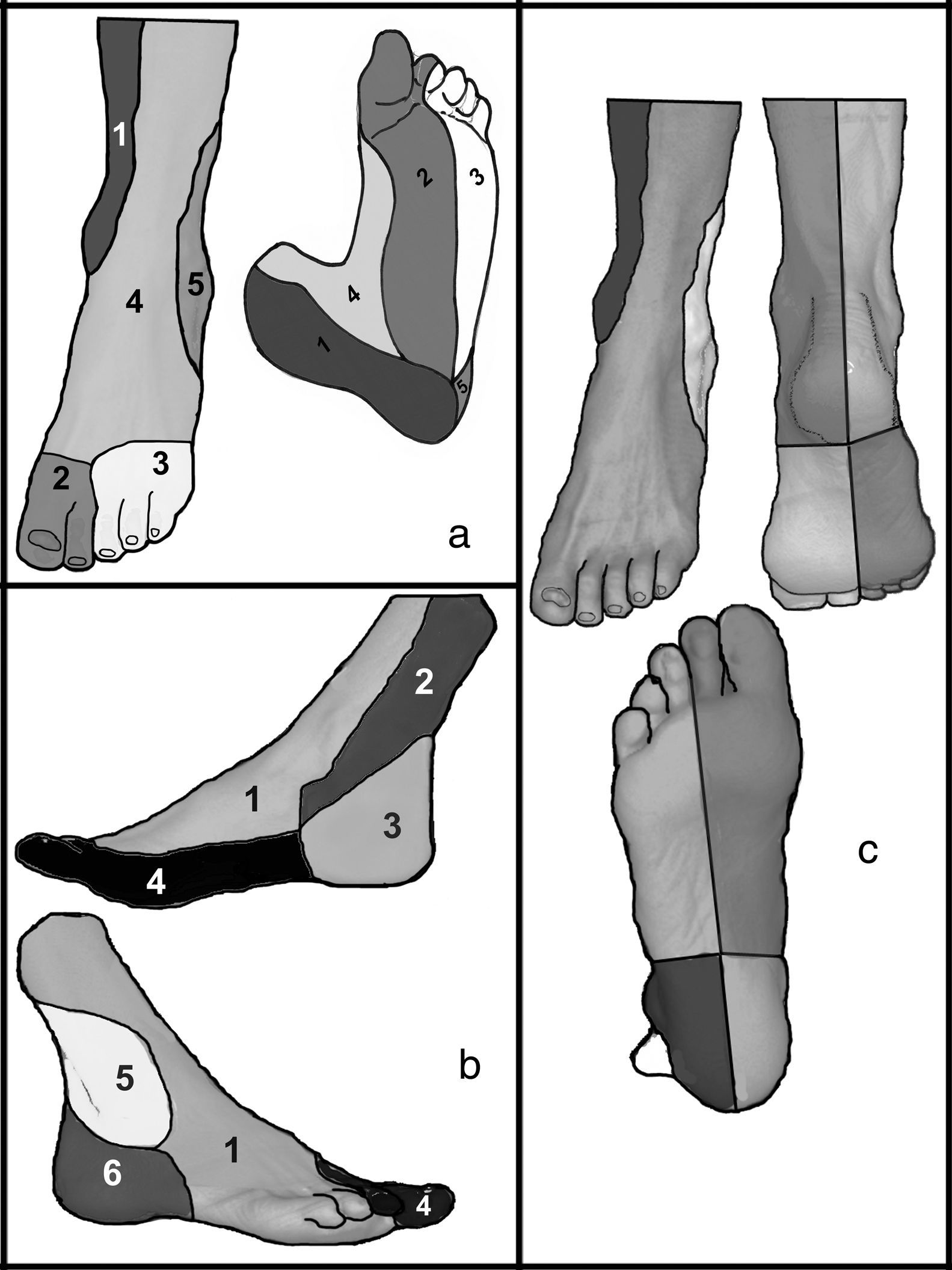
Podríamos definir dos tipos de MA: el defendido por Alexandrescu de 5 angiosomas (fig. 3 A), el de Attinger e Iida de 6 angiosomas (fig. 3 B) y otros también de 6 angiosomas, pero con diferencias notables entre ellos (fig. 3 C).
Modelos de angiosomas. A.Cinco angiosomas de Alexandrescu. Tibial posterior: (1) zona medial y plantar de tobillo y talón; (2) arco plantar medial, dedos primero y segundo; (3) arco plantar lateral, dedos tercero, cuarto y quinto. Tibial anterior: (4) dorso del pie; peronea (5) cara anterolateral de tobillo y planta lateral del talón.
B. Seis angiosomas de Attinger-Iida. Tibial anterior: (1) dorso de pie. Tibial posterior: (2) zona medial de tobillo; (3) zona medial de talón. Peronea: (5) cara anterolateral de tobillo (6) planta lateral del talón
C. Otros modelos de 6 angiosomas.
Mientras se desarrollaban paulatinamente las teorías de revascularización basadas en el MA, los «virtuosos» de la angioplastia distal y ultradistal han seguido evolucionando y publicando numerosos trabajos con excelentes resultados29: la angioplastia puede ser realizada incluso en lesiones esteno-obstructivas largas, o en lesiones a múltiples niveles, o en arterias calcificadas, ya que obtener un flujo directo al pie a través de un vaso tibial o peroneo es imprescindible si deseamos curar una lesión isquémica. Paradójicamente, las características de la arteriopatía diabética distal permiten conseguir resultados angiográficos iniciales muy buenos30–33.
La recurrencia clínica después de una revascularización exitosa es infrecuente, y el procedimiento endovascular puede ser repetido varias veces. En los pacientes diabéticos que se benefician de la recanalización distal la amputación por encima del tobillo es muy rara. Por eso, la angioplastia de troncos distales podría ser tenida en cuenta como la primera indicación de revascularización en pacientes diabéticos con IC34.
La angioplastia permite la revascularización de múltiples arterias y llegar a zonas muy distales del pie, donde la cirugía arterial directa no llega, recanalizando territorios que dependen directamente de arterias tronculares o abriendo colaterales. Como a este nivel son muy frecuentes las variables anatómicas35, el tratamiento endovascular debería ir orientado, siempre, a recanalizar el vaso dominante donde asiente la lesión36 o conectar las anastomosis entre las arterias plantar medial y pedia, basándose en la prevalencia angiográfica del flujo arterial hacia el dorso o la planta del pie37.
Hay pacientes en los que, a pesar de revascularizaciones exitosas, ya sean derivaciones a vasos tibiales o revascularizaciones distales extensas, incluso con pulsos palpables, determinadas lesiones isquémicas del pie no cicatrizan y conducen a la amputación, porque la colateralización del pie es pobre.
Es decir, una revascularización satisfactoria puede ser más compleja que restaurar solo la circulación de una arteria específica38–40. La revascularización podría ser más eficaz si la arteria que se repermeabiliza endovascularmente nutre directamente el área donde asienta la lesión isquémica, pues si no podría conducir a la amputación mayor de la extremidad.
Hay que tener en cuenta además que la capacidad de colateralización de las anastomosis arterioarteriales a nivel distal tiene tanta o más importancia que el simple abordaje endovascular mediante el MA para predecir si una lesión va a curar o no. Si el cirujano vascular no puede recanalizar la arteria que nutre el angiosoma afectado debe contemplar que su revascularización podría no recuperar el tejido isquémico, a menos que se demuestren conexiones arterioarteriales entre la arteria revascularizada y la arteria que nutre ese angiosoma (fig. 4 A).
El pie diabético es un caso específico y de especial interés en la aplicación del concepto de revascularización topográfica siguiendo el modelo angiosoma. En el pie diabético la microangiopatía que afecta a las arterias distales y el desequilibrio microcirculatorio provocado por la neuropatía y la infección local inducen múltiples oclusiones vasculares de arterias de diferentes calibres al nivel del pie, convirtiendo a cada pequeña porción de pie en un territorio que depende de una sola arteria terminal, sin posibilidades de colateralización (teoría de la arteria terminal de O′Neal)41 (fig. 4 B). Esa red compensatoria —los vasos de choque— está severamente dañada en la diabetes de larga duración.
La teoría de la arteria terminal42, ya descrita por Hyman en 1965, probablemente explique mejor la razón por la que la irrigación de pequeñas porciones de piel depende de vasos nutricios específicos: arteriosclerosis parcheada. Por tanto, en estos pacientes cuanto más distal y específica sea la revascularización, mayor será la posibilidad de restablecer un adecuado flujo arterial a una cantidad específica de tejido comprometido43.
Cuando un angiosoma se revasculariza indirectamente, y va a recibir sangre a través de vasos colaterales, las posibilidades de curación de una lesión pueden disminuir. Neville44 fue el primer autor que publicó tasas de curación del 91% con tasas de amputación solo del 9% cuando se revasculariza directamente el angiosoma donde asienta la lesión, frente a tasas de curación del 62% y de amputación del 38% cuando la revascularización es indirecta.
Iida45 definió claramente la superioridad de la revascularización directa del angiosoma sobre los porcentajes de curación de lesiones isquémicas, salvamiento de extremidad (86 frente a 69%), aparición de eventos isquémicos adversos y supervivencia libre de amputación, tanto a medio como a largo plazo46,47. En nuestro país Genovés48 ha comunicado similares resultados.
Sin embargo, Varela49 afirma que se pueden obtener los mismos resultados con la revascularización del angiosoma a través de vasos colaterales, es decir, indirectamente. Blanes50 también ha publicado que los buenos y malos resultados sobre la curación de las lesiones isquémicas son iguales, tanto si se revasculariza el angiosoma de forma directa como de forma indirecta.
Muy recientemente Alexandrescu51 ha publicado sus resultados respecto a curación de lesiones (85, 81 y 73% a 12, 24 y 36 meses) y salvamiento de extremidad (91, 88, y 84% en los mismos intervalos), si la angioplastia distal sigue el MA, siendo evidente y estadísticamente significativa la diferencia a favor del éxito para ambos criterios si se siguió el MA.
Alexandrescu52, una vez más, ha rescatado una vieja idea histórica de la cirugía vascular: la arterialización selectiva de venas profundas de la pantorrilla basada en el MA de revascularización como alternativa complementaria en situaciones extremas de IC inoperables o con nulas arterias distales recanalizables.
Limitaciones del modelo angiosomaEl MA, como idea teórica, está bien planteado, pero choca frontalmente con la tozuda realidad de la arteriopatía distal (tabla 4), sobre todo en los pacientes diabéticos53.
Limitaciones del modelo angiosoma
| Variabilidad en distribución arterial infrapoplítea |
| Diferencias entre extensión y fronteras de angiosomas |
| Dificultades para identificar angiosoma afectado |
| Muchas lesiones dependen de varios angiosomas |
| Patrón angiográfico diagnóstico objetivo no descrito |
| No se conoce end-point angiográfico óptimo post-TEV |
| Diferencias en la colateralización |
| Segmentos arteriales muy largos |
| Lesiones difusas, calcificadas y múltiples |
| Calibre arterial pequeño |
| Flujo lento de lechos distales |
| Run-off deficiente |
| Manejo de instrumental |
| Dificultades técnicas |
A nivel infrapoplíteo existe una enorme variabilidad en la distribución arterial, haciendo muy difícil en ocasiones identificar el angiosoma afectado. Muchas lesiones dependen de varios angiosomas, y a nivel distal se encuentran densas calcificaciones en la zona retromaleolar (al nivel del retináculo flexor del pie) y en la zona dorsal dependiente de la arteria pedia (al nivel del retináculo extensor).
Los territorios isquémicos distales dependen de segmentos arteriales muy largos, que están crónicamente calcificados y que los convierten en segmentos rígidos difícilmente recanalizables y de muy pequeño calibre54,55.
Desconocemos cómo definir un patrón angiográfico diagnóstico objetivo, y tampoco conocemos el end-point angiográfico óptimo postangioplastia. Las diferencias en la colateralización a nivel del pie, junto a las lesiones difusas, calcificadas, múltiples, los calibres arteriales límite, el flujo lento de los lechos distales y el run-off deficiente plantean tremendas dificultades técnicas, que no todos los que tratamos a estos pacientes somos capaces de superar.
La revascularización de zonas lesionales basada en el MA puede ser literalmente imposible debido a barreras técnicas o lesiones severas de las arterias distales. Por eso, antes de planificar cualquier tipo de TEV de los troncos distales el primer paso es conseguir una excelente imagen de la vascularización arterial del pie. La no visualización de arterias que están permeables a nivel distal es un hecho habitual, sobre todo en arteriografías preoperatorias que pueden estar mal seriadas y cuando la enfermedad arterial afecta a múltiples niveles. El hallazgo de permeabilidad distal se puede demostrar en arteriografías intraoperatorias, pero ya se puede vaticinar con una buena exploración con doppler de ultrasonidos o ecodoppler.
Las fronteras entre los angiosomas del pie son difíciles de delimitar, y es bien sabido que las posibilidades de curación o cicatrización de las amputaciones menores dependen en gran medida de la colateralización arterial. El flujo colateral puede mantener un angiosoma isquémico hasta una cierta extensión a partir de un angiosoma adyacente mejor prefundido (fig. 1 C). Pero la red capilar compensatoria (choke vessels) está muy determinada por la duración de la diabetes y la inflamación vascular crónica, indicando la necesidad de tratar regiones del pie cada vez más distales y específicas.
Una reciente publicación destaca que es necesario conseguir un wound blush en la zona lesional tras la angioplastia. Esto garantiza un aumento de la presión de perfusión a la piel y mejora la tasa de salvamiento de la extremidad y la cicatrización. En otras palabras, independientemente del MA es necesario demostrar relleno o «rubor» angiográfico en la zona isquémica del pie donde se localiza la lesión como end point óptimo postangioplastia56.
Este «rubor angiográfico» se puede conseguir tanto con revascularización directa como con revascularización colateral a través de los vasos del pie. Cuando el rubor angiográfico es positivo mejora el salvamiento de la extremidad, y mejora más cuando se consigue con revascularización directa.
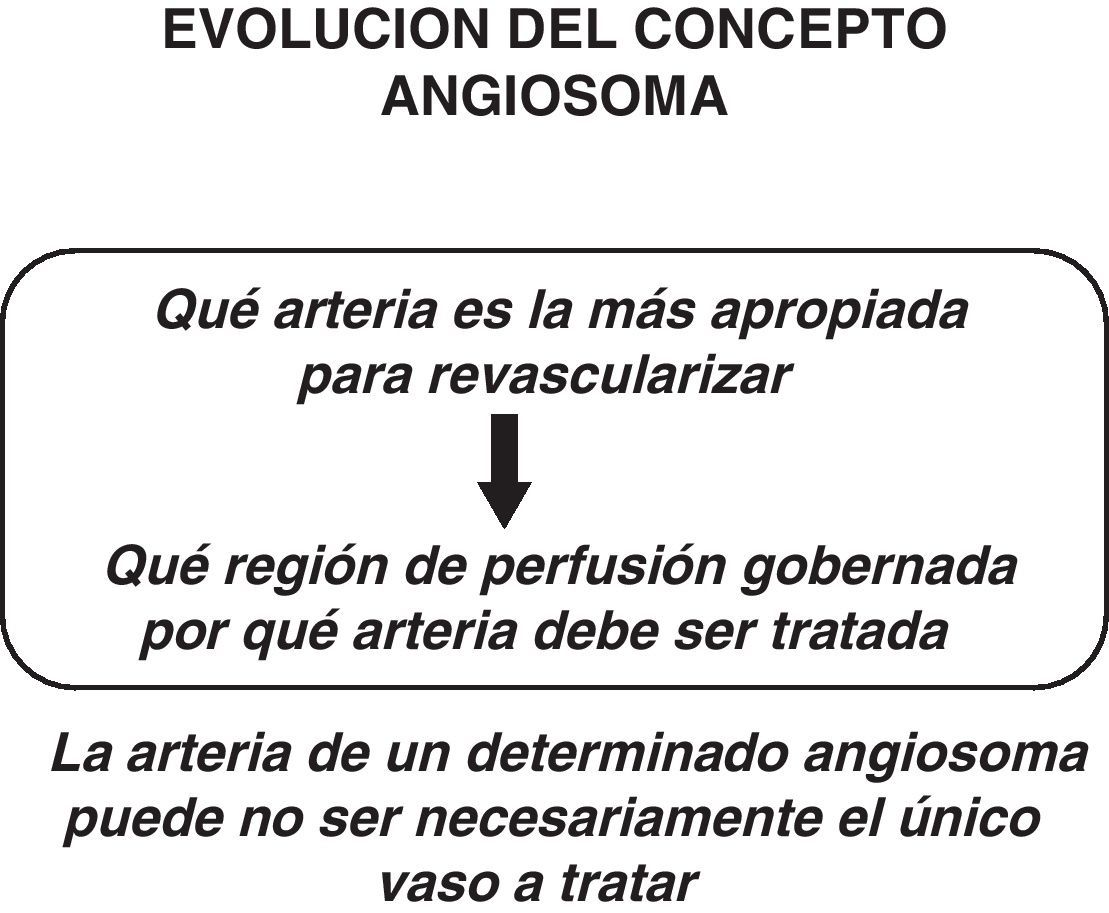
Evolución del modelo angiosomaEn la actualidad —y han pasado muy pocos años desde la incorporación del MA en la estrategia de revascularización de la isquemia crítica— el concepto de revascularización está evolucionando desde el inicial, que se basaba en «qué arteria es más adecuada para revascularizar» hacia una perspectiva diferente: «qué región de perfusión, que dependa de una determinada arteria, debe ser tratada» (tabla 5).
Por tanto, la arteria de la que depende un angiosoma puede no ser necesariamente la que debe ser recanalizada, ya que la cantidad de tejido que depende de una arteria una vez revascularizada puede variar de unos pocos milímetros cuadrados de piel a todo el pie o la pierna.
El MA57, necesario para planificar angioplastias que intenten llevar flujo arterial directo al pie, aunque válido, sugiere también que el éxito de la angioplastia no es solo recanalizar arterias del pie, sino aquellas que irriguen directamente la zona lesional58. Y esto puede conseguirse con recanalizaciones directas, pero también a través de colaterales: el flujo principal a una zona del pie puede restaurarse a partir de arterias que no son de su angiosoma original59.
Este cambio supone plantear intervenciones endovasculares más agresivas para hacer frente a oclusiones arteriales más graves, extensas y distales, incorporando habilidades, técnicas y materiales de última generación13,60.
Es decir, cuanto más distal y específica sea la revascularización, mayor será la probabilidad de restablecer un adecuado aporte arterial a la zona de tejido afectado. Esta evolución hacia revascularizaciones cada vez más desafiantes requiere el uso de abordajes anterográdos, catéteres largos, rígidos y reforzados, balones de angioplastia específicos y adaptados al territorio distal, microdisecciones arteriales, abordajes ultradistales para recanalizaciones retrógradas o combinadas, técnicas de enlace pedio-plantar, técnicas de «safari», etc.61–64.
En este punto merece la pena plantear varias interrogantes: ¿qiénes están más preparados, conviven con la IC, reúnen los dispositivos adecuados, manejan las técnicas y habilidades endovasculares y cuentan con los mejores medios radiológicos? Si la contestación es cirujanos endovasculares, radiólogos vasculares o cardiólogos hemodinamistas el tiempo lo dirá. A fecha de hoy las publicaciones se decantan claramente a favor de especialidades que no son la cirugía vascular65–68.
El MA nos hace reflexionar sobre qué zona del pie en la que asienta una lesión debe ser revascularizada, porque ofrecerá mejor pronóstico al TEV. Esta forma de hacer las cosas, este concepto, debería ser incorporado como un componente más en el tratamiento integral de los pacientes isquémicos y particularmente en los diabéticos69–71.
La angioplastia primaria puede representar un método revascularizador eficaz y menos agresivo que la cirugía arterial directa. Sin embargo, los mejores resultados respecto de la curación de las úlceras isquémicas o salvamiento de extremidad no solo dependen de revascularizaciones más o menos exitosas, sino también del tratamiento directo y adecuado que reciban esas mismas lesiones72, optimizando los cuidados clínicos que, a la postre, pueden ser la clave del pronóstico de los pacientes con IC, por lo que se requieren equipos entrenados, experimentados y multidisciplinarios73,74.
Para demostrar la superioridad de la aplicación del MA en la revascularización de la IC se necesitan aún estudios amplios, prospectivos y comparativos y muchas mejoras en los materiales de TEV que permitan superar barreras insalvables hoy en día.
Responsabilidades éticasProtección de personas y animales. Los autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datos. Los autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informado. Los autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.