La aterosclerosis es una de las principales causas de morbimortalidad en países desarrollados que presenta varias similitudes histopatológicas con la inflamación crónica. Los ratones deficientes en apolipoproteína E (apoE-/−) son ampliamente utilizados en el estudio de los mecanismos implicados en el inicio y el progreso de las lesiones ateroscleróticas.
ObjetivoEvaluar el impacto en la formación de la placa de ateroma de una dieta aterogénica en el ratón apoE-/−.
Material y métodosRatones apoE-/− de 2 meses de edad fueron sometidos o no a una dieta hipercolesterolémica (10,8% de grasa, 0,75% en colesterol) durante 2 meses adicionales. Se determinó el perfil lipídico, la lesión y el contenido en macrófagos, linfocitos, colágeno, células de la musculatura lisa vascular (CMLV) y core necrótico por técnicas histológicas e inmunohistoquímicas. Cuantificación de las interacciones leucocito-endotelio por microscopia intravital en la microcirculación cremastérica.
ResultadosLos ratones apoE-/− sometidos a dieta hipercolesterolémica mostraron elevados niveles circulantes de colesterol total y triglicéridos frente aquellos sometidos a dieta control. Estos efectos fueron acompañados de un claro desarrollo de lesión aterosclerótica en la aorta caracterizada por un mayor contenido en macrófagos (Mac3+), linfocitos (CD3+), colágeno, core necrótico y CMLV. Paralelamente hubo una mayor adhesividad de los leucocitos al endotelio arteriolar en aquellos animales sometidos a dieta grasa.
ConclusiónEl modelo de aterosclerosis que se desarrolla en el ratón apoE-/− sometido a dieta aterogénica presenta numerosas similitudes con la lesión humana, y constituye un adecuado modelo para la detección de nuevas dianas terapéuticas y ensayo de nuevos fármacos.
Atherosclerosis is one of the leading causes of morbidity and mortality in Western countries and bears several histopathological similarities to chronic inflammation. Mice deficient in apolipoprotein E (apoE-/−) are widely used in the study of the mechanisms involved in the onset and progression of the atherosclerotic lesion.
ObjectiveTo evaluate the impact of an atherogenic diet in lesion formation in apoE-/− mice.
Material and methodsTwo month-old apoE-/− mice were subjected, or not (controls), to a high fat/high cholesterol diet (10.8% fat, .75% cholesterol) for two months. Lipid profile, lesion formation, and macrophage, lymphocyte, collagen, vascular smooth muscle cells (VSMC), and necrotic core content, were determined within the lesion using histological and immunohistochemical techniques. Leukocyte-endothelial cell interactions were quantified by intravital microscopy in the cremaster microcirculation.
ResultsapoE-/− mice subjected to a hypercholesterolemic diet showed increased circulating levels of total cholesterol and triglycerides compared to those subjected to a control diet. These effects were accompanied by a clear development of atherosclerotic lesion in the aorta, which was characterized by enhanced macrophage (Mac3+), lymphocyte (CD3+) collagen, VSMC and necrotic core content. In parallel, increased adhesiveness of leukocytes to the arteriolar endothelium in those animals subjected to an atherogenic diet was also detected.
ConclusionThe atherosclerosis model in apoE-/− mice subjected to an atherogenic diet shares common features with the human atherosclerotic lesion, and constitutes an appropriate model to detect new therapeutic targets and evaluate novel developed drugs.
Las enfermedades cardiovasculares (ECV), principalmente la cardiopatía coronaria (CC) y los accidentes cerebrovasculares siguen siendo la principal causa de muerte en la mayoría de los países europeos1, y la aterosclerosis es el principal contribuyente a la patogénesis del infarto de miocardio y cerebral. Además, la Organización Mundial de la Salud (OMS) ha estimado que para el 2020 las ECV serán el principal problema sanitario y socioeconómico a nivel mundial.
La aterosclerosis se caracteriza por la formación de lesiones en la pared interna de arterias de medio y gran tamaño, y el consiguiente estrechamiento de la luz de las mismas2. De hecho, presenta varias similitudes histopatológicas con la inflamación crónica, ya que este fenómeno es debido, en parte, a la acumulación de células inflamatorias tanto innatas como adaptativas en la placa arterial. Una de las primeras etapas de la aterogénesis es la disfunción endotelial. La disfunción endotelial conduce a un fenotipo proinflamatorio y protrombótico del endotelio3 y, por lo tanto, provoca la adhesión y posterior migración de los leucocitos al espacio subendotelial. Además, se promueve la acumulación de material no celular, como lípidos modificados y componentes de la matriz extracelular. De esta manera, la adhesión y migración de monocitos hace que estos se diferencien en la íntima en macrófagos y sean capaces de absorber lipoproteínas de baja densidad oxidadas (oxLDL) circulantes por el torrente sanguíneo, convirtiéndose así en células espumosas. También se han detectado otros subtipos leucocitarios y la activación de los mismos puede producir la síntesis y liberación de mediadores inflamatorios que promueven la proliferación de células de la musculatura lisa vascular y su migración hacia la lesión aterosclerótica, contribuyendo a su crecimiento y provocando el estrechamiento de los vasos sanguíneos2,4-6. Estos eventos se producen continuamente a lo largo de todo el proceso aterogénico7,8. Cuando la enfermedad se encuentra en un estado avanzado se puede producir la rotura de la placa de ateroma, provocando la formación de trombos y eventos isquémicos agudos4.
Por lo tanto, un mayor conocimiento del inicio y progresión de la formación de la lesión aterosclerótica9, así como una mejor comprensión de la respuesta inflamatoria sistémica que precede al proceso aterogénico, podría ayudar a establecer nuevas estrategias terapéuticas que puedan inhibir o incluso prevenir la formación de la lesión aterosclerótica.
En este sentido, los ratones deficientes en apolipoproteína E (apoE-/−) constituyen un modelo apropiado para el estudio de los mecanismos moleculares implicados en el inicio y el progreso de las lesiones ateroscleróticas10. Estos animales desarrollan de manera espontánea hipercolesterolemia y complejos ateromas muy similares a los presentes en humanos; además el proceso se puede acelerar al exponerlos a una dieta rica en grasa11.
ObjetivoEn el presente estudio se pretende demostrar cómo una dieta aterogénica a ratones apoE-/− de 2 meses provoca la generación de placa arteriosclerótica en la aorta, altera el perfil lipídico y aumenta la disfunción endotelial, la cual se manifiesta como una mayor adhesividad de los leucocitos al endotelio vascular, corroborando la aplicación del modelo a estudios traslacionales en humanos.
Material y métodosRatonesTodos los experimentos llevados a cabo con animales se ajustaron a los principios recogidos en la Guía para el cuidado y uso de animales de laboratorio publicados por los Institutos Nacionales de Salud de Estados Unidos y aprobados por el comité ético institucional de la Facultad de Medicina de la Universidad de Valencia. Se emplearon ratones macho de 2 meses de edad deficientes en la apoE-/− (C57BL/6J, Charles River). Un grupo de animales fue mantenido con una dieta control (2,8% de grasa, Panlab, Barcelona, España) y otro con una dieta rica en grasa (10,8% de grasa, con un porcentaje en colesterol del 0,75%, S4892-E010, Sniff, Soest, Alemania) para acelerar el desarrollo de aterosclerosis por la dieta. La dieta grasa fue iniciada a los 2 meses de edad y mantenida durante 2 meses más.
Medida de los niveles lipídicosSe evaluaron las concentraciones plasmáticas de triglicéridos y colesterol total en plasma de ratones en ayunas usando métodos enzimáticos (Wako, St. Louis, EE. UU.). El colesterol HDL se determinó tras la precipitación de la apolipoproteína-B con dextransulfato/MgCl2 (Sigma-Aldrich, St. Louis, EE. UU.) como ha sido previamente descrito12.
Cuantificación de la lesión ateroscleróticaPara los estudios de aterosclerosis se lavaron las aortas con PBS in situ y se fijaron con paraformaldehído/PBS al 4% durante 24h a 4°C. Al día siguiente se tiñeron con Oil Red (0,2% Oil Red, Sigma-Aldrich, St. Louis, EE. UU.) en 80% MeOH, como ha sido explicado anteriormente13,14. La cuantificación del tamaño de la lesión se llevó a cabo mediante una tinción de hematoxilina/eosina de los cortes de la sección del seno aórtico de 5μm de grosor. Las imágenes fueron tomadas con una cámara Olympus Camedia C5060 sobre un microscopio Zeiss Axiolab y la caracterización de la lesión para ambos genotipos se efectuó con el programa ImageJ Launcher.
Análisis inmunohistoquímico de la placa de ateromaSe realizó el estudio inmunohistoquímico en secciones de 5μm de seno aórtico de ratón, para poder analizar en profundidad la lesión. La infiltración de macrófagos en el tejido fue detectada mediante un anticuerpo monoclonal de rata frente a ratón anti-Mac-3 (dilución 1:200, clon M3/84, Santa Cruz Biotechnology, Texas, EE. UU.), seguido de un anticuerpo secundario biotinilado de cabra anti-rata (dilución 1:400, Santa Cruz Biotechnology Inc., Texas, EE. UU.). A continuación se añadió peroxidasa de rábano asociada a estreptavidina (HRP-Estreptavidina, Thermo Fisher Scientific, Waltham, EE. UU.) y sustrato 3,3′-diaminobenzidina (DAB, Vector Laboratories, Inc., Burlingame, CA, EE. UU.). Posteriormente, los cortes fueron contrateñidos con hematoxilina (Sigma-Aldrich, St. Louis, EE. UU.). El contenido neoíntimo en colágeno, relacionado con la estabilidad del ateroma, fue cuantificado mediante la tinción tricrómica de Masson, como ha sido detallado previamente13.Las células del músculo liso fueron identificadas con el anticuerpo monoclonal de ratón anti-α-actina conjugado con fosfatasa alcalina (dilución 1:100, clon 1A4, Sigma-Aldrich, St. Louis, EE. UU.) seguido del revelador Fast Red (Sigma, Sigma-Aldrich, St. Louis, EE. UU.).
Detección de linfocitos T en la placa aterosclerótica por inmunofluorescenciaLa identificación de células T en la lesión aterosclerótica se obtuvo mediante ensayos de inmunofluorescencia, que fue empleada para la detección de linfocitos CD3+. Tras la desparafinización, la eliminación del antígeno y el bloqueo de las interacciones no específicas (5% suero de caballo en PBS, 45min), los cortes histológicos fueron incubados con un anticuerpo monoclonal de conejo frente a ratón anti-CD3 (dilución 1:50, Santa Cruz Biotechnology Inc., Texas, EE. UU.) y visualizado con un anticuerpo secundario fluorescente, Alexa Fluor 488 anti-IgG de conejo (dilución 1:200, Life Tecnologies™, Grand Island, NY, EE. UU.). Los núcleos celulares fueron teñidos con 4′-6-diamidino-2-fenilindol (DAPI, dilución 1:1000, Invitrogen, Grand Island, NY, EE. UU.). Tras ello, se llevó a cabo el montaje con SlowFade® Gold antifade reagent (Life Tecnologies™, Grand Island, NY, EE. UU.). Tanto en los protocolos experimentales de inmunohistoquímica como de inmunofluorescencia se tomaron fotografías de los cortes del seno aórtico mediante la cámara digital Olympus CAMEDIA-C5060 acoplada a un microscopio Carl Zeiss Axiolab Observer A1 y analizadas con el programa Sigma Scan Pro (Jandel Scientific, San Rafael, CA, EE. UU.). Las condiciones fueron ajustadas para producir la ratio señal/ruido óptimo. Por otra parte, se utilizó el modo secuencial para adquirir las imágenes con el objetivo de evitar cualquier interferencia procedente de la fluorescencia solapante.
Microscopia intravitalLa preparación de cremáster de ratón utilizado en este estudio fue similar a la descrita anteriormente15,16. Los animales fueron anestesiados, y se colocó un catéter de polietileno en la vena yugular para permitir la administración intravenosa de anestésico adicional (30μl iv) cada 20min para mantener la anestesia profunda hasta el final del experimento (2h); al finalizar el estudio los animales fueron eutanizados por sobredosis de anestesia. El músculo cremáster se disecó libre de tejidos y exteriorizó en un portaobjetos. Se cortó longitudinalmente con una cauterización y se mantuvo plano contra el pedestal uniendo suturas de seda a las esquinas del tejido. A continuación, el músculo se perfundió continuamente con solución salina tamponada con bicarbonato a 37°C (pH 7,4) a una velocidad de 1ml/min.
Posteriormente, se observó la microcirculación cremastérica usando un microscopio intravital (Nikon Optiphot-2, SMZ1, Badhoevedorp, Países Bajos) equipado con una lente de objetivo 50× y un ocular 10× (Nikon SLDW, Badhoevedorp, Países Bajos). Una cámara de vídeo (Sony SSC-C350P, Köln, Alemania) montada en el microscopio proyectó la imagen en un monitor de color y las imágenes fueron grabadas para su análisis posterior. Se seleccionaron arteriolas y vénulas cremastéricas individuales no ramificadas (20-40μm de diámetro) para el estudio. El diámetro de los vasos se midió en línea usando un vídeo-caliper (Instituto de Investigación de la microcirculación, Texas A&M University, College Station, Texas, EE. UU.). La velocidad de los glóbulos rojos (VRBC) también se midió en el momento mediante el uso de un velocímetro doppler óptico (Instituto de Investigación de la microcirculación, Texas A&M University, College Station, Texas, EE. UU.).
Se cuantificaron el número de leucocitos adheridos, emigrados y la velocidad de rodamiento durante la reproducción. Se define un leucocito en fase de rodamiento cuando se mueve a una velocidad inferior a la de los eritrocitos en el torrente circulatorio. La velocidad de rodamiento (Vwbc) se determinó calculando el tiempo requerido por un leucocito en fase de rodamiento para recorrer 100μm de microvaso y es expresada en μm/s. Un leucocito se definió como adherido al endotelio arteriolar o venular si permaneció estacionado durante al menos 30s. La migración se determinó mediante recuento del número de leucocitos rodeando el vaso (vénula poscapilar) en estudio. En cada animal se promediaron las respuestas determinadas en 3 a 5 arteriolas o vénulas poscapilares seleccionadas al azar16,17.
Análisis estadísticoLos resultados se expresaron como la media±el error estándar de la media (ESM). Las diferencias entre los 2 grupos experimentales fueron evaluadas mediante el test de la «t» de Student. En todos los casos los datos fueron considerados estadísticamente significativos cuando p<0,05.
ResultadosLa administración de una dieta aterogénica durante 2 meses altera el perfil lipídico en ratones deficientes en apolipoproteína EEl análisis de los parámetros plasmáticos de colesterol total, HDL y triglicéridos permite relacionar los niveles de colesterol proaterogénico con la lesión (fig. 1). Los ratones sometidos a dieta aterogénica mostraron aproximadamente una cantidad de colesterol en plasma de 350mg/dl, mientras que los ratones sometidos a una dieta control tenían niveles en torno a 180mg/dl (fig. 1A). El colesterol HDL se situó alrededor los 30mg/dl, en los ratones apoE-/− sometidos a dieta aterogénica frente a los niveles de casi 50mg/dl en los animales sometidos a dieta control (fig. 1B). Por otra parte, los triglicéridos se situaron en torno a 60mg/dl en los ratones con dieta control, viéndose incrementando hasta 90mg/dl en los animales sometidos a dieta aterogénica (fig. 1C).
La administración de una dieta aterogénica durante 2 meses incrementó los niveles plasmáticos de colesterol total (A), disminuyó los niveles de colesterol HDL (B) y aumentó los niveles plasmáticos de triglicéridos (C) en animales apoE-/−. Se muestran los niveles de colesterol (mg/dl) (A), los niveles de colesterol HDL (mg/dl) (B) y los niveles de triglicéridos (mg/dl) (C). Los resultados están expresados como la media±ESM de n=12-14 animales por grupo.
*p<0,01 relativo a los valores en el grupo sometido a dieta control.
El estudio de la lesión a nivel macroscópico mediante la tinción de Oil Red-O de aortas procedentes de ratones apoE-/− manifestó un claro aumento de la presencia de lesión aterosclerótica en aquellos animales sometidos durante 2 meses a dieta aterogénica (fig. 2A).
La administración de una dieta aterogénica durante 2 meses incrementó la lesión aterosclerótica en el arco aórtico, en la aorta torácica (A) y en el seno aórtico (B-D) en ratones apoE-/−. Se muestran imágenes representativas de las aortas de ratones apoE-/− sometidos o no a una dieta aterogénica (A). La ratio íntima/media (B) y el área de la lesión (mm2) (C). También se muestran imágenes representativas del seno aórtico de los diferentes grupos experimentales (D). Los resultados están expresados como la media±ESM de n=9-12 animales por grupo.
*p<0,01 relativo a los valores en el grupo sometido a dieta control.
El análisis de la lesión mostró unos valores aproximados del 20% en el arco aórtico y del 3% en la aorta torácica. En ratones apoE-/− sometidos a dieta control se observaron valores significativamente inferiores, 0,9% y 0,06% respectivamente, indicando con ello que la dieta aterogénica favorece el desarrollo y aumento del tamaño del ateroma.
Al mismo tiempo se determinó la lesión a nivel microscópico mediante una tinción de hematoxilina/eosina en cortes transversales del corazón de la zona del nacimiento de la aorta o seno aórtico (fig. 2B-D). El cociente íntima/media determina el grado de lesión (fig. 2B). Así, en ratones sanos la íntima es menor que la media, mientras que en ratones sometidos a dieta aterogénica un valor >1 indica que la superficie de la íntima es mucho mayor, y por ello existe mayor lesión. También se determinó el área de la lesión, siendo esta significativamente mayor en los ratones sometidos a dieta aterogénica frente aquellos con dieta control (fig. 2C).
La administración de una dieta aterogénica durante 2 meses incrementó la infiltración de macrófagos y linfocitos CD3+ en la lesión aterosclerótica en ratones deficientes en apolipoproteína ELos estudios inmunohistoquímicos realizados demostraron que en ratones apoE-/− sometidos a una dieta aterogénica durante 2 meses aumentó significativamente la infiltración de macrófagos (Mac-3+) y linfocitos CD3+ en el seno aórtico (fig. 3). Concretamente, la infiltración de macrófagos (Mac-3+), expresado como porcentaje de área Mac-3+ relativo al área de la lesión, así como el área de macrófagos en la lesión, se vio acentuado en un 45,5% y en un 84,5% respectivamente (fig. 3B y C). La presencia de linfocitos (CD3+) se incrementó en un 97,84% con respecto al grupo de animales control (fig. 3D y E).
La administración de una dieta aterogénica durante 2 meses incrementó la infiltración de macrófagos (A-C) y linfocitos CD3+ (D y E) en la lesión aterosclerótica en ratones apoE-/−. Se muestran imágenes representativas de la tinción de macrófagos (células Mac-3+) (A) y de la inmunofluorescencia de células CD3+ (D) en la lesión aterosclerótica en el seno aórtico de ratones apoE-/− sometidos o no a una dieta aterogénica. Las barras representan el porcentaje de área Mac-3+ y el área con infiltración de macrófagos (Mac-3+) normalizada con respecto al área total de la lesión aterosclerótica (B y C). Las barras muestran el número de linfocitos CD3+ en la lesión (E). Los resultados están expresados como la media±ESM de n=8-12 animales por grupo.
*p<0,05 relativo a los valores en el grupo sometido a dieta control.
**p<0,01 relativo a los valores en el grupo sometido a dieta control.
El análisis en ratones sometidos a dieta aterogénica mostró diferencias significativas con respecto al grupo de animales sometidos a dieta control en la presencia de colágeno y la proliferación de células de la musculatura lisa vascular en la lesión aterosclerótica (fig. 4).
La administración de una dieta aterogénica durante 2 meses incrementó el contenido de colágeno (A) y la proliferación de la musculatura lisa vascular (D) en la lesión aterosclerótica en animales apoE-/−. Se muestran imágenes representativas de la tinción de colágeno (A) y de la inmunohistoquímica para la detección de α-actina (proliferación de musculatura lisa) (D) en la lesión aterosclerótica en el seno aórtico en ratones apoE-/− sometidos o no a una dieta aterogénica. Las barras representan el porcentaje de colágeno normalizado con respecto al área total de la lesión aterosclerótica y el porcentaje de core necrótico (B y C). Las barras muestran el número de células que expresan α-actina en la lesión (E). Los resultados están expresados como la media±ESM de n=5-7 animales por grupo.
*p<0,05 relativo a los valores en el grupo sometido a dieta control.
La tinción tricrómica de Masson permitió determinar el área del core necrótico, es decir, zonas acelulares donde el colesterol ha cristalizado. Se observó un aumento significativo del tamaño del core necrótico en aquellos ratones sometidos a 2 meses de dieta aterogénica frente a los que se suministró dieta control (fig. 4A-C).
Paralelamente, y mediante el uso de técnicas immunohistoquímicas para la detección de α-actina, se pudo observar que el número de células musculares que habían migrado de la media al ateroma era mucho mayor en los animales sometidos a dieta aterogénica, en comparación con los ratones controles (fig. 4D y E).
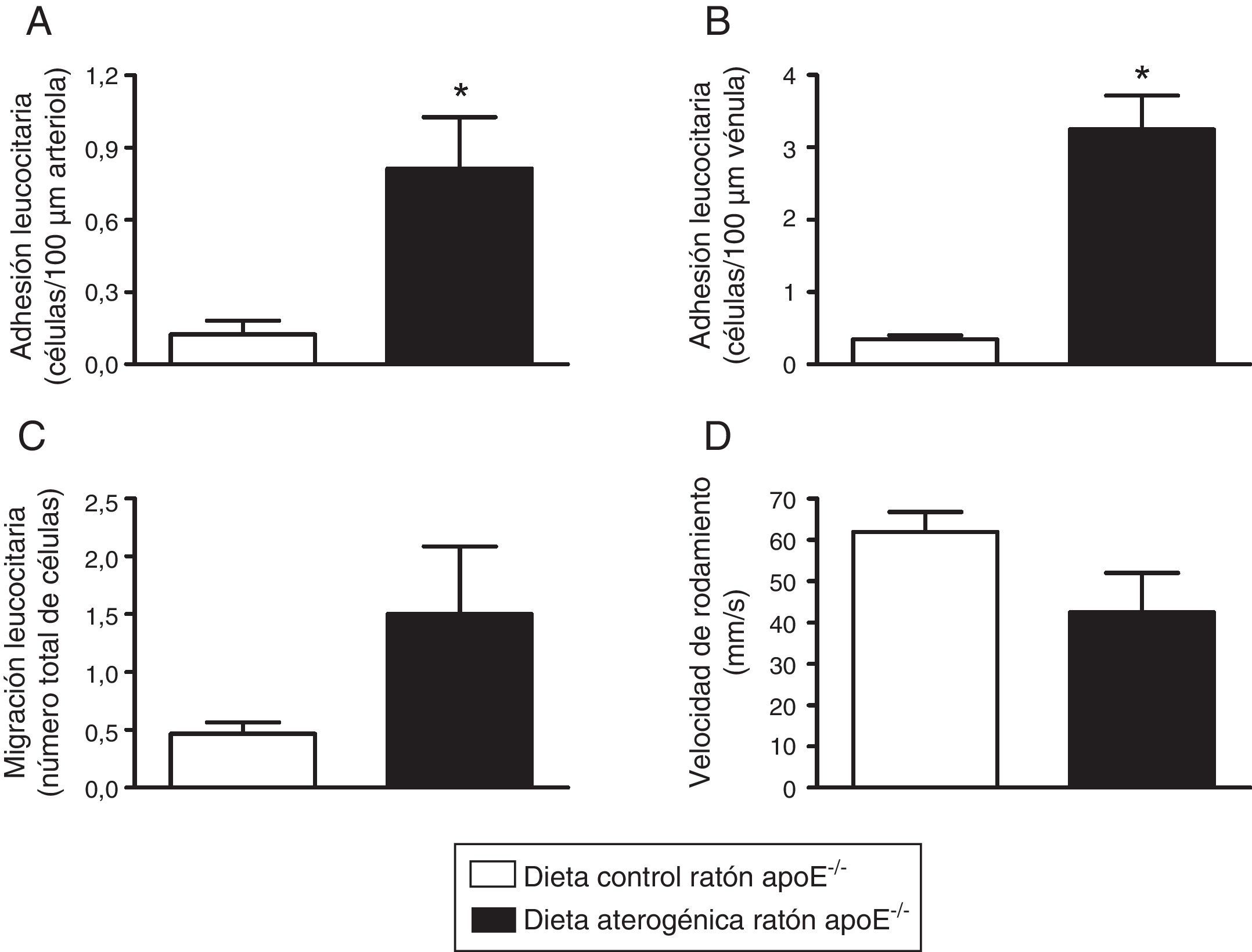
La administración de una dieta aterogénica durante 2 meses produjo un aumento de las interacciones leucocito-endotelio en la microcirculación del cremáster de ratones deficientes en apolipoproteína EPara el estudio de las interacciones leucocito-endotelio en la microcirculación cremastérica del ratón se empleó la microscopia intravital. En primer lugar comprobamos que los animales sometidos a dieta aterógenica mostraron un aumento significativo en la adhesión leucocitaria arteriolar, frente a la hallada en los ratones a los que se había administrado dieta control (fig. 5A). Sin embargo, ninguna de las dietas suministradas afectó a parámetros hemodinámicos, como la fuerza de cizallamiento arteriolar (datos no mostrados).
La administración de una dieta aterogénica durante 2 meses produjo un aumento de las interacciones leucocito-endotelio en la microcirculación del cremáster de ratones apoE-/−. Las barras muestran el número de leucocitos adheridos al endotelio en arteriola en la microcirculación del cremáster de los ratones sometidos o no a una dieta rica en grasa (A). Respuestas venulares sobre la adhesión (B) y migración leucocitaria (C), así como de la velocidad de rodamiento (D). Los resultados están expresados como la media±ESM de n=4-6 animales por grupo.
*p<0,01 relativo a los valores en el grupo sometido a dieta control.
Por otro lado, en las vénulas poscapilares de los mismos animales, la administración de dieta aterogénica, aunque aparentemente produjo un significativo incremento de la adhesión este no se consideró remarcable, ya que en este territorio la aparición de hasta 6 leucocitos adheridos es habitual en condiciones basales. Igualmente, no se detectaron diferencias significativas en la migración, velocidad de rodamiento (fig. 5B-D) o la fuerza de cizallamiento a nivel venular (datos no mostrados).
DiscusiónEl ratón constituye un importante modelo experimental para el estudio de distintas enfermedades. Su mantenimiento es barato, es fácil de alimentar, presenta un corto ciclo reproductivo y existen numerosas cepas. Una de sus principales desventajas reside en su pequeño tamaño, que hace que algunos estudios sean difíciles de llevar a cabo, dada la pequeña cantidad de muestra de la que se puede disponer o el tipo de cirugía a aplicar. Sin embargo, en este último aspecto ha habido un gran avance en las técnicas quirúrgicas desarrolladas, que han permitido solventar esta limitación haciendo posible el estudio de la función cardiaca18, vascular16,19,20 o renal21. Los descubrimientos genéticos y la biotecnología molecular han permitido desarrollar numerosos modelos animales de enfermedades humanas, incluyendo la aterosclerosis, enfermedad multifactorial de un proceso prolongado y que afecta a órganos críticos en humanos.
Hace aproximadamente 2 décadas se consiguió la generación por ingeniería genética de un modelo murino de aterosclerosis a través de la inactivación genética de la apoE por recombinación homóloga22-24. Entre los distintos modelos obtenidos por ingeniería genética disponibles, el ratón apoE-/− es considerado como uno de los más relevantes, ya que desarrolla hipercolesterolemia espontáneamente y lesiones arteriales muy similares a las observadas en humanos. Como mostramos en nuestro estudio, el sometimiento a una dieta hipercolesterolémica aumentó los niveles circulantes de colesterol total, triglicéridos y disminuyó significativamente los niveles de HDL colesterol (fig. 1). De hecho, se ha comprobado que la mayor parte del colesterol plasmático en estos animales se encuentra en facciones lipoproteicas aterogénicas, incluyendo las lipoproteínas de muy baja densidad o VLDL, de densidad intermedia o IDL y de baja densidad o LDL25. Aunque desarrollan aterosclerosis espontánea, la administración de una dieta aterogénica, como es nuestro caso, contribuye a que el desarrollo de lesiones se acelere en este modelo animal.
Respecto a la cuantificación de la lesión de la placa aterosclerótica, existen 2 aproximaciones experimentales. La primera consiste en la medida de la lesión macroscópica basada en el método en face, que permite determinar el área de la lesión como porcentaje de la superficie total. En nuestro caso se observa claramente la lesión en el arco aórtico, la cual es prácticamente inexistente en los ratones sometidos a dieta control, y muy patente en aquellos animales sometidos a dieta aterogénica (fig. 2). También se detecta un significativo aumento en la lesión formada en la aorta torácica (fig. 2). Por otro lado, la tinción de secciones trasversales obtenidas del seno aórtico permiten cuantificar la lesión microscópica, la cual sigue un patrón similar a la detectada macroscópicamente, es decir, prácticamente inexistente en el ratón sometido a dieta control y muy marcada en aquellos sometidos a una dieta hipercolesterolémica.
Como se ha indicado anteriormente, la arteriosclerosis presenta numerosas similitudes histopatológicas con la inflamación crónica, ya que este fenómeno es debido, en parte, a la acumulación de células inflamatorias. En este sentido, los monocitos desempeñan un papel crucial. En los estadios iniciales se producen interacciones monocito-endotelio, las cuales son debidas al aumento de expresión de moléculas de adhesión (MAC) endoteliales como vascular cell adhesión molecule-1 (VCAM-1) o intercellular adhesion molecule-1 (ICAM-1). Estas MAC son expresadas gracias a la liberación de citocinas proinflamatorias, como el factor de necrosis tumoral-α (TNFα) o la interleucina 6 (IL-6). Asimismo, en las lesiones ateroscleróticas también se detectan citocinas quimiotácticas o quimiocinas como la monocyte chemoattractant protein-1 (MCP-1) y otras que atraen monocitos y linfocitos circulantes a la placa aterosclerótica. Tanto la expresión de MAC como la síntesis y liberación de quimiocinas intervienen tanto en el inicio como en el desarrollo de la placa arteriosclerótica26. De hecho, en el presente estudio se comprueba la manifiesta presencia de macrófagos en la lesión derivada de la administración de una dieta hipercolesterolémica a ratones apoE-/− (fig. 3). Respecto a los linfocitos T, aunque también existe una clara infiltración de los mismos en la lesión (fig. 3), su papel no ha sido totalmente esclarecido, debido, en parte, al elevado número de subtipos celulares presentes en esta línea linfoide. Sin embargo, parecen ser requeridos en los estadios iniciales del desarrollo de la placa27.
Asimismo, los resultados obtenidos en los estudios de microscopia intravital demuestran que en el ratón apoE-/− sometido a dieta aterogénica existe un claro escenario proinflamatorio que se manifiesta por una mayor adhesividad de los leucocitos al endotelio, especialmente al arteriolar (fig. 5), indicando una clara disfunción endotelial en la microcirculación. A este respecto, en los eventos ateroscleróticos tempranos parece estar implicada VCAM-1, molécula de adhesión que media la interacción de leucocitos mononucleares al endotelio, pero no de neutrófilos28. En este sentido, estudios de disfunción endotelial llevados a cabo por nuestro grupo, ya demostraron la importancia de esta MAC en la adhesión arteriolar de leucocitos mononucleares inducida por angiotensina-ii29. Por ello cabe esperar que la mayoría de los leucocitos adheridos a las arteriolas cremastéricas sean mononucleares y a través del aumento de expresión de VCAM-1.
Por otro lado, con el tiempo, las lesiones ateroscleróticas pasan de la fase de estría grasa inicial compuesta de células espumosas, ricas en macrófagos cargados de lípidos y células de la musculatura lisa vascular que han emigrado, a lesiones más complejas en animales de mediana edad. Estas lesiones avanzadas son heterogéneas, pero están principalmente compuestas de un core necrótico rodeado de células proliferantes de la musculatura lisa vascular y de proteínas de la matriz extracelular30,31. Como se comprueba en el presente estudio (fig. 4), la administración de una dieta ateogénica a ratones apoE-/− provoca un claro aumento de fibras de colágeno, del core necrótico y del número de células de la musculatura lisa vascular en el área de la lesión.
A pesar de todo lo anteriormente expuesto, la principal limitación de este modelo animal reside en la reducida frecuencia de rotura de placa o en la detección de fenómenos trombóticos, 2 complicaciones típicas de la lesión aterosclerótica en humanos.
ConclusiónEl modelo de ratón apoE-/− sometido a dieta aterogénica ha sido y es un modelo tremendamente útil en la caracterización de la relevancia de los mecanismos inflamatorios y el papel del sistema inmune en la formación y progresión de la placa aterosclerótica, permite ensayar nuevos fármacos a nivel preclínico, ya que dado el pequeño tamaño del animal se requieren bajas cantidades de fármaco para evaluar el efecto del mismo in vivo y, finalmente, permite descubrir y diseñar nuevas dianas terapéuticas, ya que este modelo animal se puede cruzar fácilmente con otros ratones manipulados genéticamente, los cuales pueden bien no expresar, bien sobreexpresar un determinado receptor o proteína y determinar el papel de los mismos en la progresión de la placa aterosclerótica. Por ello, este modelo constituye una clara herramienta traslacional en el estudio de los fenómenos ateroscleróticos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste estudio ha sido sufragado por los proyectos SAF2011-23777, Ministerio de Economía y Competitividad, Fondos FEDER, la Generalitat Valenciana (GVACOMP2014-006 y PROMETEO II/2013/014) y una beca de la Sociedad Española de Angiología y Cirugía Vascular (SEACV). PE disfruta de una beca predoctoral (FPU) del Ministerio de Educación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.