Introducción. La etiopatogenia de la arterioesclerosis reúne una serie de factores condicionantes y procesos inflamatorios crónicos que originan un estado permanente de disfunción endotelial. La endotelina (ET) es una proteína relacionada con la función de las células endoteliales, y que parece tener un papel en la enfermedad arterial periférica (EAP), como manifestación de la arterioesclerosis. Objetivo. Investigar el papel de la ET en la EAP, y su relación con los síntomas, la función endotelial y los procesos inflamatorios. Sujetos y métodos. Realizamos un estudio transversal con 141 sujetos: 66 pacientes con claudicación intermitente, 37 pacientes con isquemia crítica y 38 controles sanos. Medimos los niveles de ET y proteína C reactiva (hsPCR) plasmática y la dilatación de la arteria braquial mediada por flujo (DABMF) en estos tres grupos. Resultados. Las concentraciones de ET son significativamente más altas en pacientes comparados con los controles sanos (8,76±7,1 frente a 6,45±0,89 pM/L; p=0,002). Los pacientes con claudicación presentan concentraciones de ET significativamente más altas que los pacientes con isquemia crítica (10,97±7,9 frente a 4,82±2,57 pM/L; p<0,001). Los valores de hsPCR fueron mayores en los pacientes con isquemia crítica que en los claudicantes (16,94 frente a 4,73mg/L; p=0,001). En la DABMF no obtuvimos diferencias significativas entre los dos grupos (5,4 ±3,7% en claudicantes, 5,85 ±4,35% en críticos; p=0,58). Las concentraciones de ET presentan una modesta correlación negativa con los valores de hsPCR (−0,165; p=0,095). Conclusión. Las concentraciones plasmáticas de ET en los pacientes con EAP son mayores en etapas iniciales de la enfermedad. Con la progresión de la enfermedad, se observa una disminución de los valores de ET, mientras que existe un incremento del marcador inflamatorio hsPCR. [ANGIOLOGÍA 2008; 60: 395–401]
Introduction. The aetiopathogenesis of arteriosclerosis includes a series of conditioning factors and chronic inflammatory processes that give rise to a permanent state of endothelial dysfunction. Endothelin (ET) is a protein that is involved in the functioning of endothelial cells and which seems to play a role in peripheral arterial disease (PAD), as a manifestation of arteriosclerosis. Aim. To examine the role of ET in PAD and its relation with the symptoms, endothelial functioning and inflammatory processes. Subjects and methods. We conducted a cross-sectional study with 141 subjects: 66 patients with intermittent claudication, 37 patients with critical ischaemia and 38 healthy controls. We measured the levels of ET and C-reactive protein (hsCRP) in plasma and the brachial artery flow-mediated dilation (BAFMD) in these three groups. Results. ET concentrations are significantly higher in patients than in healthy controls (8.76±7.1 vs. 6.45±0.89 pM/L; p=0.002). Patients with claudication show significantly higher ET concentrations than patients with critical ischaemia (10.97±7.9 vs. 4.82±2.57 pM/L; p<0.001). Patients with critical ischaemia had higher hsCRP values than those with claudication (16.94 vs. 4.73mg/L; p=0.001). No significant differences were observed in the BAFMD in the two groups (5.4±3.7% in those with claudication, 5.85±4.35%; p=0.58). ET concentrations show a slight negative correlation with the hsCRP values (−0.165; p=0.095). Conclusions. Plasma concentrations of ET in patients with PAD are higher in the early stages of the disease. As the disease progresses, the ET values diminish while the inflammatory marker hsCRP increases. [ANGIOLOGIA 2008; 60: 395–401]
En la actualidad sabemos que en el proceso degenerativo ateroesclerótico están implicados una alteración en la función endotelial y una serie de procesos inflamatorios [1, 2]. Estos cambios estimulan la proliferación de células musculares lisas de la pared del vaso como resultado de la liberación de distintos factores de crecimiento. Entre estos factores se encuentra la proteína conocida como endotelina (ET) [3].
La ET es un péptido de 21 aminoácidos descubierto en 1985 y secuenciado en 1988 [4]. Es el vasoconstrictor más potente conocido hasta el momento, y está implicada en la regulación del sistema cardiovascular [5]. También colabora en otras funciones como la broncoconstricción, el desarrollo embrionario, el crecimiento prostático, la carcinogénesis, así como funciones endocrinas y gastrointestinales [6]. Se conocen hasta el momento cuatro isoformas de endotelina (ET-1, ET-2, ET-3 y ET-4 ); las concentraciones plasmáticas de la ET-2 son menos del 20% de las de la ET-1, y las de la ET-3 son el 50% de las de la ET-1 [7].
Estudios previos han puesto de manifiesto que en el inicio de la enfermedad arterial periférica (EAP) desempeña un papel importante la alteración de la función endotelial [8, 9]. Esta disfunción se considera una alteración precoz, que sucede antes de que puedan demostrarse cambios estructurales en la pared del vaso. Igualmente, se ha descrito en qué medida actúa la inflamación en el origen y el desarrollo de la EAP, siendo un proceso necesario y persistente en el tiempo [10].
De acuerdo con estudios previos sobre las acciones biológicas de la ET, creemos que esta proteína puede desempeñar un papel crucial en la etiopatogenia de la EAP [11].
Con este estudio, pretendemos conseguir los siguientes objetivos:
- –
Definir el papel de la ET en la EAP y su relación con la clínica isquémica.
- –
Determinar la relación de la ET con la función endotelial estimada por la dilatación de la arteria braquial mediada por flujo (DABMF).
- –
Evaluar la relación de la ET con los procesos inflamatorios implicados en la arterioesclerosis, estimados por los valores plasmáticos de la proteína C reactiva (hsPCR).
Realizamos un estudio transversal determinando las concentraciones plasmáticas de ET en pacientes con EAP estratificados según el grado de gravedad clínica. Calculamos el tamaño muestral necesario para el estudio con una potencia de 0,8 y un error tipo a de 0,5.
Incluimos en el análisis una muestra de 103 pacientes con EAP sintomática seleccionados de forma sistemática, con un índice tobillo/brazo<0,9 y síntomas de claudicación intermitente, dolor en reposo y/o lesiones tróficas. De ellos, 66 (64%) eran pacientes con claudicación -grados IIA y IIB de La Fontaine (grupo A)- y 37 (36%) presentaban isquemia crítica -grados III y IV (grupo B)-. Excluimos del estudio a los pacientes con enfermedades inflamatorias crónicas o procesos inflamatorios o infecciosos recientes, que pueden actuar como factor de confusión en la determinación de los marcadores inflamatorios. Para determinar las diferencias en los valores basales de la ET con respecto a los pacientes con EAP, también analizamos un grupo control formado por 38 personas menores de 35 años, sin factores de riesgo cardiovascular y sin enfermedades inflamatorias o infecciosas, seleccionados de entre la población de personal sanitario del Hospital Universitario de Getafe (grupo C).
En los tres grupos realizamos una anamnesis detallada con especial atención en los factores de riesgo cardiovascular. Se define como hipertensión arterial la obtención en al menos dos mediciones de una presión arterial≥140/90mmHg o el tratamiento con fármacos antihipertensivos. Consideramos dislipemia como un colesterol total>200mg/dL, colesterol unido a lipoproteínas de baja densidad (LDL)>100mg/dL, triglicéridos>150mg/dL o pacientes que están recibiendo tratamiento hipolipemiante. El diagnóstico de diabetes mellitus se lleva a cabo por el hallazgo de una glucosa plasmática en ayunas>126mg/dL, además de los pacientes que ya estaban en tratamiento con antidiabéticos orales y/o insulina. Realizamos una claudicometría a todos los pacientes con isquemia grado IIA y IIB que no presentan contraindicación para la misma. También realizamos a todos los pacientes un índice tobillo/brazo según la técnica habitual.
En todos los grupos realizamos una analítica con determinación de creatinina como estimador de la función renal, hemoglobina glucosilada (HbA1c) para valorar el control glucémico, perfil lipídico, homocisteína y marcadores inflamatorios (leucocitos y hsPCR). Para la determinación de la hsPCR, utilizamos un inmunoanálisis ultrasensible automatizado (Roche Diagnostics) con un límite inferior de detección de 0,2mg/L y un coeficiente de variación del 4,2% en 4mg/L y del 6,3% en 1mg/L.
Como medida de la disfunción endotelial, determinamos la DABMF según la siguiente técnica: se visualiza la arteria braquial mediante eco-Doppler por encima del pliegue del codo en una sección longitudinal, y se realizan tres mediciones del diámetro entre las interfases íntima-media. Posteriormente, se hincha un manguito de presión a 250mmHg durante 5 minutos, volviendo a medir el diámetro 70 segundos después de la liberación de la isquemia. Para calcular la DAFMD, se utiliza la siguiente fórmula: la media de los diámetros postisquemia menos la media de los diámetros basales dividido entre la media de los diámetros basales, expresado en porcentaje [12].
Las concentraciones plasmáticas de ET se midieron en muestras de sangre venosa de todos los pacientes y controles, se guardaron en hielo tras la extracción y se centrifugaron el mismo día en todos los casos. El plasma se congela a −20°C hasta el momento de la determinación. Utilizamos un enzimoinmunoanálisis con anticuerpos monoclonales de ratón antiendotelina (Biomédica Gruppe). La prueba mide ET-1 (1–21) 100%, ET-2 (1–21) 100%, ET-3 (1–21)<5% y Big-ET<1%. Tiene un límite inferior de detección de 0,02 fM/mL y un coeficiente de variación del 3% en 7,01 fM/mL y del 4% en 2,02 fM/mL.
Análisis estadísticoPara el estudio de la distribución de normalidad de las variables, utilizamos el test de Kolmogorov- Smirnov. Usamos el test t de Student para la comparación de medias de variables paramétricas. En la comparación de medias de variables no paramétricas aplicamos el test U de Mann–Whitney. Al comparar las medias de variables dicotómicas, utilizamos el test de chi al cuadrado.
La PCR sigue una distribución exponencial; por lo tanto, para esta variable aplicamos el test de la comparación de medianas.
Realizamos una correlación entre variables utilizando el test rho de Spearman.
Los datos se expresan como media±desviación estándar, excepto para la PCR, expresada como mediana±cuartiles 25 y 75.
Se consideró la significación estadística para un valor de p<0,05 en un análisis bilateral.
ResultadosEn el análisis por estratificación según la gravedad de la clínica, el grupo de pacientes con claudicación intermitente y con isquemia crítica son homogéneos en cuanto a edad y factores de riesgo cardiovascular. Sólo encontramos diferencias significativas en los valores de fibrinógeno, el cual, como marcador de inflamación sistémica de fase aguda, se encuentra elevado en los pacientes con mayor gravedad de la clínica, como cabría esperar según estudios previos (Tabla).
Comparación de las características de los pacientes con claudicación intermitente e isquemia crítica.
| Claudicantes (n=66) | Críticos (n=37) | p | |
| Edad (años) | 68,73 | 71,43 | 0,10 |
| Tabaco (%) | 54,40 | 26,20 | 0,14 |
| Hipertensión arterial (%) | 41,72 | 23,30 | 0,97 |
| Creatinina (mg/dL) | 1,11 | 1,21 | 0,43 |
| HbA1c (%) | 7,09 | 7,20 | 0,63 |
| Leucocitos (células/mm3) | 8.029,73 | 8.599,66 | 0,13 |
| Homocisteína (mM/L) | 13,25 | 12,45 | 0,37 |
| Colesterol total (mg/dL) | 185,76 | 176,83 | 0,26 |
| Colesterol-HDL (mg/dL) | 53,72 | 50,92 | 0,29 |
| Colesterol LDL (mg/dL) | 96,66 | 103,08 | 0,22 |
| Triglicéridos (mg/dL) | 148,20 | 143,28 | 0,60 |
| Cardiopatía isquémica (%) | 17,50 | 8,70 | 0,74 |
| ACVA (%) | 7,80 | 1,90 | 0,26 |
| Fibrinógeno (g/L) | 341,83 | 404,39 | 0,004 |
ACVA: accidente cerebrovascular agudo; HbA1c: hemoglobina glucosilada; HDL: lipoproteínas de alta densidad; LDL: lipoproteínas de baja densidad.
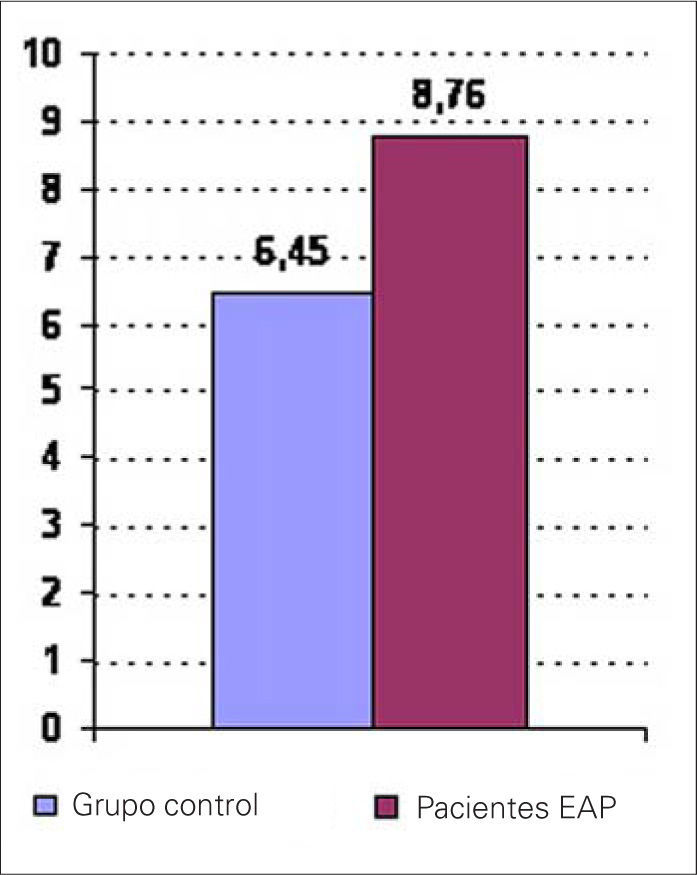
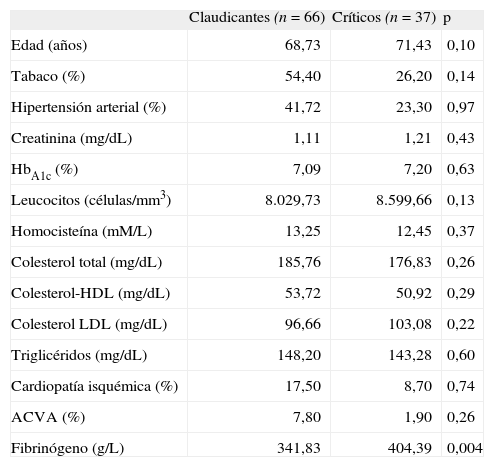
Encontramos concentraciones plasmáticas de ET mayores en el grupo de enfermos que en el grupo control: 8,76±7,1 frente a 6,45±0,89 pM/L; p=0,002 (Fig. 1).
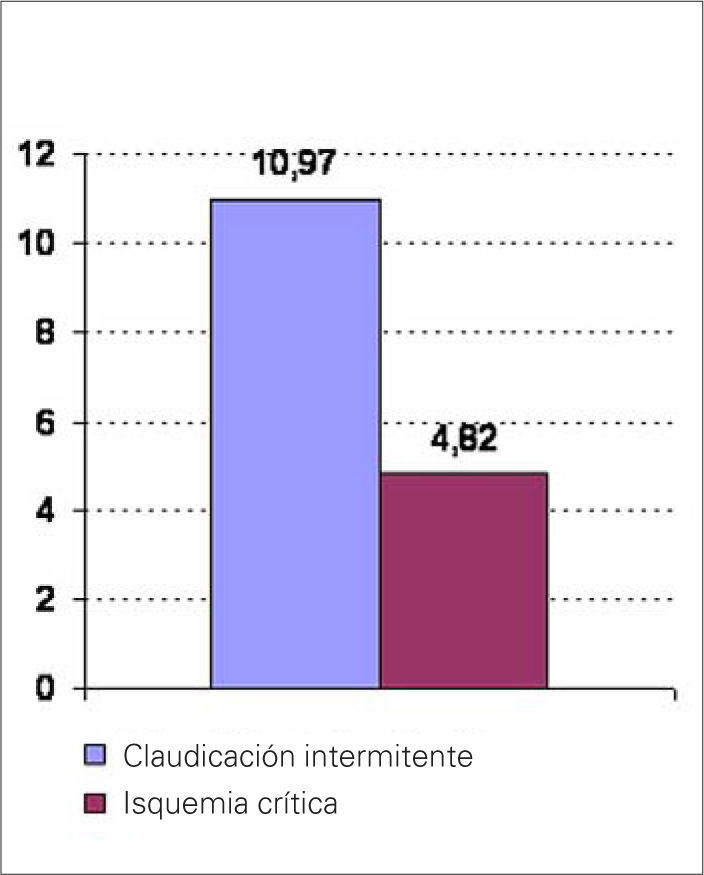
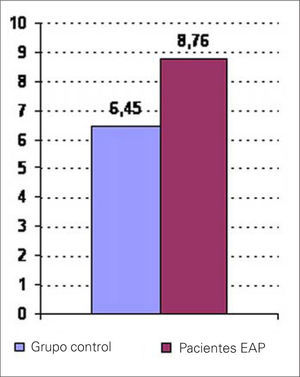
Comparamos los valores de ET entre ambos grupos de enfermos, y encontramos diferencias significativas; éstas fueron mayores en los pacientes con claudicación que en los afectados de isquemia crítica: 10,97±7,9 frente a 4,82±2,57 pM/L; p<0,001 (Fig. 2).
En la DABMF no obtuvimos diferencias significativas en los porcentajes de dilatación entre los dos grupos de pacientes: 5,4±3,7% en claudicantes; 5,85±4,35% en críticos; p=0,58.
En cuanto a la hsPCR, obtuvimos valores mayores en los pacientes con isquemia crítica, con una diferencia estadísticamente significativa con respecto a los claudicantes: 16,94 (5,6; 66,37) mg/L frente a 4,73 (3,32; 7,37) mg/L.
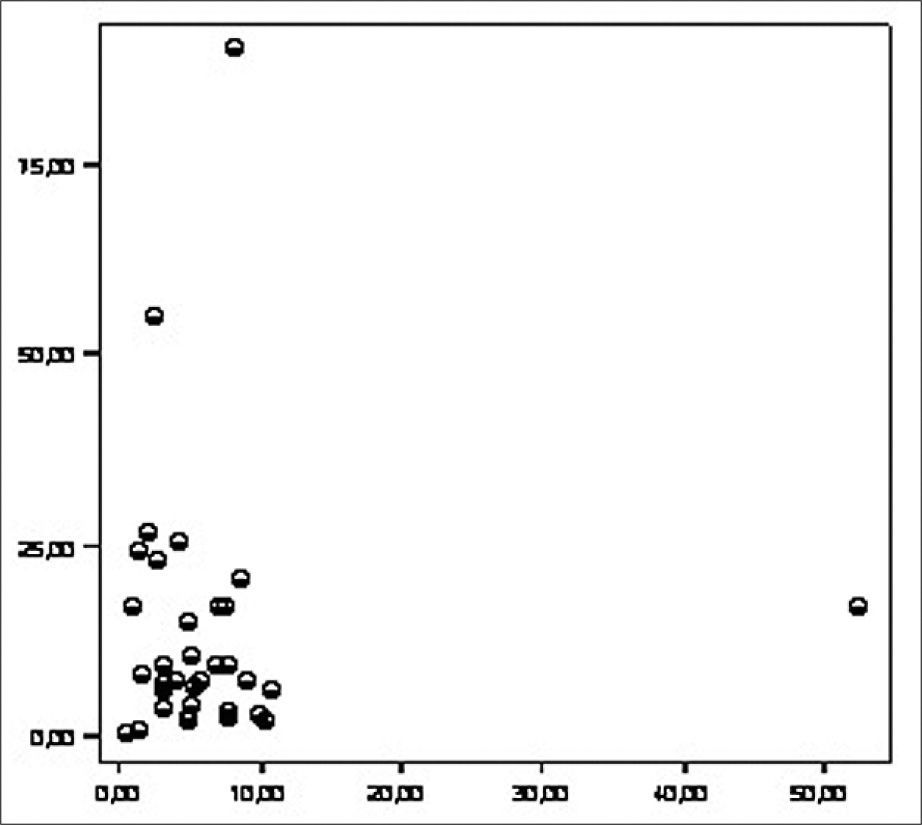
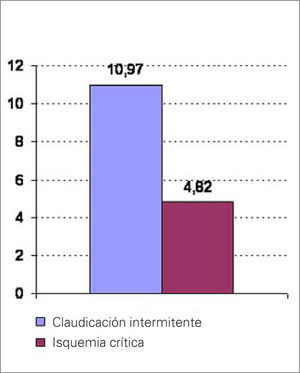
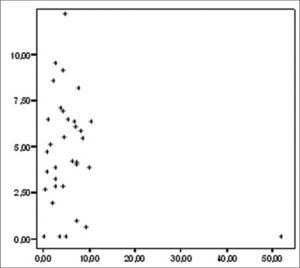
Analizamos la correlación entre la ET y la hsPCR y encontramos un coeficiente de correlación de −0,165 (p=0,095) (Fig. 3).
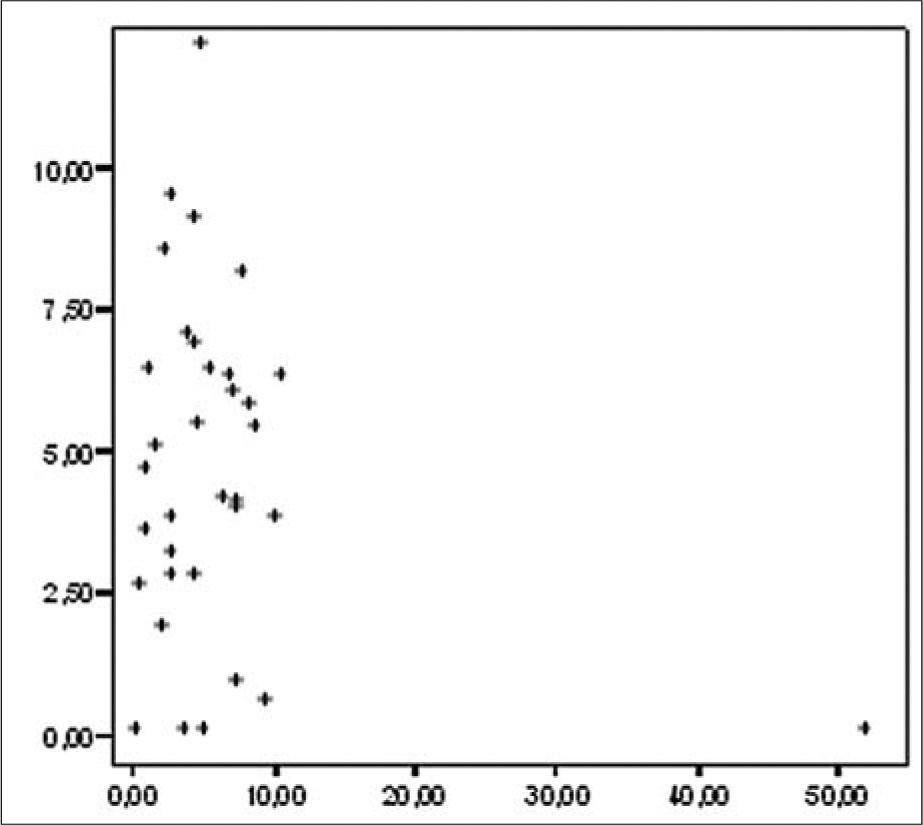
Al relacionar la ET con la DABMF, el coeficiente de correlación entre ambas variables fue de −0,040 (p=0,68) (Fig. 4).
DiscusiónEn la EAP está implicada la disfunción endotelial como alteración que se observa en el origen de la enfermedad en respuesta a distintos estímulos nocivos. La respuesta inflamatoria también tiene un papel muy importante en el inicio, perpetuando la enfermedad en el tiempo y agravando sus síntomas.
Pocos trabajos aclaran la participación de la ET en la fisiopatología de la EAP. Los resultados de nuestro estudio evidencian que la ET está implicada en la etiopatogenia de la enfermedad en los pacientes claudicantes, de forma paralela a la disfunción endotelial. Sin embargo, también podemos inferir que no tiene un papel importante en la progresión de la enfermedad, que sí observamos en los procesos inflamatorios.
Una de las manifestaciones de la alteración de la función endotelial es la producción excesiva de ET. Ésta se produce mayoritariamente en las células endoteliales y, en menor medida, en leucocitos, macrófagos, células musculares lisas, miocitos cardíacos y fibroblastos [13]. El 80% de su producción se libera hacia la membrana basal, y su acción se ejerce por un mecanismo paracrino, mediante la unión a distintos tipos de receptores de membrana. La ET-1 se halla aumentada en la sangre en distintas enfermedades relacionadas con procesos isquémicos, como el infarto de miocardio, la insuficiencia renal aguda y el ictus [14].
Inicialmente se descubrió su acción vasoconstrictora y broncoconstrictora. Actualmente, también conocemos su función como citocina proinflamatoria y factor de crecimiento de fibroblastos y células musculares lisas de la pared vascular, lo que contribuye al desarrollo de la placa de ateroma [15, 16]. En condiciones fisiológicas, la ET-1 tiene efectos mitogénicos e inotrópicos, influye en la excreción renal de agua y sal, estimula el sistema renina-angiotensina, aumentando el volumen intravascular, y potencia la actividad del sistema nervioso simpático.
Como factores que estimulan la producción de la ET-1 se conocen la hipoxia, concentraciones elevadas de colesterol-LDL y glucosa, obesidad, deficiencia estrogénica, envejecimiento, factores procoagulantes y consumo de cocaína.
En distintos estudios se han hallado valores elevados de ET-1 en pacientes con arterioesclerosis, sobre todo en la enfermedad coronaria, y se ha encontrado elevada desde las etapas iniciales de ésta [17, 18].
En el presente estudio obtenemos concentraciones mayores de ET en los pacientes con EAP que en los controles, en congruencia con otros estudios al respecto [18].
Cuando comparamos los valores de ET entre los pacientes con claudicación intermitente y los que presentan una isquemia crítica, encontramos una diferencia significativa a favor de los primeros. Estos valores elevados en las etapas iniciales de la enfermedad pueden poner de manifiesto el papel de la ET en el origen de la enfermedad, determinada por sus acciones proinflamatorias fibrogénicas y mitogénicas. Sin embargo, en las etapas finales de la EAP, las concentraciones disminuyen significativamente, lo cual puede explicarse por los fenómenos de autorregulación, así como por la desestructuración de las células endoteliales en arterias muy lesionadas, que perderían parcialmente la capacidad de sintetizar ET.
Utilizamos la DABMF como un estimador de la función endotelial, y nuestros resultados ponen de manifiesto, como ya hemos afirmado en otras ocasiones, que la disfunción endotelial que se observa en las etapas iniciales de la enfermedad no aumenta con la gravedad de ésta [8]. No encontramos una correlación directa entre la ET y la disfunción endotelial estimada mediante la DABMF (bajo coeficiente de correlación entre ambas variables).
Sin embargo, al analizar el marcador inflamatorio hsPCR, observamos que sus valores aumentan significativamente con la progresión de la EAP, por lo que reafirmamos el papel de la inflamación en el mantenimiento y la progresión de la EAP [10]. Como esperábamos, no existe correlación entre las concentraciones de ET y las de hsPCR.
Nuestros resultados ponen de manifiesto la importancia de actuar en las etapas iniciales de la enfermedad para prevenir su progresión, y colocan a la ET-1 como una diana a la que dirigir nuestros esfuerzos terapéuticos. Se ha demostrado que los fármacos inhibidores del sistema renina-angiotensina inhiben indirectamente la producción de ET-1, al igual que las estatinas, que disminuyen la expresión del gen de la ET, independientemente de su efecto hipolipemiante [19, 20]. Se han sintetizado distintas moléculas capaces de bloquear los receptores de ET, de forma selectiva o no selectiva, y que en el futuro podrían utilizarse junto con los otros fármacos para frenar la progresión de la EAP desde sus etapas más iniciales.