La endofuga tipo 2 (EF2) es la complicación más frecuente tras EVAR, con una tasa de crecimiento del saco variable y un tratamiento de resultados poco efectivos. Se pretende analizar la incidencia de EF2, su persistencia y evolución en una población homogénea, buscando variables predictoras de crecimiento del saco.
Material y métodosSetenta EF2 (32,2%) detectadas en 217 EVAR aortoilíacos tratados con GORE® Excluder entre 2003 y 2011. Seguimiento clínico y con angiotomografía computarizada (media 32,5 meses). Análisis univariante de datos recogidos de forma prospectiva. Función de supervivencia de Kaplan-Meier y regresión de Cox.
ResultadosUn 90% de varones con edad media 75,5±8 años y diámetro aórtico 59,6±10mm. El vaso aferente más frecuente fue una arteria lumbar (n=42), con un 30% de endofugas complejas (n=21). Veinticinco endofugas fueron transitorias (35,7%) y 45 persistentes, grupo este último con mayor número de mujeres (p=0,044) y de colaterales aferentes al saco (1,5±0,7 vs. 1,2±0,4, p=0,022). Crecimiento >5mm en un 38,6% de casos (mediana 8,5mm, rango 5-24); once se trataron con embolización (éxito 63,6%). Las endofugas complejas no incrementaron el riesgo. El único predictor independiente de crecimiento en la regresión de Cox fue la edad (HR 2,71 IC95% 1,01-7,19 p=0,046).
ConclusionesLas EF2 constituyen una complicación frecuente y sin factores predictores sólidos que permitan estratificar el riesgo de crecimiento del saco, por lo que es necesario un seguimiento exhaustivo.
Type 2 endoleaks (T2E) are the most common finding after endovascular aortic repair (EVAR), with a variable sac growth rate and a treatment with unpromising results. The aim of this study is to analyze the incidence of T2E and their evolution in a homogeneous population, seeking predictors for sac growth.
Material and methodsA total of 70 T2E (32.2%) were detected in 217 aorto-iliac EVAR treated with a GORE® Excluder endograft from 2003 to 2011. They were systematically followed-up with contrast enhanced tomography (mean 32.5 months). Univariate analysis of prospectively collected data; Kaplan-Meier survival functions and multivariate Cox regression.
Results90% of patients with T2E were males, with a mean age 75.8±8 years, and mean aortic diameter 59.5±10mm. The most common persistent collateral vessel was a lumbar artery (n=42), with 30% of complex T2E (n=21). The endoleaks were transient in 25 cases (35.7%), and 45 persisted for more than 6 months, the latter with a higher percentage of women (p=0.044), and total number of afferent vessels (1.5±0.7 vs. 1.2±0.4, p=0.022). Sac growth over 5mm was observed in 38.6% of cases (median 8.5mm, rank 5-24), with eleven of those treated with trans-arterial or trans-lumbar embolization (63.6% success). Complex endoleaks did not show a higher risk profile. Age was the only independent risk factor in the Cox regression analysis (HR 2.71, 95% CI; 1.01-7.19 p=0.046).
ConclusionsT2E are a frequent complication, with no solid predictive factors for stratifying sac growth risk, thus needing close surveillance.
La persistencia de flujo sanguíneo en el interior del saco aneurismático (endofuga) es la complicación más frecuente tras la reparación endovascular de los aneurismas de la aorta abdominal (EVAR)1. Si bien las endofugas tipo 1 y 3 tienen un potencial mayor de ocasionar rotura del aneurisma2, es la endofuga tipo 2 (EF2) la más común –con frecuencias que oscilan entre un 133 y un 44%4–, la de diagnóstico más complicado5 y, en caso de precisarse, la que presenta un tratamiento con resultados menos efectivos6,7.
Por este motivo, las guías clínicas más recientes recomiendan realizar un seguimiento por imagen protocolizado y exhaustivo8, potencialmente dañino para el paciente por las altas dosis de radiación recibidas9 y la nefrotoxicidad del contraste yodado, y que además dispara los costes globales del EVAR10, sobre todo si se necesitan procedimientos secundarios11. Sería útil por tanto disponer de factores predictores para estratificar el riesgo de crecimiento del saco y/o aparición de complicaciones asociadas tras el diagnóstico de una endofuga tipo 2, con objeto de seguir de forma diferente a los grupos con distinto perfil de riesgo12, reduciendo significativamente los costes y efectos deletéreos que conlleva.
Exponemos aquí los resultados de un estudio observacional analítico realizado sobre una cohorte retrospectiva de pacientes consecutivos, encaminado a cuantificar la incidencia de EF2 en una población homogénea para el modelo de endoprótesis, su persistencia en el tiempo y, además, identificando posibles predictores o grupos de mayor riesgo de crecimiento de saco a largo plazo.
Material y métodosEn nuestro centro se llevaron a cabo un total de 569 procedimientos de reparación programada de aneurisma aortoilíaco entre 2003 y 2011. De ellos, 298 se realizaron por técnica endovascular (EVAR), colocándose en 217 casos una endoprótesis Gore® Excluder (WL Gore and Associates, Inc., Flagstaff, AR, EE. UU.). Todos los casos fueron evaluados mediante tomografía computarizada con contraste (aTC) antes de la intervención, con un grosor de corte de 3mm y empleando un volumen de contraste ajustado al peso del paciente y su creatinina sérica; asimismo, se realizaron aTC de control una semana, seis y dieciocho meses postimplantación, y anualmente a posteriori.
Los pacientes fueron seguidos durante una media de 32,5±24 meses. Aquellos que no completaron al menos un año de seguimiento (n=13) computaron para el cálculo de incidencia y persistencia de endofuga tipo 2 pero fueron excluidos del análisis de crecimiento. A este respecto, también se excluyeron tres pacientes con endofuga tipo 1, uno con endofuga tipo 3 y otros dos con endotensión (endofuga tipo 5) detectadas tras la implantación.
Se definieron tres variables resultado principales en el estudio: la presencia de endofuga tipo 2 en algún estudio posprocedimiento, su persistencia en un control inmediatamente posterior (seis meses después) y el crecimiento del saco aneurismático en cinco o más milímetros respecto al diámetro máximo preoperatorio. Se consideró como estable un tamaño del saco entre+5 y -5 milímetros sobre el previo, y como regresión del saco si se registró una disminución en su diámetro mayor de cinco o más milímetros. Las endofugas detectadas se consideraron complejas si presentaban más de un vaso en comunicación con el saco.
Se recogieron asimismo datos biométricos, de factores de riesgo, enfermedades previas y condiciones de cada caso, datos del acto quirúrgico y eventos en el seguimiento (mortalidad, complicaciones mayores, complicaciones menores y reintervenciones), incorporándolos de forma prospectiva a una base de datos informatizada (Access®, Microsoft Corp., Redmond, WA, EE. UU.), actualizada a un sistema online en los últimos meses (Zoho Corp., Pleasanton, CA, EE. UU.). Se consideraron complicaciones mayores las de tipo sistémico: síndrome coronario agudo, insuficiencia cardíaca con edema agudo de pulmón, arritmia cardíaca, accidente cerebrovascular, isquemia mesentérica, fallo hepático, neumonía, sepsis de cualquier origen, insuficiencia renal aguda, síndrome renoureteral o isquemia aguda de miembros inferiores. El acceso a la historia clínica, la recogida y análisis de datos se realizaron según los protocolos del Comité Ético de Investigación Clínica del centro.
Se empleó el test de Shapiro-Wilk para contrastar la hipótesis de ajuste a distribución normal en las variables cuantitativas, expresando como media y desviación típica las que se ajustaron, y como mediana y recorrido intercuartílico las que no. Se testaron las variables asociadas a presencia de endofuga, persistencia de endofuga y crecimiento del saco en relación con EF2 empleando la prueba X2 de Pearson para variables cualitativas y la prueba t de Student para variables cuantitativas, con un nivel de significación de 0,05. Con frecuencias registradas inferiores a cinco y variables continuas con distribución no asimilable a una normal de Gauss se emplearon los test homólogos no paramétricos (test exacto de Fischer y test U de Mann y Whitney, respectivamente). Se realizaron funciones de supervivencia de Kaplan y Meier para el tiempo libre de crecimiento superior a 5 milímetros, comparándolas entre grupos mediante el test log-rank (Mantel-Cox). Para estos cálculos se tuvo en cuenta el tiempo transcurrido desde la primera identificación de la endofuga. Los cálculos se realizaron con los paquetes estadísticos SPSS Statistics 20 (IBM Corporation, Armonk, NY, EE. UU.) y Stata® 12 (StataCorp LP, College Station, TX, EE. UU.).
ResultadosUn total de 70 pacientes (32,2%) presentaron una endofuga tipo 2 (EF2) a lo largo del seguimiento. La media de edad fue 75,5±8 años, y el diámetro aórtico medio al tratamiento fue de 59,6±10mm. Diez de esos pacientes (14,3%) fallecieron; de esas muertes, solo una guardó relación con la enfermedad aneurismática, en concreto la de un varón de 81 años con enfermedad pulmonar obstructiva crónica (EPOC) severa en oxigenoterapia domiciliaria no candidato a procedimientos abiertos. En este caso se detectó una EF2 por arterias lumbares que fue embolizada con microcoils, apareciendo después otra endofuga compleja que llevó al crecimiento del saco a 120mm y a la muerte por rotura del aneurisma, 5 años y 7 meses tras el EVAR. Asimismo, 20 pacientes con EF2 (28,6%) sufrieron algún tipo de complicación, menor en 18 casos y mayor en dos (fallo cardíaco derecho y trombosis de rama de la endoprótesis). Quince precisaron reintervención, de ellos 10 por EF2 y otros cinco por otros motivos: revisión de hemostasia inguinal (n=2), desbridamiento de infección de herida quirúrgica inguinal (n=1), migración distal con colocación de extensores aórticos (n=1) y bypass fémoro-femoral por trombosis de rama (n=1).
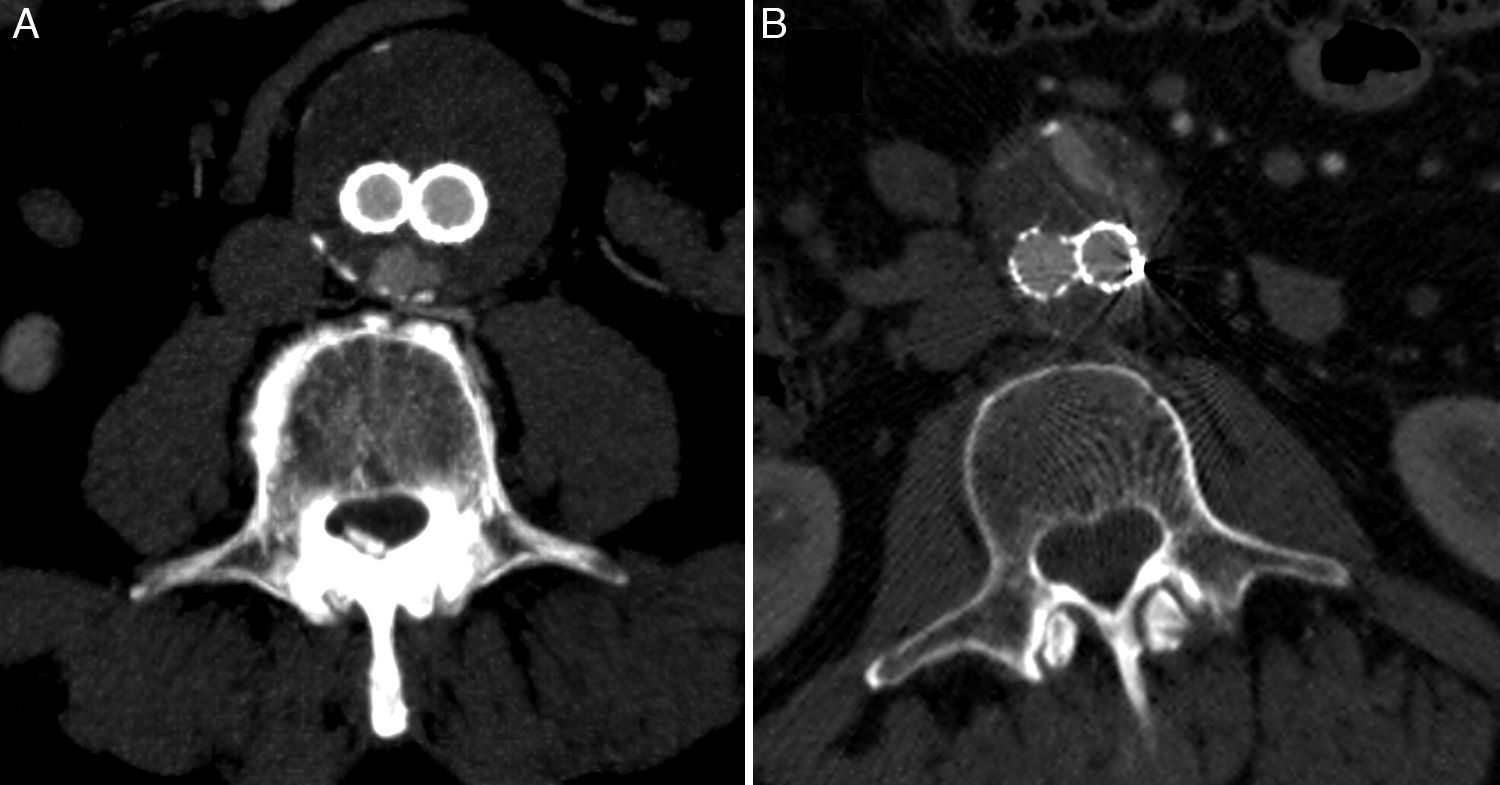
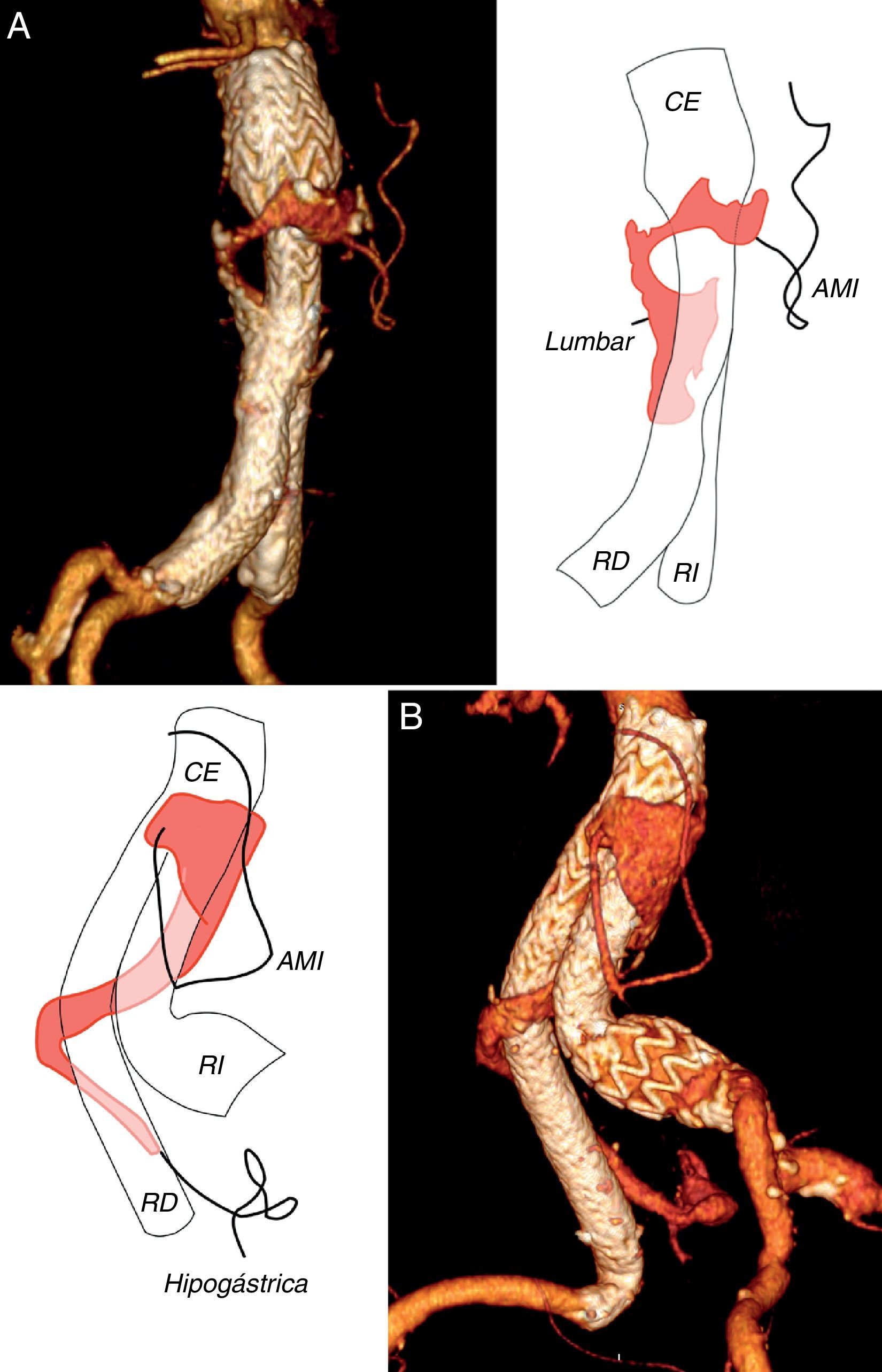
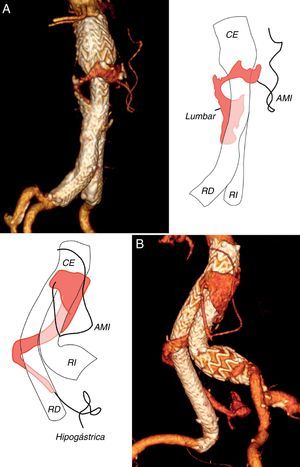
La colateral que con mayor frecuencia originó la endofuga fue una arteria lumbar (n=42), (fig. 1 A), seguida de la arteria mesentérica inferior (n=26), (fig. 1B). En quince casos se encontraron dos colaterales (21,4%) y en otros seis se encontraron tres (8,6%), para un total de 21 endofugas complejas (30%), (fig. 2 A y B). Otros orígenes fueron menos comunes, como la arteria hipogástrica (n=4), la sacra media (n=1) o una arteria polar renal (n=1). En cuatro pacientes no se visualizó un vaso permeable que alimentase la endofuga (5,7%).
Reconstrucción tridimensional de angiotomografía computarizada en dos casos de endofuga compleja, por arteria mesentérica inferior (AMI) y una arteria lumbar A) y por AMI y arteria hipogástrica derecha B). CE: cuerpo de la endoprótesis; RD: rama derecha de la endoprótesis; RI: rama izquierda de la endoprótesis.
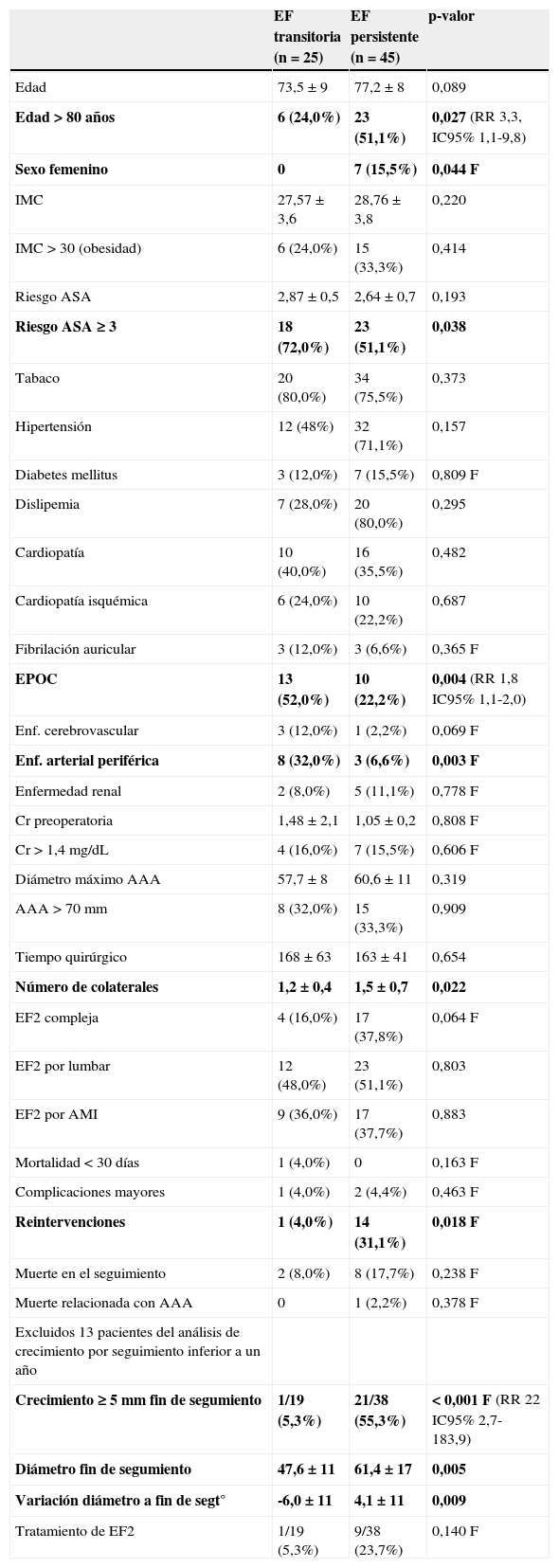
Veinticinco de las 70 EF2 (35,7%) fueron transitorias, consideradas como tales por visualizarse en un único estudio de imagen. Otras 45 (64,3%) fueron persistentes, de las que 33 aparecían ya en el primer control postimplantación y 12 comenzaron en fases más tardías, una mediana de 39 meses tras el diagnóstico (rango 14-62 meses). Todas las endofugas detectadas en fases tardías persistieron en los controles posteriores. La tabla 1 resume las características diferenciales de los grupos con endofugas transitoria y persistente.
Datos biométricos, de factores de riesgo, anatómicos y evolutivos de los grupos con endofuga tipo 2 transitoria y persistente
| EF transitoria (n=25) | EF persistente (n=45) | p-valor | |
|---|---|---|---|
| Edad | 73,5±9 | 77,2±8 | 0,089 |
| Edad>80 años | 6 (24,0%) | 23 (51,1%) | 0,027 (RR 3,3, IC95% 1,1-9,8) |
| Sexo femenino | 0 | 7 (15,5%) | 0,044 F |
| IMC | 27,57±3,6 | 28,76±3,8 | 0,220 |
| IMC>30 (obesidad) | 6 (24,0%) | 15 (33,3%) | 0,414 |
| Riesgo ASA | 2,87±0,5 | 2,64±0,7 | 0,193 |
| Riesgo ASA ≥ 3 | 18 (72,0%) | 23 (51,1%) | 0,038 |
| Tabaco | 20 (80,0%) | 34 (75,5%) | 0,373 |
| Hipertensión | 12 (48%) | 32 (71,1%) | 0,157 |
| Diabetes mellitus | 3 (12,0%) | 7 (15,5%) | 0,809 F |
| Dislipemia | 7 (28,0%) | 20 (80,0%) | 0,295 |
| Cardiopatía | 10 (40,0%) | 16 (35,5%) | 0,482 |
| Cardiopatía isquémica | 6 (24,0%) | 10 (22,2%) | 0,687 |
| Fibrilación auricular | 3 (12,0%) | 3 (6,6%) | 0,365 F |
| EPOC | 13 (52,0%) | 10 (22,2%) | 0,004 (RR 1,8 IC95% 1,1-2,0) |
| Enf. cerebrovascular | 3 (12,0%) | 1 (2,2%) | 0,069 F |
| Enf. arterial periférica | 8 (32,0%) | 3 (6,6%) | 0,003 F |
| Enfermedad renal | 2 (8,0%) | 5 (11,1%) | 0,778 F |
| Cr preoperatoria | 1,48±2,1 | 1,05±0,2 | 0,808 F |
| Cr>1,4mg/dL | 4 (16,0%) | 7 (15,5%) | 0,606 F |
| Diámetro máximo AAA | 57,7±8 | 60,6±11 | 0,319 |
| AAA>70mm | 8 (32,0%) | 15 (33,3%) | 0,909 |
| Tiempo quirúrgico | 168±63 | 163±41 | 0,654 |
| Número de colaterales | 1,2±0,4 | 1,5±0,7 | 0,022 |
| EF2 compleja | 4 (16,0%) | 17 (37,8%) | 0,064 F |
| EF2 por lumbar | 12 (48,0%) | 23 (51,1%) | 0,803 |
| EF2 por AMI | 9 (36,0%) | 17 (37,7%) | 0,883 |
| Mortalidad<30 días | 1 (4,0%) | 0 | 0,163 F |
| Complicaciones mayores | 1 (4,0%) | 2 (4,4%) | 0,463 F |
| Reintervenciones | 1 (4,0%) | 14 (31,1%) | 0,018 F |
| Muerte en el seguimiento | 2 (8,0%) | 8 (17,7%) | 0,238 F |
| Muerte relacionada con AAA | 0 | 1 (2,2%) | 0,378 F |
| Excluidos 13 pacientes del análisis de crecimiento por seguimiento inferior a un año | |||
| Crecimiento ≥ 5mm fin de segumiento | 1/19 (5,3%) | 21/38 (55,3%) | < 0,001 F (RR 22 IC95% 2,7-183,9) |
| Diámetro fin de segumiento | 47,6±11 | 61,4±17 | 0,005 |
| Variación diámetro a fin de segt° | -6,0±11 | 4,1±11 | 0,009 |
| Tratamiento de EF2 | 1/19 (5,3%) | 9/38 (23,7%) | 0,140 F |
AAA: aneurisma de la aorta abdominal; AMI: arteria mesentérica inferior; ASA: American Society of Anesthesiology; Cr: creatinina sérica; EF: endofuga; EF2: endofuga tipo 2; EPOC: enfermedad pulmonar obstructiva crónica; F: test exacto de Fisher; IC95%: intervalo de confianza al 95%; IMC: índice de masa corporal; RR: riesgo relativo.
Negrita indica aquellas variables en las que la comparación entre grupos tiene un p-valor significativo.
El análisis de crecimiento se realizó excluyendo trece pacientes con seguimiento inferior a un año. Los 57 restantes fueron seguidos durante una mediana de 47 meses. De ellos, en 22 casos se objetivó un crecimiento de saco superior a 5mm (38,6%), con una mediana de crecimiento de 8,5mm (rango 5-24). Veintidós pacientes mantuvieron estable el diámetro del aneurisma (38,6%) y 13 más experimentaron reducción respecto a los diámetros preoperatorios (22,8%). La media de supervivencia libre de crecimiento (> 5mm) fue de 38,5±17 meses. Once EF2 recibieron tratamiento, con una media de 1,18 procedimientos por paciente y una efectividad del 63,6% (7/11). Uno de los tratamientos se efectuó de forma precoz, antes de un año de seguimiento. El saco aneurismático había crecido una media de 12,5±7mm en el momento del tratamiento de la EF2, que tuvo lugar un tiempo medio de 29,6±16 meses (rango 7–62 meses) tras el procedimiento EVAR. El tratamiento inicial consistió siempre en embolización, bien selectiva de las ramas aferentes por vía transarterial (n=8) o no selectiva del saco aneurismático por vía translumbar (n=3), con materiales diversos como Onyx® (ev3 Endovascular, Inc., Plymouth, MN), coils o trombina. Un caso precisó conversión a cirugía abierta para ligadura de arterias lumbares tras intento infructuoso de embolización transarterial.
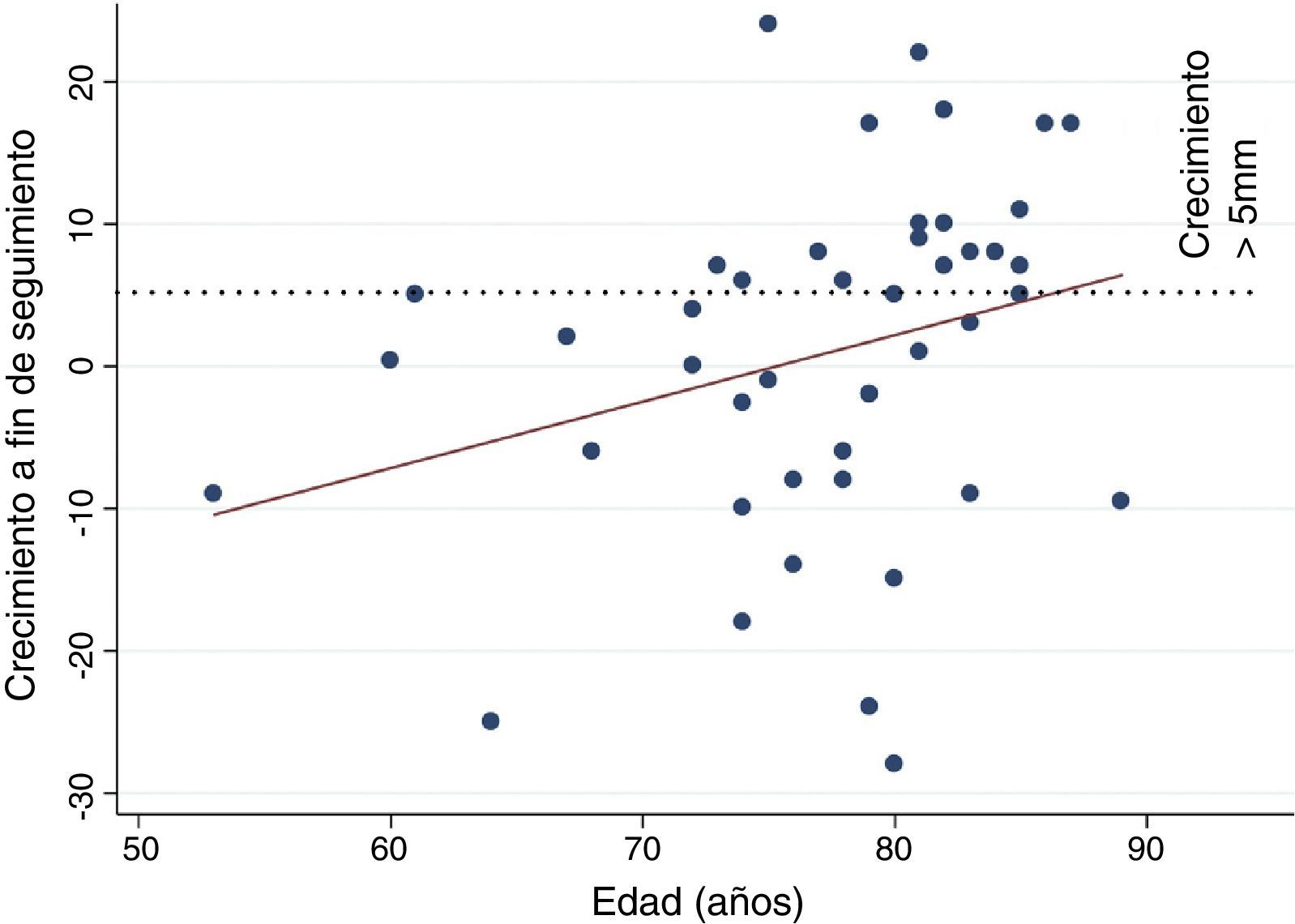
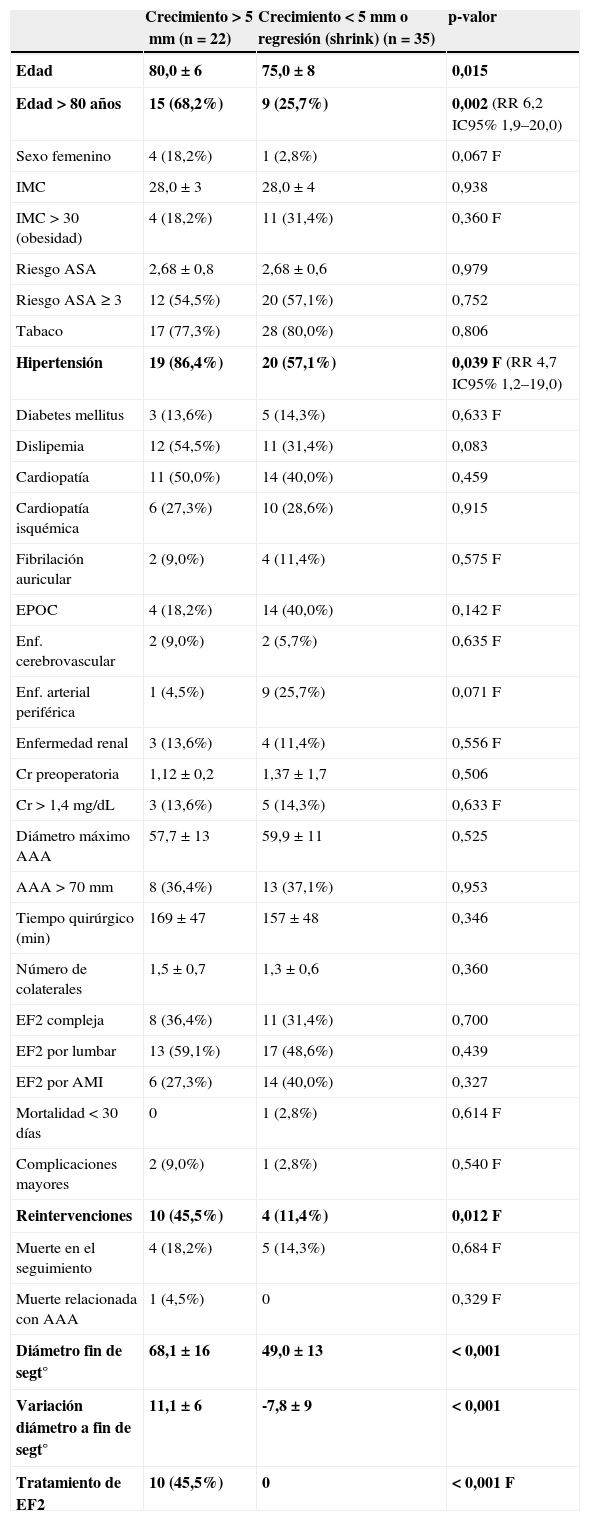
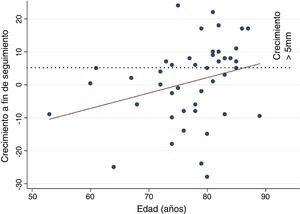
Factores predictoresLa media de edad fue significativamente superior en el grupo con crecimiento del saco>5mm (80,0±6 vs. 75,0±8 años, p=0,015), con una correlación positiva aunque no significativa (R=0,288) entre edad y crecimiento (fig. 3). También se asoció con aumento de tamaño la hipertensión arterial (p=0,039). Ninguna otra característica clínica del paciente o anatómica de la endofuga se comportó como predictor de crecimiento (tabla 2).
Datos biométricos, de factores de riesgo, anatómicos y evolutivos de los grupos con endofuga tipo 2 con y sin crecimiento de saco
| Crecimiento>5mm (n=22) | Crecimiento<5mm o regresión (shrink) (n=35) | p-valor | |
|---|---|---|---|
| Edad | 80,0±6 | 75,0±8 | 0,015 |
| Edad>80 años | 15 (68,2%) | 9 (25,7%) | 0,002 (RR 6,2 IC95% 1,9–20,0) |
| Sexo femenino | 4 (18,2%) | 1 (2,8%) | 0,067 F |
| IMC | 28,0±3 | 28,0±4 | 0,938 |
| IMC>30 (obesidad) | 4 (18,2%) | 11 (31,4%) | 0,360 F |
| Riesgo ASA | 2,68±0,8 | 2,68±0,6 | 0,979 |
| Riesgo ASA ≥ 3 | 12 (54,5%) | 20 (57,1%) | 0,752 |
| Tabaco | 17 (77,3%) | 28 (80,0%) | 0,806 |
| Hipertensión | 19 (86,4%) | 20 (57,1%) | 0,039 F (RR 4,7 IC95% 1,2–19,0) |
| Diabetes mellitus | 3 (13,6%) | 5 (14,3%) | 0,633 F |
| Dislipemia | 12 (54,5%) | 11 (31,4%) | 0,083 |
| Cardiopatía | 11 (50,0%) | 14 (40,0%) | 0,459 |
| Cardiopatía isquémica | 6 (27,3%) | 10 (28,6%) | 0,915 |
| Fibrilación auricular | 2 (9,0%) | 4 (11,4%) | 0,575 F |
| EPOC | 4 (18,2%) | 14 (40,0%) | 0,142 F |
| Enf. cerebrovascular | 2 (9,0%) | 2 (5,7%) | 0,635 F |
| Enf. arterial periférica | 1 (4,5%) | 9 (25,7%) | 0,071 F |
| Enfermedad renal | 3 (13,6%) | 4 (11,4%) | 0,556 F |
| Cr preoperatoria | 1,12±0,2 | 1,37±1,7 | 0,506 |
| Cr>1,4mg/dL | 3 (13,6%) | 5 (14,3%) | 0,633 F |
| Diámetro máximo AAA | 57,7±13 | 59,9±11 | 0,525 |
| AAA>70mm | 8 (36,4%) | 13 (37,1%) | 0,953 |
| Tiempo quirúrgico (min) | 169±47 | 157±48 | 0,346 |
| Número de colaterales | 1,5±0,7 | 1,3±0,6 | 0,360 |
| EF2 compleja | 8 (36,4%) | 11 (31,4%) | 0,700 |
| EF2 por lumbar | 13 (59,1%) | 17 (48,6%) | 0,439 |
| EF2 por AMI | 6 (27,3%) | 14 (40,0%) | 0,327 |
| Mortalidad<30 días | 0 | 1 (2,8%) | 0,614 F |
| Complicaciones mayores | 2 (9,0%) | 1 (2,8%) | 0,540 F |
| Reintervenciones | 10 (45,5%) | 4 (11,4%) | 0,012 F |
| Muerte en el seguimiento | 4 (18,2%) | 5 (14,3%) | 0,684 F |
| Muerte relacionada con AAA | 1 (4,5%) | 0 | 0,329 F |
| Diámetro fin de segt° | 68,1±16 | 49,0±13 | < 0,001 |
| Variación diámetro a fin de segt° | 11,1±6 | -7,8±9 | < 0,001 |
| Tratamiento de EF2 | 10 (45,5%) | 0 | < 0,001 F |
AAA: aneurisma de la aorta abdominal; AMI: arteria mesentérica inferior; ASA: American Society of Anesthesiology; Cr: creatinina sérica; EF: endofuga; EF2: endofuga tipo 2; EPOC: enfermedad pulmonar obstructiva crónica; F: test exacto de Fisher; IC95%: intervalo de confianza al 95%; IMC: índice de masa corporal; RR: riesgo relativo.
Negrita indica aquellas variables en las que la comparación entre grupos tiene un p-valor significativo.
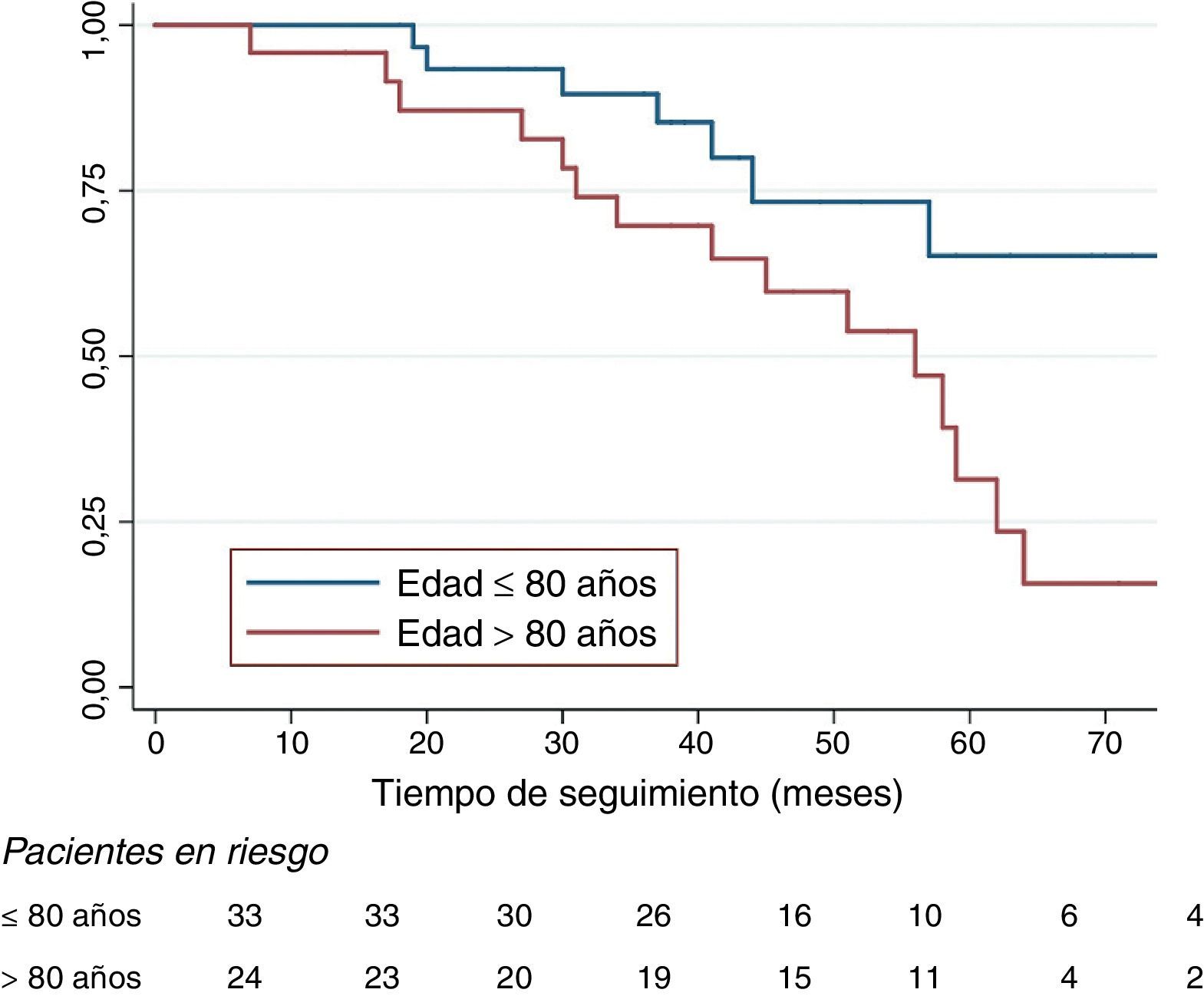
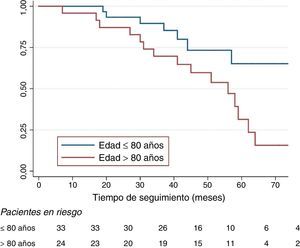
La mediana de supervivencia libre de crecimiento>5mm fue de 59 meses para todos los pacientes con EF2. La función de Kaplan-Meier mostró una supervivencia libre de crecimiento superior a 5mm significativamente inferior para el grupo de pacientes de más de 80 años (Mantel-Cox p=0,017), (fig. 4), menos de la mitad a cinco años (65,4 vs. 31,4%). La regresión de Cox confirmó a la edad como único predictor independiente de crecimiento, con una hazard ratio de 2,71 (IC 95% 1,01-7,19, p=0,046).
Discusión y conclusionesEl término endofuga fue acuñado primero en 199613 y sistematizado después en 199714 por el grupo de G.H. White, de la Universidad de Sydney (Australia). En esa primera aproximación se define la endofuga tipo 2 como la persistencia de flujo dentro del saco tras la colocación de una endoprótesis, ocasionada por la afluencia retrógrada de sangre a través de vasos colaterales14. Es el tipo de endofuga más frecuente (40-45%)15 y la complicación más común tras el EVAR1,16.
Las series más antiguas comunican incidencias de EF2 postimplantación de hasta un 44%,4 aunque trabajos más recientes la reducen a cifras que oscilan entre el 13-14%3,17 y el 23-24%18–22. En nuestra cohorte, un 32,2% de casos presentaron endofuga en el primer control post-EVAR, cifra levemente superior a las anteriores aunque concordante con los resultados del estudio EUROSTAR23, que mostró incidencias levemente superiores en endoprótesis modelo Gore® Excluder de primera generación. Asimismo, nuestra tasa de resolución espontánea en el segundo control (35,7%) es comparable a las que se han obtenido en otros estudios previos (35,2%),22 aunque las series más tempranas obtenían cifras mucho más elevadas (70%)4,24. Los estados neoplásicos, la enfermedad coronaria y la EPOC se comportan como factores protectores frente a la persistencia de la endofuga,20 en probable relación con la discrasia sanguínea y el aumento de factores protrombóticos que se les asocia, y así en nuestra población la persistencia fue significativamente inferior en los grupos con EPOC y enfermedad arterial periférica. También el uso de antiagregantes se ha implicado en la persistencia de la endofuga y la ausencia de regresión del saco25. Este extremo no es comprobable en nuestro estudio por escasez de grupo control: el 78,5% (n=55) de los pacientes recibieron algún antiagregante al alta, de acuerdo a las recomendaciones más recientes8.
La importancia de la EF2 como problema de salud no deriva de su elevada incidencia sino fundamentalmente de los eventos adversos que asocia. El más evidente es la aproximación de la presión arterial intrasaco a la sistémica26, llevando al crecimiento del aneurisma (hasta un 55% si la EF2 es persistente)5, y su eventual rotura hasta en un 20% de los casos2,27. En nuestra experiencia, en torno a uno de cada dos pacientes con EF2 persistente experimentó aumento en los diámetros máximos del aneurisma por encima de 5mm. Además, la EF2 es la causa más frecuente de reintervención tras EVAR16,28 siendo responsable de en torno a un 40% de los procedimientos secundarios27. Por si fuera poco, los pacientes con EF2 presentan más complicaciones29, en muchos casos reciben más dosis de radiación de la permitida9, tienen una elevada incidencia de nefropatía por contraste9 e incluso sufren ansiedad por ser etiquetados con el diagnóstico de endofuga30. Finalmente, la aparición de una EF2 multiplica por 4,6 los costes globales del procedimiento EVAR a 5 años (por 8,6 si se necesitan procedimientos secundarios)9.
De forma intencionada no se utilizó la necesidad de tratamiento de la EF2 como variable resultado de este trabajo, por ausencia de sistematización en su indicación. Esta ha sido siempre objeto de controversia, con opiniones que abogan por tratar de forma agresiva casi todas las EF231 frente a otras más conservadoras que solo tratan crecimientos de saco superiores al centímetro8. En cualquier caso, es evidente que ofrece resultados pobres en su variante endovascular (embolización transarterial o translumbar)6,7 o bien obliga a la reintervención abierta, perdiendo los beneficios del EVAR. Nuestra tasa de éxito del 63,6% en el tratamiento así lo confirma, e incide en la necesidad de estratificar el riesgo dentro de las EF2 y mejorar la selección de pacientes32.
Para ello, distintos trabajos han buscado variables con potencial predictivo de persistencia o crecimiento del saco, y han señalado a las características anatómicas del aneurisma y la endofuga como las que muestran una asociación más clara. Brountzos et al.33 y AbuRahma et al.34 relacionan la persistencia de la EF2 con el número de colaterales aferentes al saco y la cantidad de trombo intraluminal preoperatorios; otros trabajos refuerzan la importancia del número de colaterales permeables,19 de su calibre17,35 y del tamaño de la cavidad de la endofuga17,35, incluso con evaluación exclusiva mediante ultrasonografía3. En nuestra población algún factor anatómico (número de colaterales) se asoció a la persistencia de la endofuga pero no al crecimiento del saco, lo que sugiere la existencia de subpoblaciones entre las endofugas persistentes cuyo potencial de crecimiento no depende de la anatomía. Factores no morfológicos como el hábito tabáquico pueden aumentar el riesgo de crecimiento6, al igual que en nuestro estudio lo elevó significativamente la hipertensión arterial. El único predictor independiente, sin embargo, fue la edad del paciente en el momento del EVAR, un factor que ensombrece su pronóstico en multitud de estudios6,36 pese a ser la técnica de elección en los pacientes más ancianos por su menor morbimortalidad37,38. Cinco años tras el procedimiento, un 65% de octogenarios y nonagenarios sufrirían crecimiento significativo del aneurisma según la función de Kaplan-Meier, frente a solo un 31% en la población con edades inferiores.
Nuestro estudio se ve limitado por la heterogeneidad en la indicación del tratamiento, no sistematizada en los primeros años del total de 9 que comprende. En el momento actual, se tratan todas aquellas endofugas tipo 2 con crecimiento superior a los 10mm, o con aumentos rápidos del tamaño del saco (5mm en un año), de acuerdo a las recomendaciones publicadas8. Asimismo, no se realizó volumetría del saco aneurismático ni de la cavidad de cada endofuga, variables que sí han mostrado relevancia en otros trabajos35.
En resumen, la EF2 es una complicación frecuente en los pacientes tratados con la endoprótesis modelo Gore® Excluder, encontrándose en más de un tercio (32,2%) a lo largo del seguimiento. Del total de endofugas detectadas, casi dos tercios (64,3%) persisten en un segundo control y un 38,6% origina aumento del diámetro máximo del aneurisma superior a 5 milímetros. Factores sistémicos como la hipertensión arterial y sobre todo la edad predisponen a un crecimiento significativo y temprano del saco, por lo que el seguimiento debe ser especialmente exhaustivo en estos subgrupos. El futuro augura que pruebas de imagen menos dañinas como la tomografía sin contraste39 y la ecografía Doppler40 pueden formar parte de los controles estándar tras el EVAR con resultados similares al seguimiento con contraste12,41,42, por lo que los grupos de pacientes con un perfil de riesgo más bajo pueden ser idóneos para su implantación.
Información adicionalLos autores no presentan ningún conflicto de intereses relativo al diseño y desarrollo del presente estudio.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
El presente trabajo fue objeto de Comunicación Oral en el LVIII Congreso Nacional de la Sociedad Española de Angiología y Cirugía Vascular (SEACV), celebrado en Barcelona entre el 31 de mayo y el 2 de junio de 2012.