Las endofugas tipo ii ocurren en el 10 y el 45% de los pacientes sometidos a reparación endovascular de aneurismas aortoiliacos infrarrenales. La mayoría son benignas y se resuelven espontáneamente, pero hay un porcentaje que persiste.
Nuestro objetivo es describir el comportamiento de estas endofugas en nuestro centro: efecto sobre el saco y el paciente, y necesidad de tratamiento.
Material y métodosEstudio observacional retrospectivo. Entre febrero del 2009 y diciembre del 2013 se implantaron en nuestro centro 236 endoprótesis tipo Endurant II®. Recogimos datos demográficos, factores de riesgo cardiovascular, anatomía de los aneurismas, eventos periprocedimiento, persistencia de la endofuga, efecto sobre el saco, tasa de reintervención y mortalidad. Se realizó un análisis actuarial mediante curvas de Kaplan Meyer.
ResultadosObservamos 47 endofugas tipo ii (20,8%). El seguimiento medio fue de 16,94 meses, contabilizándose 12 pérdidas (25,5%). La endofuga desapareció en 21 pacientes (44,7%), en 16 casos en los primeros 6 meses (34,0%). El saco creció en 5 casos (10,6%), con rotura en uno de ellos y fallecimiento intraquirófano (2,1%). La supervivencia libre de crecimiento a 31 meses es del 70,6% y la supervivencia libre de rotura es a 44 meses del 75,1%. Cinco pacientes precisaron reintervención (10,6%): 2 por crecimiento sintomático del saco y 3 por complicaciones del dispositivo. Fallecieron 7 pacientes (en un caso en relación con el aneurisma): la supervivencia global a 58 meses es del 76,3%.
ConclusiónLas endofugas tipo ii pueden condicionar crecimiento del saco aneurismástico con riesgo de rotura y fallecimiento. Deben realizarse un seguimiento estrecho y un planteamiento temprano de su tratamiento ante la persistencia y el crecimiento del saco.
Type II endoleaks occur in 10-45% of patients undergoing endovascular infrarenal aortoiliac aneurysms repair. Most of them are benign and resolve spontaneously, but there is a percentage that persists. The behaviour of these endoleaks in this centre is described, including the effect on aneurysm sac, on the patient, and reinterventions.
Material and methodsA retrospective review was conducted on 236 Endurant II® stent grafts implanted between February 2009 and December 2013. A record was made of the demographic data, cardiovascular risk factors, anatomy of aneurysms, peri-procedural events, persistent endoleak, effect on the sac, reintervention rate, and mortality. Actuarial analysis was performed using Kaplan Meyer curves.
ResultsA total of 47 type ii endoleaks (20.8%) were observed. Mean follow-up was 16.94 months, with 12 cases lost (25.5%). The endoleak disappeared in 21 patients (44.7%), and in 16 cases within the first 6 months (34.0%). The sac grew in 5 cases (10.6%), with one rupture and death in the operating room (2.1%). Freedom from growth at 31 months was 70.6%, and freedom from rupture at 44 months was 75.1%. Reintervention (10.6%) was required in 5 patients: 2 symptomatic growth of sac, and 3 device related complications. There were 7 deaths (in one case due to an aneurysm): overall survival at 58 months was 76.3%.
ConclusionType II endoleaks may lead to aneurysm sac growth with risk of rupture and death. Persistent endoleaks with sac enlargement should be closely monitored in order that they can be treated early.
La complicación más frecuente tras la reparación endovascular de los aneurismas de aorta abdominal es la presencia de endofugas; esto es, la persistencia de flujo sanguíneo dentro del saco aneurismático y fuera de la endoprótesis1,2.
Cuando este flujo sanguíneo proviene de ramas colaterales del saco aneurismático, hablamos de endofuga tipo ii. Son las más frecuentes y su historia natural no está del todo bien definida. Aparecen en un 10-45% de los pacientes durante el seguimiento y, aunque la mayoría se resuelven espontáneamente (35-79,9%), hay un porcentaje que persiste con crecimiento del saco aneurismático, necesidad de reintervención y riesgo de rotura2-6.
Estudios recientes describen en pacientes con este tipo de endofuga altos porcentajes de reintervención (10-20%), de crecimiento del saco aneurismático (37,9%) y de explante de endoprótesis (8,4%)3,7-9. El riesgo de rotura recogido en la literatura es del 0,5-2,4%1,5,8 y la mortalidad relacionada con el aneurisma se cifra en el 1,6%8.
Por todo lo descrito anteriormente, parece fundamental realizar en todos los pacientes sometidos a este procedimiento un seguimiento estrecho. Se recomienda realizar una angio-TC con contraste al mes y a los 12 meses tras la colocación de la endoprótesis. En caso de identificar una endofuga o crecimiento del saco aneurismático, se debe repetir la prueba a los 6 meses. Si no hay anomalías en esas 2 primeras angio-TC, se puede realizar el seguimiento con angio-TC o ecografía Doppler anual10.
El objetivo de nuestro trabajo es describir el comportamiento de las endofugas tipo ii en los pacientes sometidos a reparación endovascular de aneurismas aortoiliacos infrarrenales con endoprótesis tipo Endurant II® en nuestro centro: su efecto sobre el saco y sobre el paciente, y la necesidad de tratamiento.
Material y métodosAnálisis y ampliación de datos de forma retrospectiva de una base de datos mantenida de forma prospectiva de los pacientes sometidos a reparación endovascular de aneurismas aortoiliacos infrarrenales. Entre febrero del 2009 y diciembre del 2013 se colocaron en nuestro centro un total de 236 endoprótesis tipo Endurant II® en 233 pacientes.
Se realizó un seguimiento postoperatorio mediante angio-TC con contraste en triple fase al mes, a los 6 meses, al año y luego anualmente o semestralmente, según la presencia o no de endofuga o ante crecimiento del saco aneurismático.
Se excluyó del estudio a 11 pacientes en los que la endoprótesis se implantó para tratamiento de endofugas de otros dispositivos (10 Talent® y uno Vanguard®) y aquellos que no tenían endofuga tipo ii.
Para la recolección de los datos se llevó a cabo una revisión de la historia clínica del paciente, incluyendo hoja de ingreso, protocolo quirúrgico, seguimiento en consulta y otros informes, así como de las pruebas de imagen realizadas antes del procedimiento y durante el seguimiento. Se obtuvieron así:
- –
Datos relacionados con los pacientes: sexo, edad, factores de riesgo cardiovascular, otros antecedentes personales, antecedentes quirúrgicos, valoración anestésica (American Society of Anesthesiologists).
- –
Datos relacionados con el aneurisma: diámetro máximo, diámetro y longitud del cuello, diámetro de arterias iliacas primitivas, afectación aórtica pura o aortoiliaca, colaterales permeables del saco antes del procedimiento (arteria mesentérica inferior, lumbares, hipogástricas).
- –
Datos relacionados con el procedimiento: urgente o electivo, tipo de dispositivo implantado (bifurcado o aortomonoiliaco), complicaciones durante el mismo.
- –
Datos relacionados con el seguimiento: duración, aparición de endofuga tipo ii, efecto de la endofuga sobre el tamaño del saco (consideramos significativo un aumento del diámetro máximo igual o mayor a 5mm), eventos adversos graves relacionados con el dispositivo (trombosis, embolia, migración de la endoprótesis, rotura del saco), necesidad de reintervención, fallecimiento por todas las causas, fallecimiento relacionado con el aneurisma definido como aquel que ocurre en el primer mes postoperatorio o tras una reintervención por rotura del saco o por otro evento adverso grave relacionado con el dispositivo11.
El análisis estadístico se realizó con el software IBM-SPSS 20® para Windows®. Los cálculos descriptivos de variables continuas se expresan como medias y los de variables cualitativas como porcentajes. Se realizó un análisis actuarial mediante curvas de Kaplan Meyer, aceptando un error estándar inferior a 0,1.
ResultadosObjetivamos un total de 47 endofugas tipo ii durante el seguimiento postoperatorio (20,8%). Todas ellas aparecieron precozmente, visualizándose desde el primer control.
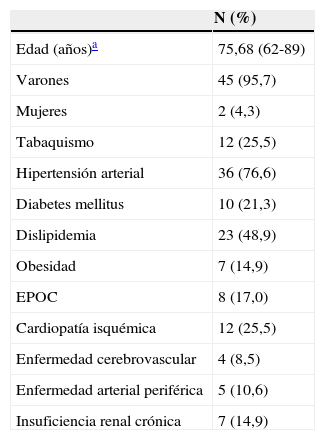
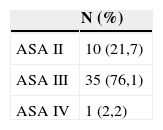
Resultados inicialesEn la tabla 1 se recogen las características demográficas de los pacientes, así como los factores de riesgo cardiovascular relacionados. La clasificación anestésica preoperatoria de 46 pacientes se refleja en la tabla 2, en un caso el procedimiento se había realizado de urgencia (2,1%).
Características de los pacientes
| N (%) | |
|---|---|
| Edad (años)a | 75,68 (62-89) |
| Varones | 45 (95,7) |
| Mujeres | 2 (4,3) |
| Tabaquismo | 12 (25,5) |
| Hipertensión arterial | 36 (76,6) |
| Diabetes mellitus | 10 (21,3) |
| Dislipidemia | 23 (48,9) |
| Obesidad | 7 (14,9) |
| EPOC | 8 (17,0) |
| Cardiopatía isquémica | 12 (25,5) |
| Enfermedad cerebrovascular | 4 (8,5) |
| Enfermedad arterial periférica | 5 (10,6) |
| Insuficiencia renal crónica | 7 (14,9) |
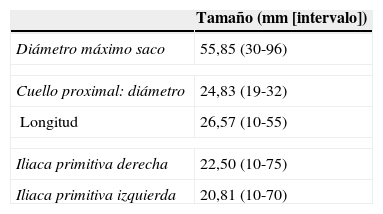
En la tabla 3 se recogen las características anatómicas de los aneurismas aortoiliacos infrarrenales tratados. Observamos afectación aórtica pura en 20 pacientes (42,6%) y en el resto degeneración aneurismática aortoiliaca (57,4%). En todos los pacientes había al menos una arteria hipogástrica y una arteria lumbar permeables. La permeabilidad de la arteria mesentérica inferior fue menor (86,4%).
Se implantaron 38 endoprótesis bifurcadas (80,9%), siendo el resto aortomonoiliacas acompañadas de bypass femorofemoral cruzado. En 10 pacientes fue preciso el anclaje distal del dispositivo a nivel de arteria iliaca externa (21,3%), realizándose embolización hipogástrica en 5 casos (10,6%): en uno de ellos, de forma bilateral. La indicación de embolización hipogástrica la determinaba la afectación aneurismática del origen de la misma.
Endofuga desde hipogástrica: serie completaDel total de los 236 dispositivos implantados, se precisó anclaje distal en arteria iliaca externa en 39. En 10 casos se realizó embolización hipogástrica mediante colocación de coils en su tercio proximal por afectación aneurismática de su origen.
Observamos un total de 5 endofugas tipo ii originadas desde ramas hipogástricas: 12,8%. En 2 de ellas se había realizado embolización hipogástrica previa. Por tanto, contamos con un 20% de endofuga desde rama hipogástrica entre las que embolizamos (2/10) y un 10,3% entre las que no embolizamos (3/29).
ProcedimientoVolviendo al grupo de pacientes con endofuga tipo ii, se produjeron 5 complicaciones (10,6%) que precisaron intervención en el mismo acto para su resolución: una fuga tipo i proximal reparada mediante la implantación de un cuff proximal, una fuga tipo i distal resuelta tras inflado de balón en el interior del dispositivo y 3 plastias con parche de arteria femoral común, acceso arterial utilizado para la introducción de los diferentes módulos de la endoprótesis.
SeguimientoSe perdieron en algún punto del seguimiento 12 pacientes (25,5%); 5 de ellos completaron al menos un año de revisiones. El seguimiento medio fue de 16,94 meses (intervalo 0,5-45).
Evolución de la endofuga y del saco aneurismáticoEl origen de la endofuga tipo ii fue reinyección desde: arteria mesentérica inferior (29,8%); ramas lumbares (44,7%); arteria mesentérica inferior+ramas lumbares (14,9%); arteria hipogástrica (8,5%), y arteria mesentérica inferior+hipogástrica (2,1%).
De los 10 pacientes con fuga tipo ii y anclaje distal del dispositivo en la arteria iliaca externa, se observó fuga hipogástrica en 5; en 2 de ellos se había realizado previamente embolización a dicho nivel.
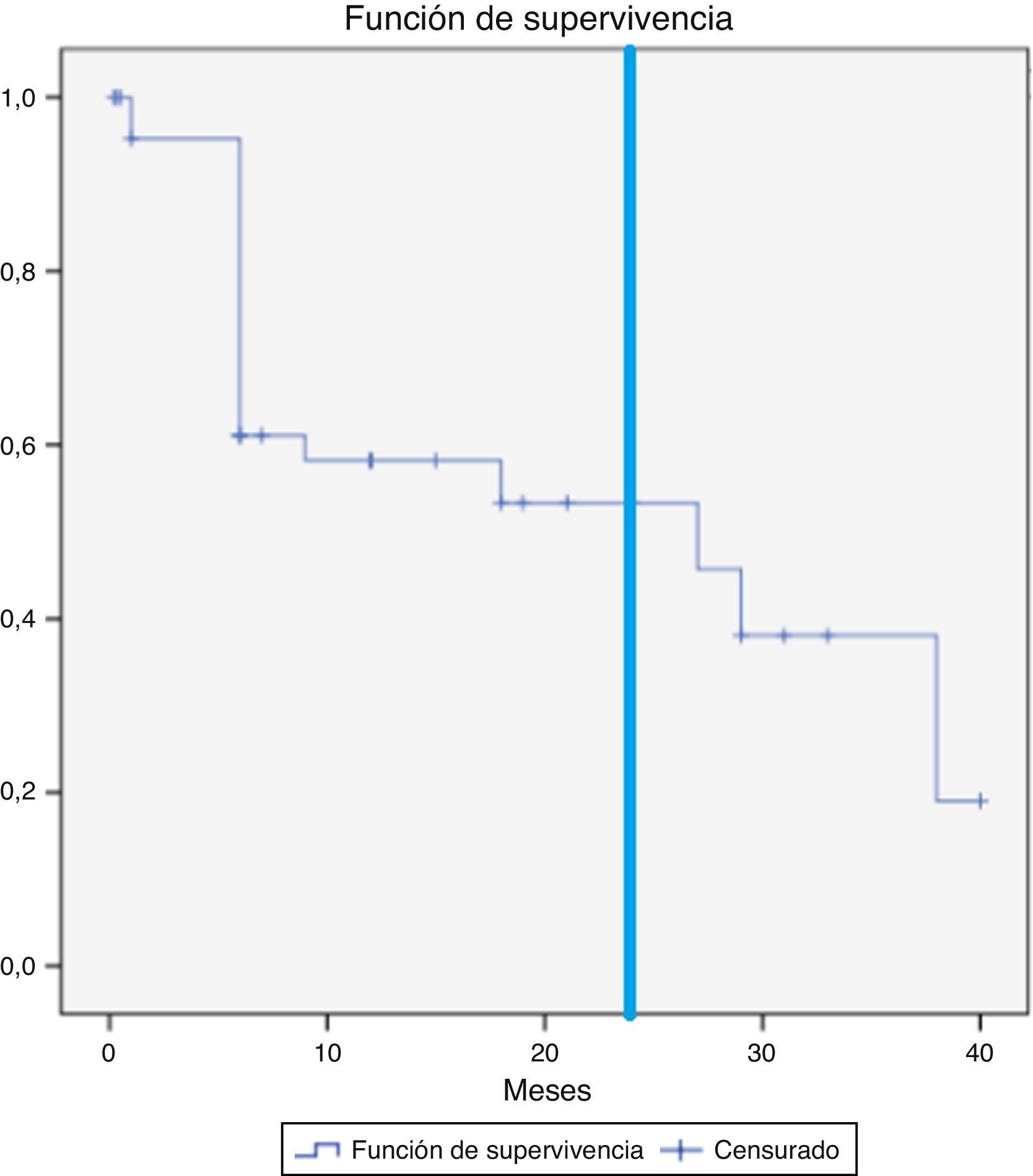
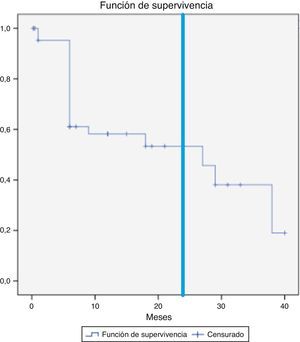
Se objetivó la desaparición de la endofuga en 21 pacientes (44,7%), en 16 casos dentro de los primeros 6 meses (34,0%). Esto no sucedió en ninguno de los pacientes cuya endofuga se originaba de ramas hipogástricas. Las curvas de supervivencia (fig. 1) muestran que la persistencia de la endofuga a 12 y 24 meses es del 58,1 y el 53,3%.
De los 26 pacientes en los que persistió la endofuga, se observó crecimiento del saco aneurismático en 5 casos al comparar el primer control postimplantación y el último registrado (10,6% del total de endofugas tipo ii y 19,2% de los pacientes en los que esta persistió).
En 2 casos el crecimiento fue sintomático y originado desde ramas hipogástricas hacia los sacos iliacos (4,3%). En el primer caso, el origen de la endofuga era la arteria hipogástrica izquierda y la arteria mesentérica inferior, que produjo crecimiento del saco iliaco izquierdo de 15mm en 6 meses y clínica asociada de dolor abdominal: se trató mediante embolización de la arteria mesentérica inferior y extensión iliaca derecha al asociar endofuga tipo ib distal tras el crecimiento del saco, persistiendo la fuga desde la rama hipogástrica izquierda, pero de menor cuantía. En el segundo caso, cuyo origen era también desde una rama hipogástrica derecha, se produjo rotura del saco iliaco, con fallecimiento intraquirófano. El paciente asociaba aneurisma hipogástrico derecho, que también creció de forma significativa.
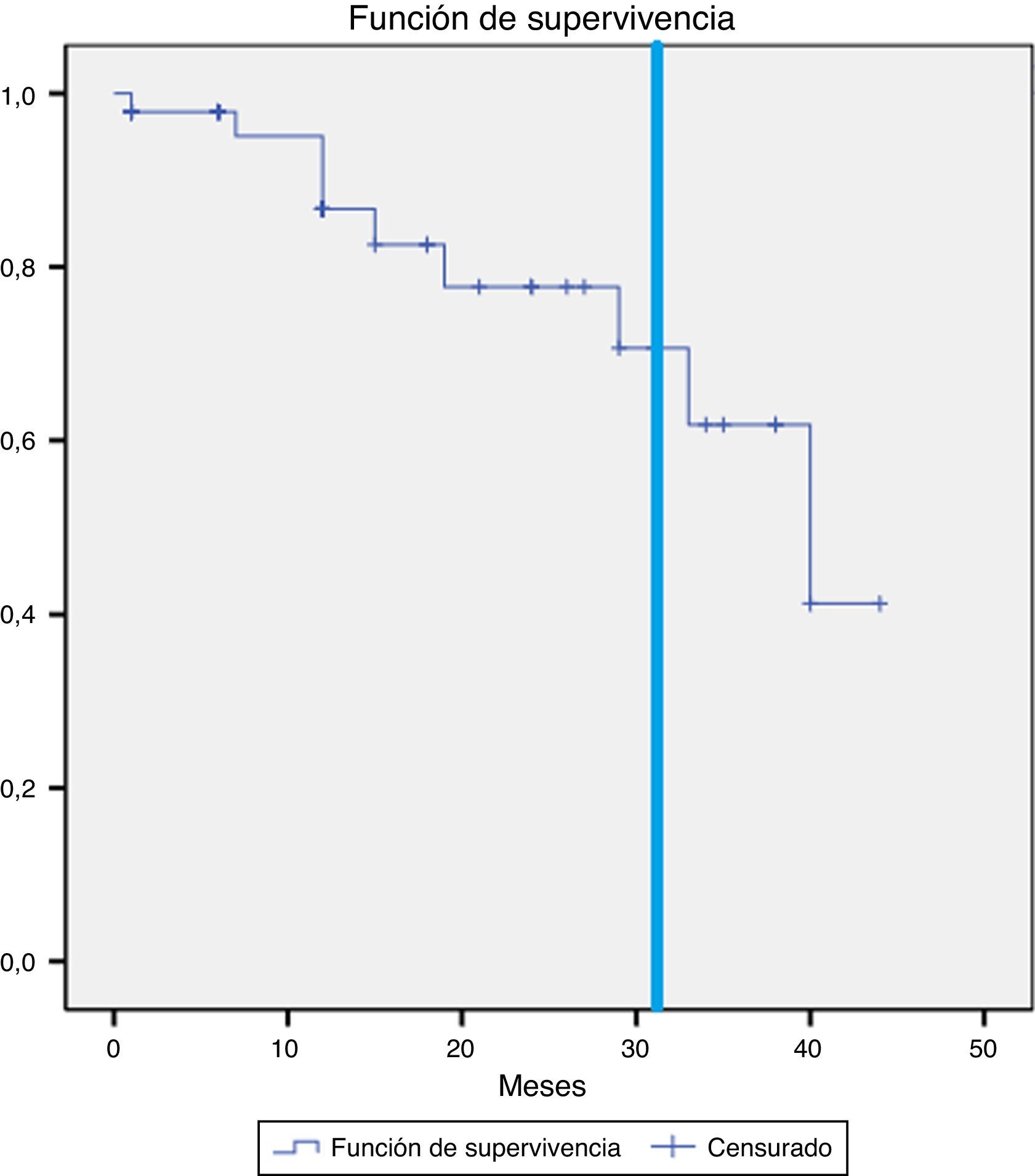
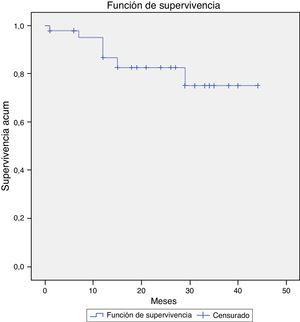
En los otros 3 pacientes el crecimiento ha sido más larvado y completamente asintomático, por lo que se ha optado por manejo conservador. En el primer caso, se ha producido crecimiento de 1cm del saco iliaco derecho en 19 meses por reinyección desde la arteria mesentérica inferior y 2 ramas lumbares. En el segundo caso, el saco aórtico ha aumentado 1cm en 31 meses por reinyección desde una rama lumbar. En el tercer caso, el crecimiento del saco aórtico ha sido de 7mm durante 33 meses por reinyección desde una rama lumbar. En la figura 2 se representa la supervivencia libre de crecimiento a 12, 24 y 31 meses: el 95,1, el 77,7 y el 70,6%, respectivamente.
Eventos adversos graves y reintervenciónSe recogieron 4 eventos adversos graves relacionados con el dispositivo y su implantación (8,5%): 2 hematomas inguinales a tensión en el postoperatorio inmediato, un caso de ateroembolismo (a los 2 meses) y un caso de trombosis del dispositivo (a los 5 meses).
Se reintervino a un total de 5 pacientes (10,6%): 2 por crecimiento sintomático del saco aneurismático (descritos en el anterior apartado); 2 por hematomas inguinales a tensión que precisaron revisión y hemostasia, y uno por isquemia arterial aguda de ambos miembros inferiores por trombosis del dispositivo, en el que se realizó bypass axilobifemoral.
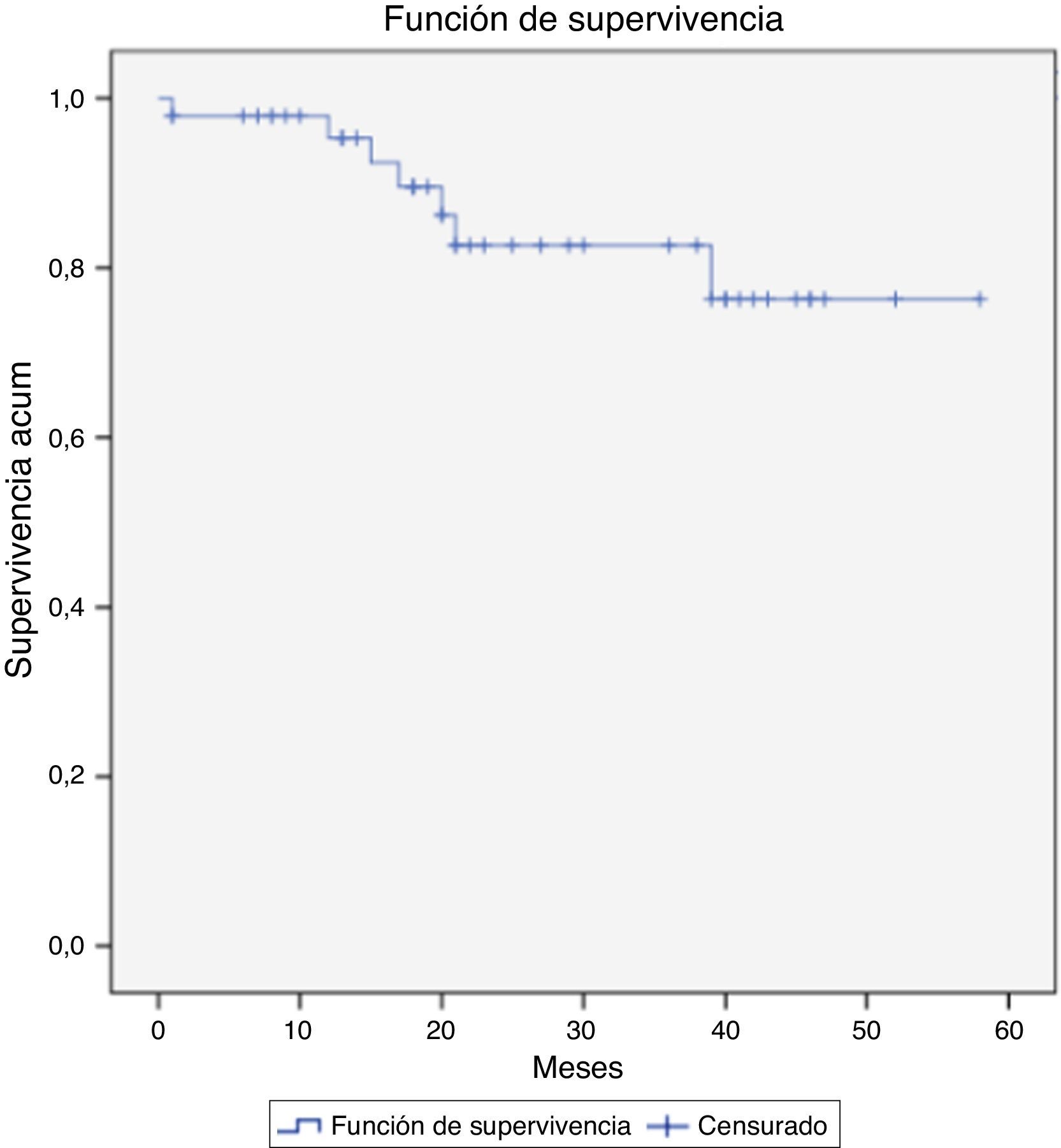
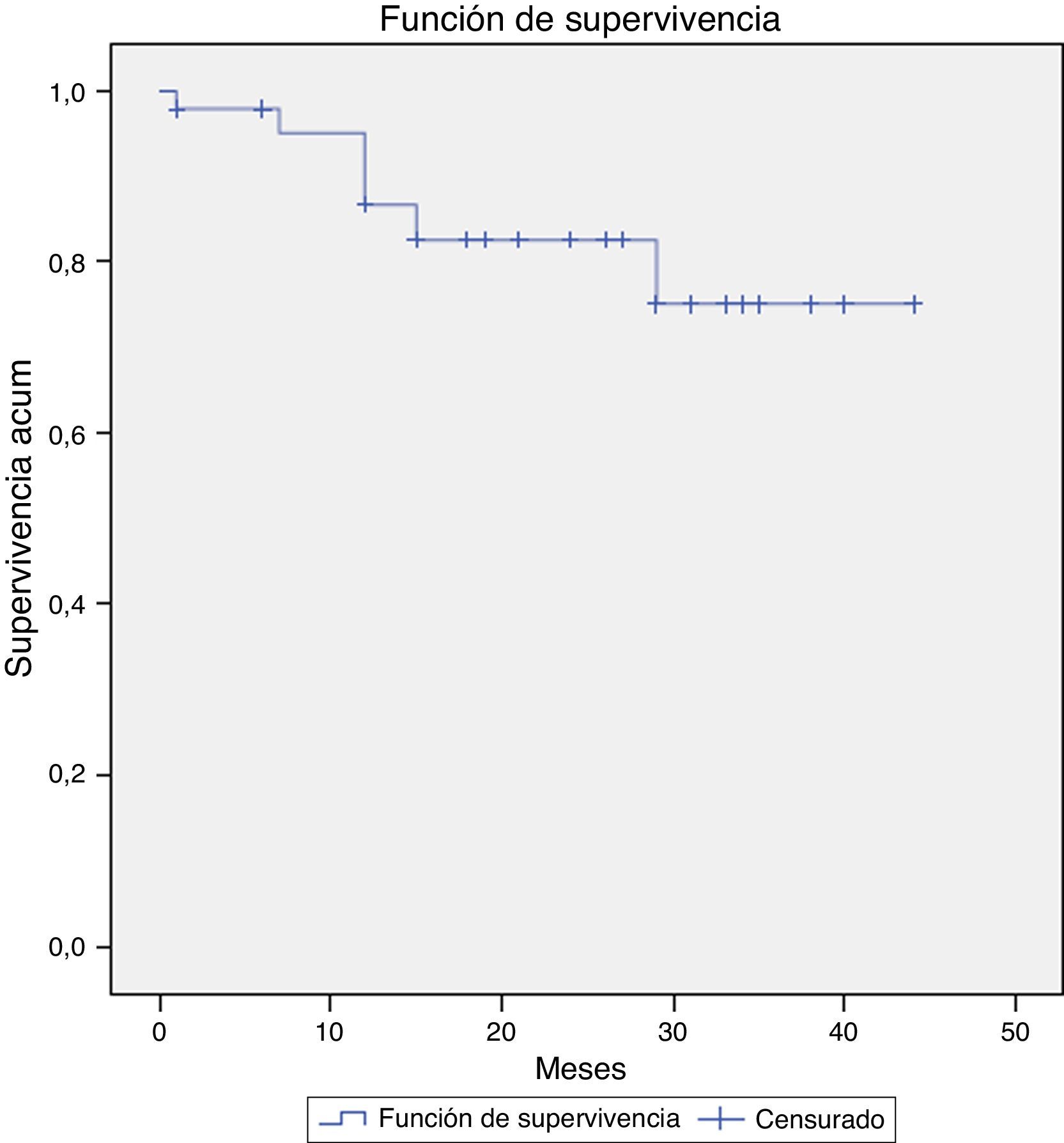
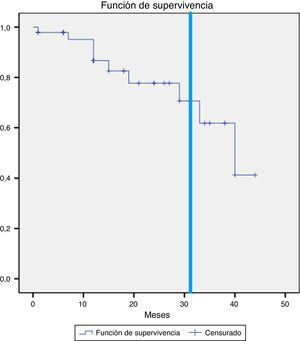
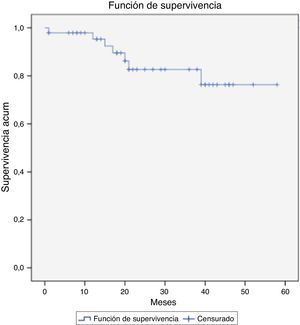
FallecimientoDurante el seguimiento se cuantificaron 7 fallecimientos, uno de ellos relacionado directamente con el crecimiento del saco aneurismático y su rotura (defunción intraquirófano) (2,1%). El resto de los casos ocurrieron en el contexto de otras patologías médicas y/o quirúrgicas. En la figura 3 se muestra la supervivencia global de nuestra serie a 12, 36 y 58 meses: el 95,3, el 82,6 y el 76,3%. Y en la figura 4, la supervivencia libre de rotura a 12, 24 y 44 meses: el 86,7, el 82,6 y el 75,1%.
DiscusiónLas endofugas suponen el caballo de batalla del cirujano vascular tras la reparación endovascular de los aneurismas aortoiliacos infrarrenales. En nuestro estudio, nos hemos centrado en las endofugas tipo ii.
En nuestra serie, encontramos un 20,8% de endofugas tipo ii, valor esperable teniendo en cuenta la literatura disponible. Respecto a su evolución, Jones et al. observan en su estudio desaparición de la endofuga en el 79,9% de los pacientes, el mayor porcentaje recogido en la literatura, frente a nuestro 44,7%6. Es un estudio que incluye a más pacientes con endofuga tipo ii (164) y un seguimiento medio más largo (32,6meses), 2 de nuestras principales limitaciones. Aún así, nuestros resultados están dentro de lo descrito en otros estudios2-6.
En concordancia con nuestros resultados, en la literatura se recoge que las endofugas que persisten durante el seguimiento (25-65% frente a nuestro 55,3%) favorecen el crecimiento del saco aneurismático (37,9% frente a nuestro 10,6%) y el consiguiente riesgo de rotura3,6,12.
La tasa de rotura de saco aneurismático recogida en otros estudios es similar a la nuestra: 2,1%1,5,8. Jones et al. en su estudio refieren una tasa de rotura del 2,4% y consideran esta endofuga como factor predictor de rotura cuando produce crecimiento del saco aneurismático6. En cuanto a nuestra tasa de reintervención, es también similar a la de otras series: 10-20% frente a nuestro 10,6%3,7-9.
En nuestro estudio, solo hemos observado un fallecimiento directamente relacionado con la patología aneurismática y fue precisamente por rotura de saco iliaco en el contexto de una endofuga tipo ii desde hipogástrica persistente (2,1%). Resultados también comparables con otros estudios8.
Debemos destacar que los 2 crecimientos sintomáticos de nuestro estudio y el fallecimiento directamente relacionado con la patología aneurismática se produjeron por sacos iliacos en expansión y reinyección desde ramas hipogástricas.
Cabría preguntarse si esa variación del diámetro máximo válido para los sacos aórticos es extrapolable para los sacos iliacos o si en estos sería significativa una variación menor. No hemos encontrado en la literatura revisada ningún estudio que lo describa.
Muchos autores coinciden en que la indicación de tratamiento de una endofuga tipo ii persistente es el crecimiento de al menos 5mm del diámetro máximo del saco aneurismático aortoiliaco. Con ello se pretende eliminar la endofuga para frenar el crecimiento del saco y, por tanto, disminuir el riesgo de rotura13. Esto se realiza mediante diferentes técnicas tanto endovasculares como mediante cirugía abierta: embolización transarterial, translumbar o transcava; inyección directa de trombina en el saco aneurismático, y ligadura endoscópica o abierta de la rama productora de la reinyección14.
En la literatura se recogen bajas tasas de éxito en los procedimientos endovasculares secundarios dirigidos a controlar la endofuga (43-75%)3,5. De ahí que algunos autores se hayan planteado estrategias preventivas: Chun et al. defienden la embolización, uni o bilateral, de la arteria hipogástrica proximal15; Brenes et al. plantean la ligadura endoscópica de la arteria mesentérica inferior previamente a la implantación de la endoprótesis16; Muthu et al. y Thomas Ward et al. proponen embolización de esta arteria pero durante el mismo tiempo operatorio de la implantación del dispositivo4,17; Zanchetta et al. proponen introducir fibrina en el interior del saco para favorecer su trombosis18, y Piazza et al. sugieren añadir fibrina y coils en el saco con resultados estadísticamente significativos durante el 1.er y el 6.° mes3. Sin embargo, no quedan muy claros los resultados de estas estrategias a largo plazo y sus implicaciones clínicas, y además no están exentas de complicaciones.
Como estrategia preventiva, en nuestro centro realizamos anteanclaje en iliaca externa del dispositivo la embolización proximal de las ramas hipogástricas cuando su origen presenta afectación aneurismática, con tasas de éxitos similares a las de otros estudios15 y sin complicaciones graves relacionadas con el procedimiento. No podemos comparar nuestra tasa de endofuga desde hipogástricas en los pacientes que embolizamos y los que no, porque nuestra indicación de embolización es precisamente la afectación aneurismática del origen de la rama y, por tanto, un mayor riesgo asociado de endofuga. Nuestros resultados muestran asimismo que no es una técnica infalible y, por tanto, no podemos recomendarla siempre como método preventivo.
Las principales limitaciones de nuestro estudio son que se trata de un estudio retrospectivo (por tanto, con posibles sesgos de información), con un limitado número de pacientes y con numerosas pérdidas durante el seguimiento. Pese a ello, nuestros resultados son concordantes con lo recogido en la literatura.
ConclusiónA la luz de nuestros resultados, las endofugas tipo ii, cuando persisten durante el seguimiento, pueden condicionar el crecimiento del saco aneurismástico, con el consiguiente riesgo de rotura y fallecimiento. Por ello, consideramos necesario el seguimiento estrecho de estos pacientes.
Habría que plantearse el tratamiento ante endofugas tipo ii persistentes que asocien crecimiento significativo del saco aneurismático. Esto adquiere especial importancia cuando nos enfrentamos a aneurismas iliacos en expansión y origen de la endofuga desde ramas hipogástricas, donde cabría considerar una aproximación más agresiva y precoz y plantearse de entrada estrategias preventivas. Consideramos que este último punto es clave en el manejo de las endofugas y que precisa aún de más estudios para poder definirlo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
El contenido de este trabajo fue presentado en el 60.° Congreso de la SEACV, el 6 de junio del 2014, celebrado en Madrid.