Existen datos que asocian los aneurismas de aorta abdominal (AAA) con un incremento de la prevalencia de la enfermedad herniaria. Una posible alteración estructural de la matriz extracelular puede ser común en el proceso degenerativo de la pared aórtica y de la fascia abdominal.
ObjetivoConocer la expresión de metaloproteinasas de matriz-2 (MMP-2) y el inhibidor tisular de metaloproteinasas-2 (TIMP-2) en pared aórtica, fascia abdominal y plasma de pacientes intervenidos de AAA frente a pacientes con enfermedad aórtica oclusiva (EAO).
Material y métodosEstudio piloto, observacional prospectivo. Se analizó la expresión proteica de MMP-2 y TIMP-2 en 10 pacientes con AAA y 10 con EAO. Recogimos datos epidemiológicos, antecedentes de hernias y diámetros del AAA. El análisis se realizó por técnica de ELISA.
ResultadosEn el subgrupo de AAA de mediano tamaño con antecedentes de hernia, encontramos sobreexpresión de MMP-2 en fascia y de TIMP-2 en aorta y fascia, respecto a EAO sin hernia (MMP-2 fascia: AAA=4,53 [3,11-6,90]; EAO=1,87 [1,45-2,90]; p=0,04; TIMP-2 en aorta: AAA=72,62 [9,26-161,12], EAO=9,79 [5,55-25,61]; p=0,04 y TIMP-2 en fascia: AAA=35,24 [13,15-61,08], EAO=4,98 [1,42-18,01]; p=0,02).
La MMP-2 y el TIMP-2 estaban aumentados en fascia de AAA con enfermedad herniaria frente a EAO sin hernia (MMP-2: 4,31 [3,35-6,35] versus 1,87 [1,45-2,90]; p=0,009 y TIMP-2: 18,73 [7,76-57,97] versus 4,98 [1,42-18,01]; p=0,08).
En pared aórtica hubo aumento de TIMP-2 en AAA (29,27 [14,05-140,30] frente a EAO, 9,79 [6,19-32,74]; p=0,06).
ConclusionesLa MMP-2 y el TIMP-2 están aumentados, en aorta y fascia de pacientes con AAA, sobre todo, en los de mediano tamaño, lo que indica cierto papel en la etiología. El incremento de MMP-2 y TIMP-2 en presencia de hernia potencia la idea de un mecanismo patogénico común.
There are data that associates abdominal aortic aneurysms (AAA) with an increased prevalence of hernia disease. A possible structural alteration of extracellular matrix may be common in the degenerative process of the aortic wall and the abdominal fascia.
ObjectiveDetermine the expression of matrix metalloproteinases-2 (MMP-2) and tissue inhibitor of metalloproteinases-2 (TIMP-2) in aortic wall tissue, abdominal fascia, and plasma of patients undergoing AAA versus patients with aortic occlusive disease (EAO).
Material and methodsA pilot, prospective observational study was conducted, in which the protein expression of MMP-2 and TIMP-2 was analyzed in 10 patients with AAA, and in 10 with EAO, using an ELISA technique. Epidemiological data, history of hernias, and AAA diameters were collected.
ResultsIn the subgroup of medium sized AAA with a history of hernia, over-expression of MMP-2 was found in fascia, and of TIMP-2 in aorta and fascia. As regards EAO without hernia (MMP-2 fascia: AAA=4.53 [3.11-6.90], EAO=1.87 [1.45-2.90], P=.04; TIMP-2 in aorta: AAA = 72.62 [9.26-161.12], EAO=9.79 [5.55-25.61], P=.04, and TIMP-2 in fascia: AAA=35.24 [13.15-61.08], EAO =4.98 [1.42-18.01], P=.02).The MMP-2 and TIMP-2 was increased in AAA fascia hernia disease compared with EAO without hernia (MMP-2: 4.31 [3.35-6.35] versus 1.87 [1.45-2.90], P=.009, and TIMP-2: 18.73 [7.76-57.97] versus 4.98 [1.42-18.01], P=.08).There was an increased TIMP-2 in the aortic wall, AAA (29.27 [14.05-140.30] vs. EAO 9.79 [6.19-32.74], P=.06).
ConclusionsThe MMP-2 and TIMP-2 are increased in aorta and fascia of patients with AAA, especially in the medium size, suggesting a role in the etiology. The increase in MMP-2 and TIMP-2 in the presence of hernia, enhances the idea of a common pathogenic mechanism.
Existe una asociación entre los aneurismas de aorta abdominal (AAA) y las hernias incisionales que aparecen después de la laparotomía correctora. Un metaanálisis, que incluyó a 1.132 pacientes, describió un incremento de la prevalencia de hernias incisionales de pared abdominal en las intervenciones de aneurisma aórtico frente a las de pacientes oclusivos1. Aunque hay importantes evidencias clínicas que indican una asociación patogénica común, esta no ha sido todavía aclarada.
La génesis de los AAA y de las hernias incisionales se fundamenta en una base multifactorial, donde factores genéticos, autoinmunes y de respuesta inflamatoria crónica conducen a una alteración en la regulación paracrina de la matriz extracelular (MEC), con sobreexpresión de proteasas elastolíticas y colagenolíticas que desencadenan, de forma crónica, la degradación de la MEC en la pared aórtica y fascial2. En las hernias incisionales influyen factores externos ligados a las características del paciente o a factores locales, como la técnica de cierre de laparotomía y otros que pueden por sí solos condicionar la aparición de la hernia.
Se han descrito diferentes patrones de expresión de metaloproteinasas (MMP) y sus inhibidores tisulares (TIMP) en pacientes con AAA y con hernias inguinales2,3. Los hallazgos no están exentos de controversia. Hasta donde conocemos, no han sido analizados en el mismo paciente los especímenes de diferentes tejidos (aorta, fascia, plasma…), con la intención de encontrar cambios moleculares comunes que permitan asociar de forma causal dichas enfermedades.
Se sugiere como hipótesis del estudio identificar dicho comportamiento análogo en la expresión de la enzima proteolítica (MMP-2 y TIMP-2) en tejido aórtico, en fascia y plasma, que justificara un mecanismo similar en la degradación del colágeno. Así, planteamos este estudio piloto para poder identificar grupos homogéneos que discriminaran de forma significativa las diferencias y analogías de comportamiento en los procesos de degradación de la MEC.
Material y métodosLas muestras de sangre y tejidos fueron obtenidas de 20 pacientes, 10 con AAA y 10 con enfermedad oclusiva del sector aortoilíaco, intervenidos en nuestro centro. El número de pacientes elegido para este estudio piloto se basó en trabajos previos de enfermedad aneurismática4,5 y herniaria6,7, en los que se habían obtenido resultados significativos. Se recogieron datos epidemiológicos, factores de riesgo, diámetro aneurismático y existencia de hernias. De estos enfermos, ninguno presentaba enfermedad del tejido conectivo, enfermedad oncológica activa, tratamiento esteroideo ni aneurismas inflamatorios o infecciosos.
Los pacientes fueron informados y se entregó un consentimiento previo a la recogida de las muestras. El estudio fue aprobado por el Comité de Ética e Investigación del Hospital Universitario de Getafe.
Recogida de muestrasLas muestras de sangre se obtuvieron por venopunción antes de la cirugía. En los 30 min tras la extracción se realizó la centrifugación a 3.500rpm durante 10 min, a 4°C. El plasma resultante fue congelado a −80°C.
Las muestras de pared aórtica y fascia abdominal (músculo recto a nivel de la línea alba) fueron recogidas durante la intervención quirúrgica. Los especímenes fueron congelados a −80°C y cuando no fue posible, se mantuvieron en solución de RNA-later hasta su congelación y almacenaje.
Determinación de las concentraciones de Metaloproteinasa-2 y Inhibidor tisular de metaloproteinasa-2Para cuantificar los niveles de MMP-2 y su inhibidor en la fascia y aorta, se lisaron los tejidos con el sistema de homogenización MagNA Lyser (Roche Diagnostic, Mannheim, Alemania). El buffer empleado para homogeneizar fue el tissue-protein extration T-PER (Thermo Fisher Scientific Inc. Waltham, MA, EE. UU.), junto con un cocktail de inhibidores de proteasas® (Roche Diagnostic, Mannheim, Alemania). El extracto obtenido se centrifugó a 10.000rpm durante 10 min a 4°C. Se recogió el sobrenadante y se cuantificaron los niveles de proteínas mediante el método BCA protein assay kit® (Thermo Scientific Inc. Waltham, MA, EE. UU.), para normalizar los valores de la MMP-2 y TIMP-2. Posteriormente, las concentraciones de las enzimas se midieron mediante la técnica Enzyme-Linked InmunoSorbent Assay (R&D Systems Europe, Abingdon, Reino Unido). La técnica empleada para MMP-2 reconoce tanto la proenzima como la forma activa y no posee reactividad cruzada con otras MMP o TIMP.
Los análisis fueron realizados por duplicado, para evitar sesgos de medición.
Para la cuantificación de los niveles plasmáticos, se utilizaron 50μl de plasma de las muestras y se realizó la técnica ELISA. Las medias se realizaron a 450nm. Todos los valores se dieron en ng/ml.
Análisis estadísticoPara analizar las características y factores de riesgo de los pacientes así como sus diferencias entre grupos, se utilizó el estadístico chi-cuadrado. Los resultados de la expresión de MMP-2 y TIMP-2 en tejidos y suero se expresaron como la mediana más el rango intercuartil. Para determinar las diferencias entre grupos se empleó el test U de Mann-Whitney, considerándose significativo un valor de p<0,05 (SPSS versión 17.0).
Diseño del estudioSe compararon los resultados obtenidos de MMP-2 y TIMP-2 en plasma, aorta y fascia entre los grupos de aneurismas y oclusivos. Definimos un subgrupo de aneurismas de mediano tamaño, inferiores a 6 cm. Las diferencias se analizaron según la presencia o no de hernias en los grupos.
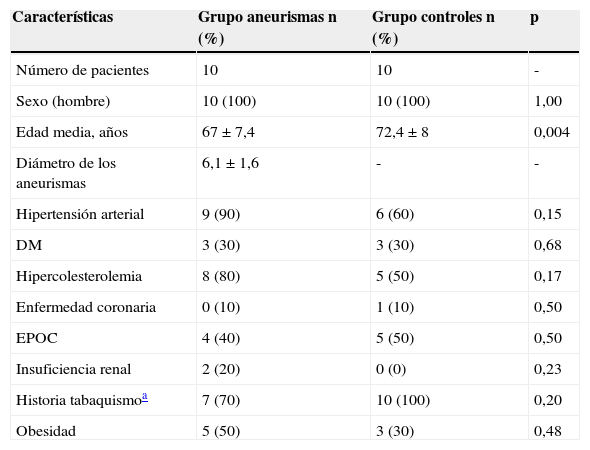
ResultadosLas características clínicas de los grupos se describen en la tabla 1.
Características clínicas de los grupos del estudio
| Características | Grupo aneurismas n (%) | Grupo controles n (%) | p |
|---|---|---|---|
| Número de pacientes | 10 | 10 | - |
| Sexo (hombre) | 10 (100) | 10 (100) | 1,00 |
| Edad media, años | 67±7,4 | 72,4±8 | 0,004 |
| Diámetro de los aneurismas | 6,1±1,6 | - | - |
| Hipertensión arterial | 9 (90) | 6 (60) | 0,15 |
| DM | 3 (30) | 3 (30) | 0,68 |
| Hipercolesterolemia | 8 (80) | 5 (50) | 0,17 |
| Enfermedad coronaria | 0 (10) | 1 (10) | 0,50 |
| EPOC | 4 (40) | 5 (50) | 0,50 |
| Insuficiencia renal | 2 (20) | 0 (0) | 0,23 |
| Historia tabaquismoa | 7 (70) | 10 (100) | 0,20 |
| Obesidad | 5 (50) | 3 (30) | 0,48 |
DM: diabetes mellitus; EPOC: enfermedad pulmonar obstructiva crónica.
Se encontró aumento de niveles de TIMP-2 en aorta en el grupo de aneurismas, 29,2ng/ml (14–140,3), frente a oclusivos 9ng/ml (6–32,7); p=0,063.
En el resto de los marcadores no hubo diferencias significativas.
Niveles MMP-2 y TIMP-2 en tejidos en aneurismas sin hernias y oclusivos sin herniasEn pacientes con AAA sin hernia, hubo sobreexpresión de TIMP-2 en aorta y fascia frente a los pacientes oclusivos sin hernia. Los valores de TIMP-2 fueron de 28,6 (17,9-108,8) frente a 9 (5-25,6), con p=0,082, en pared aórtica y 24,6 (14-62,4) frente a 5 (1-18), p=0,03, en fascia respectivamente. No hubo diferencias en MMP-2 en el análisis de estos subgrupos.
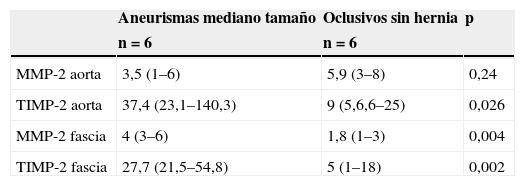
Niveles de MMP-2 y TIMP-2 en tejidos en aneurismas con hernias y oclusivos sin herniasLa expresión en aorta y fascia, en los grupos de aneurismas con hernia y oclusivos sin hernia y la comparación entre ellos, se detalla en la tabla 2. Encontramos aumento de MMP-2 y TIMP-2 en fascia de pacientes con aneurismas y hernias, respecto a los oclusivos sin hernia. En este subgrupo, los niveles de TIMP-2 en aorta aneurismática fueron 3 veces mayores que en controles, sin alcanzar significación estadística.
Comparación de niveles de MMP-2 y TIMP-2 en tejidos de aneurismas con hernia y oclusivos sin hernia, expresados como mediana y rango intercuartil en ng/ml
| Aneurismas con hernia | Oclusivos sin hernia | p | |
|---|---|---|---|
| n=5 | n=6 | ||
| MMP-2 aorta | 4,2 (1–6) | 5,9 (3–8) | 0,42 |
| TIMP-2 aorta | 29,8 (11,2–150,7) | 9 (5,6,6–25) | 0,17 |
| MMP-2 fascia | 4,3 (3–6) | 1,8 (1–3) | 0,009 |
| TIMP-2 fascia | 18,7 (7–57,9) | 5 (1–18) | 0,08 |
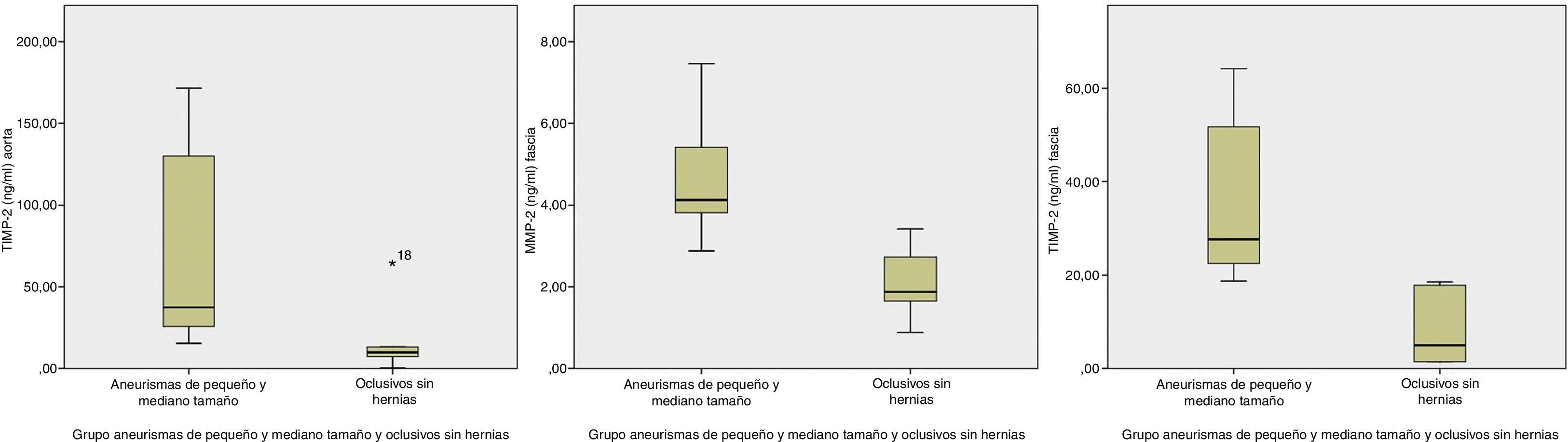
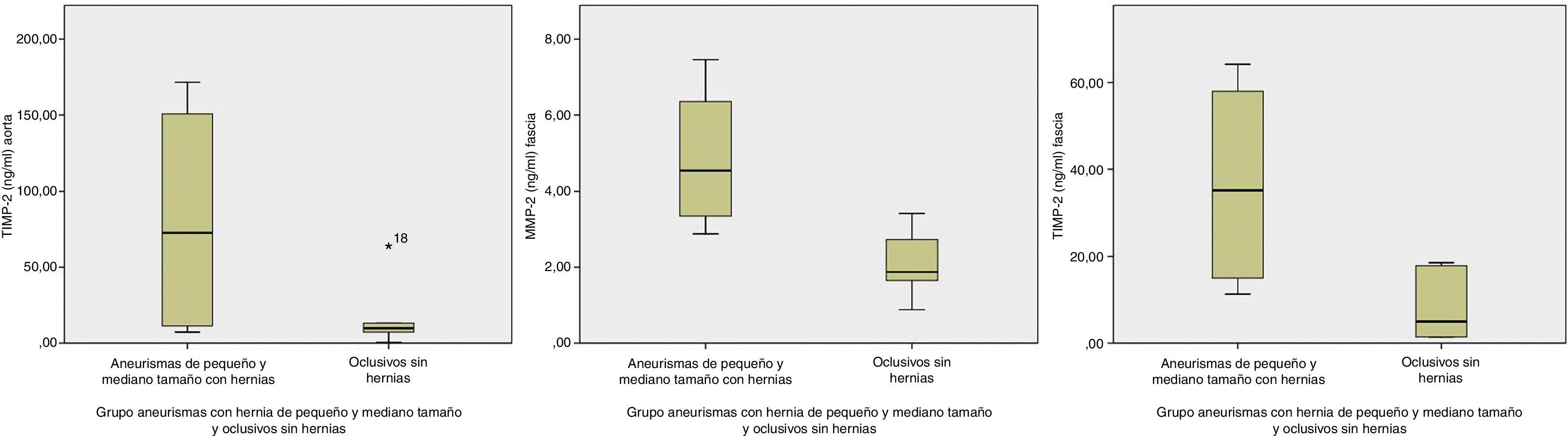
Excluyendo los aneurismas mayores de 6cm, hubo sobreexpresión de MMP-2 en fascia y de TIMP-2 en ambas muestras aórticas y fasciales (tabla 3 y fig. 1). Si, además, estos AAA eran portadores de hernia las diferencias alcanzadas en la expresión de los marcadores fue mayor (tabla 4 y la fig. 2).
Comparación de niveles de MMP-2 y TIMP-2 en tejidos de aneurismas de pequeño y mediano tamaño y oclusivos sin hernia, expresados como mediana y rango intercuartil en ng/ml
| Aneurismas mediano tamaño | Oclusivos sin hernia | p | |
|---|---|---|---|
| n=6 | n=6 | ||
| MMP-2 aorta | 3,5 (1–6) | 5,9 (3–8) | 0,24 |
| TIMP-2 aorta | 37,4 (23,1–140,3) | 9 (5,6,6–25) | 0,026 |
| MMP-2 fascia | 4 (3–6) | 1,8 (1–3) | 0,004 |
| TIMP-2 fascia | 27,7 (21,5–54,8) | 5 (1–18) | 0,002 |
Comparación de niveles de MMP-2 y TIMP-2 en tejidos de aneurismas de pequeño y mediano tamaño con hernia y oclusivos sin hernia expresados como mediana y rango intercuartil en ng/ml
| Aneurismas mediano tamaño con hernia | Oclusivos sin hernia | p | |
|---|---|---|---|
| n=4 | n=6 | ||
| MMP-2 aorta | 5 (2–6) | 5,9 (3–8) | 0,54 |
| TIMP-2 aorta | 72,6 (9–161,1) | 9 (5,6,6–25) | 0,048 |
| MMP-2 fascia | 4,5 (3–7) | 1,8 (1–3) | 0,048 |
| TIMP-2 fascia | 35,2 (13,1–61,1) | 5 (1–8) | 0,024 |
No se objetivaron diferencias estadísticamente significativas en ningún análisis del plasma de los grupos de aneurismas y oclusivos.
DiscusiónLos aneurismas son el resultado de un proceso degenerativo crónico. Investigaciones recientes se han dirigido al estudio de los mecanismos de degradación proteolítica del tejido conectivo de la pared aórtica. En la compleja estructura bioquímica de la MEC se regula la síntesis y degradación de elastina y colágeno, elementos estructurales importantes de las capas de la aorta. Hay amplia evidencia de que la MEC se degrada por una variedad de enzimas proteolíticas, principalmente las MMP. Estas están reguladas por una serie de mecanismos, entre los que se encuentran los TIMP de las MMP. Un disbalance entre ellos altera la remodelación de la pared vascular, inhibiendo o aumentando la degradación de la MEC8.
Se ha identificado la MMP-2 como la gelatinasa dominante en aneurismas pequeños, lo que indica que actuaría precozmente en la génesis de los aneurismas8,9. Así mismo, se ha relacionado la MMP-9 con aneurismas de mayor tamaño8,10. El papel de la MMP-9 en los AAA permanece en controversia porque otros estudios han encontrado niveles de MMP-9 similares en AAA y en pacientes ateroscleróticos11, siendo la MMP-2 más específica de los procesos aneurismáticos12.
La hipótesis que resaltaba la presencia de MMP-2 en arterias aneurismáticas se fortaleció por estudios histológicos, que demostraron la presencia de todos los componentes proteolíticos de la MMP-2 (MMP-2, TIMP-2 y MT-MMP), dentro de la capa media de la aorta aneurismática13 y la mayor expresión de esta en células musculares lisas de tejido aneurismático frente a aortas control arterioscleróticas14.
En cuanto a la etiología causal de la hernia, se ha considerado históricamente como un déficit estructural de la pared abdominal, producido por diferentes factores intrínsecos o extrínsecos. Hay suficiente evidencia que indica que están asociadas con alteraciones del metabolismo del tejido conectivo y del recambio de la MEC15. Varios investigadores comprobaron una estructura alterada del colágeno y un desorden en el cociente del colágeno tipo I/III en la fascia de pacientes con hernias inguinales e incisionales6,16,17. Esta alteración fue valorada por la medición de niveles de MMP en capas de la pared fascial abdominal18. Otros autores han demostrado una sobreexpresión de MMP-2 en fascia transversalis y fibroblastos de la piel en pacientes con hernias inguinales directas, comparadas con controles19.
Posteriormente, se ha descrito un desequilibrio de la actividad de MMP/TIMP a nivel plasmático y en tejido, en pacientes con hernia inguinal respecto a controles20. Los estudios de Bellón et al. describen la MMP-2 como la enzima proteolítica más importante en la fisiopatología de la hernia inguinal directa, con un significativo aumento en la fascia tranversalis de estos pacientes respecto a pacientes con hernia inguinal indirecta16,21.
El papel de la MMP-2 en la formación de la hernia incisional es controvertido. Rosch et al. demostraron similar expresión enzimática en cultivos de fibroblastos de cicatriz en pacientes con hernia incisional recurrente y controles22. Sin embargo, Salameh et al. encontraron incremento significativo de MMP-2 en tejido de fascia de pacientes con hernias incisionales frente a controles23. Otros estudios también hallaron niveles séricos aumentados de MMP-2 y TIMP-2 en pacientes con hernia inguinal recurrente24. Estas evidencias indican que tanto los AAA como la enfermedad herniaria están caracterizadas por una actividad proteolítica aumentada con alteración del equilibrio de la MEC.
No existen estudios que analicen la expresión de las MMP en los tejidos aórticos y fasciales del mismo paciente, sin haberse podido demostrar un defecto sistémico común del tejido conectivo en ambas enfermedades25.
Nuestra hipótesis es la existencia de un proceso lítico común en ambas enfermedades, por lo que nos propusimos analizar los marcadores de degradación de la MEC, en plasma, aorta y fascia, en pacientes con AAA frente a controles con enfermedad oclusiva.
En nuestros resultados no hemos encontrado diferencias en los niveles plasmáticos de MMP y TIMP entre los grupos de aneurismas y controles. En la literatura se han descrito diferentes patrones plasmáticos, con resultados controvertidos, sin haber podido identificar un marcador biológico definido3.
Si comparamos los resultados de los aneurismas portadores de hernia con los controles sin hernia, la expresión aumenta en pared aórtica y fascial. Al analizar los resultados en tejido, de los diferentes grupos de aneurismas y controles, observamos que en los aneurismas de pequeño/mediano tamaño, al eliminar los mayores de 6 cm, comparados con los oclusivos sin hernias, ofrecen la máxima expresión de TIMP-2 en aorta y MMP-2 y TIMP-2 en fascia. Estos resultados pueden ser explicados porque la MMP-2ha sido identificada como la dominante en aneurismas pequeños, lo que indica que actuaría en los periodos tempranos de la formación de aneurismas. Si en este grupo de aneurismas seleccionamos los que además presentaban enfermedad herniaria, la expresión se multiplica, porque obteníamos las mismas diferencias significativas en aorta y fascia, pero con unos niveles de concentración todavía mayores que los anteriores (figs. 1 y 2). Esta sobreexpresión más marcada es congruente con un artículo reciente, donde se hallaron niveles de MMP-2 sanguíneos más altos en pacientes con AAA y hernia abdominal primaria, en comparación con pacientes con AAA solo. Esto indica que esta proteasa juega un papel importante en la patogénesis de las hernias abdominales primarias y en la presencia de una alteración sistémica del tejido conectivo26. Excluyendo del grupo control los pacientes con antecedentes de hernia para eliminar el posible factor de confusión inducido por esta enfermedad, la diferencia en la concentración de enzimas fue más marcada.
Se mantiene una elevación de los niveles de TIMP-2 en aorta en todos los análisis de los grupos de aneurismas frente a oclusivos. El hecho de que exista sobreexpresión de los inhibidores podría parecer paradójico, pero se ha observado que, a altas concentraciones, el TIMP-2 inhibe selectivamente la actividad de MMP-2 in vitro. Sin embargo, a bajas concentraciones, el TIMP-2 aumenta la pro-MMP-2 y activa la MMP-2 mediante la formación de un complejo trimolecular compuesto por MT1-MMP (MMP-14), TIMP-2 y pro-MMP-24,27. Por tanto, el TIMP-2 actuaría como un cofactor en la activación de MMP-2, favoreciendo la formación de aneurismas. Estudios en modelos de ratones han demostrado que la TIMP-2 actúa para promover, más que inhibir, la degradación de la MEC. Este efecto parece ser mediado a través del paso de MMP-2 latente a su forma activa28. La expresión de MMP-2 en pared de AAA puede a su vez estar condicionada por el tiempo de evolución del AAA, el grado de respuesta de la MEC y otros factores que no conocemos, que puedan mantener el TIMP-2 elevado con agotamiento de respuesta de la MMP-2. En diversos estudios se han descrito niveles de TIMP-2 incrementados, inalterados o disminuidos en tejidos de AAA4,29,30. El mecanismo causal de estas variaciones aún no se conoce.
Al ser un estudio piloto tiene la limitación del pequeño número de pacientes incluido que no permite obtener evidencias firmes. Sin embargo, los datos que aporta nos permiten diseñar un estudio más amplio que logre conclusiones válidas. El análisis podía haber dado resultados más objetivos, con un grupo control de sujetos sanos en lugar de pacientes con enfermedad oclusiva. La elección del grupo control ha venido determinada por la dificultad en nuestro medio de obtener aorta y fascia del mismo sujeto sano, en condiciones de extracción que no alteraran los resultados. Parte de la ausencia de diferencias en la expresión de las MMP-2 y TIMP-2 puede deberse a esta causa, por lo que se hace preciso incluir en la ampliación del estudio un grupo control de sujetos sanos.
ConclusiónHemos analizado marcadores de remodelación anormal del tejido conectivo en aorta, fascia y en plasma de los pacientes con AAA, frente a controles con enfermedad aórtica oclusiva. Existe una sobreexpresión de MMP-2 y TIMP-2 en los tejidos de los pacientes con aneurismas de pequeño y mediano tamaño, al compararlos con oclusivos sin enfermedad herniaria concomitante. El incremento de los valores en fascia de MMP-2 y TIMP-2 en presencia de hernia potencia la idea de un mecanismo patogénico común para ambas enfermedades aneurismática y herniaria.
Las conclusiones de este estudio permiten realizar un diseño de ampliación de la muestra que confirme los resultados en los pacientes portadores de enfermedad aneurismática y herniaria en diferentes periodos de evolución frente a sujetos sanos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Parte de la información del manuscrito fue presentada en el 60 Congreso Nacional de Angiología y Cirugía Vascular (4 de junio 2014), Madrid.