Los mecanismos fisiopatológicos que se encuentran implicados en el crecimiento de los aneurismas de aorta abdominal (AAA) son multifactoriales, como cambios inflamatorios, hemostáticos, disfunciones endoteliales y los clásicos factores de riesgo ateroscleróticos. La persistencia de un trombo mural biológicamente activo y del saco aneurismático, al igual que el posible desarrollo de endofugas tipo 2, puede ser el origen de la activación de mediadores inflamatorios, cuyas consecuencias se desconocen. Nuestro objetivo es definir un modelo predictivo de complicaciones después de la reparación endoluminal del aneurisma de aorta abdominal a corto y medio plazo a partir de variables clínicas, serológicas y anatómicas.
Material y métodosSe incluyeron 50 pacientes intervenidos de AAA ateroscleróticos asintomáticos entre enero 2016 y noviembre 2016, en el Servicio de Angiología y Cirugía Vascular del Hospital Clínico Universitario de Valladolid. Se recogieron datos clínicos (edad, sexo, factores de riesgo cardiovascular, comorbilidad y medicación), diámetro basal de los AAA, crecimiento aórtico a los 6 meses y concentraciones basales circulantes de proteína C reactiva, interleucina 2 (IL2), IL6 y homocisteína, en el preoperatorio, a los 7 días del postoperatorio y a los 6 meses. A los pacientes se les realizó una angioTAC en el postoperatorio inmediato y a los 6 meses.
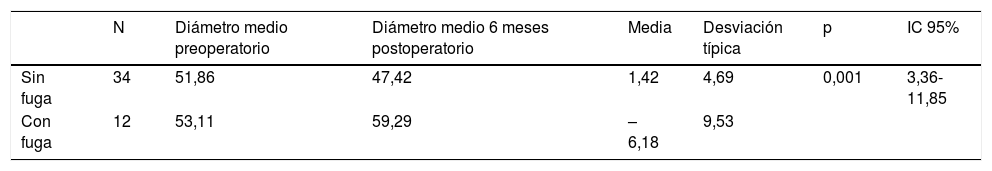
ResultadosSe observó un crecimiento medio del diámetro de los AAA con fuga de 6,18mm, mientras que los AAA correctamente presurizados disminuyeron su diámetro medio en 4,69mm, siendo esta diferencia estadísticamente significativa (p=0,001). En relación con los cambios en el trombo del saco aneurismático, en los pacientes con AAA con fuga el trombo se incrementó en 7,74mm de media, mientras que en los pacientes con AAA correctamente sellados y sin fugas se incrementó solo en 3,08mm, siendo esta diferencia estadísticamente significativa (p=0,027). Se estableció una correlación estadísticamente significativa entre la modificación del tamaño del aneurisma postEVAR y los niveles plasmáticos de PCR y homocisteína a los 7 días, y de la modificación del tamaño del trombo intraaórtico y los niveles plasmáticos de IL2 a los 7 días y a los 6 meses.
ConclusionesLos patrones de biomarcadores estudiados a corto y a medio plazo después de EVAR deben ser considerados como indicadores un proceso activo de inflamación que ejerce su influencia en la remodelación aórtica.
The pathophysiological mechanisms that are involved in the growth of abdominal aortic aneurysms (AAA) are multifactorial, and include inflammatory changes, as well as haemostatic and endothelial dysfunctions and, the classic atherosclerotic risk factors. The persistence of a biologically active mural thrombus and the aneurysmal sac, as well as the possible development of type 2 endoleaks, can be the origin of the activation of inflammatory mediators, the consequences of which are unknown. The aim of this study is to define a predictive model of complications after endoluminal repair of abdominal aortic aneurysm in the short and medium-term using clinical, serological, and anatomical variables.
Material and methodsA total of 50 hospital patients with asymptomatic atherosclerotic AAA were included in the study between January 2016 and November 2016, in the Angiology and Vascular Surgery Department of the Hospital Clínico Universitario de Valladolid. Clinical data were collected (age, gender, cardiovascular risk factors, comorbidity, medication), baseline AAA diameter, aortic growth at 6 months, as well as baseline C-reactive protein levels, interleukin-2 (IL2), IL6 and homocysteine, preoperatively, 7 days postoperatively, and 6 months later. The patients had an angioCT scan in the immediate postoperative period, and at 6 months.
ResultsA mean growth in diameter of 6.18mm was observed in the AAA with a leak, while the correctly pressurised AAA showed a decrease of 4.69mm in their mean diameter, with this difference being statistically significant (P=.001). As regards the changes in the thrombus of the aneurysmal sac, in patients with AAA with a leak the thrombus increased by a mean of 7.74mm, while patients with AAA correctly sealed and without leakage only increased by 3.08mm, with this difference being statistically significant (P=.027). A statistically significant relationship was observed between the change in the size of the post-EVAR aneurysm and the plasma levels of CRP and homocysteine at 7 days, and of the change in the size of the intra-aortic thrombus and the plasma levels of IL2 at 7 days and at 6 months.
ConclusionsThe biomarker patterns studied in the short and medium term after EVAR should be considered as indicators of an active inflammation process that exerts its influence on aortic remodelling.
Los aneurismas aórticos abdominales son responsables del 1-3% de todas las muertes de los varones entre 65-85 años en países desarrollados1. La etiología del aneurisma aórtico abdominal (AAA) incluye mecanismos ateroscleróticos, inflamatorios, inmunológicos y trombogénicos2. Estos aneurismas son generalmente asintomáticos hasta que ocurre la rotura de los mismos3. La reparación endoluminal de los AAA (EVAR) está asociada con una reducción significativa de la morbimortalidad a corto plazo. Sin embargo, siguen existiendo serias dudas con respecto a la EVAR en términos de protección contra la rotura de AAA y la necesidad de reintervención, y si todos los pacientes tratados requieren vigilancia durante toda la vida. No se conoce con certeza si la retención del trombo mural biológicamente activo y su perfusión continua a través de las denominadas fugas de tipo 2 contribuye al fallo del dispositivo y del cuadro clínico. Sorprendentemente, no hay datos disponibles sobre los efectos a largo plazo de EVAR en los mediadores inflamatorios sistémicos, que podrían ser marcadores útiles de la actividad de la enfermedad aneurismática después de EVAR.
Los objetivos principales de este estudio fueron evaluar los niveles plasmáticos de IL2, IL6, proteína C reactiva y homocisteína en pacientes con AAA en criterios quirúrgicos y estudiar su comportamiento después de la reparación endovascular. Los objetivos secundarios fueron estudiar los cambios en el perfil de estos marcadores en presencia de una endofuga y su relación con los cambios en el saco aneurismático y el trombo aórtico después de la reparación endoluminal, y establecer los principales factores pronósticos en el desarrollo de una endofuga postoperatoria.
Pacientes y métodosPacientesSe diseñó un estudio prospectivo en el que se incluyeron todos los pacientes intervenidos de AAA asintomático y no complicado entre enero de 2016 y noviembre 2016, en el Servicio de Angiología y Cirugía Vascular del Hospital Clínico Universitario de Valladolid.
Se seleccionaron los pacientes que fueron tratados mediante una endoprótesis bifurcada de anclaje suprarrenal.
Se excluyeron los pacientes con AAA sintomático o inflamatorio, múltiples aneurismas sincrónicos (de aorta torácica, femoral, poplíteo), AAA de otra localización (yuxtarrenal, suprarrenal o toracoabdominal), procesos inflamatorios o infecciosos activos, intervenciones quirúrgicas o traumatismo mayor en los 60 días previos, en tratamiento con medicación antiinflamatoria o inmunosupresora, los pacientes que requirieron otras morfologías de endoprótesis diferentes a la señalada o rechazo del paciente a ser incluido en el estudio.
Se distinguieron 2 grupos de pacientes. Grupo 1: pacientes sometidos a EVAR sin complicaciones; y grupo 2: pacientes sometidos a EVAR que desarrollaron endofugas o endotensión en el postoperatorio.
El estudio fue aprobado por el Comité de Ética e Investigación del Hospital Clínico Universitario de Valladolid.
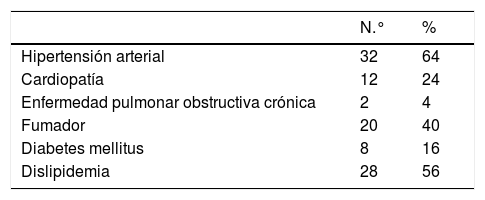
Variables clínicasSe obtuvieron como variables basales de los pacientes la edad, el sexo, los factores de riesgo cardiovascular (tabaquismo activo, hipertensión arterial, diabetes mellitus e hipercolesterolemia); comorbilidad (cardiopatía, enfermedad pulmonar obstructiva crónica, insuficiencia renal crónica, enfermedad cerebrovascular e isquemia crónica de extremidades inferiores); medicación, especialmente la toma de estatinas; diámetro anteroposterior medio del AAA y tipo de endoprótesis empleada.
Variables anatómicasLos objetivos del tratamiento endovascular son la protección frente a la rotura aneurismática y la reducción del saco aneurismático en el postoperatorio. Los pacientes fueron evaluados a este último respecto durante el seguimiento, por lo que se les realizó una angiotomografía computarizada (CTA) en el postoperatorio inmediato y a los 6 meses. El diámetro máximo del aneurisma se definió como el diámetro transversal más pequeño en el corte con mayor amplitud del aneurisma. Una expansión o reducción del saco aneurismático en el control de la CTA se definió como una modificación del diámetro máximo del aneurisma de 5mm. Se estudiaron la existencia de endofugas y endotensión.
Variables serológicasUna vez que los pacientes firmaron el consentimiento informado del estudio se obtuvo una muestra sanguínea de 50ml después de 12horas de ayuno, en el preoperatorio inmediato, a los 7 días, a los 6 meses. El suero fue aislado mediante centrifugación a 1.000g durante 10minutos. El plasma se dividió en alícuotas para su almacenaje hasta su utilización a –80°C en un ultracongelador vertical. El análisis de los especímenes obtenidos para IL2 e IL6 se realizó mediante la técnica de inmunoanálisis enzimático de captura del laboratorio Biosource. La determinación cuantitativa de la proteína C reactiva se realizó mediante un método inmunoturbidimétrico. La concentración plasmática total de homocisteína se midió mediante técnica de inmunoanálisis enzimático.
Análisis estadísticoSe realizó un análisis estadístico descriptivo, utilizando el número y el porcentaje de pacientes para las variables cualitativas y la media con la desviación estándar o la mediana con el rango intercuartilíco para las variables cuantitativas.
Se determinó el tipo de distribución de la muestra de nuestro estudio para saber si es normal o no, mediante la prueba Kolmogorov-Smirnov y, posteriormente, se estudió la relación estadística entre los niveles séricos de los diferentes mediadores inflamatorios y el posible crecimiento o complicación del tratamiento endovascular.
Se realizó un estudio multivariante, donde se incluyeron todas las variables que presentaron un valor p<0,2 en el análisis univariante y se ajustaron por el sexo, la edad y el tabaquismo activo. Sobre la base de estudios publicados previamente se ha estimado que el tamaño muestral debe ser de 50 pacientes para un valor del error α de 0,05 y un poder estadístico β de 90%.
Se realizó los análisis mediante el programa estadístico SPSS 20.0 (www.spss.com), aceptando como significativo un valor p<0,05.
ResultadosCaracterísticas de la muestraEn nuestro estudio se incluyeron 50 pacientes, todos ellos varones con una edad media 72,20±8,91 (57-86) años, los cuales fueron sometidos a reparación endovascular de AAA infrarrenal de diámetro medio máximo de 58,2±1,22mm (5,06-10). Los factores de riesgo cardiovasculares se exponen en la tabla 1.
Dos pacientes asociaron branch iliaco a la EVAR por aneurismas iliacos concomitantes. En el resto de los pacientes se implantó una endoprótesis bifurcada aortoiliaca bilateral de anclaje suprarrenal estándar. El tipo de endoprótesis implantada se recoge en la tabla 2.
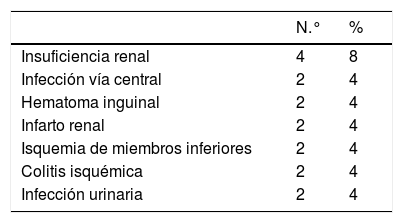
Un 68% de los pacientes no tuvo ninguna complicación postoperatoria. Las complicaciones del 32% de los pacientes se describen en la tabla 3; de ellas la más frecuente fue la insuficiencia renal asociada al procedimiento endovascular que aconteció en 4 de los 50 pacientes estudiados.
De estos 50 pacientes intervenidos encontramos 16 pacientes (24%) que desarrollaron una endofuga en el postoperatorio a medio plazo (control de CTA a los 6 meses) y 4 pacientes fallecieron en el postoperatorio (8%), aunque solo en un paciente estuvo relacionado con la intervención quirúrgica.
En relación con los hallazgos de la CTA se observó un crecimiento medio del diámetro de los AAA con fuga de 6,18mm, mientras que los AAA correctamente presurizados disminuyeron su diámetro medio en 4,69mm, siendo esta diferencia estadísticamente significativa (p=0,001) (tabla 4). En relación con los cambios en el trombo del saco aneurismático en los pacientes con AAA con fuga el trombo se incrementó en 7,74mm de media, mientras que en los pacientes con AAA correctamente sellados y sin fugas se incrementó solo en 3,08mm, siendo esta diferencia estadísticamente significativa (p=0,027). Hasta el 48% de los pacientes presentó expansión del saco aneurismático postoperatoria.
Factores pronósticos del desarrollo de endofugasSe realizó un análisis de regresión logística para estudiar los factores de riesgo que pueden influir en el desarrollo de endofugas. En este análisis se incluyeron las siguientes variables categóricas como covariables: sexo, hipertensión arterial, cardiopatía isquémica, bronquitis crónica, hábito tabáquico, diabetes mellitus y dislipidemia.
Dados los valores de las variables independientes podemos estimar la probabilidad de que se presente el evento de interés, en nuestro caso el desarrollo de una endofuga. Además nos permite estudiar la influencia de cada variable independiente (covariables) sobre la variable dependiente (endofuga) en forma de odds ratio (OR).
Como resultado se obtuvo que las covariables presencia de cardiopatía (p=0,008) y hábito tabáquico (p=0,036) mostraron una relación estadísticamente significativa con la aparición de endofugas en el postoperatorio. La OR de la presencia de cardiopatía isquémica fue de 0,087 y la OR de la presencia de hábito tabáquico fue de 7,69, siendo este modelo capaz de clasificar de forma correcta al 80% de los pacientes.
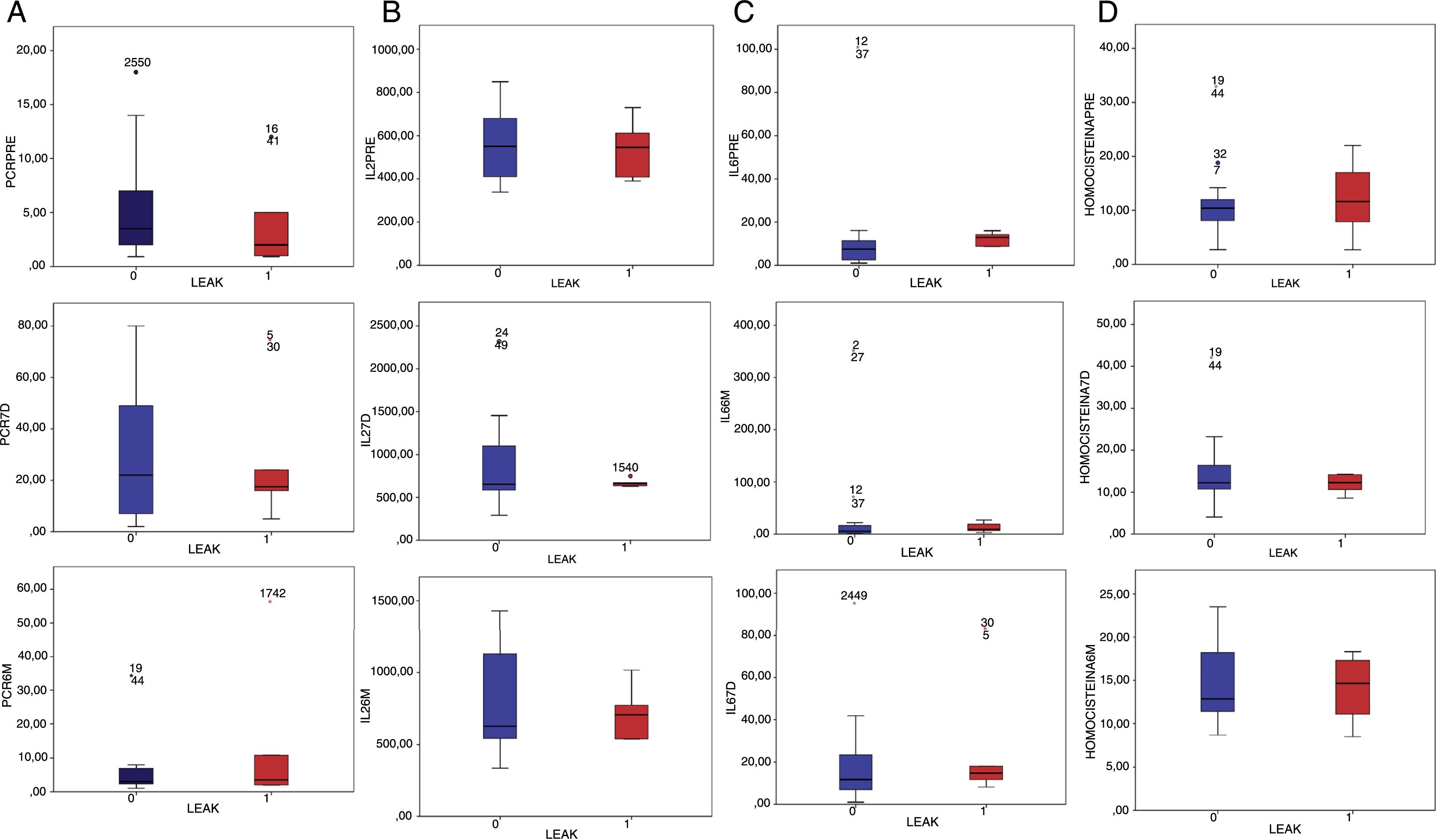
Cambios en los niveles plasmáticos de citoquinas antes y después de reparación endovascularLas concentraciones de los niveles plasmáticos de PCR, IL2, IL6 y de homocisteína en el preoperatorio, a los 7 días y a los 6 meses en los pacientes sin fuga y con fuga se muestran en la figura 1.
A. Niveles plasmáticos de PCR en el preoperatorio, a los 7 días y a los 6 meses. B. Niveles plasmáticos de IL2 en el preoperatorio, a los 7 días y a los 6 meses. C. Niveles plasmáticos de IL6 en el preoperatorio, a los 7 días y a los 6 meses. D. Niveles plasmáticos de homocisteína en el preoperatorio, a los 7 días y a los 6 meses.
Los niveles de PCR se incrementaron a los 7 días del postoperatorio adquiriendo a los 6 meses niveles similares a los del periodo preoperatorio. La IL2 muestra un pico en el postoperatorio inmediato; sus niveles descienden a los 6 meses sin adquirir los valores del preoperatorio. Los niveles plasmáticos de IL6 y de homocisteína se elevan a lo largo del todo el periodo postoperatorio. Las modificaciones de la concentración sérica de los niveles de homocisteína y de IL2 a los 7 días del postoperatorio fueron diferentes en los pacientes con endofuga y sin ella (p=0,024 y 0,05 respectivamente).
Se estableció una correlación estadísticamente significativa entre la modificación del tamaño del aneurisma postEVAR y los niveles plasmáticos de PCR y homocisteína a los 7 días, y de la modificación del tamaño del trombo intraaórtico y los niveles plasmáticos de IL2 a los 7 días y a los 6 meses (tabla 5).
Correlaciones con la modificación del diámetro y del trombo intramural del AAA tras 6 meses
| Modificación del diámetro | p | |
|---|---|---|
| Incremento PCR a los 7 días | Positiva | 0,006 |
| Incremento IL2 a los 7 días | 0,62 | |
| Incremento IL6 a los 7 días | 0,72 | |
| Incremento homocisteína a los 7 días | Positiva | 0,01 |
| Incremento PCR a los 6 meses | 0,88 | |
| Incremento IL2 a los 6 meses | 0,66 | |
| Incremento IL6 a los 6 meses | 0,29 | |
| Incremento homocisteína a los 6 meses | 0,68 |
| Modificación del trombo intramural | ||
|---|---|---|
| Incremento PCR a los 7 días | 0,28 | |
| Incremento IL2 A los 7 días | Positiva | 0,009 |
| Incremento IL6 a los 7 días | 0,07 | |
| Incremento homocisteína a los 7 días | 0,36 | |
| Incremento PCR a los 6 meses | 0,14 | |
| Incremento IL2 a los 6 meses | Positiva | 0,000 |
| Incremento IL6 a los 6 meses | 0,58 | |
| Incremento homocisteína a los 6 meses | 0,41 |
La enfermedad subyacente en los AAA a nivel celular y molecular no es bien conocida. Esta falta de conocimiento dificulta la capacidad de estratificar a los pacientes según su riesgo clínico, y tampoco nos permite pronosticar los resultados de la intervención endovascular.
Según los resultados de nuestro estudio el tratamiento endovascular de los AAA no frena el proceso inflamatorio de esta enfermedad, y esta actividad inflamatoria es todavía más evidente en aquellos pacientes con una presurización del saco aneurismático incompleta. De ahí que los niveles de homocisteína, PCR e IL2 en el postoperatorio inmediato y los niveles de IL2 tras 6 meses permanezcan elevados en los pacientes con endofugas.
Es importante conocer el proceso patogénico posterior a la implantación de la endoprótesis aórtica y utilizarlo en beneficio de los pacientes. Estos patrones de biomarcadores a largo plazo después de EVAR deben ser considerados como indicadores de un proceso activo de inflamación que ejercen su influencia en la remodelación aórtica.
Es importante destacar que todos los estudios realizados hasta el momento y disponibles en la bibliografía han analizado los cambios de los títulos de citoquinas durante un corto período después de la cirugía, cuando su liberación por el traumatismo quirúrgico enmascara cualquier mejora subyacente del perfil de citoquinas asociado a la enfermedad.
Hasta donde sabemos, el estudio actual es el primero en estudiar los niveles séricos de citoquinas y, por lo tanto, los niveles de inflamación sistémica, durante un seguimiento a más largo plazo.
Según Vainas et al.4 la PCR sérica tiene asociación con el tamaño del aneurisma de aorta abdominal, e incluso se afirma que puede estar producida por el propio tejido aneurismático. En nuestro estudio observamos que los niveles séricos de PCR eran más elevados a los 7 días del postoperatorio inmediato, reflejo del proceso inflamatorio al que se ve sometido el paciente durante la recuperación de la intervención quirúrgica, pero sus niveles descendieron a niveles preoperatorios a los 6 meses. Los niveles séricos en el preoperatorio y a los 6 meses fueron superiores de los 3,0mg/l, lo que indica un proceso inflamatorio activo.
En relación con los niveles de IL6, Sakalihasan et al.1 describieron niveles séricos elevados de esa interleucina en pacientes con un AAA. En nuestro estudio comprobamos que los niveles plasmáticos de IL6 se elevan a lo largo del todo el periodo postoperatorio y que no disminuyen a pesar de la exclusión endovascular. Los niveles altos de esta interleucina se relacionan con la síntesis de reactantes de fase aguda, como PCR y el riesgo cardiovascular.
Al igual que en nuestro estudio, Dawson et al.5 hallaron que los niveles de IL6 circulante están elevados en pacientes con AAA. Además, este grupo encontró una correlación entre el área de la superficie del aneurisma y la IL6 plasmática media. En nuestro estudio no conseguimos evidenciar la relación de los niveles plasmáticos de IL6 con el diámetro del aneurisma reparado ni con la modificación del trombo en el periodo postoperatorio.
Nessvi Otterhag et al.6 estudiaron la capacidad que tiene la reparación quirúrgica en revertir la actividad inflamatoria de los pacientes con AAA tras 6 meses de la intervención. En nuestro trabajo se observó un descenso de los niveles séricos de PCR e IL2 tras 6 meses de la intervención quirúrgica, aunque no fue así con la IL6, por lo que podemos deducir que aunque los AAA se excluyen de la circulación para evitar el crecimiento progresivo de los mismos, la reparación endovascular no es capaz de frenar el proceso inflamatorio subyacente en esta enfermedad, lo cual puede seguir influyendo en su remodelación posterior.
En relación con los niveles de homocisteína no hay estudios previos que analicen los niveles plasmáticos de homocisteína en el período preoperatorio y en el postoperatorio de la reparación endovascular de AAA. Hasta el momento actual tampoco se ha descrito su relación con la existencia de endofugas. Chan et al.7 y Takagi8 mostraron que la expresión de homocisteína era anormalmente elevada en tejidos de AAA humanos. Según se ha publicado recientemente por Bjørnestad et al.9 la homocisteína plasmática total está relacionada con la neopterina plasmática, un indicador de la activación inmune mediado por interferón-γ, y ambos biomarcadores predicen positivamente el riesgo cardiovascular. En nuestro trabajo encontramos que los niveles séricos de homocisteína se elevan a lo largo del todo el periodo postoperatorio, con pauta ascendente.
Posteriormente analizamos el comportamiento de los niveles plasmáticos de los diferentes marcadores en los pacientes con fuga y en los pacientes sin fuga después de la EVAR. Encontramos la existencia de una correlación estadísticamente significativa entre la modificación del tamaño del aneurisma postEVAR y los niveles plasmáticos de PCR y homocisteína a los 7 días, y de la modificación del tamaño del trombo intraaórtico y los niveles plasmáticos de IL2 a los 7 días y a los 6 meses, lo cual indica una clara relación de los niveles de IL2 con los cambios intratrombo y de la PCR y homocisteína con los cambios en el diámetro del AAA postEVAR.
En el estudio de los factores clínicos que ensombrecen la evolución de los AAA reparados de forma endovascular se encuentra la presencia del hábito tabáquico y de la cardiopatía isquémica, por lo que deberíamos realizar un seguimiento más exhaustivo en este grupo de pacientes.
Por otro lado, en el estudio también se observó que los AAA no presurizados aumentan su diámetro y su trombo intramural como consecuencia de la persistencia del flujo sanguíneo en la luz aórtica.
La principal limitación de este estudio se encuentra en el tamaño de la muestra. En principio el número de pacientes con AAA infrarrenal en rango quirúrgico sometidos a reparación quirúrgica endovascular son actualmente frecuentes, pero la realización de las determinaciones plasmáticas de los diferentes marcadores precisa de recursos económicos importantes. Aun así, el estudio se planteó para que cada paciente fuera control de sí mismo, lo que mejora la fuerza estadística de los resultados, y el seguimiento prolongado añade datos nuevos a la literatura10–13 no descritos hasta el momento actual en el campo de la inflamación postEVAR. Otra limitación del estudio puede proceder de la inclusión en el análisis de los resultados de los pacientes que mostraron una infección postoperatoria e infarto renal, si bien estos pacientes no desarrollaron endofuga postoperatoria que pudiera elevar los marcadores serológicos en este grupo.
En conclusión, hallamos la existencia de una correlación estadísticamente significativa entre la modificación del tamaño del aneurisma postEVAR y los niveles plasmáticos de PCR y homocisteína a los 7 días, y de la modificación del tamaño del trombo intraaórtico y los niveles plasmáticos de IL2 a los 7 días y a los 6 meses. Estos patrones de biomarcadores a largo plazo después de EVAR deben ser considerados como indicadores de un proceso activo de inflamación que ejercen su influencia en la remodelación aórtica.
FinanciaciónEste trabajo de investigación ha sido financiado mediante una ayuda económica enmarcada en el programa de acciones científicas y formativas de la fundación SEACV.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.