A pesar de su sencillez estructural, las plaquetas son células funcionalmente muy complejas debido a su capacidad para producir y liberar biomoléculas. De aquí su importancia en el desarrollo de la arteriosclerosis. Se realizó un experimento in vitro para estudiar la actividad de las plaquetas sobre la pared vascular observando los cambios en la expresión proteica del citoesqueleto en segmentos de aorta bovina incubados con plasma rico en plaquetas. Para intentar simular un estado inflamatorio (arteriosclerosis), se realizaron estas mismas determinaciones en segmentos preestimulados con factor de necrosis tumoral. Se observó una modulación de la expresión de la mayoría de las proteínas del citoesqueleto en los segmentos de aorta sana. Sin embargo, en los segmentos preestimulados el número de proteínas fue menor, pudiendo reflejar una capacidad dual de las plaquetas para alterar la contractilidad vascular en función del estado inflamatorio de la pared vascular.
Despite its structural simplicity, platelets are functionally complex cells due to their ability to produce and release biomolecules. Hence its importance in the development of atherosclerosis. An in vitro experiment was conducted to study the effect of the platelets on the vascular wall by observing changes in the cytoskeletal protein expression in bovine aortic segments incubated with platelet rich plasma. With the aim of simulating an inflammatory state (atherosclerosis), these same measurements were performed on aortic segments pre-stimulated with tumour necrosis factor. We observed a modulation of the expression of most of the cytoskeletal proteins in healthy aorta segments. However, the number of modified proteins was less in pre-stimulated segments. These results may reflect a dual platelet capacity to alter vascular contractility in relation to the inflammatory condition of the vascular wall.
En la última década se han realizado grandes avances en el estudio de la arteriosclerosis como una enfermedad inflamatoria1. De hecho, hasta no hace mucho tiempo, el concepto de la plaqueta dentro de la arteriosclerosis era el de una célula involucrada en los estadios finales de la placa de ateroma, es decir, en la activación de la coagulación tras la rotura de la misma2. Sin embargo, poseemos una creciente evidencia de la contribución de las plaquetas en la arteriosclerosis a través de la interacción con la pared vascular y otros tipos celulares mediante mecanismos paracrinos y autocrinos que condicionan un círculo de amplificación de la respuesta inflamatoria3.
Actualmente poseemos un conocimiento extenso de los efectos que ejerce el endotelio sobre las plaquetas4, pero son muy limitados lo estudios que examinan el efecto contrario, el de las plaquetas sobre la expresión proteica de la pared vascular5. En este sentido, existen estudios in vitro que señalan que las plaquetas pueden inducir un proceso inflamatorio en cultivos de células endoteliales (CE)4. Del mismo modo, existen estudios in vivo que demuestran cómo las plaquetas, bajo condiciones inflamatorias, pueden modular la expresión de proteínas asociadas al proceso inflamatorio6.
La disfunción endotelial que inicia la placa de ateroma se caracteriza por un aumento de la permeabilidad de la pared vascular vinculado a un proceso de desorganización del citoesqueleto celular7. El citoesqueleto y el sistema contráctil no solo poseen una mera acción estructural, sino que se les atribuye una función como reguladores del medio ambiente celular8. Además, el citoesqueleto tiene la capacidad de responder a estímulos extracelulares, como son los productos plaquetarios, y llevar a cabo una reestructuración9.
El objetivo de nuestro estudio experimental fue determinar si las plaquetas eran capaces de producir cambios en la expresión proteica de la pared vascular utilizando la proteómica para monitorizar dichas variaciones.
Material y métodoMuestras de aorta bovinaSe obtuvieron segmentos de aorta torácica de origen bovino, que se manipularon en condiciones de esterilidad y se dividieron cuidadosamente para preservar el endotelio intacto. Posteriormente fueron cultivados a 37°C en una atmósfera con 95% de oxígeno, 5% de dióxido de carbono con el medio Roswell Park Memorial Institute (RPMI) suplementado con suero fetal bovino, glutamina (5mmol/l), penicilina (2×10−5μg/l) y estreptomicina (2×10−5μg/l).
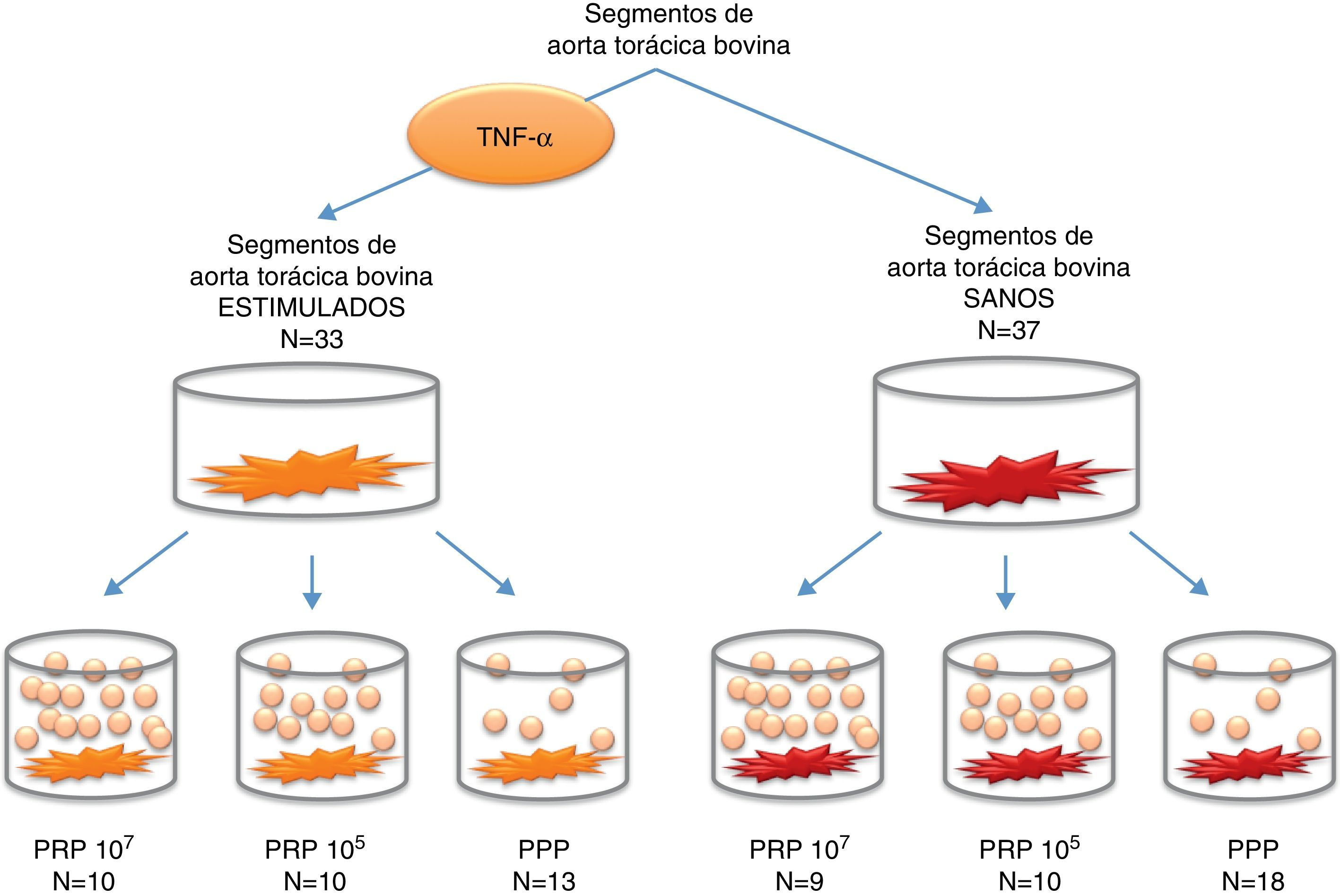
Con el objetivo de inducir un estado inflamatorio similar al que acontece en la arteriosclerosis, 33 fragmentos de aorta bovina fueron estimulados incubándolos durante 6h con 10ng/ml de la citocina factor de necrosis tumoral alfa (TNF-α), como se ha publicado con anterioridad10.
Aislamiento del plasma rico en plaquetasSe obtuvieron 10 ml de sangre periférica de voluntarios sanos con una edad media de 35± 8años para obtener plasma rico en plaquetas (PRP). Se excluyeron aquellos individuos que habían tomado antiagregantes o antiinflamatorios las 2 semanas previas a la obtención de la muestra. El estudio fue aprobado por el Comité Ético Institucional del Hospital Clínico San Carlos.
El protocolo para la obtención del PRP ya ha sido publicado por otros autores con anterioridad6,11,12, siendo de gran importancia evitar grandes fuerzas mecánicas como la agitación. Se añadió un 10% del anticoagulante citrato-dextrosa y se centrifugó a 800g y 20°C durante 15min. Para obtener las distintas concentraciones de plaquetas utilizadas en el experimento (como se indica posteriormente) se diluyó el PRP con plasma pobre en plaquetas (PPP), que se obtuvo centrifugando el PRP a 2.500rpm durante 10 min. El número de plaquetas se cuantificó con un contador celular.
Protocolo de coincubaciónEn los experimentos de coincubación (cocultivos) se utilizaron 2 concentraciones de plaquetas diferentes: 105 plaquetas por pocillo (plaq/poc), considerada una concentración fisiológica, y 107 plaq/poc, que se asemejaría a la concentración de plaquetas existente en el trombo plaquetario y, por tanto, una situación patológica.
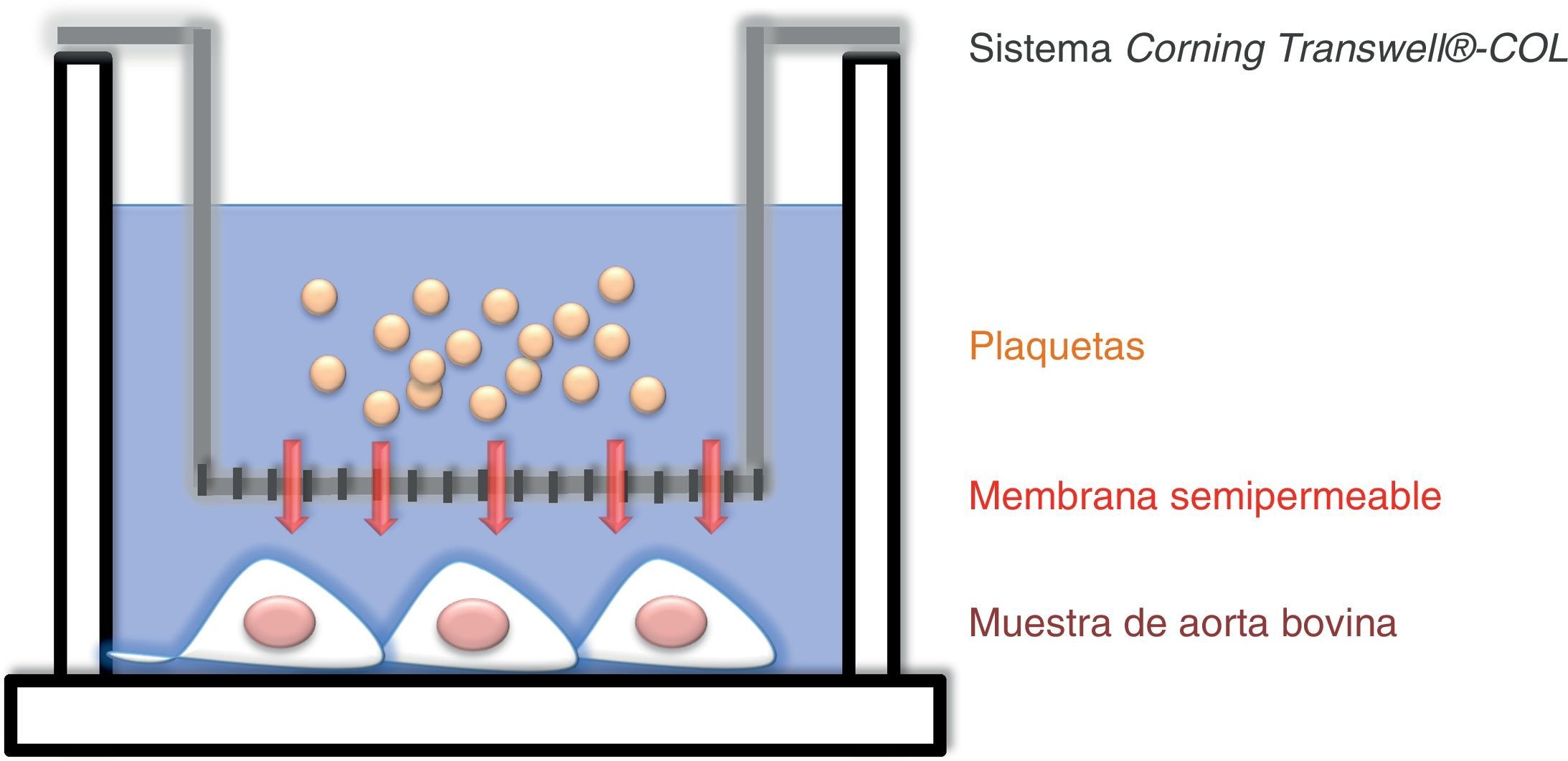
El sistema de coincubación se realizó utilizando unas membranas semipermeables de tipo Corning®-Transwell®-COL (Corning incorporated, COSTAR3491,NY), que permitieron cultivar las muestras de aorta y las plaquetas sin estar en contacto directo y, por tanto, permitió estudiar la interacción entre ellas a través de la liberación de mediadores (fig. 1). El tamaño del poro fue de 0,4μm para evitar la migración de las plaquetas, ya que estas poseen un diámetro de 1-3μm13. El experimento llevado a cabo se detalla en la figura 2. Se utilizaron 31 segmentos controles, los cuales fueron incubados con PPP.
La coincubación fue de una hora para evitar la activación espontánea de las plaquetas14. Después se retiró el sistema de membranas que contenía las plaquetas y se cultivaron las muestras de aorta 23 h más a 37°C.
Determinación de las proteínas del citoesqueleto y sistema contráctilPara la determinación de las proteínas de las muestras se utilizó la proteómica, técnica que permite el análisis de la expresión de múltiples proteínas a la vez en una única muestra. La base fundamental de la proteómica para el desarrollo de los mapas proteicos es la electroforesis bidimensional (2-DE), que separa cada proteína y sus isoformas según su punto isoeléctrico y su peso molecular.
Tras la coincubación, las muestras de aorta fueron aisladas y homogeneizadas en un tampón de rehidratación (que solubiliza las proteínas) con urea (8mol/l), CHAPS (2%), ditiotreitol (40mmol/l), anfolitos (0,2%) y azul de bromofenol (0,01%). Posteriormente se centrifugaron a 10.000g durante 10min y el sobrenadante se congeló a −80°C hasta su análisis.
Para la primera dimensión de la 2-DE se cargaron muestras de 250μg de proteína total en tiras de geles de gradiente de pH inmovilizado (IPG) con un pH de 3 a 10 (Bio-Rad ReadyStrip™). El foco isoeléctrico se realizó con el sistema PROTEAN® IEF cell (Laboratorios Bio-Rad) a 50V durante 60 h seguido de rápidas subidas lineales de tensión y voltaje limitados por una corriente máxima de 50μA por gel15.
En la segunda dimensión las proteínas de las tiras IPG se separaron según su peso molecular en geles de electroforesis de poliacrilamida y dodecil sulfato sódico al 10% (SDS-PAGE) con el sistema PROTEAN®II XL (Laboratorios Bio-Rad).
Posteriormente los geles se fijaron en una solución con Fixative Enhance Concentrate (Laboratorios Bio-Rad) y se tiñeron con plata utilizando el kit Silver Stain Plus (Laboratorios Bio-Rad) durante 25min.
Los geles teñidos fueron escaneados y el análisis de la imagen se realizó utilizando el programa Quantity One 4.2.3 (Laboratorios Bio-Rad). Dicho software permite la adquisición, cuantificación y análisis de gran variedad de datos, incluyendo muestras teñidas adquiridas mediante sistemas de geles.
Espectrometría de masasLa especrometría de masas (MS) se utilizó para confirmar las proteínas de interés obtenidas en la 2-DE. Para ello se extrajeron manualmente los puntos de interés en los geles de poliacrilamida con un punzón para biopsias16. La tinción de plata fue solubilizada y eliminada. Posteriormente las muestras fueron digeridas con 12,5ng/μl de tripsina en 25mM de bicarbonato de amonio (pH 8,5) a 37°C durante toda la noche para hidrolizar específicamente los enlaces peptídicos del extremo carboxilo de los residuos de lisina y arginina. De los extractos obtenidos se cargó 1μl en una placa de MALDI (del inglés Matriz-Assisted Laser Desorption/Ionization) para el análisis en el espectrómetro de masas 4.700 Proteomic Analyzer (Applied Biosystem). Con el análisis en modo MS se obtuvo el espectro de masas denominado «huella peptídica» (fig. 3). Los péptidos con una relación señal-ruido mayor de 20 se consideraron en la base de datos Mascot (MatrixScience, Reino Unido) para la identificación de la proteína.
Los datos se expresaron en unidades arbitrarias de densitometría (AUD), con media y desviación estándar, que son valores relativos de una unidad de medida mostrando el ratio de una determinada cantidad de sustancia, intensidad u otras cantidades respecto a un valor de referencia. Dado que las AUD expresan el ratio entre una medida y la referencia, son cantidades adimensionales. Para determinar el nivel de significación estadística se utilizó el test de Mann-Whitney. Se consideró estadísticamente significativo un valor de p≤0,05.
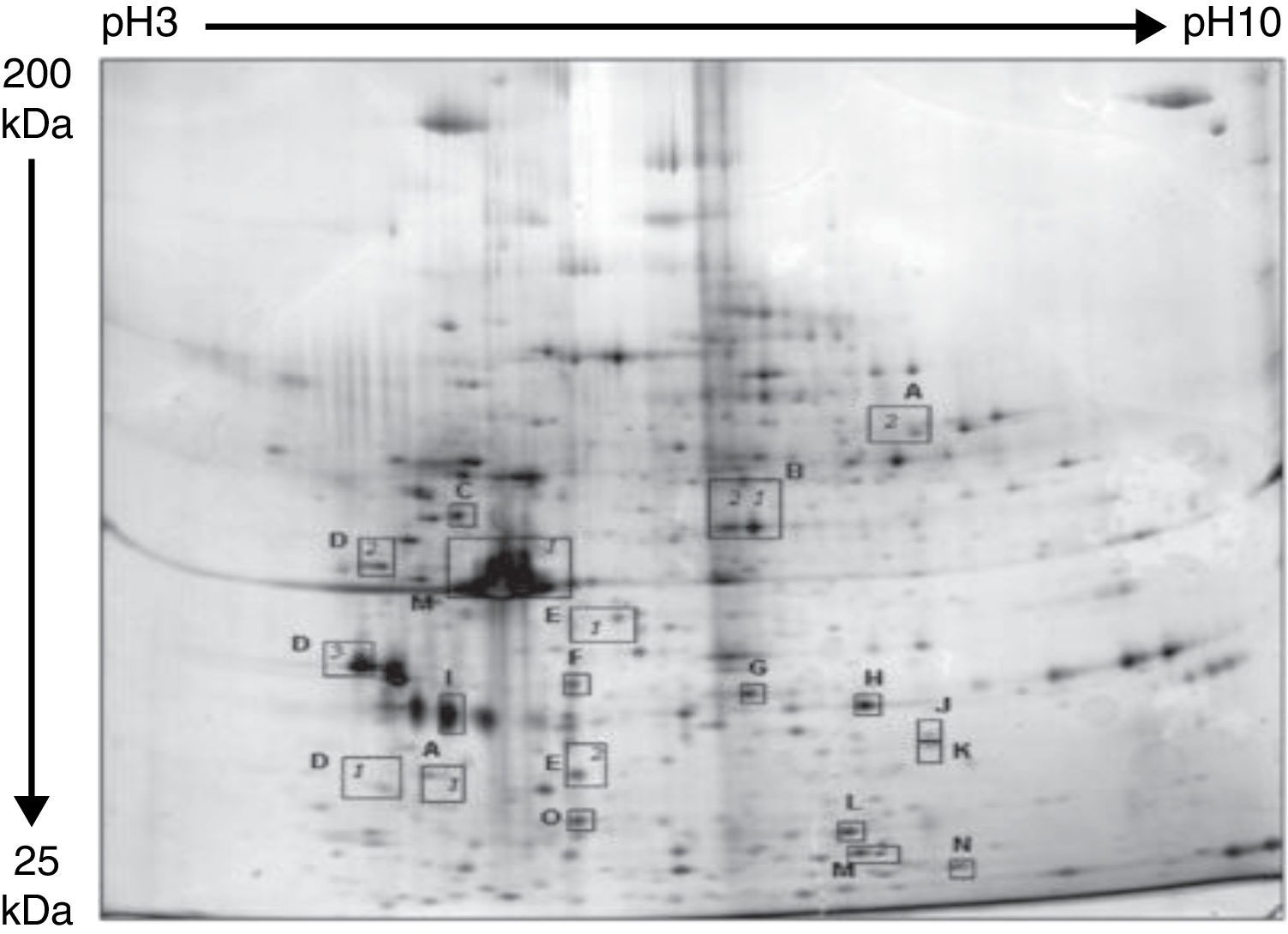
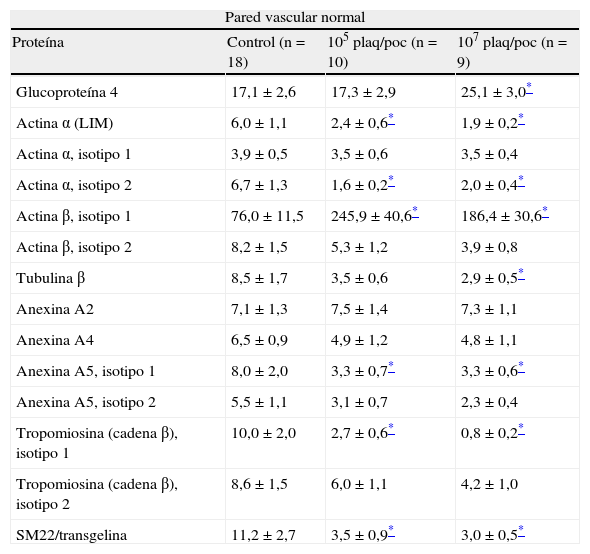
ResultadosLa figura 4 muestra el mapa proteómico de los segmentos de aorta con las proteínas que se identificaron y se cuantificaron.
Mapa proteómico tisular. Las proteínas analizadas aparecen numeradas y las isoformas numeradas. A: anexina A5; D: cadena β tropomiosina; E: actina α del músculo liso; F: tubulina ß; G: anexina A4; H: anexina A2; I: glucoproteína 4 asociada a las microfibras; J: actina α asociada a proteínas LIM; M: actina β; N: SM22/transgelina;
En los segmentos de aorta normales (no estimulados), la coincubación con PRP disminuyó significativamente la expresión de la actina α asociada al dominio LIM, del isotipo 2 de la actina α, de la tubulina β, del isotipo 1 de la anexina A5, del isotipo 1 de la cadena β de la tropomiosina y de la SM22/transgelina. Por el contrario, se observó una sobreexpresión del isotipo 1 de la actina β y de la glucoproteína 4 asociada a las microfibras (tabla 1).
Modificación de la expresión de las proteínas del citoesqueleto y del sistema contráctil celular en la aorta bovina normal no estimulada
| Pared vascular normal | |||
| Proteína | Control (n=18) | 105 plaq/poc (n=10) | 107 plaq/poc (n=9) |
| Glucoproteína 4 | 17,1±2,6 | 17,3±2,9 | 25,1±3,0* |
| Actina α (LIM) | 6,0±1,1 | 2,4±0,6* | 1,9±0,2* |
| Actina α, isotipo 1 | 3,9±0,5 | 3,5±0,6 | 3,5±0,4 |
| Actina α, isotipo 2 | 6,7±1,3 | 1,6±0,2* | 2,0±0,4* |
| Actina β, isotipo 1 | 76,0±11,5 | 245,9±40,6* | 186,4±30,6* |
| Actina β, isotipo 2 | 8,2±1,5 | 5,3±1,2 | 3,9±0,8 |
| Tubulina β | 8,5±1,7 | 3,5±0,6 | 2,9±0,5* |
| Anexina A2 | 7,1±1,3 | 7,5±1,4 | 7,3±1,1 |
| Anexina A4 | 6,5±0,9 | 4,9±1,2 | 4,8±1,1 |
| Anexina A5, isotipo 1 | 8,0±2,0 | 3,3±0,7* | 3,3±0,6* |
| Anexina A5, isotipo 2 | 5,5±1,1 | 3,1±0,7 | 2,3±0,4 |
| Tropomiosina (cadena β), isotipo 1 | 10,0±2,0 | 2,7±0,6* | 0,8±0,2* |
| Tropomiosina (cadena β), isotipo 2 | 8,6±1,5 | 6,0±1,1 | 4,2±1,0 |
| SM22/transgelina | 11,2±2,7 | 3,5±0,9* | 3,0±0,5* |
Plaq/poc: plaquetas por pocillo.
La mayor parte de las proteínas modificaron su expresión al coincubar la pared vascular normal con las 2 concentraciones diferentes de plaquetas, excepto la glucoproteína 4 y la tubulina β que solo se modificaron con la concentración más alta. Se evidenció una disminución significativa en la expresión de la actina α asociada a las proteínas LIM, tanto con 105 plaq/poc (6,0±1,1 vs 2,4±0,6, p=0,033) como con 107 plaq/poc (6,0±1,1 vs 1,9±0,2, p=0,027). No se modificó significativamente la expresión de la isoforma 1 de la actina α, sin embargo, sí se observó una disminución de la isoforma 2, tanto con 105 plaq/poc (6,7±1,3 vs 1,6±0,2, p=0,042) como con 107 plaq/poc (6,7±1,3 vs 2,0±0,4, p=0,043). El isotipo 1 de la actina β se sobreexpresó de forma significativa en las muestras de aorta sana tanto en la incubación con 105 plaq/poc (76,0±11,5 vs 245,9±40,6, p=0,050) como 107 plaq/poc (76,0±11,5 vs 186,4±30,6, p=0,048). Por el contrario, el isotipo 2 presentó una disminución, aunque no significativa, con ambas concentraciones de plaquetas. La tubulina β redujo su expresión tras la incubación con el PRP, pero solo fue significativa con 107 plaq/poc (8,5±1,7 vs 2,9±0,5, p=0,048). Las anexinas A2 y A4 no modificaron su expresión en la pared aórtica tras la incubación con PRP. En contraposición, la anexina A5 sí presentó una disminución significativa de la expresión del isotipo 1, tanto en la incubación con 105 (8,0±2,0 vs 3,3±0,7, p=0,045) como con 107 plaq/poc (8,0±2,0 vs 3,3±0,6, p=0,043). A pesar de existir también una disminución de la expresión del isotipo 2, esta no fue estadísticamente significativa. Se observó una reducción en la expresión del isotipo 1 de la cadena β de la tropomiosina tras incubarla con 105 plaq/poc (10,0±2,0 vs 2,7±0,6, p=0,019) y con 107 plaq/poc (10,0±2,0 vs 0,8±0,2, p=0,009). El isotipo 2 también se infraexpresó en la pared aórtica incubada con 105 plaq/poc (8,6±1,5 vs 6,0±1,1, p=0,273) y con 107 plaq/poc (8,6±1,5 vs 4,2±1,0, p=0,273), sin alcanzar la significación estadística. La SM22/transgelina en la aorta sana presentó una reducción significativa, tanto al incubarla con 105 plaq/poc (11,2±2,7 vs 3,5±0,9, p=0,048) como con 107 plaq/poc (11,2±2,7 vs 3,0±0,5, p=0,045).
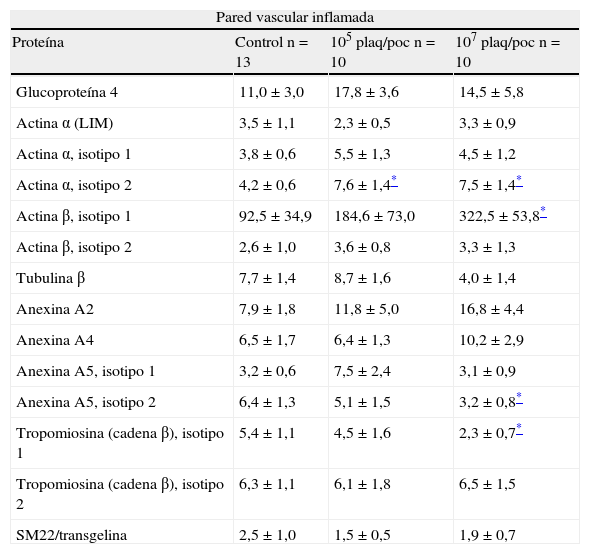
En los segmentos de aorta preestimulados con TNF-α, la presencia de PRP cambió la expresión de un menor número de proteínas de la pared vascular respecto a la pared vascular sana (tabla 2). Del mismo modo que ocurrió en los segmentos de aorta sana, no se modificó significativamente la expresión de la isoforma 1 de la actina α al incubar las muestras preinflamadas con PRP, pero sí se observó un aumento significativo de la isoforma 2 tanto con 105 plaq/poc (4,2±0,6 vs 7,6±1,4, p=0,048) como con 107 plaq/poc (4,2±0,6 vs 7,5±1,4, p=0,048). Así, en los segmentos preincubados con TNF-α se sobreexpresó el isotipo 1 de la actina β, que solo fue significativo con 107 plaq/poc (92,5±34,9 vs 322,5±53,8, p=0,037) y hubo una disminución en la expresión del isotipo 2 de la anexina A5, igualmente solo tras la incubación con 107 plaq/poc (6,4±1,3 vs 3,2±0,8, p=0,043). A diferencia de los segmentos normales de aorta, en los preestimulados con TNF-α solo se observó una disminución significativa de la isoforma 1 de la cadena β de la tropomiosina al incubarlos con 107 plaq/poc (5,4±1,1 vs 2,3±0,7, p=0,045) y no con 105 plaq/poc.
Modificación de la expresión de las proteínas del citoesqueleto y del sistema contráctil celular en la aorta bovina inflamada
| Pared vascular inflamada | |||
| Proteína | Control n=13 | 105 plaq/poc n=10 | 107 plaq/poc n=10 |
| Glucoproteína 4 | 11,0±3,0 | 17,8±3,6 | 14,5±5,8 |
| Actina α (LIM) | 3,5±1,1 | 2,3±0,5 | 3,3±0,9 |
| Actina α, isotipo 1 | 3,8±0,6 | 5,5±1,3 | 4,5±1,2 |
| Actina α, isotipo 2 | 4,2±0,6 | 7,6±1,4* | 7,5±1,4* |
| Actina β, isotipo 1 | 92,5±34,9 | 184,6±73,0 | 322,5±53,8* |
| Actina β, isotipo 2 | 2,6±1,0 | 3,6±0,8 | 3,3±1,3 |
| Tubulina β | 7,7±1,4 | 8,7±1,6 | 4,0±1,4 |
| Anexina A2 | 7,9±1,8 | 11,8±5,0 | 16,8±4,4 |
| Anexina A4 | 6,5±1,7 | 6,4±1,3 | 10,2±2,9 |
| Anexina A5, isotipo 1 | 3,2±0,6 | 7,5±2,4 | 3,1±0,9 |
| Anexina A5, isotipo 2 | 6,4±1,3 | 5,1±1,5 | 3,2±0,8* |
| Tropomiosina (cadena β), isotipo 1 | 5,4±1,1 | 4,5±1,6 | 2,3±0,7* |
| Tropomiosina (cadena β), isotipo 2 | 6,3±1,1 | 6,1±1,8 | 6,5±1,5 |
| SM22/transgelina | 2,5±1,0 | 1,5±0,5 | 1,9±0,7 |
Plaq/poc: plaquetas por pocillo.
El presente estudio experimental muestra cómo en la pared vascular sana, en presencia de distintas concentraciones de plaquetas, se modifica la expresión de distintas proteínas relacionadas con el citoesqueleto y el sistema contráctil. Asimismo, cuando la pared vascular es sometida a un estado inflamatorio, la presencia del PRP modifica la expresión de un número menor de proteínas de estos sistemas. Por primera vez se establece in vitro el efecto de la plaqueta sobre la pared vascular.
Las plaquetas poseen un papel fundamental en la hemostasia y prevención del sangrado. Sin embargo, es probable que contribuyan en otros procesos distintos de este, como el desarrollo de respuestas inflamatorias e inmunitarias y mantenimiento de la integridad vascular. De hecho, las plaquetas son capaces de reclutar leucocitos y células progenitoras en los lugares de lesión de la pared vascular, ya que producen y liberan factores proinflamatorios, antiinflamatorios y angiogénicos a la circulación. En modelos experimentales se ha demostrado que estas funciones contribuyen a la aterogénesis, sepsis, hepatitis, reestenosis y rechazo a trasplantes17. Las plaquetas han demostrado ser células más complejas de lo que en un principio se consideró, capaces de sintetizar proteínas mediante mecanismos únicos y extranucleares de traslación del RNAm dependientes de diferentes estímulos o señales18.
Un hecho ampliamente estudiado y demostrado es que la actividad plaquetaria está modulada por múltiples factores expresados y liberados por la pared vascular19,20. Esta barrera antiadhesiva y antitrombótica que constituye el endotelio sano inhibe la actividad plaquetaria21. Por ello, actualmente poseemos un extenso conocimiento de los efectos que ejerce la pared vascular sobre las plaquetas4, pero son muy limitados los estudios que examinan el efecto contrario, el de las plaquetas sobre la expresión proteica de la pared vascular.
Theilmeier et al.22 demostraron cómo en conejos hipercolesterolémicos las plaquetas se reclutaban en sitios propensos a la lesión aterosclerótica antes de que esta apareciera, pudiendo agravar o perpetuar el daño endotelial. Además, observaron que las plaquetas adheridas al endotelio disfuncionante proporcionaban un punto para el reclutamiento de monocitos en el espacio subendotelial. En diferentes estudios se ha comprobado la existencia de plaquetas en todos los estadios de formación de la placa de ateroma, por lo que cada vez ha tomado más relevancia el papel de las mismas en los primeros estadios y no solo después de la rotura de la placa23,24. Las plaquetas son fuente de numerosos mediadores, incluidos factores de crecimiento y otras sustancias que pueden influir en la expresión de proteínas de la pared vascular. Massberg et al.5 demostraron que la incubación de monocapas de células musculares lisas con plaquetas activadas producía un aumento significativo de la secreción de proteína quimiotáctica de monocitos 1 (MCP-1) y promovía la migración de células musculares lisas. Las plaquetas también han mostrado la capacidad de activar factores de transcripción nuclear como el NF-κB, que participa en el desarrollo de la arteriosclerosis. Gawaz et al.25 encontraron que las plaquetas activadas con ADP inducían la secreción de MCP-1 y la expresión en la superficie de las CE por un mecanismo mediado por NF-κB. En este sentido, existen estudios in vitro que señalan que las plaquetas pueden inducir un proceso inflamatorio en cultivos de CE4. Del mismo modo, hay estudios in vivo que demuestran cómo las plaquetas, bajo condiciones inflamatorias, pueden modular la expresión de proteínas asociadas al proceso inflamatorio. González-Fernández et al.6 demostraron una marcada disminución de la sintasa inducible de óxido nítrico por las plaquetas tras la denudación del endotelio de la arteria carótida de ratas.
Las CE de la pared vascular no solo constituyen una barrera mecánica al paso de sustancias, sino que toman un papel muy importante en funciones fisiológicas como el mantenimiento del tono vasomotor. La disfunción endotelial que se produce en la arteriosclerosis implica una alteración profunda de su patrón de expresión génica, lo que induce genes que en condiciones fisiológicas estarían reprimidos e inhibe otros expresados en condiciones normales7. En este sentido, se produce por tanto un cambio en la expresión proteica de las CE. De hecho, la disfunción endotelial está vinculada a un aumento en la permeabilidad que parece debido a un proceso de contracción celular por una desorganización del citoesqueleto celular7. El citoesqueleto y el sistema contráctil son unos componentes críticos de la pared vascular, ya que contribuyen directamente en la modulación de la hemodinámica arterial y a mantener la integridad vascular26. La estructura del vaso sanguíneo, incluyendo el citoesqueleto, parece estar regulada por factores mecánicos27, aunque otros factores y células circundantes como las plaquetas pueden estar también involucrados en esta regulación.
Las proteínas que constituyen el citoesqueleto y sistema contráctil de la pared vascular mantienen la forma y polaridad celular, contribuyendo también a otras funciones celulares fundamentales como la motilidad, el transporte de los organelos y la mitosis28. De hecho, se ha sugerido que el citoesqueleto de actina intacto es uno de responsables fundamentales de la organización celular8, ya que constituye un resistente soporte intracelular que permite organizar importantes proteínas de membrana en la célula. Tiene la capacidad de responder a estímulos extracelulares y llevar a cabo una reorganización9. Además, algunos estudios han demostrado que numerosas proteínas solubles pueden estar asociadas al citoesqueleto8. Todos estos datos señalan una función del mismo como regulador del medio ambiente dentro de la célula, y no solo una mera acción estructural. Se han demostrado cambios cuantitativos en los componentes del citoesqueleto como mecanismo compensatorio en condiciones patológicas29. A su vez, las isoformas de cada una de las proteínas parecen constituir un potente mecanismo de diversidad de acción de los filamentos de actina30.
En nuestro estudio se observó una disminución de muchas de las proteínas del citoesqueleto y el sistema contráctil en la pared vascular sana tras incubarla con PRP, lo que podría indicar una disminución de su capacidad contráctil. En concordancia con nuestra observación, Li et al.31 demostraron que los factores liberados por las plaquetas podían inhibir la expresión de la actina α del músculo liso de la pared vascular. Por otro lado, la sobreexpresión de otras 2 proteínas del sistema contráctil en la pared sana, como son la glucoproteína 4 y la actina β, podría indicar un mecanismo de compensación por la infraexpresión de las otras proteínas mencionadas con anterioridad.
Las proteínas LIM asociadas al citoesqueleto de actina actúan como mediadoras de la interacción entre proteínas del núcleo y del citoplasma32. Se ha demostrado que modulan la interacción entre las proteínas del citoesqueleto, representando un papel en la transducción de señales y en la organización de los filamentos de actina durante determinados procesos celulares33. De esta manera, la disminución observada en nuestro estudio podría relacionarse con una alteración en la transmisión de señales intracelulares y de organización del citoesqueleto inducida por las plaquetas.
Otras proteínas identificadas en el estudio aún no poseen funciones bien identificadas, como es el caso de las anexinas, que parece que actúan como puntos de unión membrana-citoesqueleto34. Especialmente poco conocida es la función de la anexina A5, posiblemente relacionada con la inhibición de la coagulación sanguínea por competición con la trombina. También se desconoce el abanico de acción de la transgelina/SM22, otra proteína que hemos encontrado disminuida al incubar la pared sana con PRP. Parece ser un marcador temprano de diferenciación del músculo liso y estar relacionada con la contractilidad y la supresión de tumores35.
En el presente trabajo, cuando se indujo un estado preinflamatorio en la pared vascular, la presencia de PRP también produjo una modulación de la expresión de las proteínas del sistema contráctil pero en menor número que en los segmentos de aorta sanos. Dado el escaso conocimiento en este tema, es difícil determinar la importancia de los cambios observados en la expresión de las proteínas sobre la funcionalidad del endotelio. Sabemos que las uniones adhesivas entre las CE regulan la permeabilidad del endotelio y muchos estudios han indicado la importante contribución del citoesqueleto de actina para mantener la integridad de la unión36–40. En conjunto, estos resultados pueden señalar un efecto dual de las plaquetas a nivel molecular sobre el sistema contráctil, dependiendo de la situación inflamatoria de la pared vascular. Esto estaría en concordancia con la extensa literatura médica existente sobre la observación de que las plaquetas inducen vasodilatación en las arterias sanas, pero vasoconstricción en las arterias enfermas41.
Una limitación del estudio podría ser la heterogeneidad interespecie al incubar las plaquetas humanas con los segmentos de aorta bovina. Sin embargo, es importante resaltar que la presencia de plaquetas no modificó la expresión de otras proteínas en la pared vascular bovina, lo cual apoya la especificidad de los cambios observados. Otra limitación del estudio es que durante la centrifugación para la obtención del PRP existe la posibilidad de un cierto grado de activación plaquetaria, lo cual podría favorecer la liberación de diferentes factores de origen plaquetario (pero mucho menor que utilizando plaquetas aisladas).
ConclusionesEn resumen, el principal hallazgo de este estudio fue que en la pared vascular normal las plaquetas pueden modificar la expresión de proteínas asociadas con el sistema contráctil por sí mismas. Sin embargo, bajo una situación inflamatoria las plaquetas cambian la expresión de un menor número de proteínas. Estos resultados proporcionan nuevas evidencias sobre la implicación principal de las plaquetas en la regulación de la expresión de proteínas en la pared vascular, particularmente en condiciones de ausencia de enfermedad y de inflamación, teniendo un importante papel en los procesos isquémicos.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónFondo de Investigaciones de la Seguridad Social (Redes Temáticas de Cooperación Red Heracles RD06/0009/010 y FIS04/1205).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.