La isquemia de larga duración es un proceso bastante común durante y tras la cirugía vascular, y la correcta recuperación de la función del órgano afectado depende de que se recupere el flujo sanguíneo del órgano afectado. La isquemia desencadena procesos como la inflamación, angiogénesis o vasculogénesis, que permitirán la reperfusión del órgano. Endoglina es un correceptor para los miembros de la superfamilia de citocinas de TGF-β. En nuestro laboratorio llevamos muchos años estudiando la función y los mecanismos de acción de endoglina, así como su implicación en regulación del tono vascular, angiogénesis, inflamación, fibrosis y en enfermedades como la preeclampsia y la hipertensión. Nuestro objetivo en este trabajo es revisar cómo se suceden los eventos que tienen lugar en la revascularización postisquémica, y mostrar las evidencias que colocan a endoglina como una molécula clave en estos eventos y como una posible diana terapéutica.
Long-term ischemia is frequent during and after vascular surgery, and the recovery of affected organ function depends on the re-establishment of blood supply. Ischemia triggers processes such as inflammation, angiogenesis, or vasculogenesis that will lead to tissue remodeling and blood supply restoration. All these events are closely related and highly regulated to achieve complete recovery. Endoglin is a co-receptor for TGF-β cytokines superfamily that plays a central role in vascular physiology, angiogenesis, inflammation and post-ischemic blood supply recovery. Our laboratory has been involved for a long time in the study of endoglin function and its mechanisms of action and involvement in the regulation of vascular function, angiogenesis, inflammation, and fibrosis, as well as in diseases such as hypertension and preeclampsia. The aim here is to review how post-ischemic revascularization takes place, and to assess the role of endoglin in these events, and its importance as a possible therapeutic target.
El bloqueo de larga duración o permanente del flujo sanguíneo a través de un tejido (isquemia tisular) es una situación relativamente frecuente en la cirugía vascular, que tiene consecuencias graves para el paciente si este flujo sanguíneo no se restablece adecuadamente. La isquemia desencadena varios procesos biológicos complejos por los cuales, por un lado, desaparece la mayor parte de los lechos vasculares del tejido y, por otro, se estimula tanto el crecimiento de vasos nuevos como el remodelado de los preexistentes, que en última instancia permitirán recuperar total o parcialmente el aporte sanguíneo en la zona afectada. Este último proceso se denomina revascularización o neovascularización, y permite recuperar la función de los órganos isquémicos, como puede suceder en el corazón, el pulmón, el riñón o las extremidades inferiores.
La neovascularización o revascularización incluye 3 procesos: angiogénesis, arteriogénesis y vasculogénesis. La angiogénesis consiste en la formación de nuevos vasos capilares en respuesta al entorno hipóxico. La arteriogénesis es el proceso de reclutamiento de células murales a vasos ya existentes que permitirán su crecimiento y maduración o, dicho de otra manera, la remodelación de vasos colaterales preexistentes a la isquemia. La vasculogénesis es un proceso de novo en el cual células madre progenitoras se diferencian y dan lugar a un lecho vascular nuevo que reemplaza al que ha desaparecido.
El objeto de esta revisión es analizar de forma sencilla los principales eventos involucrados en la remodelación vascular tras la isquemia y el papel de endoglina (Eng) en ellos. Aunque teóricamente separemos los procesos de angiogénesis, vasculogénesis y arteriogénesis, está claro que forman parte de la sucesión de eventos que tiene lugar durante un mismo proceso: la revascularización o neovascularización.
Asimismo, para los lectores interesados en profundizar en el tema, incluimos en la bibliografía preferentemente revisiones actualizadas sobre cada uno de los procesos que vayamos analizando.
Procesos involucrados en la revascularización tras la isquemiaAngiogénesisLa angiogénesis es el proceso de formación de novo de vasos sanguíneos desde vasos preexistentes en respuesta a un estímulo que generalmente es la hipoxia, en este caso consecuencia de la isquemia a la que está sometido el tejido. Durante el proceso de angiogénesis, las células del endotelio llevan a cabo multitud de procesos de forma altamente coordinada y que finalmente darán lugar al nuevo vaso. Entre estos procesos se encuentran un aumento de la permeabilidad vascular, la degradación de la membrana basal, la gemación o sprouting del endotelio gracias a la proliferación y migración de las células endoteliales, la formación de la luz del nuevo vaso, la anastomosis con otros vasos, la estabilización del endotelio del nuevo vaso y la maduración y reclutamiento de células murales que darán consistencia al vaso.
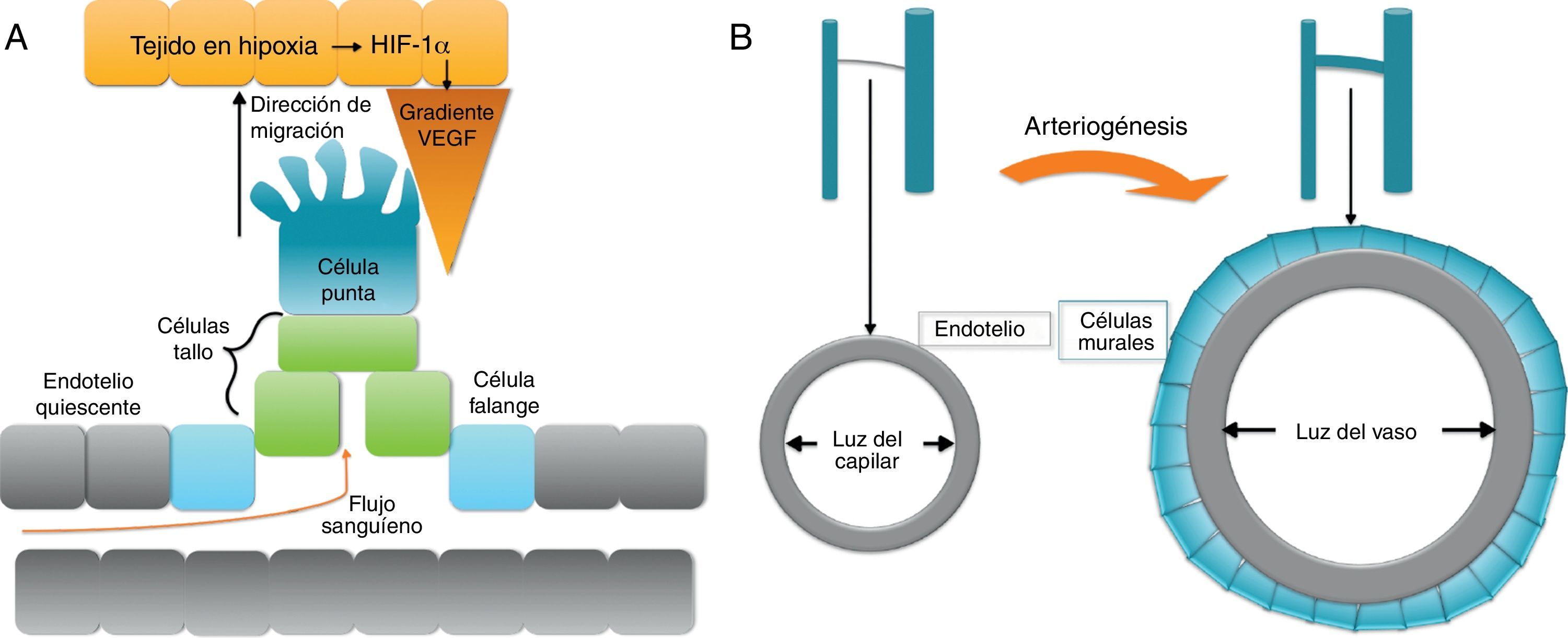
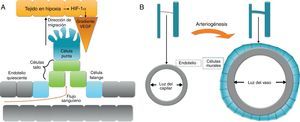
Hipoxia se define como un descenso local de la concentración o presión parcial de oxígeno. Ante el estímulo hipóxico, las células endoteliales forman una yema o sprout que crecerá en dirección a la zona hipóxica. En respuesta a la ausencia de llegada de nutrientes, concretamente oxígeno, las células afectadas producen el factor de respuesta a hipoxia (hypoxia response factor-1α [HIF-1α]), que regula la expresión de múltiples genes implicados en la angiogénesis. La principal molécula involucrada en la revascularización que se libera en respuesta a HIF-1α es vascular endotelial growth factor (VEGF). Así, se establece un gradiente de concentración de VEGF en el medio extracelular con origen en la zona de hipoxia que desencadena y regula el proceso de gemación del endotelio, que en condiciones normales se encuentra quiescente (figs. 1a).
Este proceso de gemación o sprouting consiste en una diferenciación coordinada de las células endoteliales en respuesta al VEGF del medio extracelular. En el sprouting, una célula del endotelio abandona la quiescencia y se diferencia a «célula punta» o tip cell, y las células endoteliales adyacentes a la célula punta se diferencian a «células tallo» o stalk cells. La célula punta tiene un fenotipo migratorio, atraída por el gradiente de VEGF, mientras que las células tallo son eminentemente proliferativas, por lo que se dividen formando las paredes que constituirán el nuevo vaso. Un tercer tipo celular, las «células de la falange» o phalanx cells, mantienen la unión del nuevo capilar con el vaso originario (fig. 1a). Cuando 2 capilares en crecimiento se encuentran, formarán un nuevo vaso capilar, que tendrá que ser estabilizado por el reclutamiento de pericitos y, en su caso, células de músculo liso vascular. Todo este proceso ha sido ampliamente revisado por Eilken y Adams1 y más recientemente por Chappell et al.2.
Este proceso no ocurre solamente en situación de isquemia: la correcta formación y función de los vasos sanguíneos permite el desarrollo y crecimiento de los órganos así como el mantenimiento de la homeostasis en el adulto, o sea, el mantenimiento del balance entre los aumentos o disminuciones prolongados del consumo de oxígeno y metabolitos por los órganos y la cantidad de sangre (y por lo tanto de nutrientes y metabolitos) que llega a esos órganos1,3. Una angiogénesis alterada o deficiente contribuye al desarrollo de enfermedades tan importantes como la esclerosis, o a complicaciones en la diabetes como las úlceras4,5, así como a defectos en la recuperación de la revascularización postisquémica. Una angiogénesis excesiva y desregulada es responsable de alteraciones oftalmológicas como la degeneración macular húmeda o del crecimiento tumoral y los procesos de metástasis, puesto que las células tumorales entran en apoptosis o necrosis si el aporte sanguíneo en el tumor es insuficiente para mantener el metabolismo elevado de aquellas6.
ArteriogénesisEn los procesos de arteriogénesis, tiene lugar fundamentalmente la cobertura de canales de células endoteliales preexistentes por células murales, bien por pericitos en microvasos o, en el caso de grandes vasos, por células de músculo liso vascular (vascular smooth muscle cells [VSMC]) (fig. 2b). Esto aporta estabilidad al vaso y permite que se pueda controlar el diámetro del mismo y, consecuentemente, el flujo sanguíneo y la perfusión tisular7.
En este caso, es el platelet derived growth factor (PDGF) el principal factor quimioatrayente para las células murales. VEGF y el factor de crecimiento transformante β (transforming growth factor β [TGF-β]) también promueven la diferenciación y acumulación de células murales, así como la interacción entre células murales y endoteliales en el nuevo vaso maduro8.
VasculogénesisLa vasculogénesis es el proceso que tiene lugar durante las etapas de desarrollo prenatal, cuando se crean los primeros vasos sanguíneos. Podemos definir la vasculogénesis como la formación de novo de vasos por diferenciación y ensamblaje de células precursoras mesodérmicas indiferenciadas. Estos precursores se unen, se alinean formando cordones que desarrollan una cavidad interna y dan lugar a capilares primitivos. Hasta hace unos años se creía que vasculogénesis y angiogénesis coexistían en la formación de vasos en el embrión mientras que la angiogénesis era el único mecanismo de desarrollo vascular presente en el organismo adulto.
En 1997, se demostró la existencia de células circulantes en la sangre que eran capaces de incorporarse a la pared de vasos en crecimiento y diferenciarse en células endoteliales9. Posteriormente se demostró que, tras la administración de células mononucleares CD34+ marcadas a ratones en los que se había hecho una isquemia en la pata por ligadura de la arteria femoral, en el endotelio de los vasos de nueva formación se reconocen abundantes células que expresan β-galactosidasa y que solo pueden derivar de la diferenciación endotelial de las células CD34+ inyectadas. Al tratarse de endotelio diferenciado in situ a partir de precursores circulantes indiferenciados, era preciso hablar de vasculogénesis y no de angiogénesis10. La vasculogénesis posnatal se ha reconocido posteriormente como un fenómeno importante en la revascularización postisquémica11.
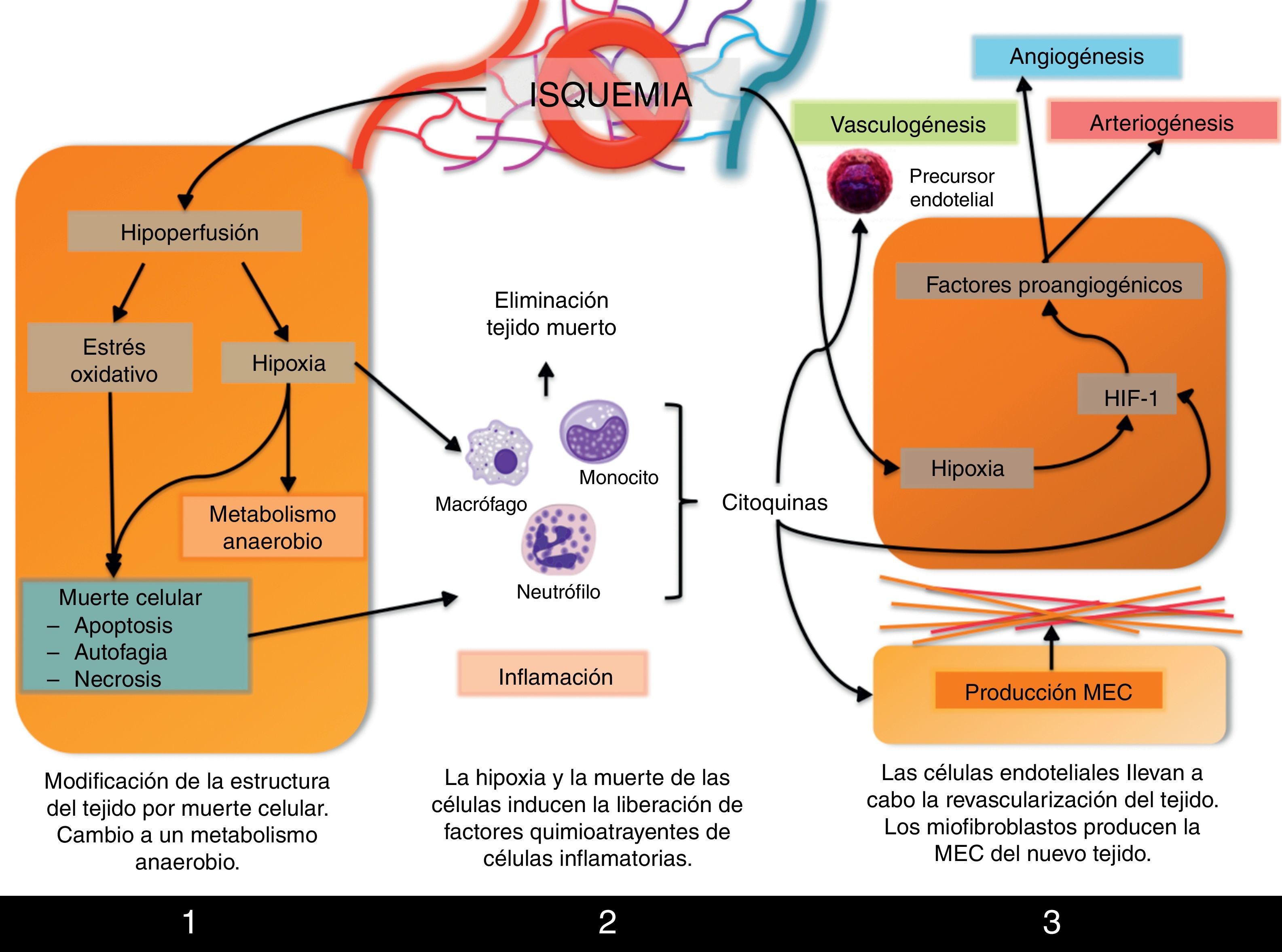
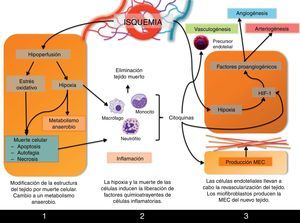
Procesos involucrados en la remodelación tisularPor lo tanto, la formación de un árbol vascular que aporte sangre a la zona isquémica (revascularización, neovascularización) es el proceso que permitirá la recuperación de la función del tejido. Este proceso se inicia inmediatamente después de la isquemia, pero no se completará hasta pasados varios días desde que se produjo el daño. Desde que se bloquea el flujo sanguíneo hasta que nuevamente se recupera tras la revascularización, se suceden varias fases en las que tienen lugar eventos como cambios metabólicos, necrosis y apoptosis celular y reclutamiento de células inflamatorias a la zona isquémica que, junto con la formación del árbol vascular, llevarán a remodelación tisular que finalmente se observa en el órgano recuperado (fig. 2).
Primeras consecuencias de la hipoxia y la hipoperfusiónEl principal efecto que sufre el tejido isquémico es la hipoxia de sus células que, como hemos visto, es el principal agente inductor de la formación de nuevos vasos sanguíneos. Pero en un primer momento, la hipoxia y la hipoperfusión a las que está sometido el tejido isquémico llevarán a la activación de la expresión de genes involucrados en el metabolismo anaerobio, necesario ante la escasez de oxígeno para satisfacer las necesidades celulares, como el gen que codifica para la enzima lactato deshidrogenasa.
Además, se ha descrito en múltiples órganos cómo el daño por isquemia-reperfusión lleva a la muerte de las células por apoptosis, autofagia o necrosis, procesos inducidos bien por factores de respuesta a hipoxia o por el estrés oxidativo al que se encuentra sometido el tejido tras la liberación de especies reactivas de oxígeno. Todos estos eventos han sido ampliamente revisados por Silvestre et al.12.
Fase inflamatoriaLa inflamación es una de las principales respuestas tempranas a la isquemia del tejido. Como consecuencia de la muerte de zonas del tejido afectadas por la hipoxia, se produce la infiltración de células inflamatorias que se encargarán de la retirada de las células muertas y de los restos de tejido, así como de la degradación de la matriz extracelular circundante.
Inflamación y neovascularización son procesos interconectados durante la respuesta a isquemia puesto que, a su vez, las células inflamatorias van a controlar diversos procesos angiogénicos. En primer lugar, existe una relación íntima entre hipoxia e inflamación que detallaremos más adelante. Pero además, las células inflamatorias están activamente involucradas en la revascularización. Los monocitos liberan las citocinas proangiogénicas bFGF y VEGF, así como MMP-9, metaloproteasa implicada en el remodelado de la matriz que rodea al nuevo árbol vascular en formación. Por su parte, los macrófagos no solo están implicados en la respuesta inflamatoria, sino que también intervienen en la angiogénica. Los macrófagos M1 expresan iNOS, enzima encargada de la síntesis de la citocina proangiogénica NO, y además producen las citocinas proinflamatorias IL-1 e IL-12. Los macrófagos M2 producen citocinas antiinflamatorias como IL-10, y también VEGF12.
Revascularización, remodelado y regeneración del tejidoDurante la fase más tardía de recuperación postisquémica se ponen en marcha los procesos de revascularización propiamente dichos, que permitirán la remodelación y regeneración tisular.
Una vez han sido retiradas las células necróticas y se ha degradado la matriz extracelular de la zona afectada, podrá producirse la revascularización, que tendrá lugar gracias a la puesta en marcha de la angiogénesis, pero también la arteriogénesis y el crecimiento de arteriolas colaterales locales. Todo ello se activa gracias a los mecanismos que ya hemos comentado: la hipoxia y la inflamación, pero también la diferenciación de células precursoras de endotelio locales.
Los fibroblastos de la zona son células activamente implicadas en estos procesos. No solo liberan citocinas proangiogénicas sino que, además, también contribuyen activamente a la revascularización diferenciándose a miofibroblastos, que sintetizarán la nueva matriz extracelular del tejido, que ocasionalmente y de forma temporal constituirá una cicatriz en sustitución de las células necróticas que han sido eliminadas.
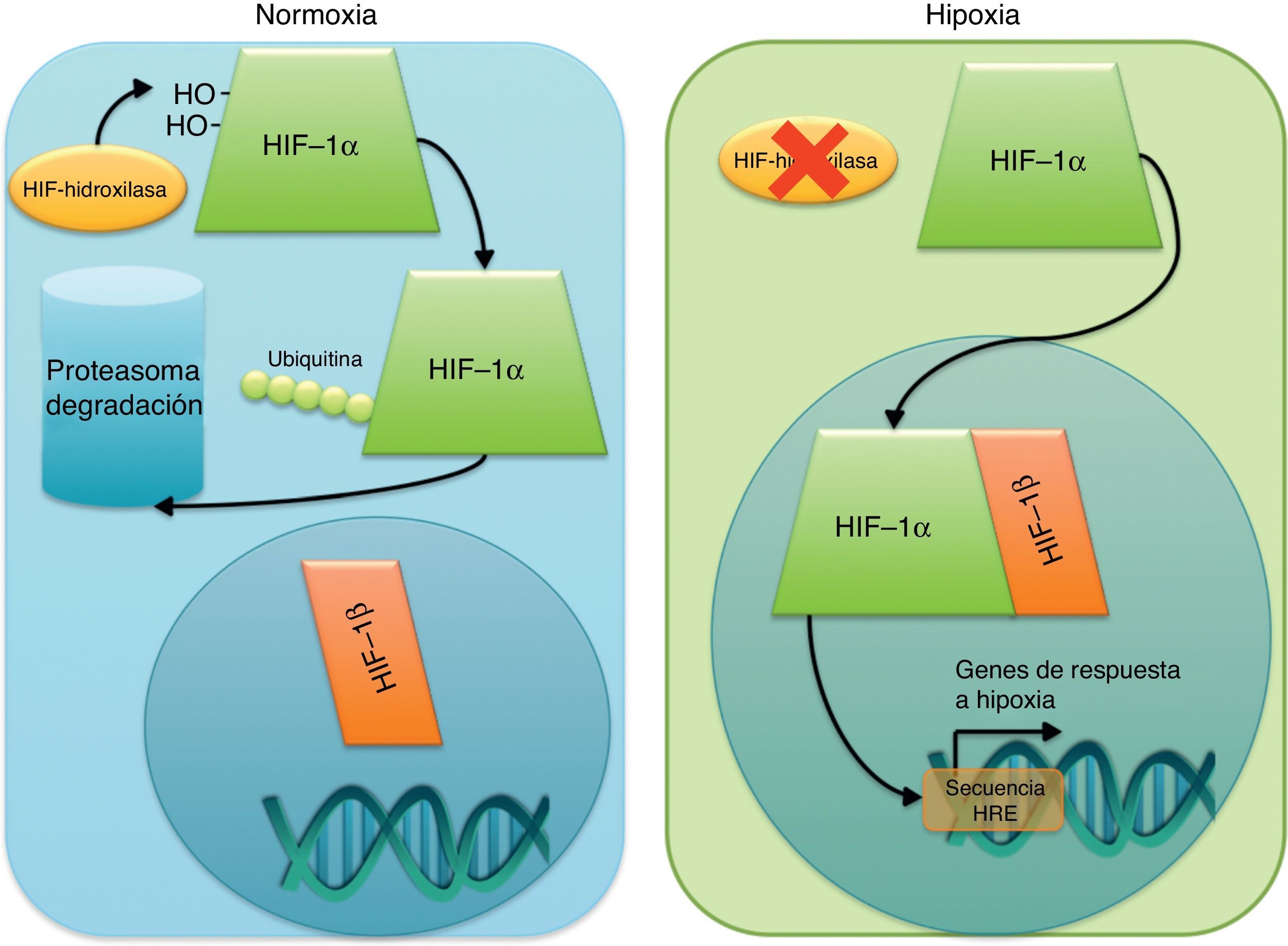
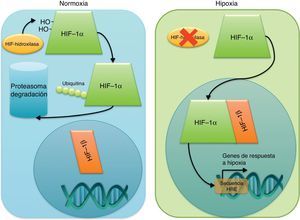
Hipoxia y revascularización del tejido postisquémico: el factor de respuesta a hipoxia 1, clave en la respuesta a la isquemiaEl factor de respuesta a hipoxia 1 en la revascularizaciónHIF-1 es un heterodímero formado por las proteínas HIF-1α y HIF-1β. HIF-1β se localiza en el núcleo de las células, mientras que HIF-1α es citoplasmático y, en condiciones normales, está siendo continuamente degradado en el proteasoma. En situación de hipoxia, la ausencia de oxígeno impide la hidroxilación de 2 aminoácidos de HIF-1α al impedir el funcionamiento de la enzima que cataliza esta hidroxilación. Así, HIF-1α no puede ser marcado para su degradación en la célula, lo que permitirá que se trasloque al núcleo y allí se una a HIF-1β, completando el dímero activo que actuará como factor de transcripción (fig. 3). HIF-1 se unirá a los promotores de genes con «secuencia de respuesta a hipoxia» (hypoxia response element [HRE]), favoreciendo o impidiendo su expresión en cada caso y respondiendo así a la carencia de oxígeno. El mecanismo detallado de activación y transporte de HIF-1 al núcleo ha sido recientemente revisado por Ahluwalia y Tarnawski13.
Mecanismos de activación de HIF1 en hipoxia. La ausencia de oxígeno impide la activación de la enzima hidroxilasa que se encarga de marcar a HIF1-α para su degradación en el proteosoma, permitiendo así su actividad como factor de transcripción que induce la expresión de los genes de respuesta a hipoxia.
La regulación de la expresión de los genes implicados en la respuesta a hipoxia por parte de HIF-1 es esencial en la coordinación de los procesos de proliferación y migración de las células endoteliales, clave en la formación de nuevos vasos sanguíneos, ya que HIF estimula reguladores de la neogénesis vascular (angiogénesis y arteriogénesis).
Entre otros, HIF estimula la expresión de VEGF. El gen que codifica para VEGF es uno de los genes que tiene promotor con secuencia HRE. Ya en 1995 Levy et al. describieron cómo su expresión aumenta durante la hipoxia e identificaron en su gen los elementos de respuesta a hipoxia responsables de este aumento14.
HIF estimula también la expresión de Eng y TGF-β. Eng y TGF-β son 2 moléculas que se han demostrado activamente implicadas en angiogénesis. Como luego detallaremos, Eng es un correceptor de membrana para los factores solubles de la familia de TGF-β. La carencia de Eng o mutaciones en su gen llevan al desarrollo de alteraciones vasculares. Además se ha descrito un aumento de los niveles de Eng y TGF-β durante las fases activas de la angiogénesis. No solo Eng sino también su ligando TGF-β tienen un promotor regulable por hipoxia gracias a la presencia de secuencias HRE, por lo que su expresión se ve aumentada en respuesta a la hipoxia. Esto se ha observado en múltiples tipos celulares, entre ellos las células endoteliales15. Además, el propio TGF-β es capaz de inducir la expresión tanto de HIF-1α como de Eng. Recientemente se ha demostrado que los ratones deficientes en Eng, Eng+/−, tienen una respuesta angiogénica deficiente en respuesta a hipoxia16, lo que coloca a Eng como una molécula esencial en la angiogénesis postisquémica.
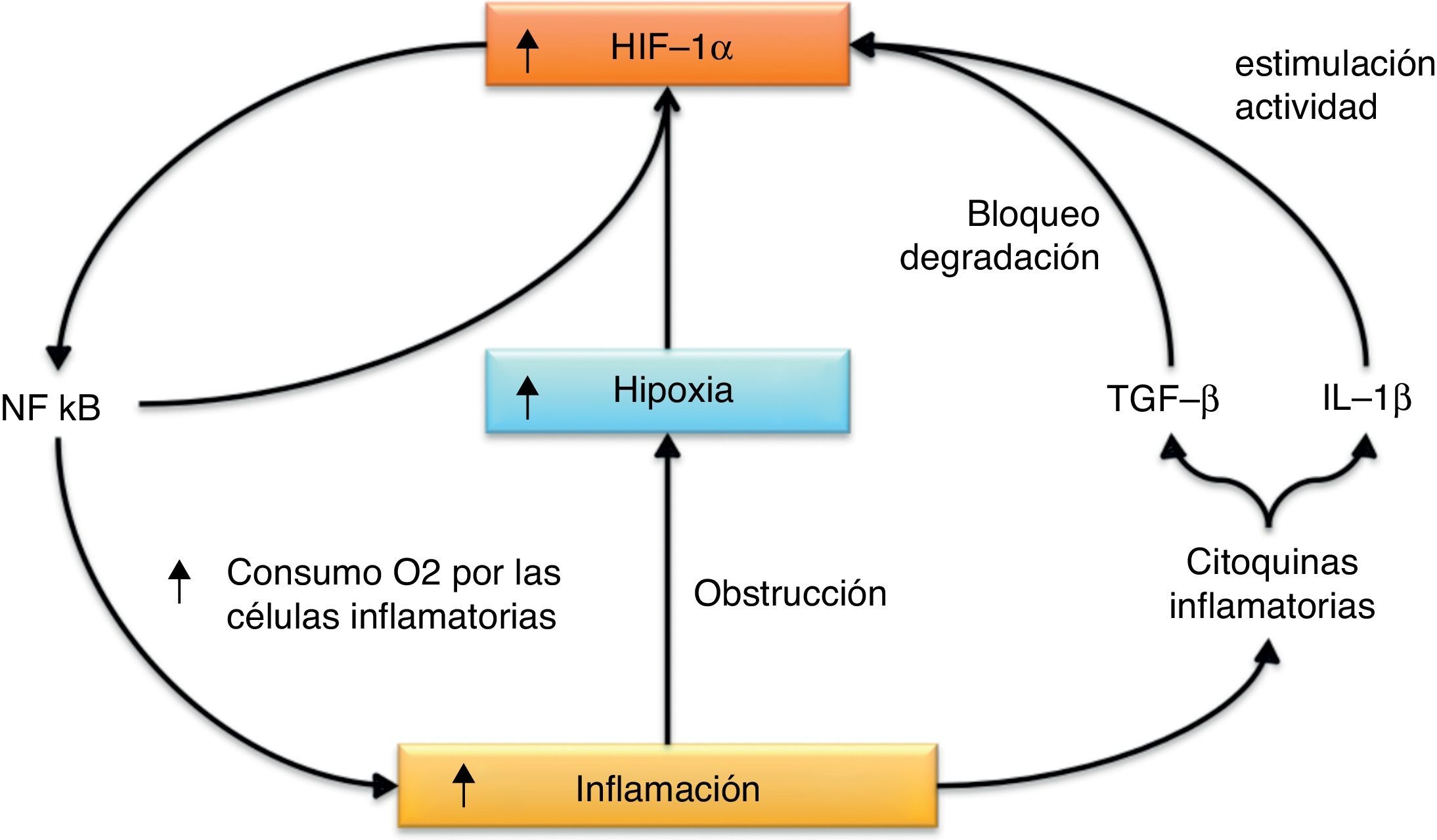
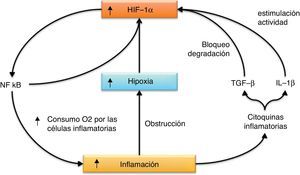
Existe una relación directa entre hipoxia e inflamaciónPor otra parte, HIF-1α también activa el factor de transcripción (nuclear factor kappa-light-chain-enhancer of activated B cells [NFκB]), una molécula clave en el control de múltiples procesos inflamatorios, y que a su vez incrementa los niveles de expresión de HIF-1α17,18. También se han descrito varias citocinas inflamatorias que favorecen la acción de HIF-1. Por ejemplo, IL-1β aumenta la actividad de HIF-119, mientras que TGF-β previene su degradación20.
Además, la inflamación por sí misma induce o agrava la hipoxia. Una excesiva inflamación y fibrosis pueden llevar al bloqueo del flujo sanguíneo a través de la microvasculatura, situación que se ve agravada por el excesivo consumo de oxígeno por parte de las células inflamatorias y del resto del tejido inflamado, que se encuentran en un estado metabólico muy activo (fig. 4). Esta relación entre hipoxia e inflamación ha sido recientemente revisada por Scholz y Taylor21, mientras que la relación entre hipoxia, HIF y VEGF y la inflamación acaba de ser revisada por Ramakrishnan et al.22.
Relación entre inflamación e hipoxia. La inflamación que se genera tras la isquemia agravará la hipoxia que esta conlleva por el efecto obstructor de la circulación sanguínea y por el aumento de consumo de oxígeno en el tejido por parte de las células inflamatorias. Además, algunas citocinas inflamatorias contribuyen a aumentar los niveles o la actividad de HIF-1α, que a su vez es capaz de activar al factor de transcripción proinflamatorio NFκB.
La interdependencia entre angiogénesis e inflamación se conoce desde hace tiempo y ya fue revisada en 1997 por Jackson et al.23. Como ya hemos visto, la isquemia conlleva frecuentemente el desencadenamiento de un proceso inflamatorio, y este a su vez juega un papel importante en la activación de todos los factores implicados en la revascularización: las células inflamatorias se encargan de la retirada del tejido dañado para permitir la formación de los nuevos vasos, proceso que estas mismas células son capaces de inducir gracias a la liberación de factores proangiogénicos y quimioatrayentes de precursores endoteliales. El papel de cada uno de los tipos de células inmunes –células mieloides, linfocitos, mastocitos, etc.– así como las citocinas que liberan y que participan en la revascularización ha sido detalladamente revisado por Silvestre et al.12.
Células madre progenitoras vasculares y revascularización del tejido postisquémicoComo hemos comentado, recientemente se han incorporado las células progenitoras vasculares como otro elemento que contribuye a la revascularización postisquémica. Los precursores de células endoteliales (endothelial precursor cells [EPC]) son células semidiferenciadas a partir de hemangioblastos que se localizan en la médula ósea y son liberadas en respuesta a ciertos estímulos, como los factores proangiogénicos VEGF, bFGF o eritropoyetina, que atraerán a estas células a la zona afectada, donde se diferenciarán a células endoteliales y colaborarán en la neovascularización. Balaji et al. han revisado este hecho de manera muy interesante24, y de forma más amplia ha sido revisado por Silvestre et al.12. Además, se sabe que el tráfico de precursores endoteliales hacia la zona isquémica es deficiente durante el envejecimiento25, lo que contribuiría a explicar el retraso en la recuperación postisquémica con la edad. Actualmente se está tratando de crear tejidos artificiales con los que regenerar la zona dañada por la isquemia, y se contempla a los EPC como una posible herramienta angiogénica terapéutica para la cicatrización de heridas o la recuperación postisquémica.
También las células madre locales pueden jugar un papel importante en la revascularización en algunos órganos. El músculo esquelético humano contiene tanto células madre multipotentes como células progenitoras, lo que facilita su capacidad de regeneración. Varios estudios en fase I y II han demostrado que el trasplante de células progenitoras derivadas de la médula ósea mejoran la angiogénesis de los miembros isquémicos y que las células satélite presentes en el músculo son la fuente de células madres residentes para este proceso26. Asimismo, las células madre y progenitores endoteliales se han demostrado como una terapia eficaz en pacientes con isquemia crónica de los miembros inferiores27.
Papel de endoglina en la angiogénesisEng, o CD105, es una glucoproteína de membrana que forma parte del complejo receptor de TGF-β. TGF-β es el representante de la superfamilia de TGF-β, que agrupa más de 40 factores solubles de crecimiento y diferenciación. La expresión de Eng es notable en el endotelio, tanto, que es ampliamente utilizada como marcador endotelial28. Son numerosas las evidencias que demuestran que Eng juega un papel muy importante en la función y homeostasis del endotelio, que posteriormente detallaremos. Se sabe que Eng es esencial en la regulación de los procesos angiogénicos, aunque aún se desconocen los mecanismos celulares que modula en cada estadio de la angiogénesis29. Además, Eng también se expresa en VSMC y en pericitos, células activamente implicadas en la angiogénesis30.
Mutaciones en el gen de Eng causan la enfermedad conocida como telangiectasia hemorrágica hereditaria de tipo 1 o síndrome de Rendu-Osler-Weber, que cursa con malformaciones arteriovenosas y otras alteraciones vasculares31. Además, los ratones a los que se les ha eliminado el gen de Eng (Eng−/−) mueren durante la gestación debido a alteraciones vasculares incompatibles con la vida32,33. Estudios llevados a cabo con ratones Eng+/− demuestran que estos ratones presentan una reperfusión deficiente tras la inducción de isquemia femoral34, así como una menor densidad de capilares tumorales y un menor crecimiento tumoral tras la generación de un tumor experimental35 y, como hemos señalado anteriormente, una respuesta angiogénica deficiente en respuesta a hipoxia16.
Además, se ha demostrado que la expresión de Eng se encuentra aumentada durante los procesos de neovascularización. Por ejemplo, se encuentran niveles de Eng aumentados en tejidos en remodelación y regeneración, así como en tumores en crecimiento36,37. Tanto es así que anticuerpos específicos frente a Eng se utilizan para el marcaje y detección de tumores38 y se ha correlacionado un marcaje de Eng más intenso con una mayor densidad de microvasos tumorales y, a su vez, con una peor prognosis39,40. Bernabeu et al.41 y Nassiri et al.6 han revisado ampliamente la relación de Eng con el diagnóstico y tratamiento del cáncer. Además, se han encontrado niveles de Eng elevados después de sufrir un infarto de miocardio. De que se produzca este aumento depende que la zona infartada se recupere correctamente a través de una angiogénesis adecuada42.
Estudios en células endoteliales han corroborado que las células con niveles más bajos de Eng se encuentran en un estado quiescente, mientras que las células que presentan niveles más elevados de Eng son activamente proliferativas36. Además, células endoteliales sometidas a un estrés por flujo, que mimetizaría las condiciones fisiológicas que se dan ante alteraciones vasculares o durante la isquemia, elevan la expresión de Eng43. Es más, TGF-β1 tiene un efecto pro-proliferativo en células endoteliales si estas tienen niveles elevados de Eng, mientras que su efecto es antiproliferativo si carecen de ella44. Asimismo, mientras que en presencia de Eng la hipoxia y TGF-β inducen proliferación endotelial, cuando las células no tienen Eng producen apoptosis45. Por todo ello, no cabe duda del papel esencial de Eng durante los procesos de formación de vasos sanguíneos. Queda por descubrir qué hace exactamente en las células endoteliales para descifrar por completo su papel en las diferentes fases de la angiogénesis. Por ejemplo, se acaba de publicar que, mientras que la presencia de Eng es indispensable para la angiogénesis dependiente de VEGF, es innecesaria para el proceso de vasculogénesis46.
Papel de endoglina en la remodelación vascularLa remodelación vascular es un importante evento que se asocia con la edad y con numerosas enfermedades, como la hipertensión arterial pulmonar o la enfermedad intersticial pulmonar. Durante la remodelación vascular tienen lugar eventos como la infiltración de células inflamatorias, una elevada proliferación celular que lleva a una hiperplasia de la íntima y la media arteriales, así como una desregulación del balance de producción/deposición de matriz extracelular frente a su degradación, incluso una calcificación de la matriz extracelular. Todo ello lleva a una modificación de la estructura de los vasos, un engrosamiento de su pared o a cambios en el calibre de la luz de los vasos47,48.
El papel de Eng en la remodelación vascular es complejo: se supone que la expresión de altos niveles de Eng en las células endoteliales vasculares es necesario para una angiogénesis activa, mientras que la expresión de niveles bajos de Eng conduce a una remodelación vascular arteriogénica49. Es interesante el hecho de que en animales KO condicionales de Eng la remodelación vascular esté alterada, y se dé un bajo reclutamiento de células de músculo liso vascular y una baja proliferación endotelial33.
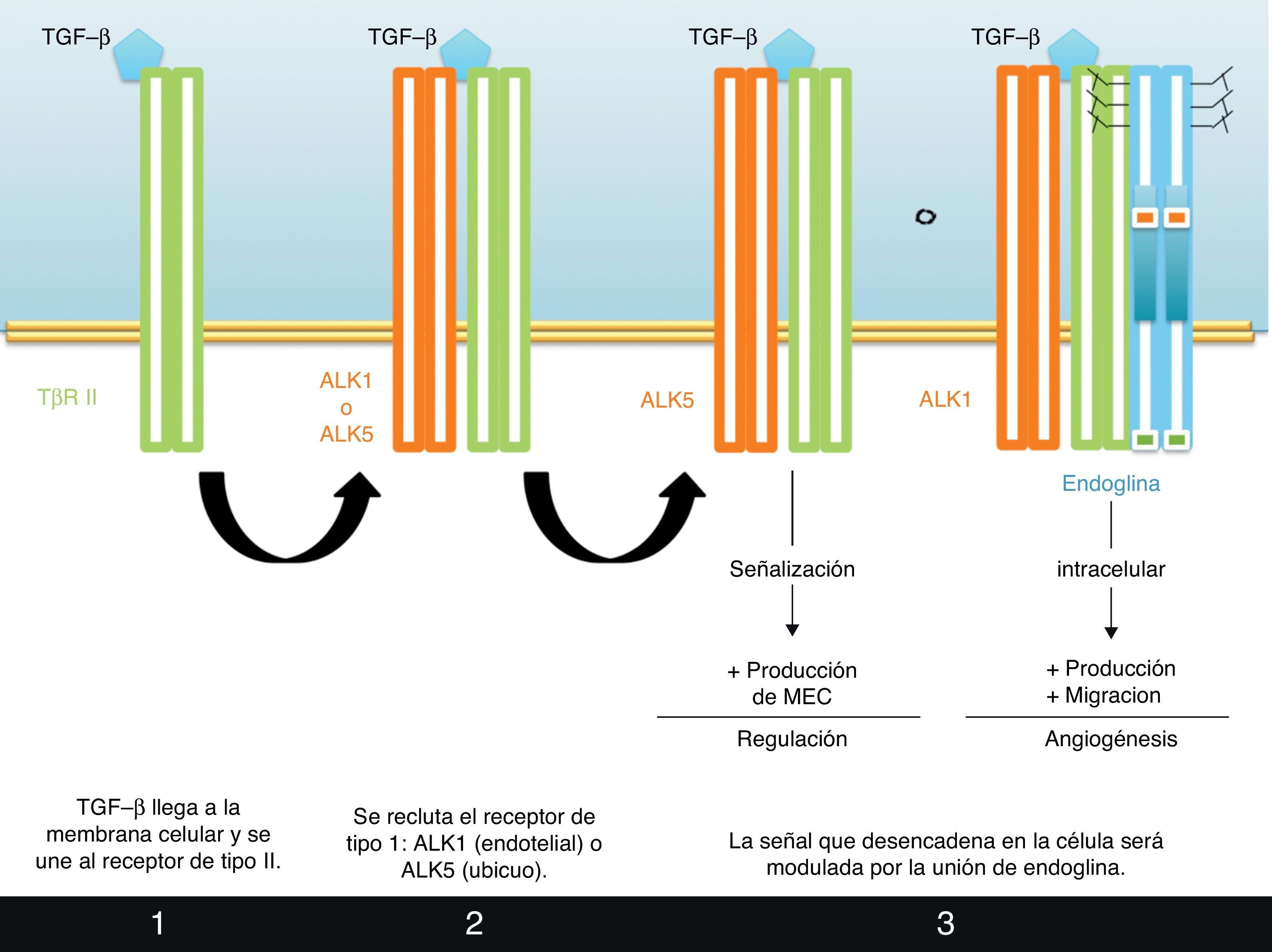
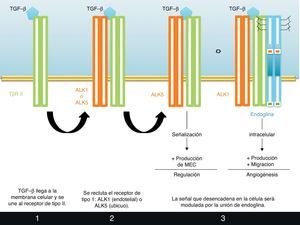
Mecanismos celulares de acción de endoglinaTGF-β ejerce su función en la célula al unirse a su complejo de receptores, del que forma parte Eng. Así, TGF-β se uniría a su receptor tipo II, tras lo que reclutaría un receptor de tipo I, que puede ser ALK1, exclusivamente endotelial, o ALK5. Eng es un receptor de tipo III que favorece la formación de complejos con ALK1.
Está aceptado que Eng ejerce un papel modulador de la acción de TGF-β durante la iniciación de la angiogénesis. Así, bajas concentraciones de TGF-β tendrían un efecto proangiogénico al señalizar vía ALK1, señal favorecida por Eng50. Altas concentraciones de TGF-β inhiben la invasión endotelial inducida por VEGF durante la angiogénesis, de manera mediada por ALK5. Así, dependiendo de si TGF-β se une a ALK1 o a ALK5, activará unas cascadas de señalización celulares u otras. Se cree que la señalización vía ALK1 favorece la proliferación y migración endoteliales, mientras que la señalización vía ALK5 inhibe la actividad endotelial y favorece la producción y deposición de matriz extracelular. Así, Eng actuaría como un modulador clave en la respuestas angiogénicas mediadas por TGF-β (fig. 5). El papel de Eng y la señalización de TGF-β en angiogénesis ha sido revisado por Ten Dijke et al.51.
Mecanismo de acción de endoglina. TGF-β se une a su complejo de receptores en la célula endotelial. De la participación de endoglina depende la señal que se desencadenará: inducción de las fases activas de la angiogénesis (proliferación y migración celular) o de las de resolución (formación de MEC, etc.).
Pero la capacidad de Eng para regular la angiogénesis no solo se debe a la regulación de la señalización intracelular. Nuestro grupo ha demostrado que Eng regula la inflamación postisquémica al regular la infiltración de leucocitos desde la sangre52. Asimismo, en otro estudio reciente en el que también participó nuestro grupo, se ha demostrado que la regulación de la infiltración de leucocitos a los tejidos desde la sangre está basada en la interacción del dominio extracelular de Eng con integrinas de los leucocitos53.
Conclusiones y perspectivasSon numerosos los eventos que tienen lugar en el tejido postisquémico, así como los tipos celulares implicados en la respuesta a la isquemia, y aún más las citocinas que regulan todos estos procesos. Los eventos postisquémicos clave son, en primer lugar, la hipoxia y la hipoperfusión, como consecuencias directas del bloqueo del flujo a través del tejido; en segundo lugar, la infiltración de células inflamatorias, que será clave para la remodelación tisular y se encuentra estrechamente ligada a la hipoxia y la angiogénesis, y por último, los procesos de formación del nuevo árbol vascular y de regeneración del tejido afectado. Por todo ello, la regulación de cada proceso a lo largo de estos estadios debe ser muy fina y precisa, para permitir en última instancia la recuperación de la función del órgano en cuestión.
Como hemos puesto de manifiesto, no hay duda de que Eng juega un papel clave en los procesos de formación de vasos sanguíneos. Tanto su presencia o ausencia, como sus niveles determinarán si se estimula o se inhibe la angiogénesis, con todo lo que ello conlleva en cada momento de la regeneración de la vasculatura tisular. Es más, nuevas evidencias demuestran que Eng está también involucrada en los procesos inflamatorios, por lo que estaríamos hablando de una molécula esencial a lo largo de todo el proceso postisquémico y no solo en su fase de resolución. Por ello, el estudio de los mecanismos exactos que Eng regula en las células, con qué moléculas interactúa y qué cascadas de señalización desencadena en cada fase de la recuperación postisquémica y la revascularización serán clave en el desarrollo de terapias con Eng como diana terapéutica, que nos ayudarán a controlar su acción en cada momento y a favorecer una rápida y eficaz recuperación de la perfusión tisular las la isquemia.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónLos estudios sobre Eng de nuestro laboratorio han sido financiados con proyectos del Ministerio de Economía y Competitividad (SAF2007-61827 y SAF2010-15881), Junta de Castilla y León (Grupo de Excelencia GR100), Red de Investigación Cooperativa en Enfermedades Renales (Red-inRen, RD06/0016/0013 y RD12/0021/0032) e Instituto Reina Sofía de Investigación Nefrológica (IRSIN) de la Fundación Renal Íñigo Álvarez de Toledo. REDINREN es una iniciativa del Instituto de Salud Carlos III (ISCIII) apoyada por fondos FEDER. Elena Núñez-Gómez está financiada por un contrato predoctoral del Ministerio de Economía y Competitividad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.