Los nuevos anticoagulantes orales (NACO) representan una alternativa eficaz a las antivitaminas K, con menor riesgo de complicaciones hemorrágicas, especialmente hemorragia intracraneal, que pueden ser manejadas de manera satisfactoria con la interrupción del fármaco y medidas de soporte. Estas características favorecen su progresiva utilización en la práctica clínica habitual. Esta revisión trata de resumir el mecanismo de acción y la farmacocinética de estos fármacos junto con la información disponible para elaborar una posible estrategia en el manejo de las complicaciones hemorrágicas en los pacientes que reciben NACO.
Novel oral anticoagulants (NOACs) represent an effective alternative to vitamin K antagonists, with a lower risk of hemorrhagic complications, especially intracranial bleeding, which can be successfully managed with drug withdrawal and supportive measures. These characteristics favor their progressive use in routine clinical practice. This review aims to summarize the mechanism of actions and pharmacokinetics of these drugs, as well as the available information to develop a possible strategy in the management of bleeding complications in those patients receiving NOACs.
Asistimos a una nueva era en el tratamiento antitrombótico con la llegada de los nuevos anticoagulantes orales (NACO). Según su mecanismo de acción, los NACO se clasifican en 2 grupos: a) inhibidores directos de la trombina (FIIa), del que solo está comercializado dabigatran etexilato; b) inhibidores directos del FXa, de los que actualmente están comercializados rivaroxaban y apixaban. Con respecto a los fármacos antivitamina K (AVK) (acenocumarol o warfarina), los NACO ofrecen numerosas ventajas, entre las cuales destacan su rápido comienzo de acción, su corta vida media y menores interacciones medicamentosas (ninguna alimentaria). Además, los NACO presentan una farmacocinética y farmacodinámica predecible por lo que no necesitan control de laboratorio para monitorizar su efecto anticoagulante. Todas estas características favorecen su progresiva utilización en la práctica clínica habitual.
Actualmente, las 3 indicaciones aprobadas en España son la profilaxis primaria de episodios tromboembólicos venosos en pacientes adultos intervenidos mediante cirugía de reemplazo total de cadera o de rodilla (dabigatran, rivaroxaban y apixaban); la profilaxis del ictus y la embolia sistémica en pacientes adultos con fibrilación auricular no valvular (dabigatran, rivaroxaban y apixaban) y el tratamiento de la trombosis venosa profunda, la prevención de trombosis recurrente y el embolismo pulmonar tras trombosis venosa profunda en adultos (rivaroxaban)1–3. En estos contextos clínicos los NACO han demostrado ser una alternativa eficaz al tratamiento con AVK.
La hemorragia representa la complicación más temida de cualquier fármaco anticoagulante. En los ensayos clínicos pivotales fase III de los NACO, la incidencia de hemorragia mayor entre los pacientes que recibieron NACO fue comparable o, incluso, inferior, a la de aquellos pacientes que recibieron tratamiento estándar4–9. Algo que parece constante con todos los NACO es la menor incidencia de hemorragia intracraneal. En un reciente metaanálisis que incluyó a casi 72.000 pacientes de 4 ensayos clínicos fase III en prevención del ictus y embolia sistémica por FA (RE-LY, ROCKET AF, ARISTOTLE y ENGANGE AF-TIMI 48), los NACO mostraron una reducción significativa del sangrado intracraneal (RR 0,48; IC 95%: 0,39-0,59). Sin embargo, los NACO presentaron un aumento significativo de la hemorragia gastrointestinal (RR 1,25; IC 95%: 1,01-1,55), en especial con dabigatran.
Los resultados comunicados en los ensayos clínicos pueden no reflejar con exactitud lo que ocurre en la práctica clínica habitual. Por ello, tanto la FDA como la EMA iniciaron una revisión de la eficacia y seguridad de dabigatran en el «real world». Los datos de estos registros demuestran que las complicaciones hemorrágicas por dabigatran, incluyendo las gastrointestinales, no son más frecuentes que las asociadas a la warfarina10,11.
ObjetivosDado que cada vez es mayor el número de pacientes que está recibiendo tratamiento con los NACO, es esencial el correcto manejo de las complicaciones hemorrágicas asociadas a estos fármacos. Sin embargo, la experiencia es escasa y la información de la que disponemos procede de modelos de experimentación animal, de pequeños estudios en sujetos sanos o de casos clínicos aislados. Además, a diferencia de los fármacos AVK, no disponemos actualmente de un antídoto específico para revertir su efecto anticoagulante.
Esta revisión trata de resumir brevemente el mecanismo de acción y la farmacocinética de estos fármacos y la información disponible para elaborar una posible estrategia en el manejo de las complicaciones hemorrágicas en los pacientes que reciben NACO.
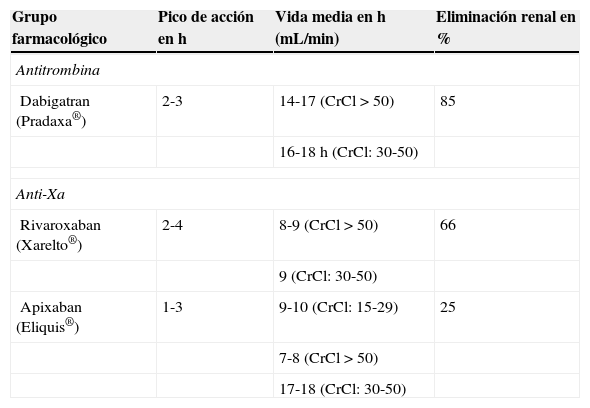
DesarrolloMecanismo de acción y farmacocinética de los nuevos anticoagulantes orales (tabla 1)Dabigatran inhibe de forma muy selectiva la trombina humana con una afinidad muy elevada e inhibe la agregación plaquetaria inducida por trombina12. Se administra como profármaco (dabigatran etexilato), el cual se convierte a su forma activa (dabigatran) in vivo12. La concentración máxima se alcanza a las 2-3 h de su administración13,14 y su vida media oscila entre 7 y 17 h13,14. La mayor parte del dabigatran administrado (80-85%) se elimina por la orina sin transformar en los pacientes con una función renal normal14,15.
Características generales de los nuevos anticoagulantes orales
| Grupo farmacológico | Pico de acción en h | Vida media en h (mL/min) | Eliminación renal en % |
|---|---|---|---|
| Antitrombina | |||
| Dabigatran (Pradaxa®) | 2-3 | 14-17 (CrCl>50) | 85 |
| 16-18h (CrCl: 30-50) | |||
| Anti-Xa | |||
| Rivaroxaban (Xarelto®) | 2-4 | 8-9 (CrCl>50) | 66 |
| 9 (CrCl: 30-50) | |||
| Apixaban (Eliquis®) | 1-3 | 9-10 (CrCl: 15-29) | 25 |
| 7-8 (CrCl>50) | |||
| 17-18 (CrCl: 30-50) | |||
Rivaroxaban y apixaban son inhibidores potentes y selectivos del FXa independientes de la presencia de antitrombina16,17. La concentración máxima de rivaroxaban en plasma se produce entre 2 y 4 h desde su administración, su vida media varía entre 6 y 13 h, y se elimina en un 33% en forma activa, en un 33% en forma inactiva por el riñón, y el resto, de forma inalterada, por vía digestiva18–20. La concentración máxima en plasma de apixaban se alcanza entre 1 y 3 h tras su administración, su vida media es de 8-13 h y el aclaramiento renal es responsable de aproximadamente el 25% del aclaramiento total y, por tanto, no se ve afectado por la insuficiencia renal leve o moderada21–23.
Actuación en las complicaciones hemorrágicas de los nuevos anticoagulantes oralesActualmente, la experiencia del manejo de las complicaciones hemorrágicas de los NACO es escasa. Al no disponer de antídoto específico, el manejo de las complicaciones hemorrágicas es similar a los protocolos de actuación ante una hemorragia secundaria a cualquier otro fármaco antitrombótico.
Nuestro principal aliado en el manejo del sangrado por NACO es la vida media corta del NACO. Así, nuestro objetivo es instaurar medidas de soporte que permitan mantener al paciente clínicamente estable hasta que desaparezca el efecto del NACO.
En un reciente estudio se evaluó el manejo y la mortalidad a 30 días de la hemorragia mayor por dabigatran. Se analizaron más de 1.200 hemorragias mayores que acontecieron en 4 ensayos clínicos (RE-LY, RE-COVER, RE-COVER II, RE-MEDY y RE-SONATE). Es muy interesante comprobar que menos del 2% de las hemorragias mayores por dabigatran requirieron agentes generadores de trombina: complejo protrombínico (CCP), complejo protrombínico activado (CCPA) o el factor VII recombinante activo (rFVIIa). En comparación con los pacientes que sufrieron hemorragias mayores asociadas a warfarina, los pacientes con hemorragias mayores por dabigatran necesitaron de manera estadísticamente significativa menos días de ingreso en UCI. Además, la mortalidad a 30 días tras una hemorragia mayor asociada a dabigatran fue menor que la que presentó la hemorragia mayor asociada a warfarina (OR: 0,66 [IC 95% 0,44-1,00]; p=0,051)24. Estos resultados reflejan que, a pesar de no disponer de un antídoto específico, las consecuencias de la hemorragia mayor asociada a NACO es similar o incluso mejor que la hemorragia mayor por warfarina.
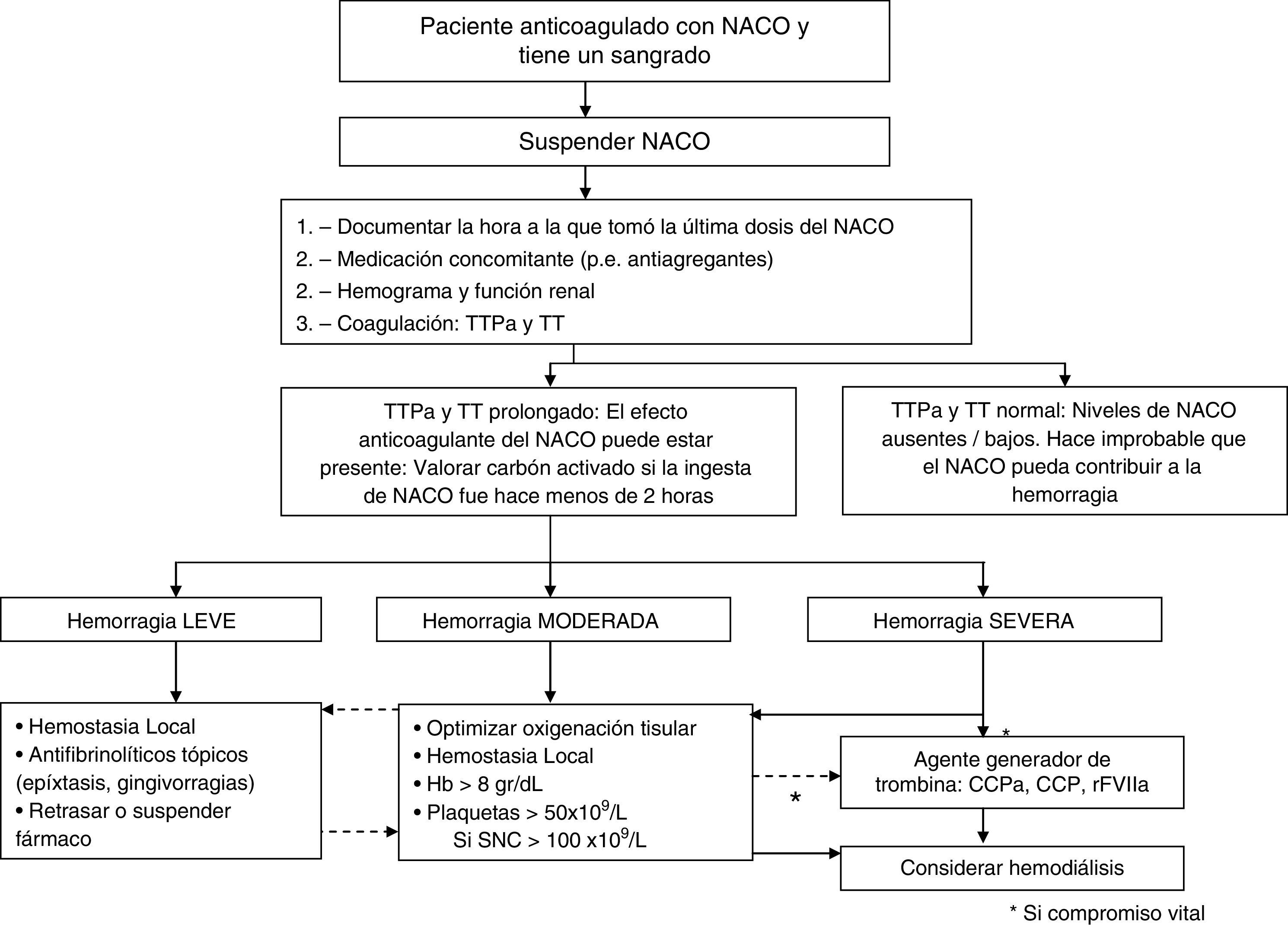
Las medidas generales ante una hemorragia en un paciente que toma un NACO incluyen (fig. 1):
- 1.
Conocer la hora de la última dosis tomada, aunque esto no siempre es posible (disminución del nivel de conciencia, dificultad comunicativa, etc.). Si la toma del fármaco se ha producido en las primeras 2 h, puede intentarse un lavado gástrico con carbón activado en hemorragias clínicamente significativas.
- 2.
Evaluar la presencia de medicamentos concomitantes que pueden aumentar el riesgo de sangrado (por ejemplo, aspirina y otros antiinflamatorios no esteroideos, clopidogrel y otros antiagregantes plaquetarios) o interferir con el metabolismo de los NACO aumentando su concentración. Inhibidores de la glucoproteína P o del CYP3A4 (como amiodarona, verapamilo, quinidina, ketoconazol, itraconazol, voriconazol, posaconazol, dronedarona, claritromicin, ticagrelor, ciclosporina, tacrolimus, dronedarona, ritonavir, rifampicina), ya que pueden aumentar las concentraciones plasmáticas de los NACO, especialmente con rivaroxaban y apixaban (dabigatran se metaboliza por el sistema del citocromo P450)1–3.
- 3.
Solicitar una analítica general con hemograma, coagulación y bioquímica (prestando especial atención a la función renal, sobre todo con dabigatran).
Dabigatran prolonga el tiempo de tromboplastina parcial activada (TTPA), el tiempo de protrombina (TP), el tiempo de trombina (TT) y el tiempo de ecarina, aunque sobre el TP el efecto es mínimo. En situaciones de urgencia, el TTPA y el TT son útiles para valorar cualitativamente la acción anticoagulante del dabigatran. En especial el TT es muy sensible. TT y TTPA son los métodos más accesibles para valorar de forma cualitativa la presencia o ausencia de efecto anticoagulante en una situación de urgencia. Un TT/TTPA en rango normal hace poco probable la presencia de dabigatran en plasma. Estos test no sirven para monitorizar la dosis o hacer una valoración cuantitativa del dabigatran en plasma. En este sentido es de utilidad el hemoclot, que es un TT diluido en plasma que utiliza calibradores de dabigatran. Su coste hace improbable su utilización en situaciones de urgencia.
Los anti-Xa prolongan el TTPA, el TP y el TT. Por tanto, estos test de coagulación básica son útiles para valorar cualitativamente la acción anticoagulante.
Los métodos cromogénicos de medición de actividad anti-Xa que utilizan calibradores específicos para cada NACO muestran una relación directamente proporcional a la cantidad de fármaco anti-Xa presente en plasma.
- 4.
Localizar la hemorragia y cuantificar su gravedad (leve, moderada, grave).
- •
Una hemorragia es moderada si se produce una reducción de la Hb ≥ 2g/dL, precisa transfusión de ≥ 2 unidades de concentrados de hematíes, o la hemorragia afecta a un área u órgano crítico.
- •
Se considera grave aquella hemorragia que produce una reducción de Hb >5g/dL, o precisa la transfusión de > 4 unidades de concentrados de hematíes, o si se trata de una hemorragia intracraneal, o aquella hemorragia que produce una hipotensión que requiere agentes inotrópicos, o la que requiere cirugía de urgencia.
- •
En caso de sangrado leve puede ser suficiente con la compresión mecánica local para controlarlo. Los antifibrinolíticos tópicos pueden ser de utilidad en la gingivorragia o la epistaxis. Debido a la corta vida media de estos fármacos, recomendamos retrasar o suspender temporalmente el fármaco y esperar a que su efecto anticoagulante desaparezca en pocas horas.
¿Qué hacer si la hemorragia es moderada?En cualquiera de estos casos se deberá notificar al hematólogo y suspender el fármaco (ya que gracias a su vida media corta, puede ser la única medida necesaria). Son fundamentales las medidas de soporte que puedan: a) garantizar un buen control hemodinámico, b) reducir la exposición al NACO y c) mejorar la hemostasia (tabla 2).
Medidas de soporte en la hemorragia asociada a los nuevos anticoagulantes orales
| Soporte hemodinámico | Reducir la exposición al NACO | Mejorar la hemostasia |
|---|---|---|
| Acceso venoso | Retrasar/suspender NACO | Compresión local |
| Expansores de volumen | Suspender AAP | Antifibrinolíticos |
| Oxigenoterapia | Carbón activado (toma del NACO<2 h) | Desmopresina |
| Corregir acidosis | Hemodiálisis (solo dabigatran) | Transfusión de plaquetas |
| Corregir hipotermia | Embolización/endoscopia | |
| Transfusión CH | Cirugía CCP/CCPA/rFVIIa |
Si la ingesta del fármaco fue hace menos de 2 h, el lavado con carbón activado puede ser útil. El uso de carbón activado se ha evaluado in vitro para reducir la absorción de dabigatran en situación de sobredosis13, demostrando que puede ser absorbido con éxito25,26. Posteriormente, estudios en modelos animales muestran que dabigatran puede ser retirado de la circulación tras una hemofiltración con carbón activado (es capaz de eliminar el 75-80% del dabigatran circulante tras una hora, con los niveles indetectables tras 2 h). Sin embargo, el filtro de carbón activado tuvo una capacidad máxima de fijación de 30mg del fármaco27. En cuanto a rivaroxaban y apixaban, no disponemos de datos que evalúen su eliminación de la circulación mediante hemofiltración con carbón activado.
Si el paciente continúa sangrando, o se trata de un sangrado grave con compromiso hemodinámico, o incluso vital, puede ser necesario el tratamiento hemostático con agentes generadores de trombina: CCP, CCPA o rFVIIa. Se ha indicado que, en caso de dabigatran, podría ser más útil el rFVIIa o el CCPA. Como solo disponemos de estudios en modelos animales o estudios ex vivo y dado que estos productos presentan una tasa no despreciable de eventos tromboembólicos, se recomiendan su uso solo en la hemorragia vital28.
¿Qué hacer ante una hemorragia grave?En estos casos se debe proceder como en el caso de la hemorragia moderada.
Si la hemorragia es secundaria a dabigatran, puede dializarse al paciente durante 4 h o hacer hemofiltración con carbón activado. La unión de dabigatran a las proteínas plasmáticas humanas es baja (∼35%), por lo que puede ser eliminado de la circulación mediante hemodiálisis29,30. De hecho, con un flujo de dializado de 700ml/min, la concentración plasmática de dabigatran se reduce un 50-60% dentro de las 4 primeras horas de hemodiálisis, y podría ser una opción eficaz en caso de sobredosis por dabigatran31. Un estudio reciente in vitro e in vivo en un modelo porcino mostró que dabigatran podía ser eliminado de la circulación mediante hemodiálisis en función del flujo de dializado, alcanzando una meseta a 300ml/min. Con este flujo, los niveles de dabigatran fueron indetectables tras 2h27. Dos casos clínicos recientemente publicados también han mostrado que la hemodiálisis puede ser eficaz para reducir los niveles de dabigatran y ayudar al manejo de la hemorragia intracraneal en pacientes tratados con dabigatran32,33. Sin embargo, el uso de altas dosis de rFVIIa32 y de CCPA33 previamente a la hemodiálisis dificulta la valoración de su eficacia real. La principal complicación de la hemodiálisis en pacientes que toman dabigatran es la hemorragia asociada al catéter central.
En caso de hemorragia grave con compromiso vital que no responde a las medidas previas podemos utilizar agentes generadores de trombina.
El CPP contiene 3 o 4 factores de la coagulación de la vitamina K dependientes no activados (II, IX y X o II, VII, IX y X) y una cantidad variable de proteína C y S. El objetivo del CCP es contribuir a la generación de trombina mediante el aporte de forma rápida de gran cantidad de factores de la coagulación mientras se produce la eliminación del fármaco. Un modelo murino de hemorragia intracraneal asociada a dabigatran demostró que la administración de CCP puede prevenir el crecimiento del hematoma intracraneal de una manera dosis-dependiente y reducir la mortalidad34. En un estudio doble ciego, controlado con placebo, de voluntarios sanos que recibieron dabigatran (150mg 2 veces al día durante 2,5 días) seguido de la administración de CCP a 50 UI/kg, el tratamiento con CCP no corrigió los tiempos de coagulación. Por el contrario, en aquellos sujetos sanos que recibieron rivaroxaban (20mg diarios durante 2,5 días) la administración de CCP sí corrigió la prolongación del TP y la alteración en el potencial endógeno de trombina35.
En modelos animales el CCPA o factor eight inhibitor bypassing activity (FEIBA) ha demostrado una reducción del sangrado inducido por dabigatran36. En comparación con CCP, el CCPA fue más eficaz en corregir los tiempos de coagulación tras la exposición a dabigatran en sujetos sanos37. Por otro lado, el CCPA fue capaz de corregir el efecto anticoagulante de altas dosis de rivaroxaban en modelos animales38. Datos de estudios in vitro sugieren que CCPA también es capaz de corregir algunos parámetros de los test de coagulación inducidos por apixaban39.
Otra alternativa es la administración de rFVIIa. El rFVIIa interacciona con el factor tisular en el endotelio expuesto en la zona dañada, de tal modo que el complejo rFVIIa-factor tisular inicia la cascada de la coagulación hasta la generación de trombina, y finalmente la formación del coágulo de fibrina. Estudios en modelos animales y en sujetos sanos muestran resultados contradictorios para revertir los efectos anticoagulantes de dabigatran utilizando altas dosis de rFVIIa37,40. Recientemente se han comunicado varios casos apoyando el uso de rFVIIa para controlar el sangrado en pacientes tratados con dabigatran. El primer caso clínico publicado fue el de un paciente de 79 años y 80kg de peso, que sufrió una hemorragia grave con compromiso vital tras cirugía cardiaca. La administración de 3 dosis de rFVIIa a 2,4mg no controló el sangrado; sin embargo, tras 2 dosis adicionales de 7,2mg el sangrado se redujo de > 1.500ml/h a ∼800ml/h32. Otro caso de un paciente de 76 años con una hemorragia intracraneal espontánea mostró que una dosis única de rFVIIa a 90μg/kg normalizó el TTPA y corrigió las alteraciones en los test de generación de trombina y de tromboelastografía alrededor de 45 min después de la administración de rFVIIa. Sin embargo, el efecto de rFVIIa fue solo parcial y temporal, indicando que puede ser necesaria la administración de dosis múltiples41. En la misma línea, el rFVIIa presenta resultados contradictorios para corregir los tiempos de coagulación tras la exposición a rivaroxan o apixaban39,40,42.
En resumen, el uso de CCPA a dosis de 80 UI/kg o rFVIIa son débilmente preferibles al CCP para revertir la hemorragia asociada a dabigatran, mientras que el CCP (50 UI/kg) es preferible a CCPA para revertir la hemorragia asociada a rivaroxaban o apixaban. Debido a que los modelos animales o los estudios en voluntarios sanos no representan fielmente los eventos hemorrágicos graves en humanos, solo se puede recomendar su uso en la hemorragia vital asociada a NACO. Además, hay que tener en cuenta el mayor riesgo de eventos tromboembólicos de los fármacos generadores de trombina en pacientes con sangrado asociado a fármacos AVK43, en especial con rFVIIa.
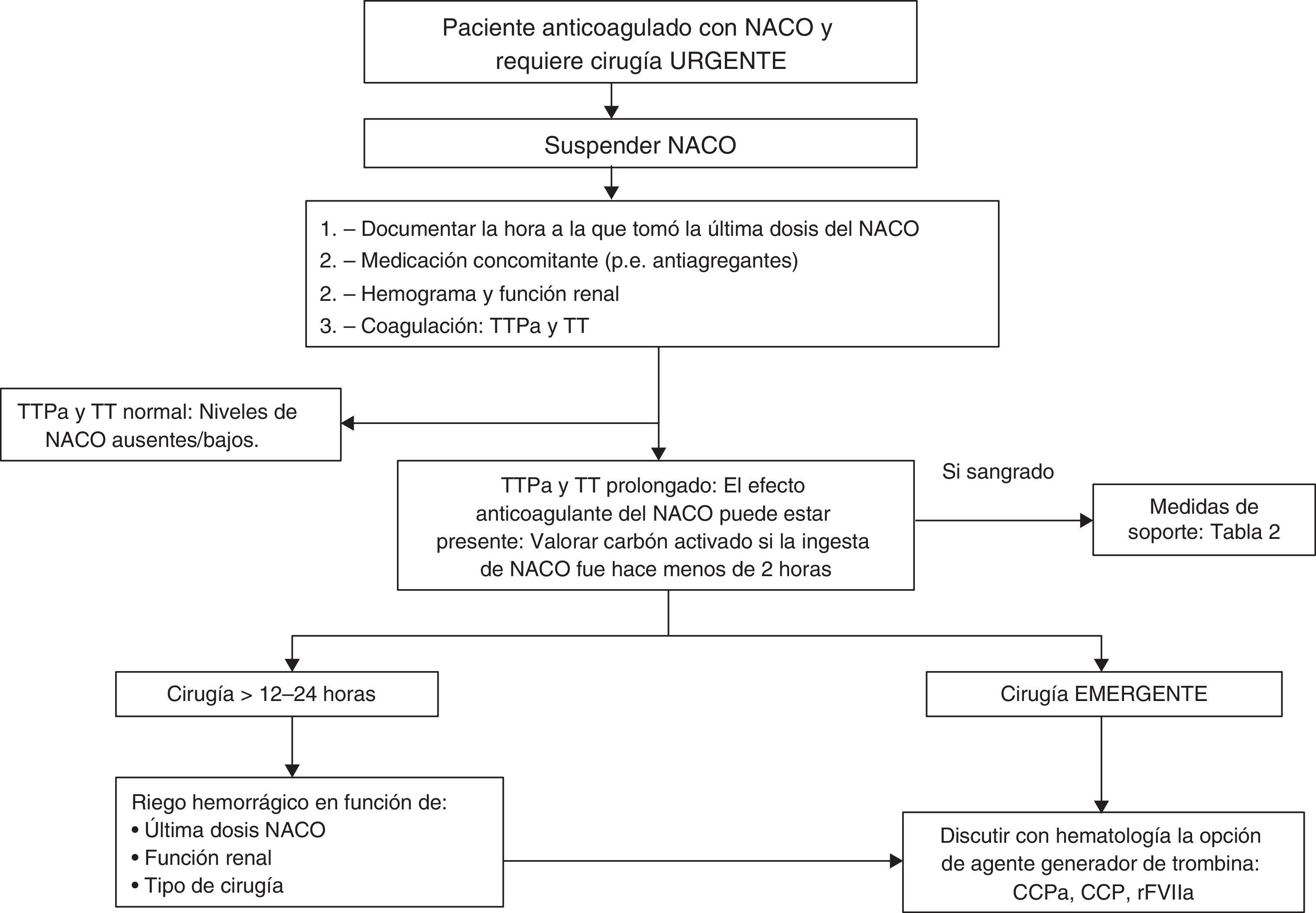
¿Qué hacer ante un paciente que toma un nuevo anticoagulante oral y requiere cirugía urgente?En pacientes que toman NACO y requieren cirugía urgente, es fundamental realizar un consenso entre cirujano, anestesiólogo y hematólogo. Un estudio basal de TTPa y TT normal sugiere un riesgo hemorrágico bajo. Por el contrario, unos tiempos de coagulación prolongados pueden reflejar la presencia del NACO. En este caso, conviene discutir la posibilidad de retrasar la cirugía 12-24 h, que pude ser un margen de seguridad para pacientes con función renal normal. Si la cirugía es urgente, se debe discutir la utilidad de emplear fármacos generadores de trombina (figura 2).
La anestesia neuroaxial debe evitarse en pacientes que requieren cirugía en las 24-48 h tras la última toma del fármaco, incluso con tiempos de coagulación normales.
ConclusiónLos NACO representan una alternativa eficaz a las AVK con menor riesgo de complicaciones hemorrágicas, especialmente hemorragia intracraneal, que pueden ser manejadas de manera satisfactoria con la interrupción del fármaco y medidas de soporte. El uso de agentes generadores de trombina debería reservarse para casos de hemorragia vital.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.