Resumen. Introducción. La cirugía endovascular del aneurisma de aorta abdominal (EVAR) está suponiendo un cambio en los procedimientos terapéuticos en la cirugía vascular. Su menor agresividad hace que se indique preferentemente en pacientes de alto riesgo quirúrgico. Frecuentemente, es necesario modificar la anatomía del aneurisma para hacerlo compatible con una EVAR. El procedimiento más frecuente es el de excluir las arterias hipogástricas (AH), especialmente ante la presencia de aneurismas ilíacos. De este modo se evitarían las endofugas tipo II por reentrada a partir de la AH. Objetivo. Profundizar en las técnicas de exclusión de las AH, sus resultados, complicaciones y la etiopatogenia de la isquemia pélvica secundaria. Desarrollo. Del análisis de la literatura publicada respecto a estos temas emergen los resultados, y los más destacables son los siguientes: casi en el 15% de los pacientes candidatos a EVAR hay que considerar la exclusión de, al menos, una AH; la exclusión de la AH, aun siendo bilateral, no se sigue de las catastróficas consecuencias observadas en la cirugía abierta; la colateralidad pélvica es fundamentalmente ipsilateral; la claudicación glútea es la complicación más frecuente; y la cobertura simple es segura y eficaz. Conclusión. La exclusión de una o ambas AH incrementa el porcentaje de pacientes candidatos a EVAR, pero aumenta en éstos la tasa de complicaciones isquémicas. [ANGIOLOGÍA 2008; 60:1–15]
Summary. Introduction. Endovascular repair of the abdominal aortic aneurysm (EVAR) is bringing about a change in the therapeutic procedures used in vascular surgery. The fact that it is less invasive means that it is especially indicated in high surgical risk patients. The anatomy of the aneurysm often has to be modified to make it compatible with EVAR. The most common procedure consists in excluding the hypogastric arteries (HA), particularly in the presence of iliac aneurysms. By so doing, type II endoleaks due to re-entry from the HA can be avoided. Aim. To further our knowledge of the techniques for excluding HA, their outcomes, complications and the aetiopathogenesis of secondary pelvic ischaemia. Development. The most significant results found in an analysis of the literature published on these issues are as follows: in almost 15% of patients who are candidates for EVAR it must be taken into account that at least one HA will have to be excluded; the exclusion of the HA, even if it is bilateral, is not followed by the catastrophic consequences observed in open surgery; pelvic collaterality is essentially ipsilateral; buttock claudication is the most frequent complication; and simple coverage is safe and effective. Conclusions. The exclusion of one or both HA increases the percentage of patients who are candidates for EVAR, but raises the rate of ischaemic complications they experience. [ANGIOLOGÍA 2008; 60: 1–15]
Tras cincuenta años de perfeccionamiento de las técnicas quirúrgicas convencionales, una nueva herramienta, basada en el catéter, complementa el armamento terapéutico disponible. La cirugía endovascular se inició en las salas de radiología en los años ochenta, pero quizá el salto definitivo lo dio en 1991 Juan Parodi [1], cuando completó en Buenos Aires la primera reparación endovascular de un aneurisma de aorta abdominal (AAA). La mayoría de los autores coincide en que este hecho supuso el inicio de la era de la terapéutica endovascular [2], caracterizada por ser menos invasiva.
Diversos estudios aleatorizados han demostrado cómo la reparación endovascular del AAA (EVAR) conlleva unas tasas de mortalidad menores que las de la cirugía abierta [3, 4]. Pero estas técnicas se asocian a seguimientos más exhaustivos (y costosos) y a una alta tasa de procedimientos secundarios [3, 5] para asegurar la ausencia de complicaciones. Los datos que han surgido del estudio EVAR-1 ponen de manifiesto la pérdida de la ventaja a largo plazo de la técnica EVAR, dado que a cuatro años la tasa de complicaciones en el grupo de tratamiento endovascular era del 41% frente al 9% de la cirugía abierta [6]. Incluso se cuestiona la baja mortalidad perioperatoria de la EVAR tras los datos del estudio EVAR-2, que mostró una mortalidad del 9% a los 30 días del procedimiento [7].
La reparación, quirúrgica o endovascular, de los AAA se consideran procedimientos profilácticos en el que cualquier tasa de riesgo debe referirse al riesgo de ruptura. Son los pacientes portadores de AAA de más de 5,5cm relativamente sanos los que se benefician de la corrección del aneurisma. Como la reparación endovascular ofrece menor trauma quirúrgico [8] (pérdida de sangre, duración de la intervención, alteración de la perfusión y ventilación), se ha postulado como el tratamiento de elección en pacientes de alto riesgo [9].
Sin embargo, los procedimientos EVAR se han popularizado de tal modo que, en muchos servicios, han superado a los procedimientos abiertos. Los motivos escapan a la intención de esta revisión. Esta situación puede suponer la pérdida de la ventaja de la menor morbilidad de las EVAR, cuando se aplican de forma indiscriminada a cualquier tipo de paciente independientemente de su riesgo quirúrgico [10]. Y este hecho se agrava cuando es necesario modificar la anatomía de un AAA para hacerlo compatible con una reparación endovascular.
La ausencia de cuello proximal se puede obviar con el uso de prótesis fenestradas [11]. Los problemas de angulación excesiva en cuello o tortuosidad de las ilíacas se superan con los dispositivos actuales, que son más flexibles y permiten una mejor navegación. La ausencia de una zona adecuada para el anclaje distal en la ilíaca común se soluciona extendiendo la endoprótesis hasta la ilíaca externa. Es en estos casos en los que, para evitar la potencial aparición de una endofuga tipo II por reflujo desde la ilíaca interna, se indica su exclusión. La oclusión de la arteria hipogástrica (AH) mediante tecnología basada en catéter ya la describió Parodi [12] en los albores de la cirugía endovascular del AAA. La exclusión de la AH se puede realizar de forma aislada por métodos endovasculares o mediante ligadura quirúrgica seguida o no de revascularización. Estos procedimientos auxiliares han aumentado el numero de pacientes candidatos a EVAR hasta en un 16% [13].
En esta revisión se comenta el estado actual de las indicaciones, técnicas, resultados y complicaciones de los distintos procedimientos de exclusión de la AH en el contexto de la reparación endovascular del AAA.
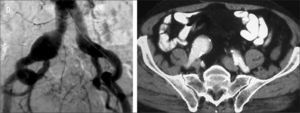
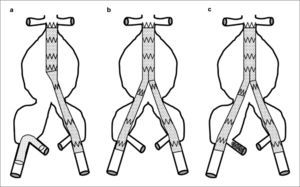
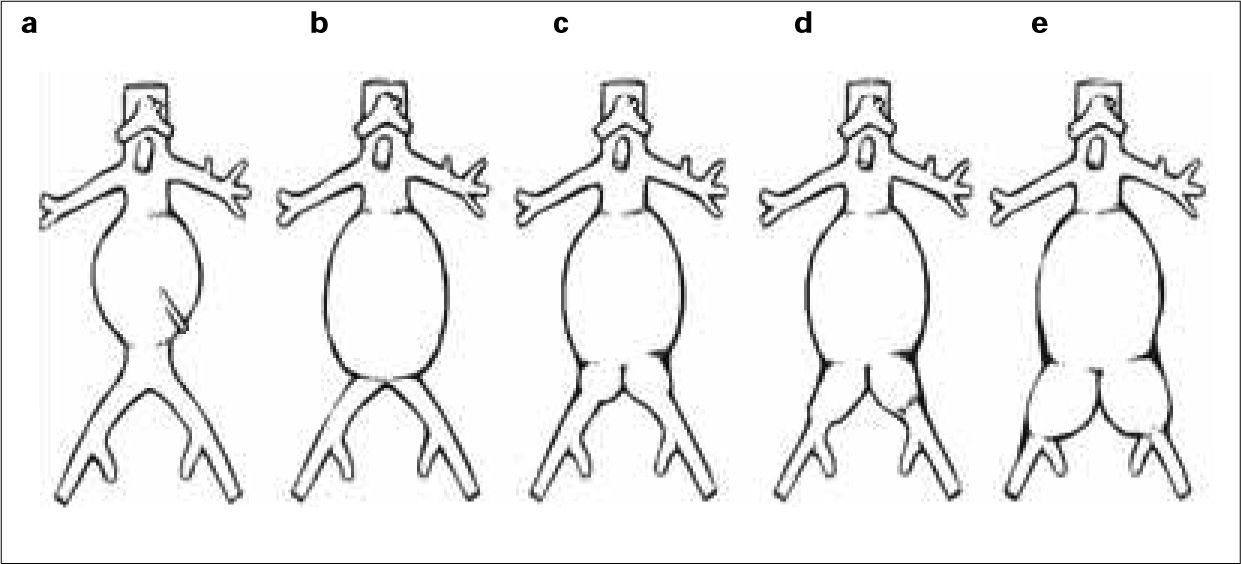
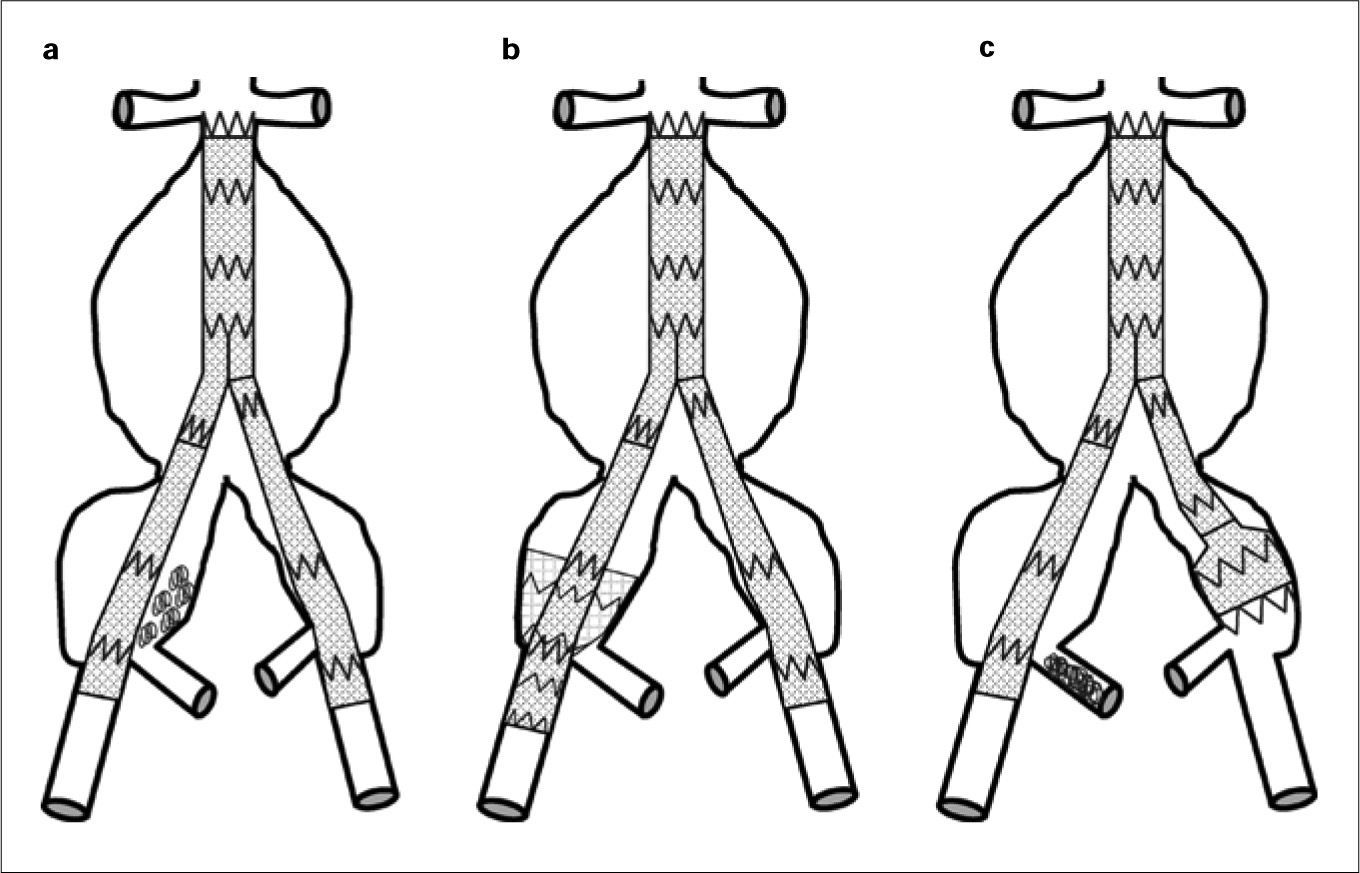
Tipos de aneurismasEl estudio más extenso de los hasta ahora publicados es el registro EUROSTAR. En él se propone una clasificación de los AAA en función del grado de afectación aneurismática de los ejes ilíacos (Fig. 1) [14]. Son los aneurismas tipo D y E los que plantean problemas. La opción de la cobertura simple de la hipogástrica es posible y efectiva cuando se dan dos condiciones anatómicas simultáneas: la existencia de cuello distal en la arteria ilíaca común donde anclar el final de la endoprótesis [15], y que el ostium de la AH se sitúe en una zona no dilatada de la ilíaca común, de modo que la endoprótesis cubra realmente su inicio (Fig. 2). Estas condiciones se suelen dar en los AAA tipo D [16].
Clasificación de los aneurismas de aorta abdominal propuesta por el registro EUROSTAR según el grado de afectación de los ejes ilíacos. En los tipos A, B y C, las ramas ilíacas de la endoprótesis se pueden anclar en la ilíaca común respetando su bifurcación. En el tipo D, la zona de anclaje en la ilíaca común puede no ser suficiente y dependerá de las condiciones anatómicas para hacer necesaria la exclusión de la arteria hipogástrica. En el tipo E, el anclaje en la ilíaca externa y la exclusión de la arteria hipogástrica son obligatorios (modificado de [14] y [16]).
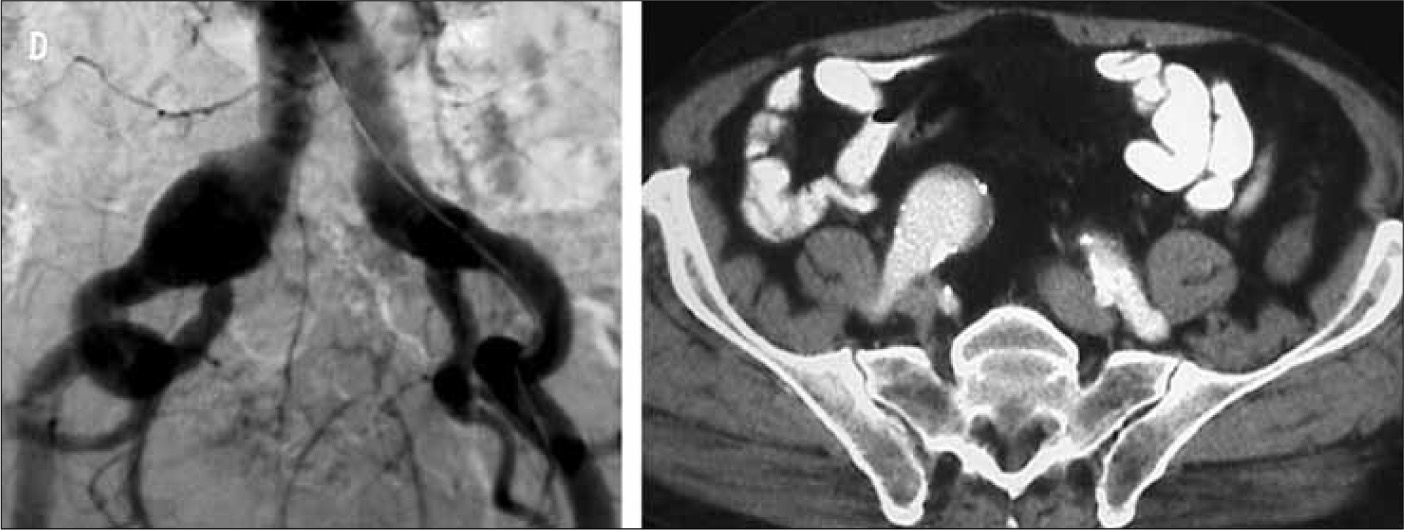
Paciente portador de aneurisma de aorta abdominal, aneurisma de ilíaca común derecha de 34mm de diámetro y ectasia de ilíaca común izquierda de 24mm. Según la clasificación propuesta por el registro EUROSTAR, se trataría de un aneurisma aortoilíaco asimétrico tipo E en el lado derecho y tipo D en el lado izquierdo. Dada la anatomía de la bifurcación ilíaca derecha, en este caso es obligatorio excluirla antes de proceder al implante de EVAR. En el lado izquierdo, las opciones pueden ser conservar la arteria hipogástrica utilizando la técnica de bell-bottom o excluirla. Si se opta por la segunda opción, se podría intentar cobertura simple, embolización selectiva, embolización no selectiva o tunnel-graft.
Sin embargo, en los portadores de AAA tipo E de esta misma clasificación, o en los de aneurismas aislados de ilíaca común o combinados de arterias ilíaca común-ilíaca externa, los cuellos para anclaje están muy alejados del ostium de la AH, por lo que se precisan otras técnicas de exclusión de la AH.
El dato de la anatomía del aneurisma no se refiere en otras grandes series americanas o europeas; el porcentaje de AAA tipo D y E supera el 15% del total de pacientes tratados mediante EVAR en el registro EUROSTAR [16].
La frecuencia con la que es necesaria la exclusión de la AH varía entre los estudios entre el 5-42%, y la tasa del 10-15% es la más referida [17-19].
Tipos de endofugas y tasasLos detalles de los distintos tipos de endofugas y sus tasas de presentación escapan a la intención de este artículo, pero, en relación con este tema, la razón para excluir la AH es para evitar el flujo periprotésico a partir de la AH que determinaría una endofuga tipo II. No todas las endofugas tipo II se originan a partir de la permeabilidad de una AH. El registro EUROSTAR (con 3.264 pacientes tratados) mostró la presencia de 191 fugas tipo II. Es destacable cómo en el 85,9% de estos casos el origen era la permeabilidad de una AH.
Sin embargo, la endofuga de tipo II conlleva una tasa de ruptura acumulada baja, del 1,8% por endofuga, año y paciente [20].
Opciones de exclusiónLos procedimientos de exclusión de la AH se pueden clasificar en dos tipos: los que conservan flujo, de los cuales la ligadura quirúrgica seguida de revascularización es el más frecuente; y los que se basan en la oclusión sin revascularización.
Exclusión de la ilíaca interna con conservación de flujoLigadura quirúrgicaGeneralmente se indica cuando hay intención de revascularizar la AH. Los métodos son variados y básicamente consisten en la ligadura y transeccion de la AH en su origen mediante abordaje retroperitoneal.
El flujo se puede restaurar de diversos modos mediante reanastomosis del tronco de la AH en la ilíaca externa [21], aunque la técnica más utilizada es la de la interposición de un bypass terminoterminal a la AH y terminolateral a la ilíaca externa [22, 23]. También se ha descrito, en el caso de endoprótesis aortounilíaca, tomar como dadora el bypass femorofemoral [24].
Estos procedimientos tienen la ventaja teórica de mantener el flujo en la pelvis de al menos una AH, pero un reciente trabajo ha mostrado cómo se incrementa el tiempo quirúrgico en el doble frente a la embolización simple, y la pérdida sanguínea en un 170% [25]. En esta misma serie, se refiere que la tasa de complicaciones isquémicas pelvianas es muy parecida entre el grupo de bypass y el de embolización. En cuanto a las tasas de permeabilidad de estos bypass, oscilan entre el 100% [23, 24] y el 91% [24]. Sin duda es un procedimiento efectivo, pero que incrementa la complejidad de la técnica endovascular y sus posibles complicaciones [26].
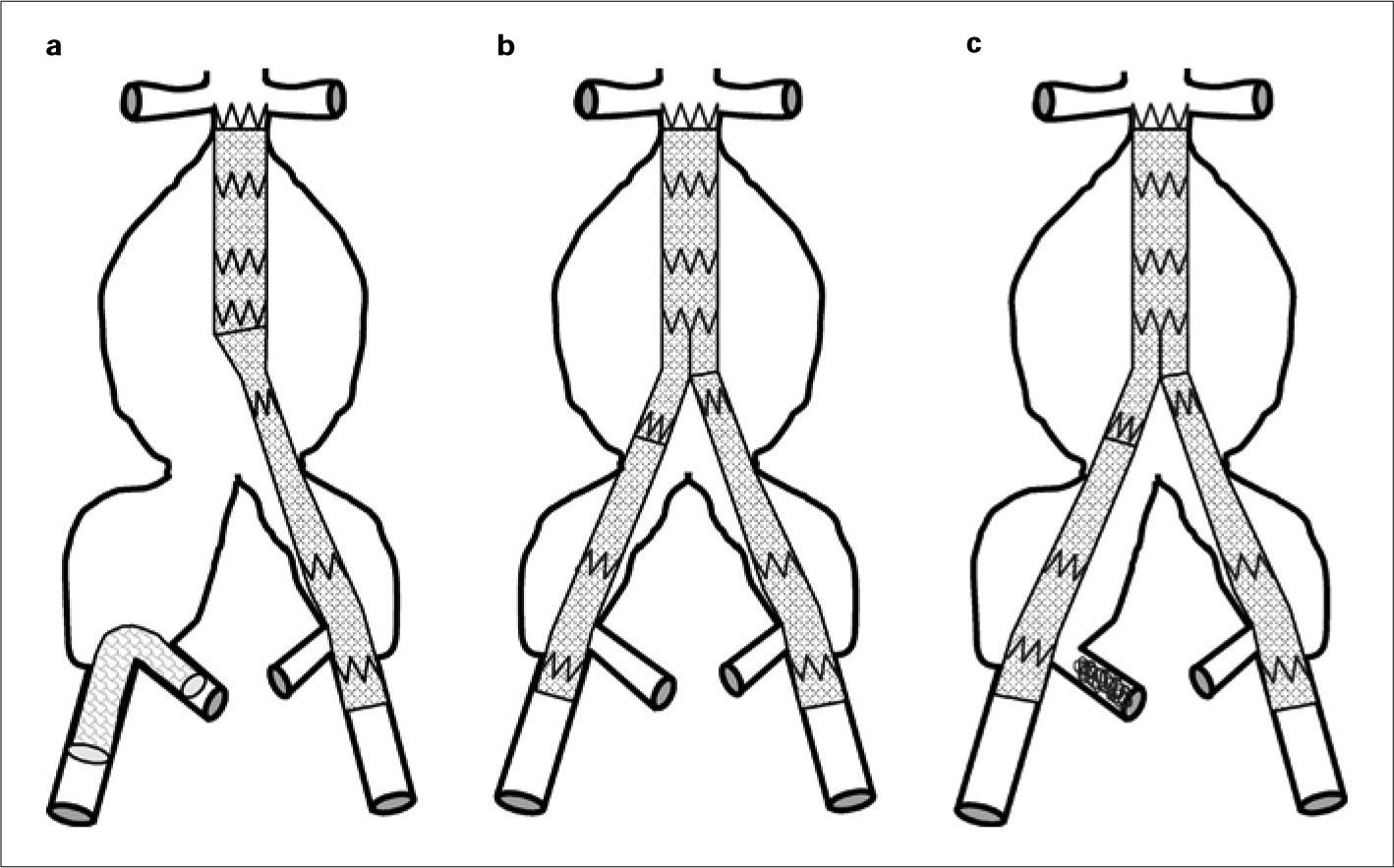
Conservación del flujo mediante endoprótesis externa-internaDescrita por primera vez en el año 2000 [27], consiste en la colocación de un stent recubierto entre la ilíaca externa y la AH (Fig. 3a). Evidentemente, se bloquea el flujo de ese eje ilíaco y se realiza en casos de endoprótesis aortomonoilíaca y bypass femorofemoral. Las series son muy cortas, pero ofrecen elevadas tasas de permeabilidad. Incrementan el tiempo quirúrgico y la pérdida sanguínea [28], pero quizá su principal inconveniente radica en que sólo es aplicable en casos de endoprótesis aortomonoilíacas, que, aunque han demostrado un excelente comportamiento a medio plazo [29, 30], conllevan la realización de un bypass extraanatómico. Tampoco hay datos referidos a la permeabilidad a largo plazo de los stents recubiertos que se colocan con una angulación muy pronunciada y que no se han diseñado para adoptar esa configuración de manera permanente.
Técnicas de exclusión de la arteria hipogástrica: a) Conservación del flujo en la arteria hipogástrica derecha mediante endoprótesis de ilíaca externa a interna. La EVAR aortomonoilíaca se complementa con bypass femorofemoral izquierdo-derecho; b) Cobertura simple bilateral; c) Embolización selectiva de la ilíaca derecha mediante coils y cobertura simple contralateral. Dibujo del autor.
Como técnica quirúrgica, estaría indicada en el caso de imposibilidad de obliteración de la AH por otras técnicas menos invasivas. También se ha descrito la ligadura mediante abordaje laparoscópico [31]. La mayoría de los procedimientos están en la esfera de la cirugía endovascular.
Cobertura simpleEs la técnica más simple, y consiste en cubrir el ostium de la AH mediante la rama de la endoprótesis aortoilíaca (Fig. 3b). Además de las condiciones referidas anteriormente, otros autores consideran, en aras de la efectividad de la técnica, las siguientes circunstancias [32]: ostium pequeño o estenótico de la AH, ausencia de aneurisma en el origen de la AH y diámetro de la rama de la endoprótesis adecuado para que, al apoyarse en la pared de la ilíaca común, oblitere el inicio de la AH. Una situación particular se produce en el caso de aneurisma de la ilíaca común y presencia de trombo. La cobertura simple se haría sobre el trombo y no sobre la pared de la arteria. Estos condicionantes no se recogen en los trabajos publicados y pueden estar en el origen de algunas endofugas tipo II en las que se había hecho cobertura simple de la AH. Casi ningún aneurisma del tipo E presenta condiciones anatómicas favorables para la cobertura simple.
Por otra parte, un estudio anatómico reveló que el diámetro medio de las ilíacas comunes en los pacientes portadores de AAA era de 17mm, frente a los 12,5mm de las ilíacas en un grupo poblacional ajustado por edad [33]. Según estos autores, sólo se puede considerar aneurisma ilíaco cuando el diámetro es superior a 24mm. Esta situación supone más dificultad para la cobertura simple.
Los resultados de esta técnica son buenos en cuanto a su capacidad de evitar endofugas [34, 35], pero su ventaja radica en que tiene menos complicaciones isquémicas en comparación con la embolización con coils, y la tasa de endofugas es similar con ambas técnicas [34, 36]. Se ha referido que hasta dos de cada tres pacientes con necesidad de exclusión de la AH se pueden beneficiar de esta técnica.
Embolización selectivaLa liberación de coils en la AH inducirá la trombosis de la misma (Fig. 3c). Es una técnica antigua que se realiza en casos de tumoraciones pelvianas, para reducir el tamaño previo a exéresis o en hemorragias incoercibles pelvianas (obstétricas, traumáticas o quirúrgicas).
La técnica en sí consiste en: abordaje generalmente contralateral de la ilíaca común, en casos en los que no existan demasiadas tortuosidades o grandes aneurismas ilíacos, cateterización de la AH, avance del catéter en el tronco de la AH y liberación de coils del tamaño necesario como para que no se desplacen a las ramas de la ilíaca interna. En la mayoría de los casos en los que es necesario embolizar la AH, las condiciones anatómicas pueden dificultar enormemente su cateterización. En estos casos, algunos autores recomiendan el abordaje femoral ipsilateral y disponer de una amplia gama de catéteres con distintas curvas [32]. El abordaje braquial es necesario en algunas ocasiones, pero supone navegar por las diversas tortuosidades de la aorta torácica y del aneurisma abdominal. Una vez posicionado el catéter, al menos 1cm, en la AH, y estando estable, se procede a la liberación de coils. Es importante utilizar un diámetro lo suficientemente grande como para que los coils no se desplacen a las ramas de la hipogástrica. Los diámetros más frecuentes van de 5 a 10mm. El numero de coils que hay que liberar es variable, y es un dato que se obvia frecuentemente en la literatura; normalmente se necesitan entre tres y seis coils para ocupar el tronco de una AH [32, 37], aunque otros autores proponen ocho o diez [15].
Además de coils, se han utilizado diversos artefactos para ocluir la AH, como el dispositivo de oclusión de Amplaz tipo Spider o balones desprendibles [2]. Más recientemente, se ha introducido el dispositivo Amplazer Vascular Plug [38]. Sus ventajas radican en la precisión de la liberación y su coste, al ser hasta 10 veces menor comparado con el uso de coils. La desventaja es la navegabilidad del dispositivo, que siempre es inferior a la de un simple catéter.
Respecto de la embolización con coils, es preciso hacer una serie de matizaciones:
- –
Tasa de fallos en la cateterización. En la literatura consultada, la tasa de fallo en la cateterización selectiva del ostium de la AH apenas se refiere, dando por hecho que siempre se tiene éxito. Sin embargo, no es así. En una serie publicada por Criado et al [15], se indica un 7,5% de imposibilidad de cateterización de la AH. El porcentaje de ligadura quirúrgica de la AH se eleva al 7,6% en otra serie española [39]. Pero si se considera el procedimiento combinado ligadura-revascularización en esta misma serie, se eleva hasta el 27%. Otros datos publicados de grupos que revascularizan, sin considerar otras opciones, sitúan esta tasa en el 11,3% de las ocasiones [40].
- –
Liberación en lugares erróneos. La pérdida de un coil durante su liberación tampoco es un hecho excepcional. En caso de liberación accidental, el sitio en el que más frecuentemente se asientan es en la femoral profunda [32]. Su rescate también por técnicas endovasculares es posible, pero incrementando los tiempos quirúrgicos, de radiación y aumentado riesgos.
- –
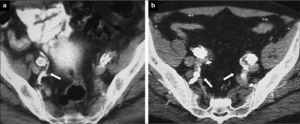
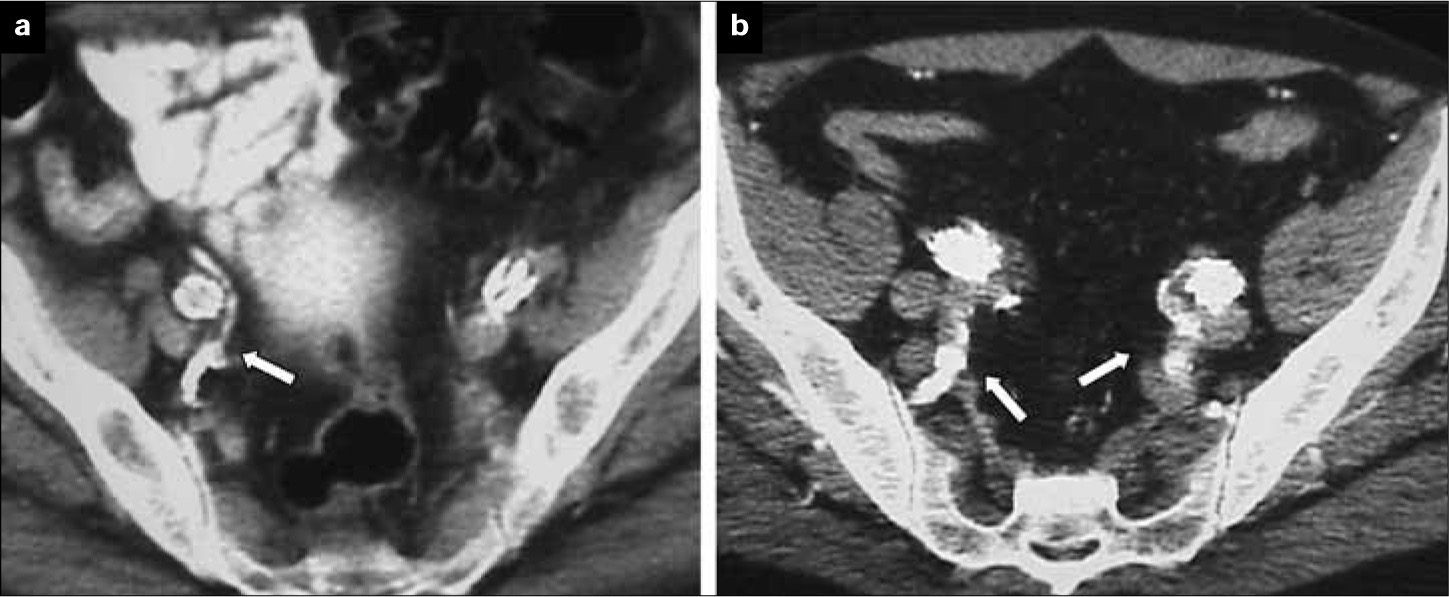
Lugar de liberación. El objetivo en una embolización de AH es evitar la potencial complicación de una endofuga tipo II, no abolir completamente el flujo en la AH y sus ramas. La liberación de los coils, por tanto, ha de hacerse en el tronco de la AH. Se debe evitar la embolización selectiva de ramas, ya que se ha demostrado que se incrementa el número de complicaciones isquémicas de forma considerable [40, 41]. La trombosis del tronco de la AH puede preservar el flujo en sus ramas secundarias a partir de su bifurcación y permitir el desarrollo de vías colaterales (Fig. 4).
Figura 4.Pacientes sometidos a exclusión de arteria hipogástrica: a) Cobertura simple del ostium de la arteria hipogástrica en el que se demuestra permeabilidad de ramas glúteas (flecha) en control tomográfico postoperatorio; b) Paciente con exclusión bilateral, en el lado derecho no selectiva y en el lado izquierdo selectiva. En ambos lados se mantienen permeables las ramas pélvicas (flechas).
(0.13MB).
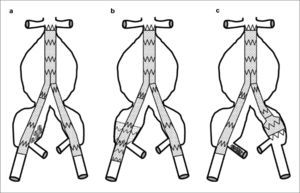
Esta técnica, desarrollada por nuestro grupo [37, 42], está especialmente indicada en la exclusión de la AH en aneurismas tipo D, e incluso más en los E. Básicamente, consiste en el relleno del saco de la ilíaca común con coils una vez implantada la endoprótesis aortoilíaca (Fig. 5a). Se ha mostrado eficaz en cuanto a la capacidad de trombosar el tronco de la AH, la conservación de flujo más allá de la bifurcación de la ilíaca interna y, en última instancia, evitar endofugas tipo II.
Técnicas de exclusión de la arteria hipogástrica: a) Embolización no selectiva de la arteria hipogástrica derecha mediante coils; b) Técnica de tunnel-graft en el lado derecho. En la zona de anclaje de la ilíaca externa se superponen dos prótesis, cobertura simple izquierda; c) Técnica de bellbottom en la ilíaca común izquierda. Embolización selectiva de la ilíaca derecha. Dibujo del autor.
Recientemente se ha publicado una variación de esta técnica, consistente en rellenar el saco con trombina en vez de con coils[43]. En esta serie no se refieren complicaciones por desplazamiento de la trombina a ramas secundarias, pero se describen casos catastróficos al internar sellar una endofuga II mediante la inyección de trombina en el saco ilíaco [44].
Técnica de tunnel-graftEs otra alternativa a la embolización selectiva, especialmente cuando técnicamente no es posible cateterizar la AH [45]. Está indicada en arterias ilíacas de entre 20 y 25mm de diámetro. Consiste en la cobertura del ostium de la AH mediante una endoprótesis ilíaca de gran calibre y anclada sólo distalmente en la ilíaca externa (Fig. 5b). Finalmente, se implanta la extensión ilíaca también hasta la ilíaca externa. La exención discurre dentro de un túnel que crea la prótesis que oblitera el ostium de la AH.
Técnica de bell-bottomRealmente, con este procedimiento no se oblitera la AH [46, 47]. Indicado en arterias ilíacas de gran calibre, e incluso con aneurismas pequeños. Consiste en colocar al final de una extensión ilíaca un extensor aórtico, de modo que el final de la endoprótesis tenga un calibre superior al del inicio de la extensión, anclado distalmente antes de la bifurcación, sobre la ilíaca común dilatada (Fig. 5c). De forma figurativa, el aspecto final es el de una campana respetando la bifurcación ilíaca.
El principal problema es la no exclusión de una arteria ilíaca dilatada y que potencialmente puede seguir creciendo; sin embargo, el grupo de Beebe ha reportado bell-bottoming en ilíacas de hasta 26mm sin complicaciones posteriores reseñables [47].
Exclusión de la arteria hipogástrica previa o simultánea a la EVARDos posturas se defienden en la literatura consultada. La liberación previa al implante de la endoprótesis aórtica o de forma simultánea. Sí hay un cierto grado de acuerdo en que cuando la embolización ha de ser bilateral, no se hagan de forma simultánea ambas hipogástricas y el implante aórtico. De forma general, se admite que si se emboliza de forma secuencial se daría tiempo a que se desarrolle circulación colateral [48].
En cuanto a la liberación previa, se recomienda hacerla al menos dos semanas antes del implante de la endoprótesis. Se indicaría especialmente en pacientes con deterioro de la función renal [19, 40, 49]. Sin embargo, la mayoría de trabajos actuales recomienda la embolización simultánea al implante de la endoprótesis aórtica, aunque se reconoce que aumenta el tiempo de cirugía, el volumen de contraste administrado y la claudicación glútea (de forma temporal) [51-53].
En términos de eficacia en la prevención de endofugas y complicaciones isquémicas pelvianas a largo plazo, parece que ambos procedimientos son similares [54]. Los procedimientos simultáneos aumentan de forma temporal los síntomas isquémicos pelvianos, y los secuenciales son más costosos y suman los riesgos de dos técnicas.
Exclusión bilateralEl registro EUROSTAR mostró cómo el 94% de los ejes ilíacos son simétricos [16]. La exclusión bilateral no es un hecho infrecuente, pero sigue siendo uno de los tópicos más controvertidos en el tratamiento endovascular del AAA, dado que se sigue más frecuentemente de complicaciones de tipo isquémico.
Preservar al menos una de las hipogástricas permeables es un tópico heredado de la experiencia acumulada en la cirugía abierta [55-57]. La complicación más catastrófica es la isquemia cólica, que aparece en tasas muy variables en la bibliografía (del 100 [50] al 0% [58] en dos series ya clásicas). Respecto de otras complicaciones que pueden aparecer en la exclusión bilateral, como la disfunción eréctil o la claudicación glútea, diversos trabajos refieren tasas variables [59].
El trabajo más significativo es del grupo de la Albert Einstein University, en Nueva York [18]. En una serie de 735 pacientes, la exclusión bilateral se efectuó en 32 (4%), sin complicaciones isquémicas de ningún tipo ni mortalidad. Quizá la estrategia seguida por estos autores secuenciando la embolización (mediante coils en el 72% de los casos) sea la causa de la ausencia de complicaciones.
ComplicacionesLa exclusión de una o ambas AH no tiene las catastróficas consecuencias de la ligadura quirúrgica, probablemente porque la interrupción del flujo se produce por trombosis gradual del tronco de la hipogástrica y da tiempo al establecimiento de circulación colateral [15, 26].
Las complicaciones que pueden aparecer se pueden clasificar en inherentes, como nefropatía tóxica, fallo de la técnica, desplazamiento de coils o del artefacto utilizado para exclusión, hematoma femoral, lesión en arterias ilíacas o femorales, o trombosis distal. El segundo grupo de complicaciones, derivadas de la técnica, son las más peligrosas. Son todas de tipo isquémico, como claudicación glútea, colitis isquémica, disfunción eréctil, paraplejía e isquemia pélvica, y pueden aparecer de forma inmediata o meses después del procedimiento.
Incidencia de las complicaciones isquémicasSon las más frecuentes, y en su patogenia está el hecho de la interrupción del flujo en una o ambas hipogástricas y el inadecuado desarrollo de red colateral.
En una revisión reciente sobre exclusión de la AH [32], se han identificado 18 series publicadas en la bibliografía indexada; en total, 605 pacientes con exclusión de una o ambas hipogástricas. La complicación más frecuente fue la claudicación glútea, que apareció en el 29% de los pacientes con exclusión unilateral y en el 32% con bilateral. La siguió en frecuencia la disfunción eréctil, que resultó en el 14% de las exclusiones unilaterales y en el 18% de las bilaterales. El resto de las complicaciones se presentó en proporciones inferiores al 5%.
La isquemia cólica está en torno al 2% [60, 61], aunque, probablemente, ocurrirá como en la cirugía abierta del AAA, que con criterios clínicos aparece colitis isquémica en torno al 1,5% [62], y si se aplicaran criterios de seguimiento endoscópicos se elevaría hasta el 6% [63].
La isquemia medular es tan rara en los procedimientos EVAR como en la cirugía abierta. El registro EUROSTAR sólo ha recogido esta complicación en el 0,21% [64] de los pacientes tratados. Sin embargo, en una serie de pacientes sometidos a EVAR de emergencia por rotura de un AAA, la tasa de paraplejía fue del 11,5% [65].
Patogenia de las complicaciones isquémicasLas AH vascularizan, en diferente medida, los órganos de la pelvis. En estudios experimentales se han identificado tres dianas potenciales de la isquemia pélvica. Primero, el colon izquierdo y sigma, estudiando de forma extensa el grado de isquemia mediante la saturación de oxígeno en la mucosa intestinal [22, 66]. El segundo grupo viene dado por los músculos glúteos, monitorizados por espectroscopia de infrarrojos [67]. La tercera diana se refiere a órganos genitales, estudiados por PVR peneana [22, 67, 68]. Todos estos trabajos han demostrado cómo estas tres zonas se comportan de modo independiente ante la pérdida de flujo troncular al excluir una AH, y esto posiblemente se deba a la capacidad de colateralizar de forma distinta.
El territorio más conocido es el glúteo, y de éste se han obtenido conclusiones globales sobre la isquemia pélvica. Se ha demostrado cómo su causa etiopatogénica es la ausencia de flujo directo por oclusión de la vía principal de aporte sanguíneo, que es la AH. Se han identificado varias situaciones como potenciales causas de mala colateralidad: la estenosis en la AH contralateral de más del 70% en su origen [2]; la ausencia de relleno en tres o más ramas de la AH de forma preoperatoria [2]; la oclusión durante la embolización de la glútea superior [36]; la presencia de patología estenótica en la femoral ipsilateral [68]; la ausencia de ramas ascendentes desde la femoral profunda ipsilateral [36]. Un estudio antiguo de cirugía determinó que las ramas circunflejas de conexión entre la pelvis y la femoral son las determinantes en la colateralidad y, por ende, en la aparición de isquemia pélvica [69], lo que rompió con el mito de la colateralidad cruzada desde la otra ilíaca. De hecho, algún autor ha recomendado la realización de una profundoplastia profiláctica en caso de exclusión de la AH [68].
Respecto de la isquemia cólica, dos importantes trabajos han concluido que el factor determinante es la microembolización de cristales de colesterol tras la manipulación de los ostium de la AH y la mesentérica inferior [60, 66, 70]. La disminución de flujo por la obliteración de la AH o la mesentérica inferior cumple un papel secundario [60]. Esta teoría se ha confirmado tras el hallazgo de cristales de colesterol en las piezas de intestino resecado [60, 70]. Se ha postulado que el paso de los sistemas de la endoprótesis, de gran diámetro, es el que lesionaría el endotelio al inducir una lluvia de ateromas [32]. Un determinado grupo ha publicado que, para evitar endofugas, emboliza de forma sistemática la mesentérica inferior [71] (30 casos) y no ha tenido ninguna complicación. Los sistemas de colateralidad entre mesentérica superior e inferior, y de ésta, vía rectales, aseguran la perfusión en la mayoría de los casos, pero cuando se establece una colitis isquémica, la tasa de mortalidad es muy alta [2, 50, 72]. En el estadio III de la clasificación de Tollefson [73] (afectación transmural), la mortalidad es del 70% [73].
La disfunción eréctil de novo tiene una patogenia similar a la de la isquemia glútea, la disminución en la presión de perfusión pélvica [67, 68]. Diversos trabajos han referido cómo la EVAR, sin necesidad de exclusión de la AH, no afecta a la capacidad eréctil [74], pero en el caso que nos ocupa, el porcentaje de afectación está en torno al 20%.
La patogenia de la isquemia espinal es incierta, y se admite que en su desarrollo interviene la obliteración de múltiples ramas lumbares y de arterias hipogástricas [58, 65]. En los pacientes sometidos a EVAR de emergencia, además de la interrupción de flujo por exclusión de una o ambas ilíacas, también ha sido determinante el shock periopeatorio [65]. Pero otros autores también defienden la teoría de la microembolizacion [64, 75]. El grado de afectación es variable, desde parestesias localizadas hasta mielitis transversa. Está asociada, cuando aparece de forma grave, a alta mortalidad [72].
Tratamiento de las complicacionesEn caso de isquemia glútea, se puede presentar de forma muy precoz con el desarrollo del síndrome compartimental glúteo, y se asocia a una isquemia más grave [76]. La mayoría de los trabajos refiere cómo la claudicación glútea mejora a lo largo del tiempo. En la serie de la Albert Einstein University, sólo uno de cada tres pacientes que presentaron claudicación glútea persistía en su clínica un año después de la cirugía [58]. La serie de la Universidad de Leicester muestra cómo la claudicación permaneció solo en uno de cada cuatro pacientes a los seis meses, pero el 70% de todos los afectados inicialmente se vio gravemente afectado en su calidad de vida [32] a largo plazo.
No existe un tratamiento eficaz para esta complicación o para la disfunción eréctil. De forma profiláctica, como ya se ha referido, se ha propuesto la profundoplastia en caso de patología femoral. Por otra parte, una técnica depurada evitará la lesión innecesaria de ramas colaterales femorales.
La colitis isquémica se presenta de igual forma clínica que tras la cirugía abierta. Debe sospecharse en pacientes con dolor abdominal, rectorragia, leucocitosis o tercer espacio. Muchos casos, tras confirmación colonoscópica, pueden tratarse de forma conservadora mediante fluidoterapia, reposo intestinal y antibioterapia. Pero en los pacientes con persistencia del cuadro clínico, empeoramiento sistémico, peritonismo o peritonitis o shock, será necesaria una laparotomía seguida de resección intestinal. En los casos de isquemia medular, se ha referido cómo los pacientes con afectación de astas anteriores medulares mejoran a lo largo del tiempo; sin embargo, la mielitis transversa o la afectación radicular no tienen cura posible [64]. Se ha comunicado un caso de paraplejía tras EVAR que regresó completamente tras drenaje del líquido cefalorraquídeo [77].
Profilaxis de las complicacionesHay una gran cantidad de medidas que se deben seguir para minimizar las complicaciones.
La nefropatía isquémica puede prevenirse utilizando la menor cantidad de contraste posible, hidratando de forma preoperatoria a los pacientes y evitando fármacos potencialmente nefrotóxicos (antiinflamatorios no esteroideos e inhibidores de la enzima convertidora de angiotensina). La administración de n-acetilcisteína también ha mostrado eficacia en la prevención de la nefropatía isquémica.
En cuanto a la técnica de exclusión que se debe utilizar, parece demostrado que cuando la anatomía de la bifurcación ilíaca lo permite, la cobertura del ostium de la AH se sigue de un menor porcentaje de complicaciones que la embolización más la cobertura [36].
Una técnica quirúrgica depurada evitará la lesión innecesaria de ramas colaterales femorales, y la manipulación endovascular adecuada evitará disecciones de los ejes ilíacos, embolizaciones y trombosis. Las nuevas endoprótesis, cada vez de menor calibre y más flexibles, sin duda minimizarán el daño endotelial y la posibilidad de microembolizaciones.
Las exclusiones bilaterales han de hacerse de forma secuencial.
Un adecuado estudio angiográfico podrá identificar a los pacientes en riesgo de sufrir complicaciones isquémicas, por la pobre colateralidad ipsilateral, estenosis contralateral o placas inestables o calcificadas [2]. En caso de patología de la bifurcación femoral, como ya se ha referido, se ha propuesto la profundoplastia.
En los grupos de riesgo es en los que estaría indicada la exclusión de la AH con conservación de flujo. La elección entre la reanastomosis de la AH o el bypass endovascular interno-externo se hará en función de las condiciones generales del paciente y la anatomía del AAA a tratar.
En la EVAR torácica, el drenaje del líquido cefalorraquídeo se ha mostrado eficaz en la prevención de la isquemia medular [77-79]. Sin embargo, en la EVAR abdominal aún no se ha identificado qué tipo de pacientes se beneficiarían de esta técnica.
Recientemente se ha introducido el uso de prótesis multirrama para el tratamiento de aneurismas toracoabdominales, y se están empezando a usar para la revascularización directa de la AH [80].
Técnicas de exclusión secundariasTras la implantación de un dispositivo endovascular aórtico, puede aparecer una endofuga tipo II a partir de la reentrada por la AH. Esta circunstancia puede darse incluso cuando la AH ya se había excluido de forma primaria. Esto ocurrió en el 18% de las 191 fugas del registro EUROSTAR [16]. En algunos de estos casos estaría indicado el tratamiento de estas endofugas ante el crecimiento del AAA [81].
Las posibilidades terapéuticas son complicadas, pero factibles. Una opción relativamente simple, pero no aplicable a todos los pacientes, es la ligadura quirúrgica o laparoscopia de la AH [82].
Para los pacientes en los que los riesgos de la cirugía son muy altos, hay soluciones endovasculares. Se realizan mediante cateterización supraselectiva del origen de la AH o del propio saco aneurismático [83], pero las vías de acceso a estas zonas son complicadas, dado que suponen alcanzar la AH mediante navegación desde la mesentérica superior, arcada de Riolano, mesentérica inferior y finalmente ramas iliolumbares [84]. Otro procedimiento consiste en la navegación lateral a la extensión ilíaca, desde la femoral ipsilateral hasta alcanzar el ostium de la ilíaca interna [83, 85, 86]. Este procedimiento se ha de finalizar con el implante de otra extensión ilíaca distal a la primitiva. En cuanto al material de embolización, la mayoría de los autores se inclina por el uso de coils en vez de esclerosantes líquidos, por el alto número de complicaciones isquémicas regionales que éstos producen [44]. También se ha descrito el tratamiento de estas endofugas mediante punción directa del saco aneurismático bajo control con TC, y la consecuente inyección de coils o material trombogénico [87].
Todos estos procedimientos tienen una tasa de fallos alta, en gran medida por la dificultad en alcanzar el vaso específico [88], en algunas series de entre el 60 a 80% [88, 89].
ConclusionesAlgunos de los hechos más destacables que han surgido a lo largo de esta revisión se han resumido en la tabla.
Tópicos relacionados con el manejo de las arterias hipogástricas en la cirugía EVAR.
| Casi en el 15% de los pacientes candidatos a cirugía EVAR hay que considerar la exclusión de, al menos, una AH |
| La revascularización de las AH no evita completamente la isquemia pelviana e incrementa la complejidad de la cirugía |
| La cobertura simple es segura y eficaz, y evita endofugas cuando se indica correctamente |
| La embolización con coils ha de hacerse en el tronco de la AH |
| La exclusión bilateral es posible, pero incrementa la tasa de complicaciones isquémicas pélvicas |
| La colateralidad pélvica no es contralateral, sino ipsilateral, a partir de ramas ascendentes de femoral |
| La embolización unilateral simultánea o secuencial a la cirugía EVAR no tiene diferencias significativas en cuanto al riesgo de isquemia pélvica |
| La claudicación glútea se presenta en un tercio de los pacientes sometidos a exclusión de AH |
| La etiopatogenia de la claudicación glútea y disfunción eréctil es la pérdida de presión de perfusión |
| La etiopatogenia de la isquemia cólica es la microembolizacion |
| La exclusión secundaria de la AH es posible, pero técnicamente muy complicada |
| AH: arteria hipogástrica; EVAR: reparación endovascular del aneurisma de aorta abdominal. |
La cirugía endovascular tiene sus propios métodos, que no tienen por qué ser la adaptación de los principios quirúrgicos al ámbito del catéter. Difieren de los tradicionales, tanto en los procedimientos como en sus resultados. Quizá el tema de la exclusión de las arterias hipogástricas sea el ejemplo más representativo de esta diferencia.
La relativa inocuidad de la exclusión de la ilíaca interna probablemente radique en que la trombosis de la AH se produce de forma gradual y en el transcurso de una cirugía poco agresiva, como es la endovascular [90].
La cirugía de EVAR es la única opción para muchos pacientes ancianos con graves comorbilidades, en los que la cirugía abierta conllevaría unas tasas de morbimortalidad muy altas. En este subgrupo es en el que las posibles complicaciones se justificarían, al ser el único recurso terapéutico posible. Pero en pacientes de bajo riesgo en los que se opte por EVAR en vez de cirugía abierta y que precisen de la 'modificación' de la anatomía del AAA para adaptarlo a tratamiento endovascular, se puede producir una pérdida de ventaja en cuanto a calidad de vida postoperatoria si aparecen complicaciones isquémicas.
En el campo de la cirugía endovascular, se están definiendo dos posturas diferentes respecto de la exclusión de las AH. Debido al comportamiento relativamente benigno de las endofugas tipo II, muchos endocirujanos optan por no excluirlas a priori, y si acaso cubrirlas. Confían en la no aparición de una fuga tipo II, y si finalmente aparece, en que no haga progresar el AAA. Pero no se puede olvidar que estamos refiriéndonos a procedimientos profilácticos, que tendrán sentido cuando realmente eviten el problema para el que se aplican. La situación contraria, más agresiva, consistente en excluir los posibles puntos de reentrada [91], eleva el número de complicaciones isquémicas pelvianas, haciéndole perder la ventaja de la menor morbimortalidad. Para evitar, en parte, estas complicaciones, otros autores proponen la revascularización pelviana, pero entonces se incrementa la morbilidad del procedimiento.
Probablemente, la situación intermedia sea la más adecuada, pero, desgraciadamente, no hay todavía suficientes estudios capaces de identificar en qué pacientes aparecerá una endofuga, y si ésta despresuriza o no el saco completamente, evitando la posterior ruptura del aneurisma.
El análisis exhaustivo de la colateralidad pelviana determinará la mejor opción terapéutica para cada paciente en caso de tener que excluir una o ambas AH en el contexto de una cirugía EVAR.





![Clasificación de los aneurismas de aorta abdominal propuesta por el registro EUROSTAR según el grado de afectación de los ejes ilíacos. En los tipos A, B y C, las ramas ilíacas de la endoprótesis se pueden anclar en la ilíaca común respetando su bifurcación. En el tipo D, la zona de anclaje en la ilíaca común puede no ser suficiente y dependerá de las condiciones anatómicas para hacer necesaria la exclusión de la arteria hipogástrica. En el tipo E, el anclaje en la ilíaca externa y la exclusión de la arteria hipogástrica son obligatorios (modificado de [14] y [16]). Clasificación de los aneurismas de aorta abdominal propuesta por el registro EUROSTAR según el grado de afectación de los ejes ilíacos. En los tipos A, B y C, las ramas ilíacas de la endoprótesis se pueden anclar en la ilíaca común respetando su bifurcación. En el tipo D, la zona de anclaje en la ilíaca común puede no ser suficiente y dependerá de las condiciones anatómicas para hacer necesaria la exclusión de la arteria hipogástrica. En el tipo E, el anclaje en la ilíaca externa y la exclusión de la arteria hipogástrica son obligatorios (modificado de [14] y [16]).](https://static.elsevier.es/multimedia/00033170/0000006000000001/v1_201304302339/S0003317008010018/v1_201304302339/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)