El tratamiento endovascular ha supuesto un cambio muy importante en las posibilidades terapéuticas que implican la aorta torácica. La disminución de la morbimortalidad gracias a los procedimientos menos invasivos hacen que este tratamiento se plantee como la primera opción terapéutica en el territorio que nos ocupa. En este trabajo se resumen las distintias entidades nosológicas que pueden afectar a la aorta torácica, los métodos diagnósticos más adecuados en cada caso y las distintas estrategias de tratamiento basándonos en una revisión actualizada de la literatura disponible.
The endovascular approach has led to great changes in therapeutic possibilities involving the thoracic aorta. Low morbidity and mortality rates due to the less invasive procedures, tends to make this the first therapeutic option. This paper summarises the most important diseases involving the thoracic aorta, the most suitable diagnostic methods, and different treatment options based on an updated review of the literature.
El tratamiento endovascular de la patología de la aorta torácica (TEVAR) representa una alternativa poco invasiva frente a la cirugía convencional, y supone una disminución de la morbimortalidad que ha llevado a esta técnica a ser el tratamiento de primera elección en casos seleccionados. Es una opción válida para el tratamiento de los aneurismas de aorta torácica y de algunos casos de disecciones aórticas tipo B, así como para la rotura de aorta generalmente de origen traumático.
Los rápidos avances que han tenido lugar en la tecnología endovascular, y el aumento de experiencia en los procedimientos, han dado lugar a una transformación radical en el tratamiento de la patología de la aorta torácica desde que se reportó el primer caso de aneurisma de aorta torácica tratado mediante un stent.
Nicholas Volodos implantó por primera vez un stent recubierto en el tratamiento de un pseudoaneurisma torácico en 1986, pero es en 1994 cuando Dake et al. publican el primer caso de reparación endovascular de un aneurisma de aorta torácica mediante la colocación de un dispositivo endovascular. Desde entonces hasta la actualidad la mejoría en los dispositivos, y la mayor claridad en las indicaciones, han abierto posibilidades terapéuticas poco agresivas en pacientes que años atrás eran desestimados para cualquier opción quirúrgica.
Los distintos capítulos que trata esta guía hacen referencia a la definición de los diferentes tipos de lesiones de la aorta torácica tributarias de reparación endovascular, al diagnóstico de las mismas, a la indicación de dicha reparación, al procedimiento y aspectos técnicos y a los resultados inmediatos y de seguimiento del tratamiento endovascular.
Patologías de aorta torácica tributarias de tratamiento endovascularAneurisma de aorta torácicaSe define como una dilatación permanente e irreversible de la aorta torácica, pudiendo distinguirse dos tipos fundamentales por la morfología y la etiopatogenia: los fusiformes, que típicamente interesan a las tres capas arteriales, a toda la circunferencia aórtica, y que se consideran habitualmente como «verdaderos aneurismas» y los aneurismas saculares, generalmente asimétricos, con morfología de una zona dilatada que no afecta a toda la circunferencia aórtica, llamados también «falsos aneurismas» y causados por infección, traumatismos o úlceras aórticas penetrantes. En general, el riesgo de rotura es proporcional al tamaño del aneurisma, y se considera indicado el tratamiento electivo de los mismos cuando alcanzan los 55-60mm de diámetro máximo en la aorta torácica descendente, o cuando siendo de menor diámetro se acompañan de algún tipo de sintomatología por complicación del mismo o por compresión de estructuras vecinas (disnea, disfagia, hemoptisis, etc.) o si existe crecimiento documentado superior a 1cm al año.
La prueba diagnóstica de elección es la angio tomografía computarizada (angioTC), que valora el tamaño y la extensión de la dilatación aórtica y de los segmentos de aorta sana proximal y distal, la afectación de los troncos arteriales cercanos así como el tamaño de la luz, la presencia y la morfología del trombo mural, el grado y la localización de las calcificaciones de la pared y las relaciones con las estructuras vecinas.
Los aneurismas de la aorta ascendente son tratados generalmente mediante reconstrucción quirúrgica, y en el caso de los aneurismas que afectan además al arco aórtico se requieren técnicas de cirugía híbrida que combina la cirugía de los troncos supraaórticos con la reparación endovascular.
Rotura traumática de la aorta torácicaLos traumatismos torácicos de alta energía condicionan fuerzas de aceleración-desaceleración en el corazón y en la aorta torácica que pueden tener como consecuencia la rotura de la misma. En aquellos casos, cada vez más frecuentes, de los pacientes que son rescatados en el momento del accidente y llevados a un hospital terciario, y que consiguen ser estabilizados, se diagnostican los pseudoaneurismas traumáticos de forma aguda; otras veces el diagnóstico tiene lugar al cabo de años tras el traumatismo y muchas es un diagnóstico casual. La localización en el 90% de los casos es el istmo aórtico inmediatamente distal al origen de la subclavia izquierda y la evolución natural es el crecimiento y la rotura, por lo que la indicación de tratamiento es cuando se diagnostican, independientemente del tamaño de los mismos, y siempre que la situación global del paciente lo permita en el caso del diagnóstico inmediato tras el traumatismo.
Síndrome aórtico agudoEste síndrome, de relativa reciente descripción, agrupa tres entidades nosológicas: la disección aórtica, el hematoma intramural y la úlcera penetrante aórtica.
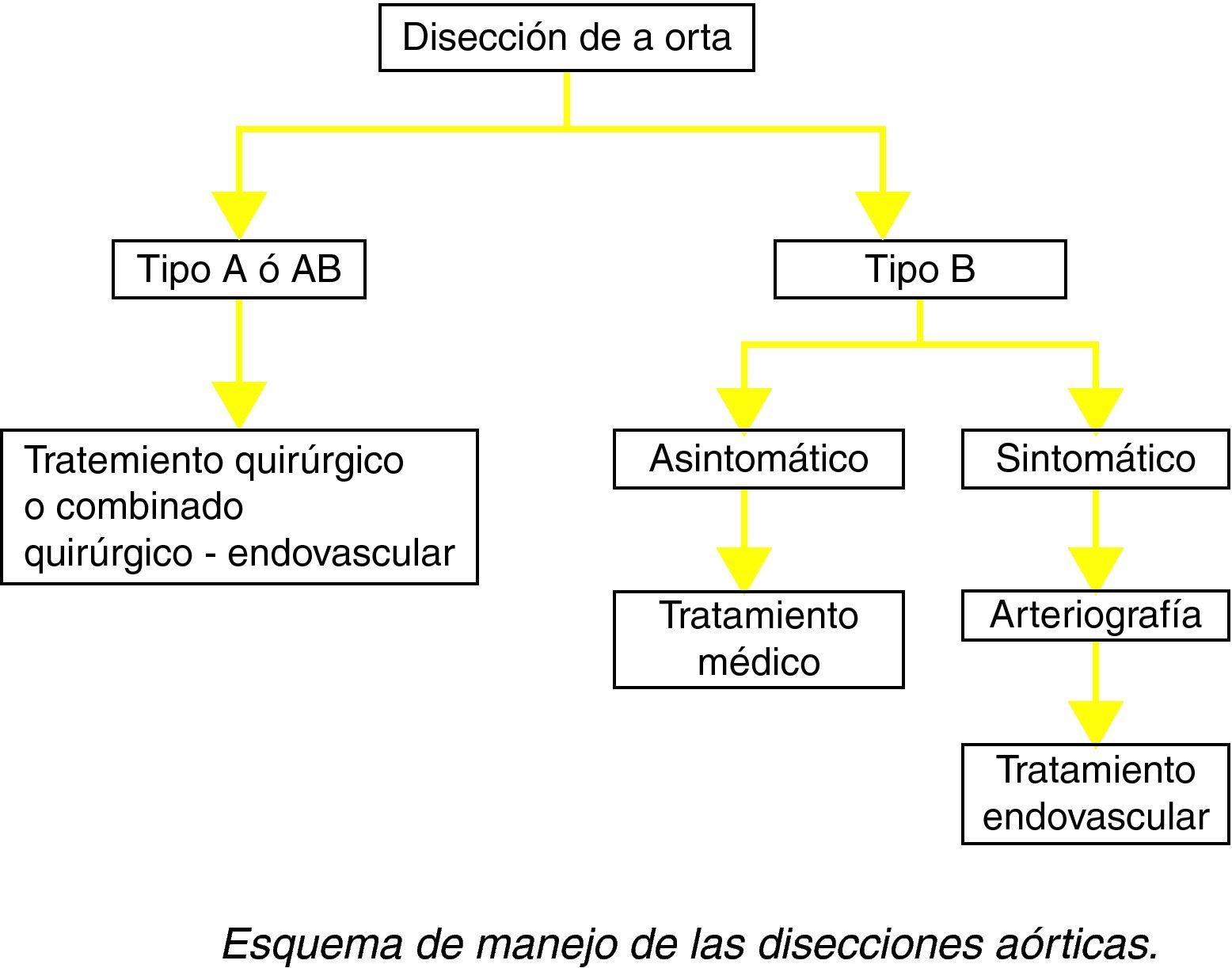
Disección de aortaEs el resultado de una lesión penetrante en la íntima arterial que permite el paso de flujo a través de la misma, que es el responsable de separar las distintas capas de la aorta, con lo que la sangre fluye hacia distal y proximal de dicha lesión a través de la capa media, creando un doble canal de paso, verdadero y falso, separados por un flap intimal. Son frecuentes varios puntos de reentrada que establecen nuevas comunicaciones entre ambas luces.
Se han descrito varias clasificaciones de las disecciones aórticas; la clasificación de Standford se centra en la presencia o no de afectación aórtica proximal y distingue:
- 1.
Disecciones tipo A: incluyen la aorta ascendente, con o sin repercusión en la aorta descendente.
- 2.
Disecciones tipo B: se limitan a la aorta descendente, distal al origen de la subclavia izquierda.
También las podemos clasificar en:
- 1.
Agudas: durante las dos primeras semanas de la aparición (tipos A o B de Stanford).
- 2.
Crónicas: después de dos semanas (solo tipo B de Standford).
Las aproximaciones diagnósticas más rápidas y disponibles en la actualidad son la TC y la ecocardiografía transesofágica (ETE).
La TC valora la localización, el tamaño de la aorta, el flap intimal. La afectación de los troncos arteriales supraaórticos o viscerales, la extensión de la disección., la persistencia de flujo o la trombosis en la falsa luz, el grado de compresión de la luz verdadera y signos de isquemia visceral.
Habitualmente la luz verdadera es menor que la falsa por la compresión que esta le produce, y se localiza frecuentemente en la cara posterolateral de la aorta descendente y abdominal.
La ETE tiene un alto rendimiento en el diagnóstico de esta patología, sobre todo en lo que se refiere a la detección del flap y de las dos luces, así como para el cálculo del tamaño de la puerta de entrada. Esta prueba presenta un valor añadido en el tratamiento endovascular, ya que ayuda en el implante de los dispositivos tanto para la localización de la luz verdadera, la posición definitiva de la misma y el resultado del procedimiento.
Deben ser consideradas como indicaciones para el tratamiento de pacientes con disección aguda tipo B (menos de 14 días desde la aparición de los síntomas) la extensión retrógrada de la disección, la rotura aórtica, la isquemia visceral con shock, la isquemia de miembros inferiores, el dolor intratable o la presencia de hipertensión arterial incontrolable.
En los casos de isquemia visceral se ha descrito como alternativa a la colocación de una endoprótesis aórtica la fenestración de la íntima arterial como técnica de revascularización del sector esplácnico y renal (fig. 1).
Hematoma intramuralSe produce por la rotura espontánea de los vasa vasorum aórticos, en general sobre un proceso aterosclerótico previo, y la localización más frecuente es en la aorta descendente (60% de los casos). Esta hemorragia debilita la pared de la aorta y puede progresar hacia la rotura de la misma o hacia la fenestración intimal y progresión a disección aórtica.
La presentación clínica es similar a la de la disección aórtica clásica; el dolor torácico brusco irradiado a la espalda es el síntoma más común, aunque es rara la insuficiencia aórtica que muchas veces se asocia a las disecciones tipo A.
El hematoma intramural no presenta flap y no existe comunicación con la luz aórtica, por lo que la TC, la ETE y la resonancia magnética nuclear (RMN) tienen un rendimiento similar. Se evidencia por TC simple mediante un área de alta atenuación con forma de semiluna o con una señal hiperintensa en la RMN. La ETE es útil para demostrar el engrosamiento de la pared, aunque no puede distinguir entre hematoma intramural agudo o crónico.
La mortalidad precoz depende de la localización del hematoma, de su grosor y del tamaño aórtico, y la evolución más frecuente es a aneurisma o falso aneurisma. La estrategia terapéutica más segura es el tratamiento hipotensor riguroso y el seguimiento estricto con pruebas de imagen, estando indicado el tratamiento endovascular si los síntomas o la hemorragia recurren o si la aorta se dilata significativamente.
Úlcera aórtica penetrantePor definición la úlcera penetrante aórtica es aquella que invade la capa media después de haber roto la lámina elástica interna en una aorta con placas ateroscleróticas previas, siendo la localización más frecuente la aorta descendente.
Los pacientes con esta entidad suelen ser ancianos con múltiples factores de riesgo cardiovascular, sobre todo hipertensión arterial, y su presentación clínica recuerda una vez más a la de la disección aórtica.
En cuanto al diagnóstico mediante TC la presencia de una ulceración distingue esta entidad del hematoma intramural, aunque en la práctica clínica esta distinción no siempre es posible, dado que los hematomas intramurales presentan también superficies ulceradas en el origen de las lesiones. La ETE también puede ayudar en el diagnóstico, y sobre todo en las úlceras que evolucionan a disecciones aórticas.
El tratamiento de estos pacientes se fundamenta en el alivio de la sintomatología, prevenir la rotura aórtica y prevenir la progresión a un hematoma intramural extenso o a una disección aórtica. Se impone como en las entidades previas un tratamiento individualizado, en general cuando está ubicada en la aorta descendente y se acompaña de dolor recurrente, embolia distal, dilatación progresiva de la aorta, aumento del hematoma intramural o rotura aórtica, estaría indicado el tratamiento endovascular del paciente. En caso de un paciente asintomático o un hallazgo casual el tratamiento conservador y el seguimiento mediante una prueba de imagen sería la actitud más indicada.
Coartación de aortaSe trata de una estenosis de la aorta (habitualmente situada en el istmo aórtico) que aparece de forma congénita.
Puede comenzar con clínica de hipertensión arterial y claudicación intermitente en las extremidades inferiores, tanto en la edad adulta como en la infantil. El tratamiento endovascular de la misma incluye la angioplastia con o sin stent asociado.
Exploraciones diagnósticasPara la preparación de un procedimiento endoluminal es necesario un estudio exhaustivo de la patología que pretendemos tratar.
Las pruebas de imagen permiten seleccionar pacientes susceptibles de recibir un tratamiento endovascular, ya que es necesaria una valoración de las características anatómicas de las lesiones de la aorta torácica debido a las limitaciones de los dispositivos endovasculares disponibles. De ahí la importancia de alcanzar la máxima exactitud posible en el diagnóstico por imagen.
El diagnóstico por imagen en el tratamiento endovascular lo constituyen la angioTC, la angiorresonancia magnética, la arteriografía y los ultrasonidos. Con el avance de la tecnología cada modalidad tiene una función en el diagnóstico del paciente y ofrece una información única e increíblemente valiosa.
La tendencia actual de utilizar procedimientos diagnósticos menos invasivos también afecta a las técnicas de imagen endovasculares. Mientras que la angiografía fue el primer procedimiento para diagnosticar la enfermedad vascular, las modalidades no invasivas de la TC y la RMN (en particular la angioTC y la angioRMN) continúan ganando popularidad entre los médicos y los especialistas en procedimientos endovasculares.
Tomografía computarizadaSe utiliza un equipo helicoidal multicorte siempre que sea posible. El protocolo estándar incluye estudios con y sin contraste intravenosos en fase arterial, seriando cortes desde las cúpulas diafragmáticas hasta la bifurcación de las arterias femorales.Todas las imágenes obtenidas se procesan para obtener reconstrucciones multiplanares y volumétricas.
Nos da información fundamentalmente referida al diámetro, mas si tenemos una buena reconstrucción podemos obtener incluso datos sobre las longitudes de la patología a tratar1.
Para optimizar la imagen y evitar el artefacto creado por la respiración del paciente se debe pedir al paciente que aguante su respiración tanto como le sea posible; la mayoría de los pacientes pueden hacerlo durante 30 segundos. Los aparatos de angioTC modernos son capaces de realizar cortes mucho más finos (0,3mm), con lo que aumentan la resolución de forma importante2.
En la evaluación del paciente es esencial la medición del diámetro y la longitud del cuello de la lesión proximal y distal, y de ambas arterias iliacas comunes para valorar la posible navegación con los dispositivos endovasculares.
La angioTC permite distinguir fácilmente entre la luz, el trombo mural y la pared aórtica; esto, junto con el procesamiento posterior de la imagen, proporciona la base para una medición exacta. A diferencia de la arteriografía la angioTC permite una descripción excelente tanto del trombo como del calcio de la pared arterial. Esta prueba nos permite también una valoración sobre el estado de los troncos supraaórticos y de la aorta abdominal.
ArteriografíaA pesar de su utilidad potencial tiene importantes limitaciones. Es incapaz de detectar el tamaño del aneurisma y del trombo asociado, ya que sólo estudia la luz arterial. Este método no es capaz de detectar con exactitud la calcificación aórtica y de las arterias iliacas, lo cual es un aspecto muy importante si nos planteamos una reparación endovascular3–5.
No es ya una prueba imprescindible en la planificación del procedimiento quirúrgico y para la toma de medidas con vistas a la elección de los dispositivos adecuados en cada caso, ya que su información es fundamentalmente logitudinal, y estos datos nos los puede proporcionar una buena reconstrucción de la TC.
El acceso vascular más empleado es la arteria femoral común, a través de la cual se usa un introductor de 5F y un catéter centimetrado.
La arteriografía diagnóstica debe incluir imágenes de la aorta toracoabdominal, vasos pélvicos y femorales, para verificar no solo las lesiones, sino también las arterias a través de las cuales se van a introducir los dispositivos endovasculares6.
Resonancia magnética nuclearBasado en su capacidad de aportar imágenes funcionales, la RMN se utiliza en los casos de disección aórtica.
El protocolo de estudio incluye una secuencia de spin-eco doble guiada por electrocardiografía en cortes transversos, sagitales y oblicuos, así como reconstrucciones tridimensionales de angiorresonancias dinámicas con contraste intravenoso.
La angiorresonancia utiliza contraste de gadolinio y permite realizar imágenes en tres dimensiones de la aorta abdominal y de sus ramas, al igual que de las arterias iliacas. El gadolinio no es tan nefrotóxico, por lo que la posibilidad de inducir insuficiencia renal con esta exploración es menor. La RMN tiene otras teóricas ventajas sobre la angioTC, incluyendo una imagen tridimensional con gran resolución y un excelente contraste de los tejidos blandos, y todo ello sin someter al paciente a una radiación ionizante.
Esta prueba tiene la capacidad de distinguir la existencia de sangrado activo o hematomas en desarrollo en los procesos agudos. Para extraer toda la información necesaria para la selección del paciente, tamaño de la endoprótesis y planificación del tratamiento desde la RMN se requieren varios registros, lo cual requiere un tiempo de exploración aproximado de 20 minutos.
Estas imágenes permiten valorar, al igual que la angiografía, la longitud del cuello aneurismático, la estenosis o tortuosidad de las arterias iliacas y el diámetro interno de las arterias iliacas comunes y externas. Sin embargo, ni la Resonancia Magnetica (RMN) ni la Angioresonancia magnetica (AngioRM) pueden describir el calcio, lo cual puede ser un problema. Tampoco se puede realizar en pacientes portadores de marcapasos y ciertos implantes metálicos. La angioRMN también permite obtener una imagen en tiempo real, parecida a la arteriografía convencional. Esta técnica se denomina TRICKS (time-resolved imaging of contrast kinetics). TRICKS tiene la ventaja de realizar una RMN de alto rendimiento, al igual que los más modernos software permiten mejorar la resolución temporal.
Ecografía transesofágicaSe utiliza para identificar el cuello verdadero de los aneurismas torácicos y su relación precisa con la salida de la arteria subclavia izquierda. También de detecta con precisión la puerta de entrada de las disecciones aórticas y evalúa el flujo en la luz verdadera y en la falsa, así como una buena colocación de guías y catéteres.
Ultrasonido intravascularSe emplea sobre todo durante el procedimiento endovascular para asegurar la colocación exacta de la endoprótesis (especialmente en un cuello aneurismático difícil) y es muy útil para identificar la verdadera luz en el tratamiento de las disecciones.
Esta técnica como método diagnóstico es menos utilizada, aunque algunos abogan por su utilización en pacientes con insuficiencia renal para realizar un primer estudio de aproximación sin contraste, y si las conclusiones obtenidas no son lo suficientemente claras como para saber si un paciente es candidato a un tratamiento endovascular, se añadirán otros estudios diagnósticos7.
Algunos autores son muy positivos en cuanto al uso rutinario del ultrasonido intravascular (IVU). El IVU puede medir con exactitud el cuello aneurismático, puede determinar la existencia y la extensión de calcio en la pared arterial de los vasos iliacos y puede determinar la longitud exacta necesaria que debe tener el dispositivo8.
La ventaja del IVU sobre la arteriografía es que no requiere contraste. Las limitaciones del IVU incluyen que requiere una punción arterial, lo cual no está exento de complicaciones, su curva de aprendizaje y, además, no está disponible en muchos centros donde se realiza cirugía endovascular. Requiere una importante inversión en el equipo y en el adiestramiento para ser utilizado de forma rutinaria como una técnica de imagen diagnóstica en el planteamiento terapéutico del abordaje endovascular.
Eco-dopplerNos permite la valoración de arterias femorales y de los ejes iliacos, lo que nos permite una buena valoración de los posibles accesos vasculares, como predecir las posibilidades de navegación por dichas arterias.
Todas estas técnicas nos permiten determinar:
- 1.
La localización de la lesión aórtica.
- 2.
La anatomía y morfología exactas de los aneurismas.
- 3.
La presencia de calcificaciones de la pared y del trombo intramural.
- 4.
Las medidas intraluminales exactas de los diámetros de la lesión aórtica y de los segmentos de aorta sana proximales y distales a ella.
- 5.
Las relaciones anatómicas del cuello de los aneurismas con los troncos supraaórticos y viscerales, especialmente arteria subclavia izquierda y tronco celiaco.
- 6.
La anatomía de la aorta abdominal.
- 7.
El acceso vascular para el procedimiento endovascular.
En el caso de las disecciones aórticas se necesita una información específica:
- -
Anatomía del flap disecante.
- -
Identificación de los puntos de entrada y reentrada.
- -
Confirmación del flujo de entrada y reentrada.
- -
Dimensiones de la verdadera y la falsa luz.
- -
El grado de trombosis de la falsa luz.
- -
La relación de ambas, la verdadera y la falsa luz con la salida de los troncos viscerales, iliacas y femorales.
- -
El diámetro del arco aórtico distal.
- -
El diámetro y la extensión de la disección hacia los ejes ilio-femorales.
-Longitud mínima de 15-20mm entre el origen de la arteria subclavia izquierda y el inicio del aneurisma, de la puerta de entrada de la disección tipo B o de la lesión aórtica a tratar. En el caso de que para asegurar un sellado proximal se deba cubrir la arteria subclavia izquierda las Guías clínicas de la Sociedad Americana de Cirugía Vascular proponen las siguientes recomendaciones9:
- 1.
Revascularización previa a TEVAR de forma rutinaria.
- 2.
En pacientes que presentan una anatomía que comprometa la perfusión de órganos críticos(presencia de bypass coronario de mamaria izquierda, ausencia o hipoplasia de la vertebral derecha, mala colateralidad del sistema vertebrobasilar, fístula arteriovenosa en la extremidad superior izquierda, planificación de cobertura de un segmento largo de aorta torácica, cirugía de aorta infrarrenal previa, oclusión de arterias hipogástricas o presencia de aneurismas en la aorta torácica más distal que hagan prever futuros tratamientos) la revascularización de la arteria subclavia previa a TEVAR es altamente recomendada.
- 3.
En pacientes que necesitan reparación urgente con TEVAR la revascularización debe ser individualizada en función de la anatomía, la estabilidad hemodinámica del paciente y la disponibilidad y experiencia del equipo quirúrgico.
Las técnicas de revascularización de dicha arteria incluyen el bypass carótido subclavio o el reimplante de la arteria subclavia en la arteria carótida común izquierda.
En cuanto a los cuellos distales cortos, donde se puede ver comprometido el tronco celiaco, se debe tener en cuenta que cubrir intencionadamente el mismo, incluso cuando existe una buena circulación colateral a través de la arteria mesentérica superior, puede no ser un procedimiento inocuo. Es necesario un estudio preoperatorio para evaluar la arteria gastroduodenal y sus conexiones. En caso de ser necesaria la revascularización de dicha rama visceral el bypass aorto o iliohepático es una técnica sencilla y con buenos resultados.
- 4.
Diámetro máximo del cuello de 42mm.
- 5.
Si la patología afecta al arco aórtico y a la aorta descendente se puede realizar un tratamiento combinado quirúrgico y endovascular.
- 1
Acceso vascular de tamaño suficiente.
- 2
Tortuosidad limitada de la aorta torácica, abdominal y del sector aortoiliaco.
En la realización de este tipo de tratamiento es imprescindible un cambio en la forma de preparación del paciente y fundamentalmente en la del cirujano, que deberá cambiar sus procedimientos quirúrgicos de forma radical.
Formación y adiestramiento previoLa realización de las técnicas endovasculares va a requerir:
- -
Nuevos conceptos teóricos: diagnósticos y de indicación clínica.
- -
Materiales: utilidad, calidad y tipos.
- -
Familiarización con nuevas herramientas de trabajo.
- -
Equipo radiológico, ETE, bombas inyectoras, IVU
- -
Aprendizaje: manipulación de material fungible y nuevas prótesis; técnica quirúrgica.
Los conceptos teóricos pueden ser muy particulares de la patología a tratar, pero los conocimientos sobre material, nuevas herramientas y manipulación deben ser generales para todas las técnicas endovasculares, por lo que la formación y adiestramiento en el tratamiento endovascular de la patología de aorta torácica tiene como primer paso una formación general básica. Esta formación básica es ineludible si se quieren resolver las posibles necesidades y complicaciones que comporte el tratamiento y no tener que recurrir a ayudas externas a la especialidad.
Material endovascularExisten multitud de artículos y pequeñas particularidades en cada uno que pueden interesar en un momento dado. El cirujano debe familiarizarse con unos determinados productos, conocerlos en profundidad y solo modificarlos ante la necesidad. Se pueden resumir en:
- -
Agujas de punción: tipo abocatt o aguja Seldinger. Vendrá determinado por la apetencia del cirujano, calidad de la arteria (ante calcificaciones mejor aguja Seldinger).
- -
Guías: teflonadas, hidrofílicas, rígidas, súper rígidas.
- -
Introductores: vaina corta (cateterización y paso de material), vaina larga con gran diámetro (paso de endoprótesis).
- -
Catéteres: diagnósticos, intercambio, selectivos.
- -
Balones de dilatación: látex (remodelación y fijación de las prótesis) y presión (dilatación arterial para abrir una lesión estenótica de paso o resolver complicaciones posteriores).
- -
Otros: catéter lazo, material de embolización, stent vascular no cubierto y cubierto.
- -
Endoprótesis: diversas casas comerciales y tipos.
Para tratar la patología aórtica torácica es habitual utilizar: introductores cortos (5F, 7F, 9F, 12F), largos (habitualmente con la prótesis) o aislados (20F a 26F), guías hidrofílicas y rígidas, catéteres diagnósticos (centimetrados) y de intercambio, balones de remodelación de la endoprótesis y dilatación arterial, endoprótesis aórticas (configuración y necesidades dependiendo de la casa comercial).
Aprendizaje y manipulaciónEl aprendizaje inicial debe de ser realizado mediante simuladores, pasando posteriormente al campo clínico y colaboración quirúrgica. La utilización de modelos nos permite familiarizarnos con el tipo de material, habituarnos a trabajar bajo control radiológico y sobre todo a memorizar los pasos técnicos y la sistemática de trabajo. El uso de modelos animales para el aprendizaje de este tipo de cirugía no es imposible, pero sí tremendamente dificultoso debido a los calibres de los dispositivos y la necesidad de utilizar animales de gran tamaño, con las dificultades que conlleva su mantenimiento, preparación, anestesia y realización del procedimiento10.
Para la realización de técnicas endovasculares en la aorta torácica se debe dominar: la punción y cateterización arterial, intercambio de guía, cateterización de ramas supraaórticas, dilatación/colocación de stent arterial y métodos de ubicación y liberación de endoprótesis torácicas11,12. El equipo qurúrgico debe conocer la manipulación de todo el material y pasos quirúrgicos.
La formación de los cirujanos vasculares que realizan estos procedimientos exige un adiestramiento importante en varios sentidos13. El consenso de la Sociedad Americana de Cirugía Vascular14 hace las siguientes recomendaciones sobre los requisitos necesarios para el tratamiento endovascular de la aorta torácica:
- 1.
Estar familiarizado con la selección de pacientes tributarios de TEVAR, interpretación de TC y reconstrucciones tridimensionales, mediciones, planificación y realización de procedimientos endovasculares en aneurismas de aorta. Debería acreditarse el tratamiento endovascular exitoso como primer cirujano de 25 aneurismas de aorta abdominal en los dos años previos o 10 endoprótesis torácicas en el mismo periodo.
- 2.
Conocimiento de la patología de la aorta: diagnóstico, historia natural, opciones terapéuticas y diagnóstico y tratamiento de las complicaciones más fecuentes de esta patología, como la isquemia medular, el fallo renal, el ictus, la isquemia miocárdica o las embolizaciones.
- 3.
Capacidad para obtener y reparar los distintos accesos vasculares en vasos braquiales, femorales o iliacos y experiencia en la realización de bypass anatómicos y extranatómicos en troncos supraaórticos.
La formación del personal de enfermería y técnicos en radiología es fundamental para la ayuda externa en el procedimiento (manipulación de la fuente de rayos, bomba inyectora).
Todo personal que actúe y manipule la fuente de rayos debe cumplir los requisitos legales que se exigen: titulación de dirección o manipulación de instalaciones radiológicas y utilización de medidas de protección (delantales, protectores tiroideos, guantes protectores y dosímetros personales)15.
Técnica quirúrgicaLa patología de la aorta torácica suele ser compleja, y su tratamiento endovascular puede ser simple o asociado a cirugía del arco aórtico y/o troncos supraaórticos. Por otro lado, una complicación grave puede comportar una intervención urgente con cirugía abierta. Estos dos motivos hacen que un quirófano sea el lugar ideal para realizar estos procedimientos. Por tanto, es necesaria la reestructuración y adecuación de un quirófano o creación de un quirófano radiológico: sistemas radiológicos digitales semirrígidos o móviles con arco en C, mesas quirúrgicas (único pie, movimientos laterales y accesorios), monitorización por techo, bombas inyectoras y material de protección endovascular, sala de material endovascular y necesidades habituales de un quirófano9. El arco digital debe de tener un diámetro mínimo que se adecue al campo, poder realizar cine y repetición de la angiografía y sustracción digital (fig. 2).
Implantación- -
Accesos: el acceso femoral es el más común; una incisión pequeña inguinal suele ser suficiente para exponer la arteria femoral común (si el tamaño arterial lo permite el lado derecho es el más cómodo para trabajar). Debe hacerse una incisión inguinal alta para controlar la arteria femoral al nivel del arco inguinal y poder movilizar la arteria iliaca externa si es necesario (acodaduras o elongaciones importantes). En ocasiones, si el calibre de las arterias femoral común y/o iliaca externa es pequeño, comparado con el diámetro de los introductores, será necesario realizar un abordaje de la arteria iliaca común mediante una vía retroperitoneal (habitualmente izquierda), colocar un injerto protésico, transitorio o definitivo, término lateral o término terminal en la misma y tunelizarlo hasta arteria femoral común izquierda para mayor comodidad de uso. Adicionalmente se obtiene un acceso percutáneo de la arteria femoral común izquierda o arteria braquial derecha (dependerá de la patología a tratar, las características del arco, elongaciones aórtica e iliacas y preferencia del cirujano).
- -
Cateterización arterial: punción de arteria femoral común abierta mediante Abocatt n.° 16 e introducción de guía hidrofílica de 280cm hasta el arco aórtico, extracción de abocatt y colocación de introductor de 7 -9F al nivel femoral. En la región inguinal izquierda se punciona de forma percutánea la arteria femoral común y se procede del mismo modo anterior. Si fuera necesario puncionar la arteria braquial inicialmente se introduciría guía de 180cm hasta la aorta ascendente, y se colocaría introductor de 5F. Tanto la vía arterial femoral izquierda como la braquial derecha servirán para realizar angiografía del arco y aorta torácica lesionada. En las disecciones aórticas tipo B la utilización del ETE nos permitirá saber la ubicación exacta de cada guía y al nivel de qué luz arterial se encuentran. Una vez puncionados los dos accesos se procede a la anticoagulación completa del paciente (heparina sódica: 1mg/ kg).
- -
Intercambio de guía y angiografía: colocación de catéter largo (100cm) tipo vertebral o multipropósito sobre guía derecha hasta el arco, extracción de la guía hidrofílica e introducción de guía rígida o muy rígida (si es el lado por el cual se va a introducir la prótesis). En el lado izquierdo se coloca un catéter centimetrado, tipo pig-tail, hasta la aorta ascendente; si se ha utilizado una vía braquial el catéter centimetrado puede colocarse por la misma.
- -
Colocación de la prótesis: se habrá decidido, dadas las características de las arterias iliacas, el lado por el que se va a introducir la prótesis. En este habrá que realizar un intercambio de introductor (dependiendo de la prótesis a utilizar será independiente o se utilizará el propio sistema del dispositivo). Introducción de la prótesis hasta cayado aórtico habitualmente. La realización de una angiografía (sustracción, road mapping) del cayado es necesaria para marcar el inicio de los troncos supraórticos y donde se va a realizar la liberación del cuello proximal; para ello se utilizará el catéter centimetrado que nos permitirá realizar las oportunas medidas de longitud necesarias.
Un punto en discusión es ¿cuándo debe realizarse la angiografía? La realización de la misma antes de subir el dispositivo nos aporta información del arco sin alteraciones posicionales del mismo, nos permite colocar y oblicuar mejor el arco, si es necesario, y nos permite medir previamente diámetros y longitudes. Esta forma es adecuada cuando inicialmente no tenemos suficiente información angiográfica y necesitamos decidir el tamaño de la prótesis. Por otro lado, si se tienen previamente reconstrucciones angiográficas suficientes del arco y la aorta torácica, la realización de la angiografía podría hacerse con el dispositivo introducido; ello nos da, por un lado, una información anatómica más aproximada a la que quedará después de la suelta, y por otro la posibilidad de movilización y alteración de las marcas, dado que el pequeño intervalo de tiempo entre angiografía y suelta es menor.
Cada dispositivo presenta unas características particulares para su implantación que es preciso conocer.
Después de la liberación se procede a la extracción del catéter de pig-tail. Si su paso era por vía femoral puede volverse a cateterizar la prótesis con guía y posterior introducción del pig-tail; si era braquial no es necesario que se extraiga. Se añadirán del mismo modo cuantas extensiones sean necesarias o se hayan previsto. Se procede a la remodelación y baloneado de la prótesis con diámetros adecuados. En los casos de disección aórtica y traumatismos se debe valorar la necesidad de la remodelación. Se realizará una angiografía final para evaluar el procedimiento, colocación y existencia de fugas.
Retirada de los dispositivos, catéteres y guías, control arterial y sutura de la arteriotomía, cierre inguinal o retroperitoneal. Compresión de las zonas de punción o utilización de dispositivos de cierre arterial percutáneo. La realización del procedimiento suele ser similar para todos los tipos de patología con aspectos diferentes para cada una. Así, la utilización de ETE durante el tratamiento de las disecciones aórticas es fundamental, ya que nos aporta información básica para el procedimiento: colocación de las guías, ubicación de la prótesis con arreglo a la puerta de entrada, valoración de antiguas o nuevas puertas distales, estado de la aorta abdominal, trombosis de la falsa luz y necesidad de remodelación.
La utilización de IVUS puede ser de gran ayuda para medir con precisión el diámetro en la zona de suelta, ver la calidad de la zona del cuello (calcificaciones, trombo).
Tipos de dispositivos para realizar estos procedimientos.
En la actualidad disponemos de varios tipos de dispositivos para realizar estos procedimientos, como son:
Prótesis Valiant® (Medtronic, Minneapolis, MN,EE.UU.)
Prótesis TAG® y C-TAG® (W.L. Gore& Associates, Flagstaff,AZ, EE.UU.)
Prótesis Zenith TX 2® (Cook Inc.; Bloomington, IN, EE.UU.)
Prótesis Relay® (Bolton Medical, Sunrise, FL, EE.UU.)
Prótesis Endofit® (LeMaitre Vascular, Burlington, MA, EE.UU.)
Está formada por un stent de nitinol cubierto con poliéster; la estructura metálica se soporta por distintos anillos de nitinol conectados al poliéster con multiples suturas de polipropileno. Los diámetros de esta prótesis van de 22 a 46mm y las longitudes pueden ser de 10,15 y 22cm. Los sistemas de liberación son de 22 a 25 F.
TAG® y C-TAG®El esqueleto de estas prótesis es de nitinol y está cubierto por PTFE. En cada extremo del material protésico hay una banda radioopaca de oro que facilita la visualización del dispositivo. La endoprótesis está disponible en diámetros de 21 a 45mm y en longitudes de 10 a 20cm. El perfil de estos dispositivos comprimidos y unidos al catéter portador es de 18 a 24 F. La C TAG® presenta mayor conformabilidad en anatomías tortuosas.
Zenith TX2® (Cook Inc.)Está diseñada con stents de acero inoxidable cubiertos con poliéster (Dacron). Los diámetros van de 22 a 42mm para el componente proximal y de 28 a 42mm para el distal. Las longitudes varían desde 108 a 206mm a 127 a 207mm proximal y distal respectivemente, y el sistema de liberación oscila de 20 a 22 F.
Relay® (Bolton Medical).Está compuesta por stents de nitinol y cubierta por poliéester prefabricado. Presenta free flow proximal.
Los diámetros de esta próteis oscilan de 22 a 46mm, las longitudes llegan hasta 25cm y los sistemas de liberación van de 22 a 26 F dependiendo del diámetro de la prótesis.
Endofit® (leMaitre Vascular)Está formada por stents de nitinol cubiertos de PTFE, el rango de diámetros oscila de 32 a 42mm con extensiones de hasta 20cm y los sistemas de liberación oscilan de 22 a 24 F.
Procedimientos asociados- -
Abordaje retroperitoneal: se realizará en aquellos casos que el diámetro de arteria femoral común y/o arteria iliaca externa presenta un diámetro inferior a 7mm y/o elongaciones o acodaduras difíciles de salvar por vía femoral, así como calcificaciones extremas que imposibiliten el paso del dispositivo. Es de interés realizar un eco-doppler de la arteria femoral común e iliaca externa para valorar su diámetro previamente. En ocasiones la dilatación global del eje iliofemoral puede ser suficiente para evitar la vía retroperitoneal.
- -
Abordaje a través de troncos supraaórticos: tan solo es realizable con prótesis que no necesiten sistema de introductor para su paso. Se han descrito casos de embolización cerebral al pasarlo por la arteria subclavia derecha.
- -
Guía braquio-femoral: consiste en introducir una guía vía braquial izquierda o incluso derecha y mediante un catéter lazo capturarla y pasarla por la vía femoral.
Este procedimiento nos permite tener una guía muy rígida y tensa que facilitará la ascensión de las prótesis en arterias iliacas tortuosas, o en cayados aórticos con una gran angulación. Este procedimiento requiere proteger a la arteria braquial, axilar y subclavia con catéter introducido en la guía.
Procedimientos combinados o híbridosEn la aorta torácica es frecuente tener que recurrir a procedimientos combinados para tratar aneurismas localizados en la aorta ascendente, cayado e inicios de la aorta descendente. La mayoría de ellos consiste en derivar los troncos supraaórticos para poder cubrir sus salidas desde el arco aórtico.
Arteria subclavia izquierdaLas indicaciones y técnicas de revascularización de la arteria subclavia izquierda han sido tratadas previamente.
Arterias carótidasCuando el cuello proximal es insuficiente para un correcto anclaje de la endoprótesis, a pesar de cubrir el ostium de la subclavia izquierda, es necesario cubrir el de la arteria carótida común izquierda y en ocasiones el del tronco braquiocefálico. La revascularización de la arteria carótida izquierda puede llevarse a cabo mediante la realización de un bypass carótido- carotídeo (vía retrofaríngea o subcutánea) asociándose un bypass carótido-subclavio izquierdo.
Finalmente, en casos menos frecuentes hay que recubrir todo el arco aórtico, siendo necesario para ello derivar previamente todos los troncos supraaórticos. Esto suele realizarse practicando una esternotomía media, por la que se instala un puente desde la raíz de la aorta con prótesis bifurcada al tronco braquicefálico y a la carótida izquierda, pudiendo añadirse una derivación carótido-subclavia izquierda. Puede aportar seguridad al procedimiento marcar con hemoclips la boca anastomótica en raíz de la aorta para referenciarla y no taparla con la endoprótesis. Otro detalle técnico de interés es anastomosar a la prótesis bifurcada una tercera rama en la cara anterior, por la que se introduce la guía traída desde femoral, y ulteriormente la punta del sistema de la endoprótesis, con lo que se evita que esta se introduzca en la válvula aórtica y que la suelta de la endoprótesis pueda tapar la anastomosis. Finalizado el procedimiento se retira esta tercera rama. De esta última técnica hay muy pocos casos publicados en la literatura mundial16 (fig. 3).
Cirugía derivativa en el cuello distalCuando la lesión aórtica afecta a las arterias viscerales, por cuellos distales muy cortos o inexistentes, puede ser necesaria la realización de un bypass aortohepático, aorto-mesentérico o aorto-renal, o una revascularización global, siendo dos las posibles revascularizaciones a realizar17–19 (fig. 4).
1.Bypass iliorenal bilateral y ligadura proximal de arterias renales. 2. Bypass de iliaca comun izquierda a arteria hepatica comun y desde este bypass a arteria renal derecha y a arteria mesenterica superior con ligadura proximal de arteria renal derecha, de tronco celiaco y de arteria mesenterica superior.
Uno de los problemas más graves relacionados con la reparación de patología en la aorta torácica es la paraplejía secundaria a isquemia medular, aunque con la reparación endovascular la incidencia de esta complicación ha disminuido considerablemente hasta situarse entre un 3 -6%. Para reducir el riesgo de isquemia espinal durante TEVAR se sugiere, como medidas más eficaces, drenar el líquido cefalorraquídeo vía lumbar y evitar hipotensiones mantenidas. La recomendación sería mantener la presión del liquido espinal ≥ 15mm Hg y la presión arterial sistémica por encima de 90mm Hg.
IctusSu aparición podría estar relacionada con la manipulación del arco aórtico con guías, catéteres, dispositivos, etc. y con la exclusión de la arteria subclavia, por lo que en principio, y como se ha comentado previamente, se debe revascularizar antes de la realización de procedimientos endovasculares en la aorta torácica.
Disecciones aórticas retrógradasEs junto con la rotura aórtica la complicación más grave durante el tratamiento endovascular de las disecciones tipo B. Se asocia con el uso de guías rígidas y se da especialmente en los casos donde existen angulaciones aórticas severas. El manejo de esta complicación es difícil, y cuando la colocación de una endoprótesis proximal no es posible se hace necesaria la reconversión a cirugía abierta.
Seguimiento y resultados. Evidencias sobre la efectividad y durabilidad del tratamiento endovascular de la aorta torácicaEs necesario el seguimiento de las endoprótesis aórticas, y más si cabe en el territorio de la aorta torácica, ya que necesitamos trabajos que avalen esta terapéutica a largo plazo; además, debemos detectar y solucionar las complicaciones propias derivadas de esta técnica, como lo hacemos habitualmente con cualquier otro tratamiento quirúrgico.
El principal objetivo del control y seguimiento será prevenir y detectar complicaciones para lograr el éxito clínico y técnico.
Durante la colocación de la endoprótesis debemos controlar la introducción del dispositivo y asegurar un correcto posicionamiento, la permeabilidad aórtica y de las ramas arteriales proximales y distales a la endoprótesis, así como la ausencia de fugas o endoleaks.
En el postoperatorio debemos valorar fundamentalmente el estado clínico del paciente, la posición de la endoprótesis, la permeabilidad del árbol vascular y de las arterias proximales y distales a la endoprótesis y complicaciones a corto, medio y largo plazo derivadas de la técnica, como son las fugas y el crecimiento aórtico.
Métodos de seguimientoEvolución clínica. Exploración físicaFundamental en toda técnica quirúrgica, tanto en el postoperatorio inmediato como en todas las sucesivas visitas del paciente a nuestras consultas, es valorar el estado de las heridas quirúrgicas, la función renal y hemática mediante analíticas y valorar el estado arterial para detectar trombosis o embolizaciones, apoyándonos en pruebas funcionales (doppler continuo, claudicometría, etc.).
Radiografía simple tóraxSe trata de un estudio sencillo y económico, que nos ayuda a valorar cambios posicionales e integridad estructural de la endoprótesis. También es útil para valorar un posible derrame pleural asociado con la colocación de endoprótesis en la aorta torácica. Es por tanto necesario realizarla en el pre y postoperatorio inmediato para poder comparar posteriormente.
Angio tomografía computarizadaSe trata de la técnica de elección para el seguimiento de las endoprótesis aórticas. Nos aporta datos sobre el tamaño, diámetro y morfología de la aorta torácica postimplante, nos muestra fugas, sellados correctos, angulaciones, migraciones, integridad del injerto, permeabilidad o trombosis de los troncos supraaórticos y de los troncos viscerales.
Es importante realizar cortes con una colimación de al menos 3mm y realizar la exploración sin y con contraste para poder comparar imágenes dudosas de fugas.
Eco-transesofágicaEs una técnica fundamental en el diagnóstico de la patología de la aorta torácica, especialmente en el síndrome aórtico agudo. Es sumamente útil durante la colocación de la endoprótesis aórtica, nos muestra de forma más fiable y exacta que la arteriografía la puerta de entrada de las disecciones aórticas, nos dice si nos encontramos en la luz verdadera o en la falsa cuando introducimos guías y demás dispositivos, diagnostica posibles disecciones retrógradas, informa del sellado en las disecciones, de posibles reentradas y de la trombosis o permeabilidad de los troncos supraórticos durante el acto quirúrgico.
Todo esto nos hace pensar que no es tan solo útil de forma intraoperatoria, y que podemos aprovecharnos de esta técnica no invasiva en el seguimiento de injertos endovasculares en la aorta torácica.
ArteriografíaEs fundamental su uso de forma intraoperatoria y como control final tras la colocación de una endoprótesis aórtica. Al tratarse de una técnica invasiva y no exenta de complicaciones, la reservamos para casos donde aparecen complicaciones y es necesario completar el estudio, así como resolverlas de forma endovascular.
Angio-resonancia magnética nuclearEl papel de la angiorresonancia magnética esta aún por determinar. Hay varios estudios que equiparan esta prueba a la TC, sin ofrecer ventajas sobre ella, salvo para alérgicos a contrastes.
Protocolo de seguimientoEn el momento actual no existen protocolos estandarizados en el seguimiento de las endoprótesis aórticas. En líneas generales recomendamos:
- -
Intraoperatoriamente postimplante: arteriografía y eco -transesofágica.
- -
A las 24 - 48 horas: Evaluación clínica, analítica, radiografía de tórax y TC.
- -
Al tercer, sexto y duodécimo mes posprocedimiento y posteriormente cada año: Evaluación clínica, radiografía de tórax y TC.
Reservamos la arteriografía cuando existen complicaciones o altas sospechas de las mismas.
Resultados y complicaciones del tratamiento endovascular de la aorta torácica
En los últimos 10 años el tratamiento endovascular de la aorta torácica se ha ido incrementando paulatinamente, revolucionando la práctica clínica de esta patología. Inicialmente se reservó para aquellos pacientes con elevado riesgo para llevar a cabo una cirugía abierta convencional, pero la evidencia de la baja mortalidad y los aceptables resultados a corto y medio plazo han ido apoyando el amplio uso de endoprótesis.
Las actuales técnicas endovasculares permiten el tratamiento de diversas patologías de la aorta torácica que incluyen el aneurisma de aorta torácica descendente, el síndrome aórtico agudo (disección aguda tipo B, hematoma intramural, úlcera penetrante), disección crónica tipo B, lesiones o roturas traumáticas y fístulas.
La terapia endovascular supone un gran avance en el tratamiento de estas patologías, con una baja morbimortalidad con respecto a la cirugía convencional, ofreciendo una opción terapéutica incluso a pacientes que eran considerados no candidatos al tratamiento quirúrgico. Sin embargo, como otros procedimientos, no está exenta de complicaciones.
Revisando la literatura actual queremos evaluar los resultados publicados, así como las complicaciones de las diversas patologías de la aorta torácica tratadas de forma endovascular.
Aneurisma de aorta torácicaEl trabajo de Greenberg20 publica 81 aneurismas de aorta torácica tratados con endoprótesis; su seguimiento medio fue de 14 meses y el diámetro medio de 62mm. La mortalidad al año fue de un 14%. Se observó una regresión del saco en el 52 y 56% a los 12 y 24 meses. Un 7,4% presentóa una isquemia espinal aguda, siendo un 6% parálisis permanente. Un 2,5% presentó un accidente cerebrovascular agudo. Las migraciones de endoprótesis fueron de un 6,3% y el crecimiento del saco aneurismático se observó en un 2,3%. Doce pacientes precisaron de procedimientos secundarios, y se observó un 8,5% de endoleaks a los 30 días y un 6% al año.
Makaroun21 presenta los resultados de un estudio multicéntrico para el tratamiento de aneurismas torácicos con una determinada endoprótesis. Ciento treinta y nueve (98%) de un total de 142 pacientes tuvieron una correcta colocación de la endoprótesis. El tamaño medio del aneurisma fue de 64,1mm. El 90% fueron pacientes ASA III-IV. El 56% requirió dos o más endoprótesis. La subclavia izquierda fue cubierta en 28 pacientes, a los que se realizó una transposición carótido-subclavia programada. La estancia media en Cuidados Intensivos fue de 2,6 días, y la estancia hospitalaria media de 7,6 días. En los 30 primeros días postratamiento se presentó al menos una complicación mayor en el 32% de los pacientes: accidentes cerebrovasculares en un 4%, temporal o permanente paraplejía en el 3%, traumatismo vascular o trombosis en un 14% y el 1,2% murió.
El seguimiento medio fue de dos años, con una mortalidad relacionada con el aneurisma de 4 pacientes (2,8%). Durante el primer año presentaron endoleaks un 7% de pacientes y un 9% durante el segundo año, precisando tratamiento endovascular por endoleak tres pacientes. No hubo rupturas. La supervivencia relacionada con el aneurisma a los dos años fue de un 97% y la supervivencia global del 75%.
Neuhauser22 trata a 31 pacientes, con una mortalidad perioperatoria del 19%. En la TC realizada a los dos días del tratamiento, un 23% presentaron un endoleak tipo I, un 13% de endoleak tipo II, y un 6% de endoleak tipo III. El seguimiento medio fue de 15 meses, y se observaron en un 23% de pacientes endoleaks, todos ellos tipo I. Además se observaron como complicaciones mayores un accidente cerebrovascular, una parálisis, un síndrome espinal anterior y 5 complicaciones relevantes del acceso vascular.
Publicaciones más recientes informan de los resultados a medio plazo del tratamiento endovascular en los aneurismas de la aorta torácica con distintos dispositivos. En este sentido Makaroun23 reporta una serie de 234 aneurismas de aorta torácica de los que 140 fueron tratados mediante TEVAR con el dispositivo TAG (Gore &Associates) y 94 tratados mediante cirugía abierta. Se realiza un seguimiento de 5 años y encuentra diferencias significativas entre ambos grupos: la mortalildad relacionada con el aneurisma fue significativamente más baja en el grupo TEVAR (2,8% comparado con 11,7%). Lo mismo sucedió con las complicaciones mayores a los 5 años de seguimiento.Se observó una disminución en el tamaño del saco aneurismático en el 50% de los pacientes a los 60 meses y un aumento del mismo en un 19%: La tasa de fugas en el primer mes fue del 8,1% y descendió al 4,3 < 5 a los 5 años. Los autores concluyen que en anatomías favorables el tratamiento con el sistema TAG es superior a la reparación con cirugía abierta a los 5 años.
En el trabajo de Matsumura24 se analizan los resultados de la endoprótesis Zenith TX2® en 160 pacientes comparados con 70 reparaciones abiertas. La mortalidad fue similar en los dos grupos en el primer mes. La tasa de reinterveciones fue también similar y en el grupo de TEVAR se observó un crecimiento del aneurisma en el 7,1% de los pacientes al año y la tasa de fugas fue del 3,9%.
Citar por último el estudio de Hughes et al.25 que analiza 79 aneurismas de aorta torácica tratados mediante TEVAR con tres tipos de endoprótesis: Gore TAG®, Zenith TX2® y Talent® de Medtronic. La tasa de muerte, ictus o paraplejía los primeros 30 días fue del 5,1%. La media de seguimiento fue de 23 meses y se observó una rotura del aneurisma y una infección de la endoprótesis. La supervivencia a los 55 meses fue del 73% y un 6,3% de los pacientes requirieron reintervención endovascular más allá de los 30 días debido a la presencia de fugas.
Rotura traumática de aorta torácicaLos pacientes que presentan rotura traumática de la aorta torácica son significativamente más jóvenes que los del resto de patologías aórticas, y la comorbilidad está principalmente asociada al traumatismo.
Scheinert26 trata de forma endovascular a 10 pacientes, con una mortalidad del 0% y una morbilidad del 10% por fallo renal, sin complicaciones neurológicas, y Rousseau27 trata a 70 pacientes con rotura aórtica; 35 fueron tratados quirúrgicamente (toracotomía), 28 de los cuales fueron operados de forma inmediata y 7 de forma electiva (en una media de 66 días). Veintinueve pacientes fueron tratados mediante endoprótesis y 6 con mínima lesión aórtica fueron tratados médicamente.
Los 28 pacientes tratados con cirugía convencional urgente presentaron una mortalidad del 21% y una paraplejía del 7%, no observándose muerte ni paraplejía en los pacientes que se demoró la cirugía. De los pacientes tratados con endoprótesis como única complicación presentaron una rotura iliaca tratada durante el procedimiento, sin morbimortalidad durante un seguimiento medio de 46 meses. Tampoco hubo morbimortalidad asociada a los pocos pacientes tratados farmacológicamente.
Fattori28 presenta a 19 pacientes con rotura aórtica que trata mediante endoprótesis; la colocación fue satisfactoria en todos los pacientes, se ocluyó la subclavia en 6 pacientes sin repercusión clínica, todos los pacientes estuvieron asintomáticos y sin complicaciones durante un seguimiento medio de 20 meses.
Morishita29 trata a 29 pacientes, 18 de ellos de forma endovascular y 11 con cirugía abierta, la mortalidad intrahospitalaria fue del 9% para la cirugía convencional, y del 17% para el grupo endovascular. Durante el seguimiento dos pacientes del grupo endovascular requirieron cirugía abierta y uno necesitó una segunda cirugía endovascular por fallo en el stent.
Ott30 trata a 18 pacientes, 6 de forma endovascular y 12 con cirugía abierta. La cirugía abierta presenta un 17% de mortalidad intrahospitalaria, un 16% de paraplejía y un 8,3% de lesión del nervio recurrente, que contrasta con un 0% de complicaciones y mortalidad de los pacientes tratados de forma endovascular.
En el metaanálisis de Xenos et al31 se realiza una revisión de la literatura publicada al respecto desde 2003, y se incluyen 589 pacientes de los que 369 fueron tratados mediante cirugía abierta y 220 mediante TEVAR: La mortalidad relacionada con el procedimiento y la mortalidad global a los 30 días fue significativamente más baja en los tratados mediante reparación endoluminal. En la misma línea el riesgo de paraplejía postoperatoria e ictus fue menor en los pacientes tratados con EVAR. La conclusión por tanto de esta revisión, y en concordancia con la mayoría de las publicaciones al respecto, es que en el tratamiento de la rotura traumática de la aorta torácica el tratamiento endovascular ofrece menos mortalidad y menos riesgo de paraplejía que la cirugía abierta. Los resultados a largo plazo aún están por determinar, lo que en este caso concreto reviste una especial importancia debido a la juventud de la población que sufre mayoritariamente esta patología.
Síndrome aórtico agudo: disección aórtica tipo B, hematoma intramuralÚlcera penetrante aórticaLos pacientes que sufren una disección aórtica tipo B complicada se han visto beneficiados por el tratamiento endovascular para evitar una rotura aórtica inminente o un síndrome de malperfusión, patología asociada a una elevada mortalidad.
El primer ensayo aleatorizado que evalúa el tratamiento médico versus el endovascular, Instead32, presenta resultados preliminares con 80 pacientes, seguidos durante 12 meses, con un riesgo de mortalidad para el grupo tratado con endoprótesis del 5,1%, con supervivencia del 94,9% frente a una mortalidad histórica con tratamiento médico del 27,5%; la supervivencia en estos pacientes al año de seguimiento es tan solo del 72,5%.
Dialetto33 trata a 28 pacientes con disección tipo B complicada, presentando una mortalidad intrahospitalaria del 10,7%. Tras un seguimiento medio de 18,1 meses la mortalidad es del 10,7% frente a un grupo de 28 pacientes con disecciones estables tratados médicamente, que presentaron mortalidad del 14,3%. La trombosis de la falsa luz sucedió en el 75% de casos tratados con endoprótesis, y tan solo en un 10,7% en el grupo tratado de forma conservadora.
Un 28,5% de los pacientes tratados de forma conservadora desarrollaron una dilatación aneurismática de aorta torácica descendente, frente a tan solo un 3,5% del grupo tratado de forma endovascular.
Lonn34 trata de forma endovascular a 18 pacientes con disección aórtica tipo B siendo 14 aguda, la mortalidad intrahospoitalaria fue del 15%, un 20% presentaron un accidente cerebrovascular perioperatorio, no hubo en ningún caso paraplejía, migración, ni fugas de las endoprótesis durante un seguimiento medio de 13 meses.
Pero los resultados más espectaculares los presenta Nienaber35, que trata de forma endovascular 127 disecciones tipo B, con un éxito del 98%, una mortalidad en los primeros 30 días del 1,7% y al año del 1,7%, además trata 15 úlceras penetrantes de aorta y 4 hematomas intramurales, con éxito en todos los casos y mortalidad temprana y al año del 0%.
La publicación más reciente al respecto es de Garbade36, que analiza los resultados del tratamiento en 135 pacientes con disección aguda tipo B. Distingue tres grupos de pacientes: 84 fueron manejados de forma conservadora con tratamiento médico (grupo A), en 46 pacientes se realizó tratamiento endovascular (grupo B) y en 5 se realizó cirugía abierta (grupo C). La mortalidad inmediata y a los 5 años fueron del 8,5% y del 27,9% en el grupo A, del 20 y 43,7% en el B y del 20% en ambos periodos para el grupo C. Los autores concluyen que las tres modalidades de tratamiento tienen unas tasas de supervivencia aceptables, y que aunque las endoprótesis o la cirugía abierta se reservan para aquellos pacientes con disecciones tipo B complicadas, los resultados son buenos en ambas modalidades.
Disección aórtica crónicaLos trabajos publicados del tratamiento endovascular de esta patología tienen el inconveniente de mezclar la patología aguda con la crónica, e incluso con entidades diferentes como los aneurismas para aumentar el número de pacientes.
Greenberg20 recientemente presenta 15 pacientes con disección crónica y aneurisma, tratados con un tipo determinado de endoprótesis aórtica, con un 100% de supervivencia a los dos años; como única complicación hubo un 11% de migraciones de prótesis.
Eggebrecht37 trata a 28 pacientes con disección crónica tipo B mediante endoprótesis; la mortalidad intrahospitalaria es del 0%.
Fístulas: aorto-esofágica, aorto-bronquialEstaría indicado el tratamiento endovascular en casos muy seleccionados, ya que hemos de tener en cuenta que estamos en territorio infectado, por tanto ha de reservarse para pacientes de muy alto riesgo y como puente a una cirugía de sustitución aórtica. Jonker et al38 realizaron una revisión de todos los casos de fístula aorto-bronquial y aorto-esofágica tratados mediante endoprótesis identificando 66 artículos relevantes que incluyen 114 pacientes. Los resultados de dicha revisión muestran que los pacientes con fistula aortoesofágica pesentan más frecuentemente shock hipovolémico e infección sistémica que los que comienzan con fístula aortobronquial. La mortalidad tras TEVAR es más elevada en las fístulas aortoesofágicas que en las bronquiales (19 versus 3%) y además los pacientes con fístulas aortoesofágicas necesitan cirugía adicional más frecuentemente que las aortobronquiales. Los pacientes reintervenidos de cirugía esofágica durante el primer mes después de TEVAR muestran disminución de la mortalidad relacionada con la fístula durante los primeros 6 meses de seguimiento comparados con los pacientes en los que no se realiza cirugía esofágica adicional. Los autores concluyen que los mejores resultados se dan en las fistulas aortobronquiales y que el manejo endovascular de la fístula aortoesofágica no debe ser considerado un tratamiento definitivo, y solo debería indicarse en casos de emergencia y como un puente hacia la correción quirúrgica definitiva tan pronto como sea posible.