El uso del stent en el sector femoropoplíteo presenta diversos inconvenientes anatómicos, asociándose a mayor tasa de fractura y reestenosis.
ObjetivoComparar la permeabilidad obtenida en pacientes con isquemia arterial crítica y lesiones femoropoplíteas con inclusión de la interlínea intervenidos mediante stent Supera con respecto a los operados con bypass femoropoplíteo.
Material y métodosSe realiza un análisis retrospectivo de pacientes con lesiones femoropoplíteas con afectación de P1-P2 e isquemia crítica tratados con stent Supera frente a pacientes tratados mediante bypass femoropoplíteo distal. Mediante el método de Kaplan-Meier, se analiza la pérdida de la permeabilidad durante un seguimiento medio de 12 meses. También se analizan las complicaciones aparecidas y la estancia media de los pacientes.
ResultadosDesde 2014 a 2016 se realizaron 63 intervenciones, 23 mediante colocación de stent Supera y 40 mediante bypass femoropoplíteo distal (77,5% con vena autógena). La permeabilidad primaria en el grupo del bypass con vena autógena fue del 84% a los 12 meses, mientras que en el stent Supera fue del 77% (p=0,630). Las complicaciones mayores (cardiacas, respiratorias, renales) fueron similares en ambos grupos de pacientes (12,5% bypass vs. 13% Supera, p=0,160). La estancia media fue inferior en pacientes tratados con Supera en comparación con los operados mediante cirugía abierta (3 días vs. 7 días, p<0,001).
ConclusiónEl uso del stent Supera para reparación de lesiones femoropoplíteas con afectación de segmento P1-P2 parece ser una opción válida con resultados a corto plazo similares a la cirugía convencional.
The use of the stent in the femoropopliteal sector has several anatomical disadvantages, and is associated with a higher rate of fracture and re-stenosis.
ObjectiveTo compare the patency obtained in patients with critical arterial ischaemia and femoropopliteal lesions, including interline, intervened using Supera stent compared to those operated using femoropopliteal bypass.
Material and methodsA retrospective analysis of patients with femoropopliteal lesions with P1-P2 involvement and critical ischaemia, treated with Supera stent versus patients treated by distal femoropopliteal bypass. Using the Kaplan-Meier method, the loss of patency was analysed during a mean follow-up of 12 months. The complications that appear and the mean hospital stay of the patients were also analysed.
ResultsA total of 63 interventions were performed between 2014 and 2016, of which 23 were Supera stent placement, and 40 by distal femoropopliteal bypass (77.5% with autologous vein). The primary patency in the autologous vein bypass group was 84% at 12 months, while in the Supera stent it was 77% (P=.630). The major complications (cardiac, respiratory, renal) were similar in both groups of patients (12.5% bypass vs. 13% Supera P=.160). The mean hospital stay was lower in patients treated with Supera stent compared to those operated on by open surgery (3 days vs. 7 days, P<.001).
ConclusionThe use of the Supera stent for the repair of femoropopliteal lesions with P1-P2 segment involvement seems to be a valid option with short-term results similar to conventional surgery.
En la actualidad, la revascularización endovascular de lesiones isquémicas en miembros inferiores está en auge. El tratamiento endovascular ha permitido el tratamiento en pacientes previamente desestimados, como los pacientes añosos o con pluripatología.
El sector femoropoplíteo presenta inconvenientes para el uso de stents debido a las fuerzas de compresión existentes en el canal de los aductores y la interlínea articular de la rodilla1-4.
El stent Supera (Abbott, Abbott Park, Illinois, EE.UU., 2006) es un stent de nitinol, autoexpandible, diseñado para resistir fuerzas extrínsecas a lo largo del eje femoropoplíteo.
En este estudio se analizan, de forma retrospectiva, los resultados en nuestro centro con el stent Supera en comparación con el tratamiento quirúrgico convencional (bypass femoropoplíteo distal).
El objetivo principal es comparar la permeabilidad obtenida en pacientes con isquemia arterial crítica y lesiones femoropoplíteas con inclusión de la interlínea intervenidos mediante stent Supera con respecto a los operados con bypass femoropoplíteo.
Como objetivos secundarios analizamos las complicaciones aparecidas, el tiempo de estancia media y el posible impacto de los distintos factores de riesgo sobre la permeabilidad.
MétodosPoblación de estudioSe realizó en nuestro centro un análisis retrospectivo, de pacientes con lesiones femoropoplíteas arterioescleróticas oclusivas con inclusión de la interlínea tratados de manera programada con stent Supera desde el 1 octubre de 2014 hasta el 30 septiembre de 2016. Los pacientes con lesiones exclusivamente localizadas en región femoral fueron excluidos. A su vez, se recogió en el mismo periodo los pacientes tratados de manera programada mediante bypass femoropoplíteo distal por lesiones arterioescleróticas oclusivas, excluyendo bypass a primera o segunda porción poplítea y a vasos infrapoplíteos. También fueron excluidos pacientes tratados por lesiones no arterioescleróticas o arterioscleróticas no oclusivas (como traumatismos, atrapamiento poplíteo o aneurismas poplíteos); así como pacientes con stents o bypass previos en la extremidad tratada. Sí fueron incluidos los pacientes a quienes durante o previamente a la revascularización con stent o bypass se les realizó una revascularización de la iliaca o femoral común ipsilateral (a esta variable se le nombró revascularización previa en extremidad intervenida).
En los pacientes tratados mediante bypass, se daba preferencia al uso de material autógeno (vena safena interna, vena de brazo) sobre el uso de prótesis (politetrafluoroetileno expandido [PTFE]), el cual se usaba en caso de ausencia de vena del paciente apta para bypass.
Se registraron un total de 204 intervenciones programadas en este periodo (104 endovasculares y 100 bypass femoropoplíteos). Se utilizó el stent Supera en 23 de ellas y se realizó bypass femoropoplíteo distal en 55 de ellas.
En total, 59 pacientes cumplieron con los criterios de inclusión/exclusión, realizándose 63 intervenciones (23 revascularizaciones mediante Supera y 40 mediante bypass femoropoplíteo distal).
Factores de riesgo y comorbilidadesSe recogieron en ambos grupos a través de la historia clínica: factores de riesgo cardiovascular (hipertensión arterial [HTA], diabetes mellitus [DM], dislipidemia [DL], tabaquismo, insuficiencia renal crónica [IRC], cardiopatía isquémica [CI], enfermedad pulmonar obstructiva crónica [EPOC]) y categoría Rutherford de isquemia arterial.
A través del angioTC o la arteriografía, se recogió y midió la longitud de la lesión a tratar, el tipo de lesión según la clasificación del TransAtlantic InterSociety Consensus-II (TASC-II)5 y el número de vasos de salida en cada caso.
En el grupo Supera se recogieron, además, el punto de punción, el número de stents usados y la longitud y el diámetro de los stents usados.
La decisión de implantación de stent o realización de bypass se decidía en sesión clínica con todo el equipo de cirugía vascular.
Estudio preoperatorio y procedimientoSe realizó en todos los pacientes un estudio vascular que incluía: índice tobillo-brazo, eco-doppler arterial y, en la mayoría de los casos, angioTC.
El procedimiento endovascular se realizó mediante punción percutánea ecoguiada de la arteria femoral común ipsilateral o contralateral utilizando un introductor de 6Fr. Se realizaba arteriografía diagnóstica para localización y caracterización de las lesiones. Todos los pacientes recibieron heparina sistémica ajustada a peso. Tras recanalización de la lesión, esta se predilató e implantó el stent siguiendo las recomendaciones del fabricante, anclando el stent en al menos 1cm de arteria sana por ambos extremos. No se realizó posdilatación en ningún caso. En 11 pacientes se requirió la colocación de stents adicionales.
Tras la intervención, se administró 375mg de clopidogrel, dejando doble antiagregación durante 4 semanas.
El procedimiento quirúrgico se llevó a cabo mediante disección medial de la arteria poplítea y dando preferencia al uso de material autógeno del paciente. Todos los pacientes fueron igualmente tratados mediante heparina sistémica ajustada a peso. Tras la intervención, los pacientes recibían dosis de ácido acetilsalicílico a las 6h de la cirugía, estando posteriormente con antiagregación simple de manera indefinida.
Los pacientes tratados de manera endovascular fueron dados habitualmente de alta en 24-48h, excepto aquellos que presentaban lesiones tróficas o complicaciones. Los pacientes quirúrgicos permanecieron la mayoría ingresados durante al menos 72h.
Se recogió el tiempo de hospitalización en cada paciente.
SeguimientoEl seguimiento en consultas se realizó al mes, a los 3, 6 y 12 meses y después cada 6 meses mediante anamnesis, control eco-doppler y, en caso necesario, angioTC. Se recogieron las complicaciones y eventos adversos aparecidos a los 30 días postoperatorios, así como la tasa de amputación y la mortalidad al año. También se recogió la permeabilidad presente del stent o bypass.
Se definió permeabilidad primaria a la permeabilidad de la intervención realizada hasta trombosis o nueva reintervención.
Se definió permeabilidad primaria asistida a la suma de la permeabilidad primaria con la permeabilidad tras reintervención de rescate del stent o bypass tras constatarse en eco-doppler o angioTC alteraciones hemodinámicas que nos sugieran un posible fallo, pero sin constatarse trombosis de los mismos.
Por último, se definió permeabilidad secundaria a la suma de la permeabilidad primaria asistida con la permeabilidad tras reintervención de rescate del stent o bypass tras constatarse trombosis de los mismos con eco-doppler o angioTC.
Análisis estadísticoSe utilizó el programa estadístico IBM SPSS Statistics versión 23 para el cálculo estadístico del estudio.
Se llevó a cabo un análisis descriptivo de la muestra, realizando un análisis de la media y el rango (valor mínimo y máximo) para las variables edad, seguimiento y estancia hospitalaria; para esta última se estimó también la desviación estándar. Para el resto de variables descritas anteriormente, se calculó la frecuencia y la frecuencia relativa.
Para calcular la tasa de permeabilidad, se estimó la curva de supervivencia por el método de Kaplan-Meier del tiempo hasta la pérdida de permeabilidad. La comparación de permeabilidad en ambos grupos se realizó mediante la prueba de log-rank. A continuación se analizó qué variables podrían estar asociadas con la supervivencia. Para evaluar la posible asociación de estas variables con la supervivencia se estimaron las curvas de Kaplan-Meier y se compararon con la prueba log-rank. Esto se realiza para todas excepto para la edad, que al ser cuantitativa no define grupos. Para la edad se estimó un modelo de regresión de Cox. Para la presencia o no de complicaciones en las distintas intervenciones, así como para observar las posibles diferencias en los factores de riesgo de ambos grupos, se realizó la prueba de Chi-cuadrado. Para evaluar las posibles diferencias en la estancia media se utilizó la prueba U de Mann-Whitney.
Se aceptó un nivel de significación para p<0,05 en todos los test aplicados.
Los análisis fueron realizados según intención de tratar, teniendo por tanto en cuenta la totalidad de los pacientes.
ResultadosPoblaciónDesde octubre de 2014 hasta septiembre de 2016 se realizaron un total de 63 intervenciones en 59 pacientes.
De estas, se realizaron 23 revascularizaciones endovasculares con stent Supera en 21 pacientes. La edad media de estos pacientes fue de 76 años (rango 48-96) y el seguimiento, de 12 meses (rango 1-26).
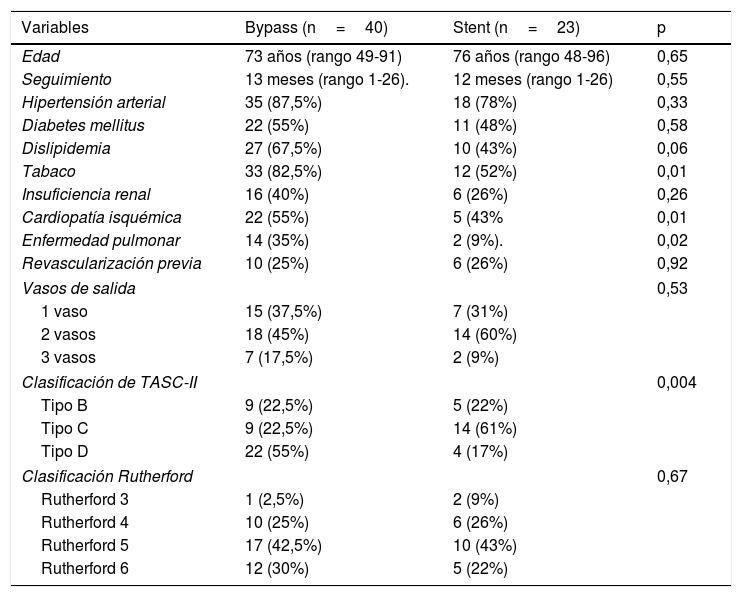
Los distintos factores de riesgo presentados en estos pacientes se detallan en la tabla tabla 1. En el 26% se había realizado una revascularización previa en la extremidad. Los vasos de salida infrapoplíteos presentes fueron de un único vaso (31%), 2 vasos (60%) o los 3 vasos (9%). La clasificación TASC-II fue: lesiones tipo B (22%), tipo C (61%) y tipo D (17%). La clasificación Rutherford fue: categoría Rutherford 3 en el 9% de casos, 4 en el 26%, 5 en el 43% y Rutherford 6 en el 22% de los casos.
Características de la población
| Variables | Bypass (n=40) | Stent (n=23) | p |
|---|---|---|---|
| Edad | 73 años (rango 49-91) | 76 años (rango 48-96) | 0,65 |
| Seguimiento | 13 meses (rango 1-26). | 12 meses (rango 1-26) | 0,55 |
| Hipertensión arterial | 35 (87,5%) | 18 (78%) | 0,33 |
| Diabetes mellitus | 22 (55%) | 11 (48%) | 0,58 |
| Dislipidemia | 27 (67,5%) | 10 (43%) | 0,06 |
| Tabaco | 33 (82,5%) | 12 (52%) | 0,01 |
| Insuficiencia renal | 16 (40%) | 6 (26%) | 0,26 |
| Cardiopatía isquémica | 22 (55%) | 5 (43% | 0,01 |
| Enfermedad pulmonar | 14 (35%) | 2 (9%). | 0,02 |
| Revascularización previa | 10 (25%) | 6 (26%) | 0,92 |
| Vasos de salida | 0,53 | ||
| 1 vaso | 15 (37,5%) | 7 (31%) | |
| 2 vasos | 18 (45%) | 14 (60%) | |
| 3 vasos | 7 (17,5%) | 2 (9%) | |
| Clasificación de TASC-II | 0,004 | ||
| Tipo B | 9 (22,5%) | 5 (22%) | |
| Tipo C | 9 (22,5%) | 14 (61%) | |
| Tipo D | 22 (55%) | 4 (17%) | |
| Clasificación Rutherford | 0,67 | ||
| Rutherford 3 | 1 (2,5%) | 2 (9%) | |
| Rutherford 4 | 10 (25%) | 6 (26%) | |
| Rutherford 5 | 17 (42,5%) | 10 (43%) | |
| Rutherford 6 | 12 (30%) | 5 (22%) | |
Además, en el grupo Supera, se realizó un acceso anterógrado en el 83% de las intervenciones. La longitud de la lesión superaba los 20cm en el 30% de los casos. El número de stents usados en cada intervención fueron: un stent (48%), 2 stents (43%) y 3 stents (9%). La longitud del stent fue >100mm en 30 de ellos, con diámetros de 4mm (5), 5mm (24), y 6mm (8).
No hubieron pérdidas en el seguimiento de los pacientes tratados con stent Supera.
Con respecto a los pacientes tratados mediante bypass, se realizaron 40 revascularizaciones quirúrgicas en 38 pacientes. De estas, el 70% fueron con vena safena interna in situ, el 7,5% con vena safena interna invertida, el 15% con PTFE, el 2,5% con vena de brazo y el 5% con compuesto de venas. La edad media de estos pacientes fue de 73 años (rango 49-91) y el seguimiento, de 13 meses (rango 1-26).
Los distintos factores de riesgo presentados en estos pacientes se detallan en la tabla tabla 1. En el 25% se habían realizado una revascularización previa en la extremidad. Los vasos de salida infrapoplíteos presentes eran de un único vaso (37,5%), 2 vasos (45%) o los 3 vasos (17,5%). La clasificación TASC-II fue: lesiones tipo B (22,5%), tipo C (22,5%) y tipo D (55%). La clasificación Rutherford fue: categoría Rutherford 3 en el 2,5% de casos, 4 en el 25%, 5 en el 42,5% y Rutherford 6 en el 30% de los casos (tabla 1).
En los pacientes tratados mediante bypass, hubo 3 pacientes que se perdieron en el seguimiento (7%).
Comparando ambos grupos mediante la prueba de Chi-cuadrado y U de Mann-Whitney (según tipo de variable), no se observaron diferencias estadísticamente significativas salvo en fumadores (82,5% bypass frente a 52% Supera, p=0,01), CI (55% frente a 43%, p=0,01), EPOC (35% frente a 9%, p=0,02) y clasificación TASC-II (lesión C 22,5% frente a 61%; y lesiones tipo D 55% frente a 17%, p=0,004) (tabla 1).
ComplicacionesEn cuanto a las complicaciones perioperatorias, mediante la prueba de Chi-cuadrado encontramos que en el grupo bypass aparecen complicaciones en el 42,5% (17 pacientes), mientras que en el grupo Supera presentan complicaciones el 30% (7 pacientes) (p=0,16) (tabla 2). De estas complicaciones, se observa unas complicaciones mayores (cardiacas, respiratorias, renales) en 5 pacientes (12,5%) en el grupo bypass frente a 3 pacientes (13%) en el grupo Supera; y mortalidad a los 30 días de 2 pacientes (5%) frente a un paciente (4%). También se observan otras complicaciones menores como son en el grupo Supera: embolia distal en el 8% (2 pacientes) y hematoma con necesidad de transfusión en el 4% (un paciente).
En el grupo bypass fueron: infección de la herida quirúrgica en el 10% (4 pacientes), persistencia de fístula arteriovenosa en el 5% (2 pacientes), dehiscencia de la herida en el 2,5% (un paciente), neuropatía persistente en el 5% (2 pacientes) y hematoma con necesidad de transfusión en el 2,5% (un paciente).
Y en cuanto a la mortalidad y amputación mayor ocurrida al año de seguimiento, 6 pacientes del grupo bypass murieron en el primer año (15%) y ninguno fue amputado, frente a 5 pacientes del grupo Supera que murieron (21%) y 2 fueron amputados (8%). No se hallaron diferencias estadísticamente significativas (p=0,51 y p=0,13, respectivamente, con la prueba de Chi-cuadrado).
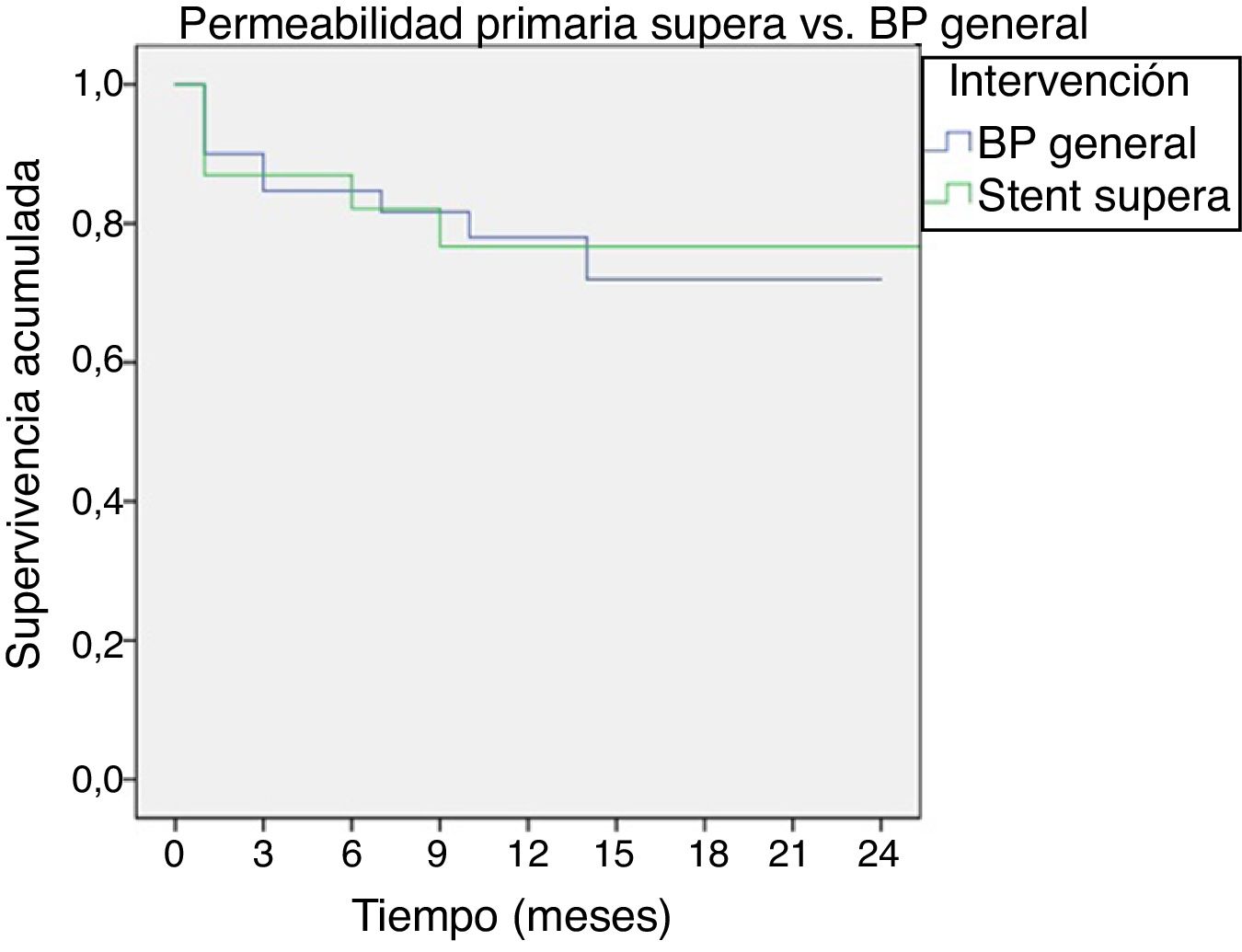
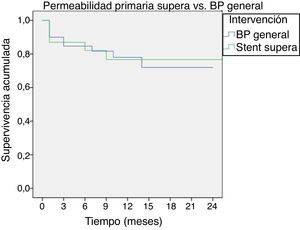
PermeabilidadesSe estimó mediante el método de Kaplan-Meier y la prueba de log-rank una permeabilidad primaria del 85% en todos los tipos de bypass y del 83% en stent Supera a los 6 meses, reduciéndose al 79 y 77% al año, respectivamente (p=0,950) (fig. 1).
En cuanto a la permeabilidad primaria asistida y secundaria, fueron del 92,5 y 95% al año en el bypass frente al 87% en ambas categorías en el Supera (p=0,890 y p=0,470).
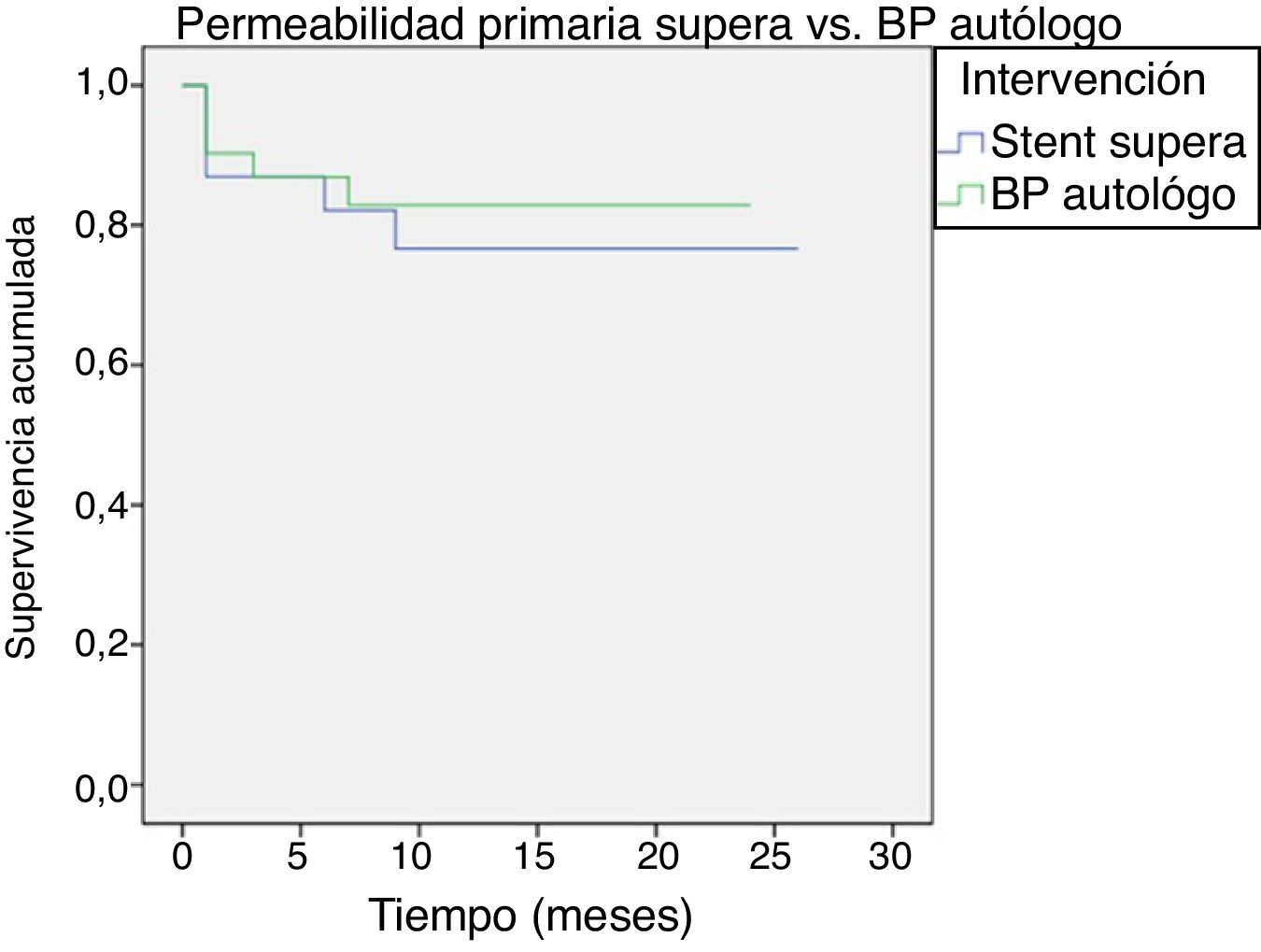
Posteriormente se realizó un análisis por los distintos tipos de injertos utilizados, comparándolos con la permeabilidad del stent Supera. Dado que los bypass realizados con PTFE y compuesto de venas tenían una muestra demasiado pequeña (6 y 3 intervenciones, respectivamente), estos no eran valorables, por lo que a continuación exponemos únicamente los resultados analizados del stent Supera frente a bypass con injerto realizado con vena autógena.
Las permeabilidades obtenidas del injerto con vena autógena frente al stent Supera fueron:
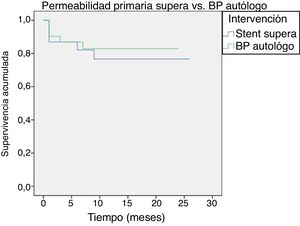
La permeabilidad primaria fue del 87% en bypass y del 83% en stent Supera a los 6 meses, pasando al 84 y 77% al año, respectivamente (p=0,630) (fig. 2).
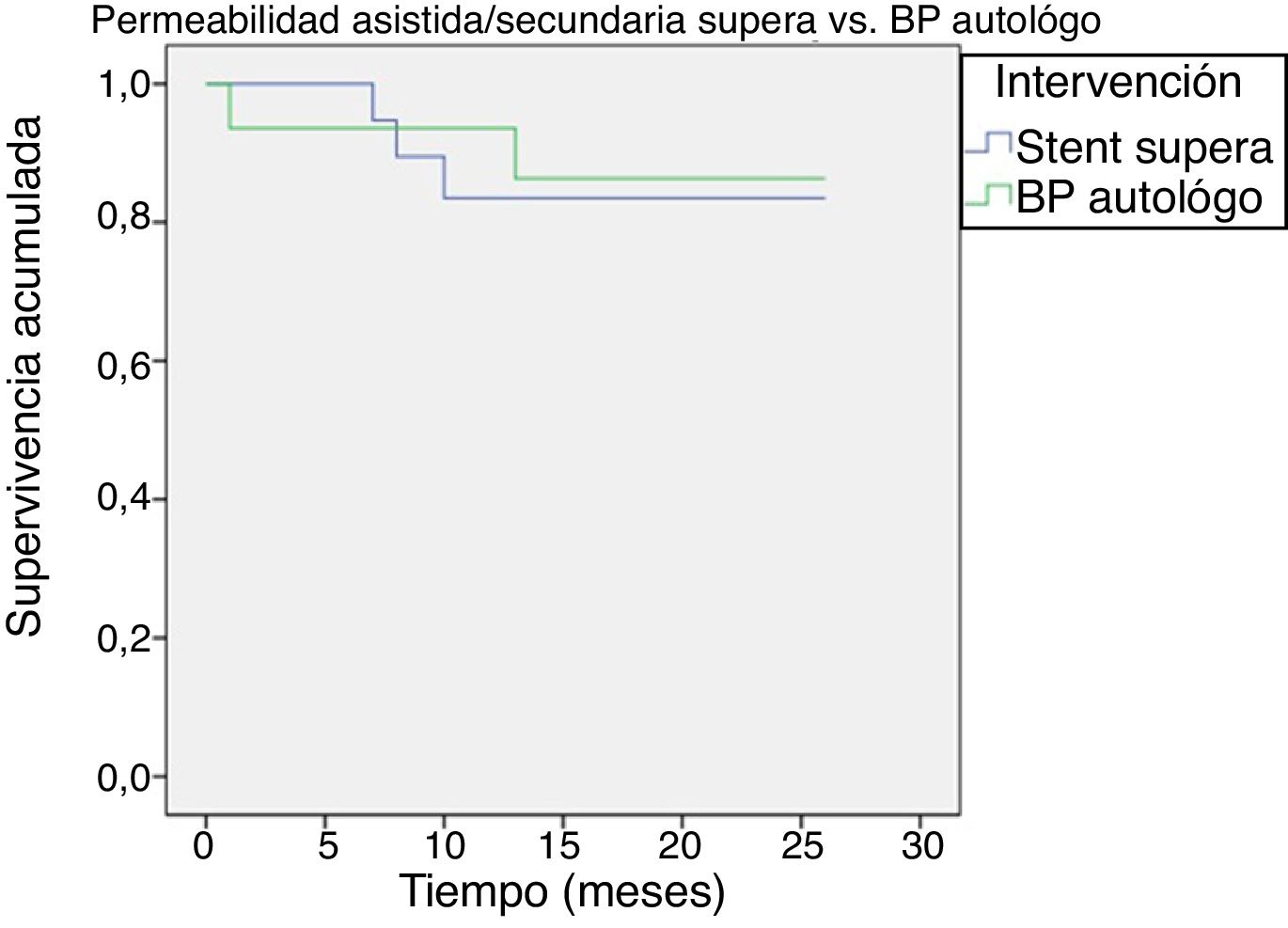
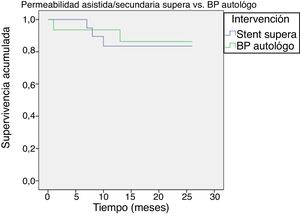
La permeabilidad primaria asistida y secundaria fue del 93,5% en bypass y del 100% en stent Supera a los 6 meses, pasando al 93,5 y 87% al año, respectivamente (p=0,680) (fig. 3).
Estancia hospitalariaLos pacientes del grupo bypass permanecieron hospitalizados una media de 7±4 días (rango 2-19 días). Por otra parte, los pacientes del grupo Supera permanecieron hospitalizados una media de 3±2 días (rango 1-13 días) (p<0,001 mediante la prueba U de Mann-Whitney).
Impacto de los factores de riesgoSe realizó un análisis multivariante comparando los distintos factores de riesgo con la permeabilidad primaria del stent Supera mediante el método de Kaplan-Meier y la prueba de log-rank o modelo de regresión de Cox según convenía, sin encontrar diferencias significativas en la comparación (tabaco, p=0,67; edad, p=0,15; HTA, p=0,98; DM, p=0,62; DL, p=0,46; CI, p=0,83; EPOC, p=0,36; IRC, p=0,53; revascularización previa, p=0,78; vasos de salida, p=0,42; clasificación TASC-II, p=0,53).
DiscusiónEl tratamiento endovascular de MMII está en auge en la actualidad, sobre todo en pacientes con venas no válidas para el bypass o que no son candidatos para la cirugía convencional. La tasa de complicaciones y el tiempo de hospitalización suelen ser inferiores que en la cirugía abierta6-9. Como por ejemplo en nuestro estudio, en que la estancia media hospitalaria era significativamente menor en el grupo Supera (3 vs. 7 días).
Sin embargo, la primera y segunda porción poplítea están expuestas a fuerzas de tracción producidas por la movilidad de las estructuras músculo-esqueléticas de su alrededor, que predisponen a la reestenosis y a la fractura del stent, por lo que esta zona suele ser conflictiva para el tratamiento endovascular10-12.
Así, por ejemplo, el estudio de Scheinert et al. del 2005, con 121 extremidades tratadas mediante stent en la región femoropoplítea, y seguimiento medio de 10 meses, muestra una tasa de fractura del 37,2% y una permeabilidad primaria al año significativamente menor en los pacientes con fractura del stent (41,1% vs. 84,3%, p=0,0001)13.
El stent Supera es más flexible y resistente a la compresión, por lo que resiste las fuerzas de torsión y flexión que se producen en los vasos femoropoplíteos.
Fue lanzado en 2010 y usado posteriormente en distintas instituciones hasta que fue aprobado en 2014 por la FDA.
Precisa de curva de aprendizaje, ya que hay que adecuar el diámetro del stent al de la arteria (1:1) para desplegarlo en su diámetro nominal, en el que alcanza la mayor fuerza radial, y conseguir buenos resultados de permeabilidad14.
En nuestro artículo describimos nuestra experiencia inicial en el stenting primario utilizando el stent Supera para lesiones en cuya extensión incluyan la interlínea articular, comparando los resultados con la cirugía abierta (bypass femoropoplíteo distal). Obtenemos una permeabilidad del Supera comparable a la del bypass (permeabilidad primaria del 85% en bypass vs. 83% en stent Supera a los 6 meses, siendo del 79% vs. 77% al año, respectivamente), sin presentar fractura del stent durante el seguimiento.
Además, en nuestro estudio, el grupo tratado mediante bypass presentaba una mayor proporción de lesiones tipo D según clasificación TASC-II que los del grupo Supera (55% vs. 17%); esto es debido a que los pacientes que presentaban lesiones más largas y complicadas, en las que se preveía el fracaso técnico del tratamiento endovascular, se pensaba directamente en realizar tratamiento mediante cirugía abierta. Esto deriva a su vez en que el grupo tratado con stent presentaba una mayor proporción de lesiones tipos B y C (del 83%), lo cual explicaría la tasa de abordajes anterógrados percutáneos (83%), ya que estas lesiones presentaban habitualmente un segmento sano en el origen de la arteria femoral superficial que favorecía el abordaje.
Estos resultados son equiparables a otros estudios publicados, como por ejemplo el de Steinert et al., quienes en 2013 publicaron 101 pacientes tratados con Supera, obteniendo una permeabilidad primaria del 87,7% y una mortalidad del 10% al año15.
Un año después, el mismo grupo publicó 439 pacientes con lesiones femoropoplíteas, tratados con Supera, con una permeabilidad primaria del 83,3% al año y del 72,8% a los 2 años. En ninguno de estos estudios hubo fracturas de stent, incluso cuando fue utilizado para el tratamiento de lesiones en la arteria poplítea16.
También, el SUPERB trial en 2015, estudio prospectivo multicéntrico, presentaba 264 pacientes con lesiones femoropoplíteas, en el cual se describía una permeabilidad primaria al año del 78,9% y una mortalidad a los 30 días del 0,4%17.
Por último, Leon et al. describieron la experiencia inicial en EE.UU. con stent Supera en el territorio poplíteo. Realizaron en 2013 un análisis de 34 pacientes con seguimiento de 12,7 meses, y obtuvieron una permeabilidad primaria del 79,2% y una mortalidad del 8,8% al año18.
Un dato relevante es que nuestro estudio presenta una tasa de pacientes con una isquemia arterial considerada crítica (categorías 4,5 y 6 de Rutherford) muy elevada (del 91%). Hay que destacar este dato porque este porcentaje de isquemia arterial crítica es más elevado que en el resto de estudios mencionados (22,8% con isquemia arterial crítica en el estudio de Steinert et al., 5,3% en el SUPERB trial o 73,5% en el estudio de Leon et al.)15-18.
A pesar de las tasas de complicaciones totales tan elevadas en pacientes tratados con Supera, las tasas de complicaciones mayores son similares a las de otros estudios (Leon et al.18 presentan una tasa de morbilidad mayor del 12%). Además, estas tasas de complicaciones mayores en pacientes tratados con Supera (13%) son similares a las obtenidas en pacientes tratados mediante bypass (12,5%).
Sin embargo, un dato en contra en nuestro estudio es la elevada tasa de mortalidad a los 30 días en los pacientes operados mediante Supera (4% frente a lo presentado en otros estudios como el SUPERB trial con mortalidad a los 30 días del 0,8%17). Esto podría explicarse por el estado basal de los pacientes (el 22% presentaba una isquemia en categoría 6 de Rutherford, el 46% cardiopatía isquémica, con media de edad de 76 años), lo cual nos recuerda que la revascularización endovascular no es un procedimiento inocuo.
LimitacionesEste estudio presenta diversas limitaciones, al tratarse de un estudio retrospectivo de un único centro y con una muestra de estudio pequeña. Además existe un sesgo de selección, ya que en los pacientes con lesiones más complicadas se realizaba bypass.
ConclusionesEn nuestra experiencia inicial, el uso del stent Supera para la reparación de lesiones que abarcan la interlínea articular en pacientes con isquemia crítica parece ser una opción válida en lesiones apropiadas y pacientes seleccionados, con resultados a corto plazo similares a la cirugía convencional.
Conflicto de interesesNo existe ningún interés personal, político o financiero por parte de los autores de este manuscrito en cuanto a material, información o técnicas descritas en el mismo.
Parte de los resultados de este manuscrito fueron presentados en el 63.o Congreso SEACV, que se realizó en Gijón, España, los días 6, 7, 8 y 9 de junio del 2017.