La publicación de la primera reparación endovascular de un aneurisma de aorta abdominal ha cumplido 20 años, y los estudios aleatorizados que comparan la cirugía abierta con la endovascular han completado los 10 años de seguimiento.
La experiencia en la reparación endovascular ha crecido notablemente, así como su uso ampliado a anatomías complejas mediante endoprótesis estándar en unos casos o con fenestradas y/o ramificadas en otros. El empleo para aneurismas rotos se ha difundido, aunque su uso sistemático para ello cuenta aún con dificultades y diversos puntos de controversia que motivan estudios no aceptados por todos. Las novedades en nuevas endoprótesis son continuas, y actualmente asistimos a un boom de ofertas comerciales, frente a un reducido grupo establecido en el mercado desde hace años que, no obstante, también ha implementado modificaciones que deben demostrar su efectividad a largo plazo. Sociedades científicas internacionales destacadas en el ámbito europeo y mundial han publicado actualizaciones de sus guías entre 2010 e inicios de 2011, en un intento de plasmar la actualidad de un campo tan cambiante.
En este momento parece razonable poner al día el documento publicado en el capítulo de Cirugía Endovascular de la Sociedad Española de Angiología y Cirugía Vascular (SEACV), que pretende ser un documento de base que, manteniendo la esencia del original, incorpora novedades, puntos de debate y propuestas razonadas de mejora a partir de las que establecer un acuerdo global en la reparación endovascular de AAA, tanto en aspectos clínicos como técnicos.
Por ello las recomendaciones son genéricas, a falta de un consenso explícito y recomendaciones oficiales emanadas de la sociedad científica que nos agrupa.
It is now twenty years since the publication of the first endovascular repair of an abdominal aortic aneurysm, and randomised studies comparing open surgery with endovascular surgery have completed 10 years of follow-up.
Experience in endovascular repair has markedly increased, as well its widened use in complex anatomies using standard endoprosthesis in some cases, or fenestrated and/or branched in others. The use for ruptured aneurysms has spread, although its systematic use still for this still has difficulties and several points of controversy due to studies not accepted by everyone. The innovations in new stents are continuous, and we are currently experiencing a boom in commercial offer, due to a reduced group established in the market for years. These, however, have also implemented changes that still are to show their effectiveness in the long term. International scientific groups in Europe and worldwide have published updates of their guidelines between 2010 and the beginning of 2011, in an attempt to reflect the current situation in such a changing field.
Up to this point, it seems reasonable to update the document published by the Endovascular Chapter of the Spanish Angiology and Vascular Surgery (SEACV), which attempts to be a reference document, that while maintaining the essence of the original, includes innovations, points for debate and reasoned proposals for improvement, from which to establish an overall agreement on the repair of abdominal aortic aneurysms, in both the clinical and technical aspects.
For this reason the recommendations are generic, lack a clear consensus and official recommendations by the Scientific Society to which we belong.
En el paciente con un aneurisma de aorta abdominal (AAA) las exploraciones complementarias pueden servir para confirmar el diagnóstico, establecer la indicación quirúrgica dependiendo del tamaño, tomar medidas para escoger la prótesis y realizar los controles postoperatorios periódicos. Una vez establecida la indicación de tratamiento endovascular, deben realizarse los estudios pertinentes.
Exámenes diagnósticosAl margen de las exploraciones empleadas en el cribado de la población en programas de detección de AAA, o de las que incidentalmente ponen de manifiesto la existencia de dicho hallazgo —entre las que figuran principalmente la ecografía1—, y una vez establecida la indicación de tratamiento endovascular, las exploraciones necesarias para poder hacer una adecuada indicación y planificación anatómica del tratamiento endovascular se concentran en unas pocas2.
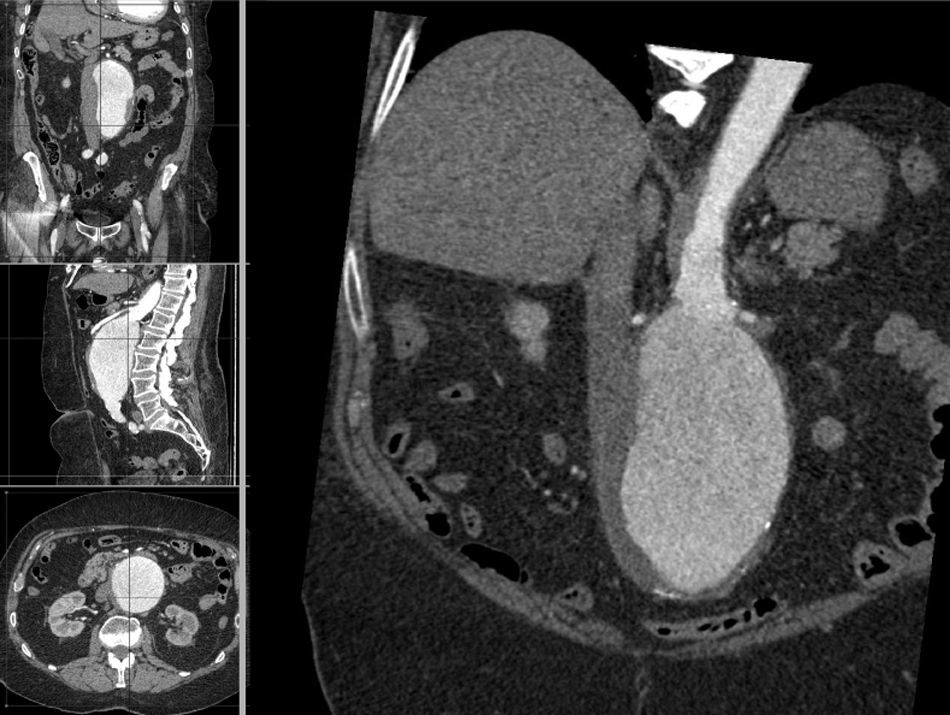
Con los avances en los equipamientos de tomografía computarizada (TC) multicorte se puede lograr una exploración del cuerpo entero en pocos segundos, con una resolución casi milimétrica, que al ser realzada con la administración de contraste yodado3 la ha convertido en la exploración principal4-6, ya que ofrece una información precisa sobre morfología, dimensiones, existencia y distribución de trombo mural y calcio parietal, arterias colaterales anómalas e incluso coexistencia de enfermedad oclusiva. En la mayoría de casos es incluso la única exploración requerida para dicho propósito, soslayando el empleo de la angiografía7.
La proliferación de plataformas informáticas para el análisis de los estudios con TC como las «estaciones de trabajo» y sus diversos programas convenientemente homologados por los organismos correspondientes (FDA, CE) ha propiciado que fueran asequibles al cirujano vascular y ha hecho más precisa y reproducible la planificación del tratamiento endovascular del aneurisma de aorta. Estudios metodológicos han puesto de manifiesto que la evaluación tridimensional para planificar el procedimiento endovascular de los AAA es fiable, rápida y reproducible8. Entre las herramientas que ofrecen figuran:
Las reconstrucciones multiplanares (MPR): son imágenes bidimensionales en múltiples planos del espacio
La proyección de intensidad máxima (MIP), que permite conocer la distribución precisa del calcio en la pared del vaso.
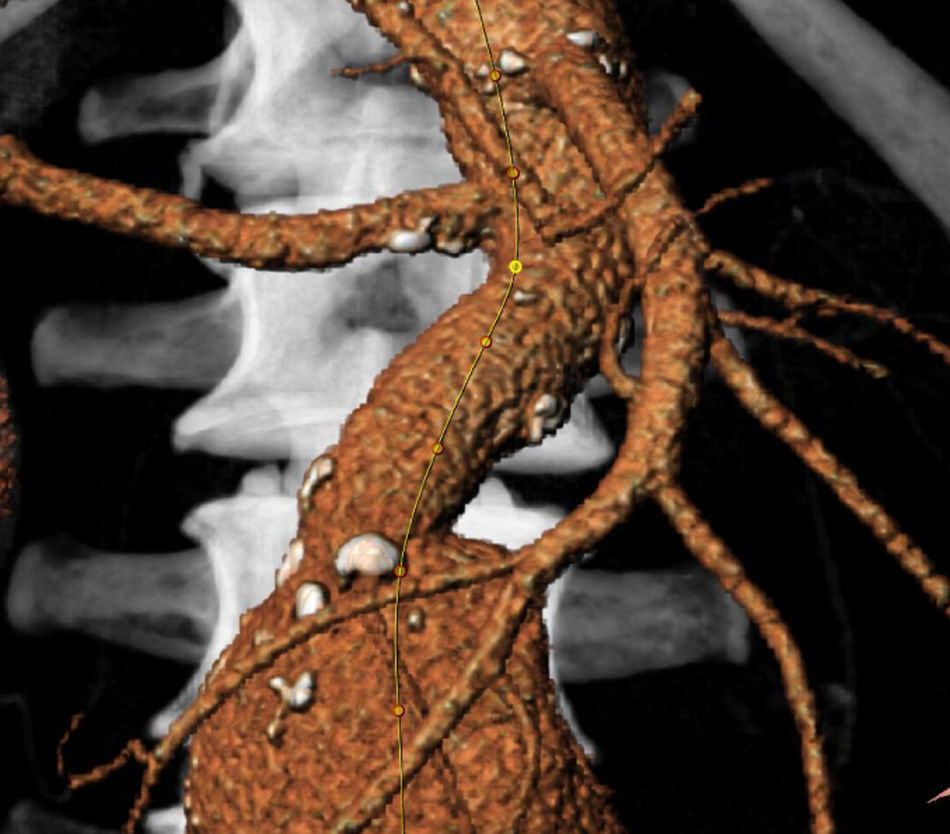
La reconstrucción tridimensional; aunque es más llamativa que útil, permite una visión global en 3D e identificar en qué punto del espacio nos encontramos, así como una representación más gráfica de las angulaciones y tortuosidades.
Línea central de la luz (CLL, central lumen line), que asociada al «estiramiento o rectificación» de la aorta es la recreación virtual de la arteria en cuestión, estirada a lo largo del eje central de la luz del vaso. Aunque permite medir diámetros de forma perpendicular a dicha línea acercándonos mucho al diámetro real teórico, también mide longitudes siguiendo tal línea. Sin embargo, la creación de esta CLL es un proceso semiautomático que el explorador puede manipular en diferentes sentidos llegando incluso distorsionar la realidad, cosa que hay que tener en cuenta. Además, las longitudes estimadas pueden no coincidir con las longitudes finales de la arteria que los dispositivos liberados, con sus rigideces variables, provocan al modificar de forma más o menos acusada la anatomía aórtica.
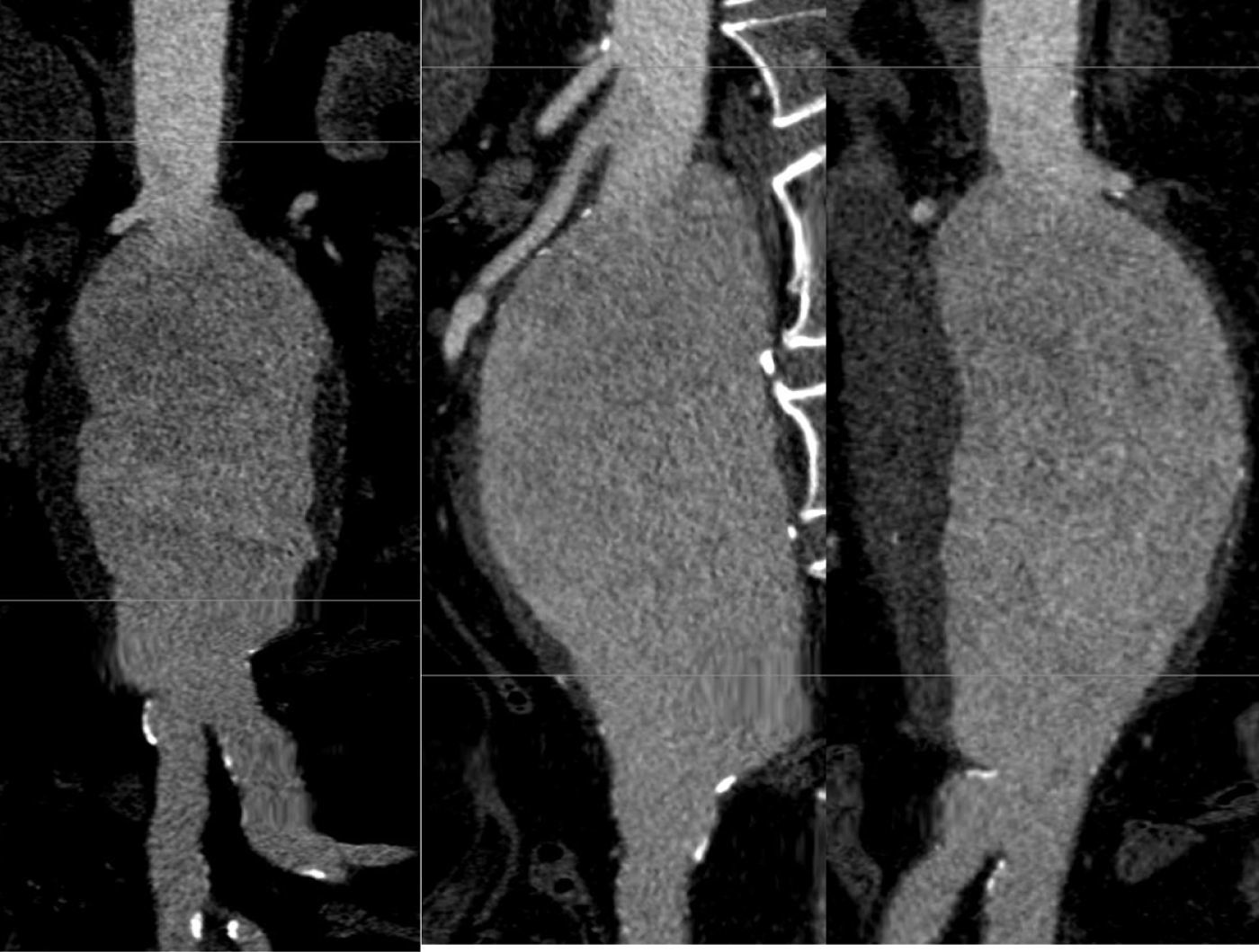
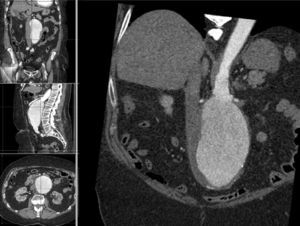
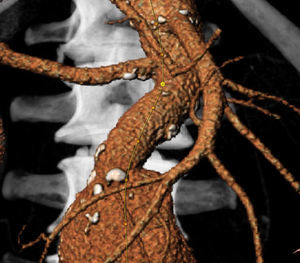
La información y las medidas obtenidas a partir de la TC son tanto más exactas cuanto menor es el grosor de los cortes, de manera que mientras no suponga una exposición excesiva a la radiación ionizante se consideran preferibles cortes con un grosor de menos de 3mm, e idealmente de 1mm o incluso menos. De esa manera las estimaciones que los programas informáticos harán para el estudio serán menores, y también lo será así el margen de error debido a la resolución espacial (figs. 1-3).
La angiorresonancia magnética (ARM) evita el empleo de radiaciones ionizantes y permite imágenes de gran calidad, pero su habitualmente menor disponibilidad, su lentitud de exploración, su limitación en pacientes con marcapasos o con claustrofobia, la magnificación de lesiones arteriales estenóticas y la potencial aparición del síndrome de fibrosis sistémica nefrogénica en pacientes con insuficiencia renal previa al emplear gadolinio o derivados9,10 la han relegado como exploración previa a tan solo algunos pacientes con probada reacción adversa al contraste yodado.
El examen angiográfico rutinario preoperatorio se ha obviado y tan solo se emplea para algunos casos con dudas sobre la existencia de lesiones oclusivas, cuando otras exploraciones como la ARM, la angioTC o los ultrasonidos no ofrecen suficiente claridad diagnóstica, o para conocer el comportamiento de las arterias con elongaciones extremas con guías rígidas, antes de proceder a la exclusión endovascular. La angiografía, que tuvo un papel relevante en otras épocas, ha sido descartada como exploración única, o incluso cuestionada como exploración necesaria en estos casos11.
Cuando la premura impera, como en los AAA rotos, el argumento que aboga a favor de la angioTC como única exploración previa cobra especial relevancia12.
Limitaciones e inconvenientes de las técnicas diagnósticasLa trascendencia que un adecuado estudio de imagen previo tiene de cara a la reparación endovascular ha sido comunicada en diversas publicaciones de impacto13, y por ello es necesario conocer la metodología y tener muy presentes sus limitaciones.
- 1.
Reacción adversa a contraste yodado. Puede motivar la necesidad de emplear otro medio de contraste o bien de un protocolo de medicación preventiva14.
- 2.
Insuficiencia renal crónica. Puede empeorar con el contraste yodado, y con el gadolinio y sus derivados desencadenar una fibrosis sistémica neurogénica10.
- 3.
Radiación ionizante. Hay que tener en cuenta que algunos de sus efectos secundarios son dependientes de la dosis, y a la dosis del estudio inicial hay que añadir las que eventualmente se requerirán en el momento de la intervención y en el seguimiento.
- 4.
Estudio radiológico inadecuado y artefactos en la exploración radiológica, por insuficiente administración de contraste, por obtención de cortes gruesos o por excluir zonas de interés, por objetos metálicos o por abundante calcificación.
- 5.
Toma inadecuada de las medidas, por medición sobre un estudio inadecuado, por mala medición o por el uso defectuoso de las herramientas durante el posprocesado de la imagen.
La planificación de la Reparacion Endovascular de Aneurismas (REVA) tiene una gran trascendencia, dado que en ella se basa la capacidad para decidir si la exclusión endovascular del aneurisma es viable, fiable y potencialmente durable. Además, también se basa en ella la elección del modelo y de la configuración y las dimensiones de la endoprótesis, así como la previsión de posibles procedimientos asociados y maniobras o recursos alternativos en caso de dificultades. La medición de diámetros, longitudes y ángulos es una parte decisiva pero no la única a considerar, ya que es una parte de la planificación, y de ahí la relevancia que tiene que el cirujano implantador esté familiarizado con todos estos aspectos.
Los puntos que deben considerarse en la planificación son:
- 1.
Vías de acceso vascular para el dispositivo: calibre, calcificación, tortuosidad y elongación y estenosis u oclusiones de la luz. Puede ser motivo de tener que cambiar el lado por el que introducir el cuerpo de la endoprótesis, que generalmente es de mayor perfil, o incluso a cambiar de modelo de endoprótesis con sistema de menos perfil, o de configuración de una endoprótesis.
- 2.
Estimación del espacio que tiene la endoprótesis para acomodarse en zonas estrechas o anguladas. Puede obligar elegir una configuración aorto-uniilíaca en vez de la habitual bifurcada.
- 3.
Estimación de la disposición en que quedará la rama corta del cuerpo que puede modificarse para poder facilitar su cateterización.
- 4.
Elección de las zonas de sellado proximal y distal.
La conveniencia de mejorar la fijación puede requerir sistemas de fijación suprarrenal, y la adaptación de endoprótesis de cuellos curvos puede ser mejor con unos que con otros tipos de endoprótesis, generalmente las que no tienen fijación suprarrenal, o con las que disponen de un stent de menor longitud. Diversos estudios han correlacionado la resistencia a la migración según los diferentes sistemas de fijación de la endoprótesis15.
La ausencia de suficiente longitud para lograr un sellado adecuado puede llevar a plantear endoprótesis fenestradas para arterias renales y/o viscerales, para alargar proximalmente el área de sellado con la aorta16.
La elección de la zona de sellado distal también cobra relevancia, sobre todo en los casos en que se asocia a ectasia y/o aneurismas de las ilíacas comunes. Se ha descrito la posibilidad de que la dilatación de las ilíacas comunes progrese con endofugas tipo 1 distales o incluso con rotura del aneurisma a partir de ellas. Por otro lado, la seguridad del sellado en las ilíacas externas comporta una mayor proporción de casos de trombosis de la misma a largo plazo y la asociación de un síndrome de isquemia pélvica, cuya evitación supone técnicas aún más complejas17.
La experiencia adquirida en el mundo tras 20 años de tratamiento endovascular de AAA, aunque genera nuevas controversias a la hora de extender el tratamiento a casos cada vez anatómicamente más complejos, permite identificar y en cierto modo cuantificar los factores que modifican el resultado de la reparación endovascular de AAA, y contemplan factores clínicos y factores anatómicos18.
En cuanto a la medición de diámetros, existen diferentes criterios, según la prótesis y las respectivas instrucciones de uso. En muchas se considera el diámetro interno (de íntima a íntima), pero en otras con mayor tolerancia a la sobredimensión o con distinta fuerza radial se aconseja emplear el diámetro externo (de adventicia a adventicia). Algunos estudios analizan el impacto que diversos factores pueden tener en las endofugas proximales y migraciones, entre los que se encuentran la sobredimensión respecto al diámetro del cuello aórtico19.
Con los estudios sobre la estación de trabajo se puede analizar con relativa facilidad el diámetro en la zona de sellado de forma perpendicular a la línea central de la luz arterial, pero en los cortes axiales de la TC sobre zonas anguladas se recomienda elegir, en secciones elípticas del vaso, el diámetro menor.
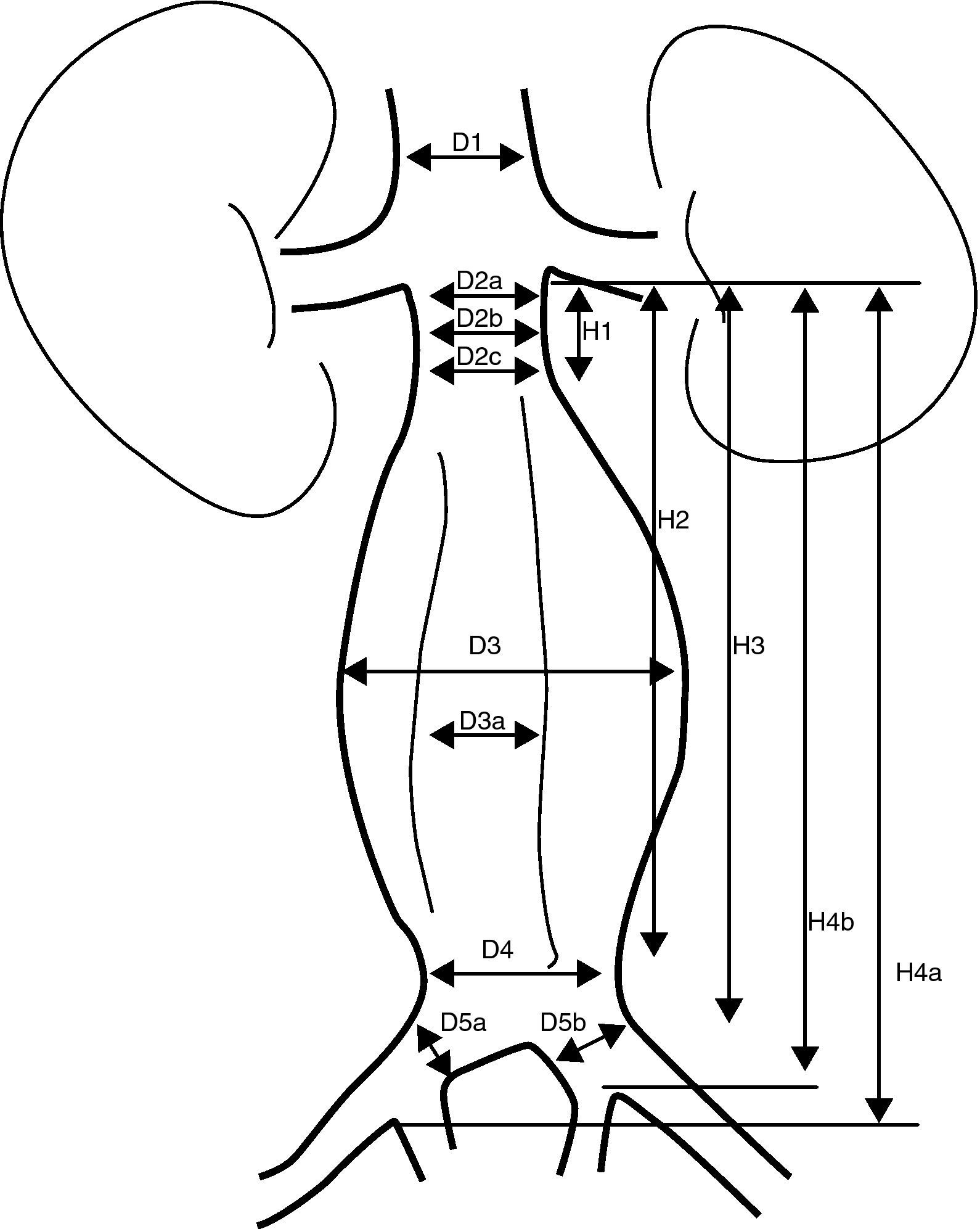
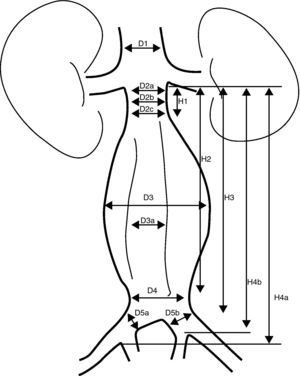
Se consideran las medidas que se especifican en la figura 4.
Mediciones necesarias en una valoración de un REVA.
D1: diámetro de la aorta suprarrenal
D2a: diámetro del cuello superior infrarrenal
D2b: diámetro del cuello medio infrarrenal
D2c: diámetro del cuello inferior infrarrenal
D3: diámetro externo del aneurisma
D3a: diámetro de la luz del aneurisma
D4: diámetro distal de la aorta antes de la bifurcación
D5a: diámetro de la ilíaca primitiva derecha
D5b: diámetro de la ilíaca primitiva izquierda
H1: longitud del cuello proximal
H2: longitud desde la línea infrarrenal hasta la parte distal del aneurisma
H3: longitud desde la línea infrarrenal hasta la bifurcación.
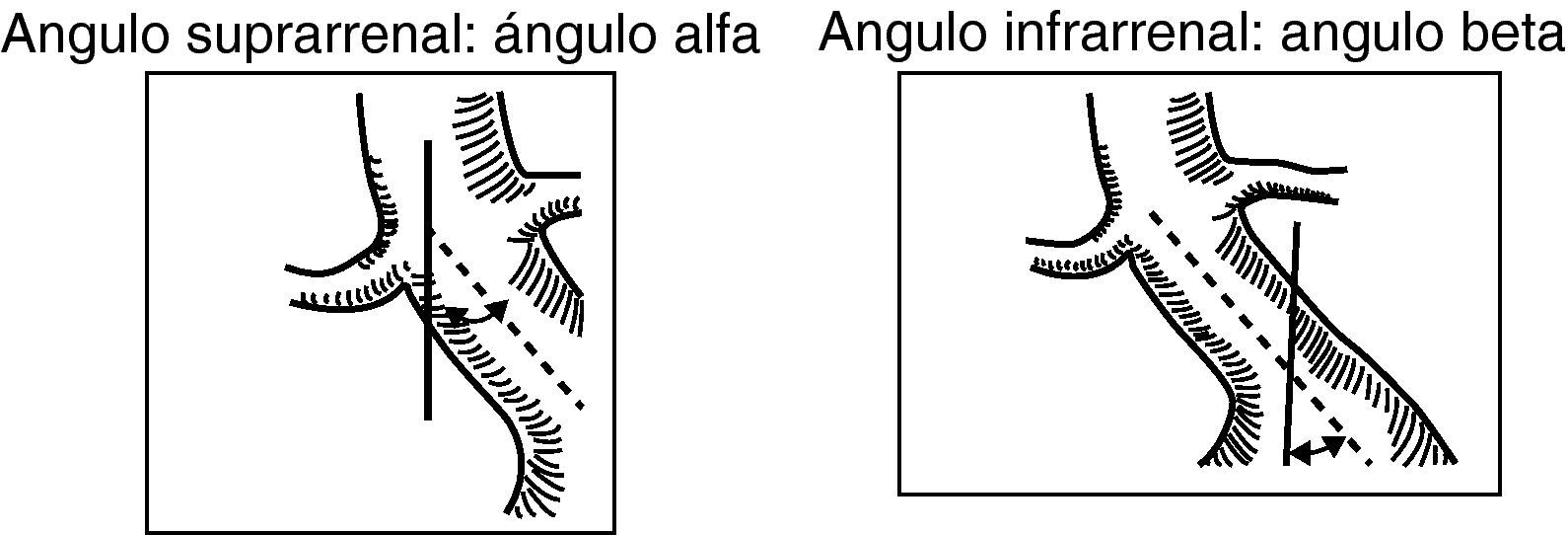
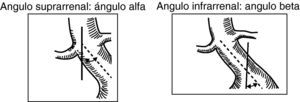
En el cálculo de las angulaciones del cuello de aneurisma, se considera:
- -
Ángulo alfa: ángulo entre el eje central del segmento de aorta suprarrenal y el del cuello infrarrenal.
- -
Ángulo beta: ángulo entre el eje del cuello infrarrenal y el de la luz del aneurisma. Se considera una angulación de 0¿ cuando el cuello es recto. Es aconsejable que sea menor de 60¿ (fig. 5).
Existen diversos parámetros anatómicos en relación tanto con el cuello como al aneurisma y las arterias ilíacas, y hacen referencia a diámetros, longitudes, angulaciones, existencia de trombo y calcificación, así como compromiso de arterias viscerales y/o pélvicas que permiten obtener una cuantificación de la anatomía de un aneurisma de cada al tratamiento endovascular19.
Es recomendable que la exploración usada para realizar las mediciones sea reciente (no más de 6 meses)20.
RecomendacionesPara la REVA, la exploración ideal es un estudio mediante TC con contraste (angioTC) de alta resolución, obteniendo cortes de grosor en torno a 1mm, con una antigüedad no superior a 6 meses.
La planificación se logra de forma más ágil y precisa con estaciones de trabajo adecuadamente empleadas, por lo que son recomendables.
En caso de limitación por insuficiencia renal, o reacción adversa a contraste yodado, una adecuada preparación con medicación y/o hidratación puede hacerla factible y reducir los riesgos de complicación.
La ARM o los ultrasonidos pueden completar la información de un estudio TC sin contraste, aunque la fiabilidad se reduce.
IndicacionesEs este un punto de gran trascendencia, pues pretende establecer a quién se debería tratar y cómo se debería tratar. La indicación de tratamiento depende en gran medida de las expectativas de éxito que tanto a corto como a largo plazo se espera tener con el tratamiento a la hora de prevenir la muerte o las complicaciones por la rotura de un aneurisma. Además de las referencias internacionales, la propia experiencia y los resultados también deben formar parte del árbol de decisión. Por otra parte, la introducción de la opción de terapéutica endovascular ha añadido una variable más, e inevitablemente ha establecido nuevas controversias.
Instituciones internacionales han establecidos guías prácticas21 que establecen criterios generales basados en la evidencia disponible, pero de forma general se basa en el balance de 4 aspectos:
- 1.
Riesgo de rotura del aneurisma
Durante los últimos 50 años, el principal elemento para indicar tratamiento ha sido el diámetro máximo del aneurisma, basado en un estudio de Szilagyi en los años sesenta22, que apreció que en pacientes con aneurismas >6cm la probabilidad de rotura era mayor. Sin embargo, el diámetro se determinaba por métodos imprecisos que incluso podrían sobrestimar dicho tamaño. Otros estudios con medios diagnósticos algo más precisos, como los ultrasonidos, establecieron el umbral para la indicación quirúrgica en 5,5cm23,24. Sin embargo esta norma ampliamente aceptada y empleada, incluso estimando el riesgo de rotura al año según el diámetro máximo25, tiene varios inconvenientes:
- -
En algunas series, en el 10 al 24% de pacientes con rotura de aneurisma éste tiene un diámetro <5,5cm26,27.
- -
En >50% de pacientes con aneurisma de entre 5,5 y 6ccm de diámetro máximo presentan rotura del mismo en un período medio de 19 meses, y solo de 9meses si es mayor de 7cm cuando son sometidos a observación o mientras el tratamiento se difiere por «alto riesgo quirúrgico»28.
- -
El método de determinar el diámetro máximo presenta problemas metodológicos: Muchos aneurismas tienen una sección elíptica en los cortes axiales de la TC, y el riesgo de rotura se ha correlacionado más con el diámetro menor de dicha sección elíptica, lo cual se explica en las reconstrucciones 3D, ya que dicha sección elíptica se debe a la tortuosidad del aneurisma más que a una verdadera forma asimétrica29,30. Por otro lado, en los estudios con reconstrucciones 3D el diámetro mayor parece ser el más apropiado para establecer el riesgo de rotura cuando la forma elíptica se debe a un aneurisma verdaderamente «asimétrico» (sacular)28. La mayoría de estudios sobre aneurismas no especifican cómo han determinado el diámetro máximo, aunque lo han considerado el principal criterio para el análisis de resultado
- -
Algunas técnicas cuantitativas como el wall stress, calculado a partir del análisis de elementos finitos mediante las reconstrucciones de una TC tridimensional31, son mejores que el diámetro para diferenciar los aneurismas con mayor riesgo de rotura. Sin embargo, este extremo no ha podido ser confirmado en estudios con grandes cohortes de pacientes32.
- -
Determinadas variables clínicas sí se han revelado como factores de riesgo para la rotura de aneurisma, como el sexo femenino, la enfermedad pulmonar obstructiva crónica, la hipertensión arterial, el tratamiento con esteroides y el tabaquismo activo.
Por ello aunque el diámetro máximo >5,5cm ha sido el patrón de oro, aún está lejos de ser el método ideal para determinar el riesgo de rotura. Aun así, y a falta de métodos más precisos, se sigue considerando vigente pero modificado por determinantes clínicos. Además, es necesario ceñirse a la obtención de diámetros y otras dimensiones siguiendo los estándares actuales establecidos para tales medidas33, lo que permite que los resultados obtenidos sean más comparables.
- -
- 2.
Riesgo operatorio
La cirugía abierta convencional tiene el patrón de resultados con el que se compara la opción endovascular, y para muchos aún sigue siendo la técnica de elección en pacientes con buenas condiciones generales para la solución de esta patología34,35.
La tasa de mortalidad actual para la cirugía abierta de los AAA está entre el 3 y el 8% en los centros con más experiencia, pero llega hasta al 8% en otras series36-38. Los peores resultados se observan en las series prospectivas multicéntricas, más que en los retrospectivos de un solo centro. Estos resultados se correlacionan con diversos grados de comorbilidad, e incluso existen escalas que lo cuantifican. En un estudio se han llegado a comparar 5 entre sí 39, obteniendo una aceptable correlación de entre el 75 y 80% y con la tasa de mortalidad postoperatoria prevista, aunque no con las complicaciones postoperatorias. Todas ellas hacen referencia al efecto que ejercen la función renal, cardíaca y/o respiratoria deterioradas, y en menor proporción, aunque también, el sexo y la edad. Los resultados postoperatorios en términos de morbilidad y de mortalidad también guardan relación con el volumen de intervenciones de cada cirujano y de cada centro40. Paradójicamente, la escala más empleada quizás por su simplicidad, y pesar de su subjetividad a la hora de decidir el tratamiento endovascular, es la escala ASA (American Society of Anestesiology). En dicha escala se valora el estado físico puntual por lo que puede estar sobrevalorada en caso de empeoramiento clínico puntual, o infravalorada en caso de patología crónica grave compensada. Por ello otras escalas de morbilidad pueden aportar más objetividad, a la hora de decidir la modalidad terapéutica.
Gran parte del impacto que los estudios sobre comorbilidades y morbimortalidad postoperatoria tienen sobre la cirugía abierta en el tratamiento de los aneurismas de aorta ha quedado algo minimizado por el eco que ha tenido en este tratamiento la reparación endovascular debido a su menor morbimortalidad inmediata. Aunque este tema ha sido motivo de encendidos debates, con la evolución de la técnica y la experiencia adquirida la tasa de mortalidad en la reparación endovascular programada de los aneurismas de aorta se ha mostrado consistentemente menor que para la reparación abierta en estudios nacionales, como el que recoge 7.000 casos con menor mortalidad (1,3% vs 3,8%, p=0,0001) y morbilidad (18% vs 29%, p=0,0001) frente a la cirugía abierta, a pesar de tener una gran proporción de octogenarios41, o en otro trabajo similar con análogos resultados a pesar de concentrar mucha mayor comorbilidad en el grupo endovascular42. Sin embargo, estos estudios grandes en volumen tienen el sesgo de selección, puesto que no son aleatorizados. Por ello los estudios aleatorizados multicéntricos aportan más consistencia. Entre estos son de destacar el estudio EVAR143, que con un total de 1.252 pacientes aleatorizados a tratamiento endovascular o cirugía abierta, mostró una mortalidad mejor en el grupo endovascular (1,8% vs 4,3%, p=0,02). El estudio DREAM44, con 351 pacientes, también mostró una mejor mortalidad frente al grupo quirúrgico (1,2% vs 4,6%, p=0,1). El estudio OVER45 incluyó 881 pacientes, y el grupo endovascular presentó menor mortalidad (0,5% vs 3,0%, p=0,004).
Por lo tanto, el resultado inmediato del grupo endovascular se ofrece como más atractivo en cuanto a morbilidad, mortalidad y menor agresividad, lo que justifica una gran aceptación por parte de los pacientes. Sin embargo, el coste de la endoprótesis y el resultado a largo plazo —que requiere algún tipo de seguimiento—, así como la eventual actuación en una relativamente alta proporción de los casos, hacen, junto con algún otro aspecto como la limitación anatómica, que no sea el único tratamiento a considerar.
- 3.
Expectativas de vida del paciente
Es el elemento cuyo juicio resulta más difícil, pero sin embargo es crítico a la hora de tomar una decisión sobre si ofrecer o no un determinado tipo de tratamiento. Se estima que la supervivencia de un paciente que sobrevive al tratamiento de un aneurisma de aorta es de 13 años para los que tienen 60 años, de 10 años para los de 70 años y de 6años para los de 80años46. Estos valores son algo peores que los de la población general, pues los afectados por aneurisma de aorta presentan mayores patologías asociadas. Así, otro trabajo encontró que la supervivencia media a los 5 años es del 70% en los pacientes tratados de un aneurisma, mientras que es del 80% en la población general47. La clave estaría en cómo incorporar las diferentes comorbilidades en un predictor razonable de la expectativa de vida, pero ello no es simple. Uno de los intentos está en la escala de Glasgow, que aunque logra detectar diferencias significativas en la mortalidad a corto y a largo plazo en cirugía tanto abierta como endovascular, su precisión se sitúa entre el 75 y el 80%, y la sensibilidad de algunos resultados cae incluso hasta el 55%39,48,49. La dificultad para tomar decisiones en pacientes con patologías asociadas relevantes queda reflejada en el estudio EVAR 2, en el que pacientes considerados no aptos para cirugía abierta eran asignados de forma aleatoria a tratamiento endovascular o a actitud expectante. En el grupo sometido a la actuación endovascular la mortalidad a los 4 años era del 64%, con algunas contradicciones, como que el 50% de los fallecimientos de los asignados a la opción endovascular ocurrieron en el intervalo previo al tratamiento programado; la mortalidad operatoria fue del 9%, pero además la mortalidad operatoria de 47 pacientes que pasaron del brazo de actitud expectante a la exclusión endovascular fue del 2%50. Por ello, una indicación uniforme no parece apropiada, sino que la opción más plausible consiste en dirigir el tratamiento hacia aquellos con mayor riesgo de rotura, la optimización de su estado general y, en caso de que sea posible mejorarlo, llevar a cabo la reparación del aneurisma con el procedimiento que permita una menor mortalidad operatoria.
- 4.
Características anatómicas del paciente y de su aneurisma
Un cuarto elemento en juego a la hora de establecer la indicación de tratamiento es la anatomía del paciente y de su aneurisma.
De cara a la opción de cirugía abierta, la existencia de un abdomen hostil, con intervenciones abdominales previas, presencia de ostomías o de masas viscerales intraabdominales distintas del aneurisma, puede hacer orientar la preferencia al tratamiento endovascular.
Para aceptar como apropiada la exclusión endovascular, la anatomía del aneurisma representa un factor determinante. Los criterios que se establecían en un principio han ido cambiando con el tiempo y generalmente hacia la ampliación de criterios más que hacia la restricción51, debido a la experiencia adquirida con los dispositivos y con la aparición de algunos nuevos con diferente comportamiento, según la anatomía.
La anatomía aórtica también hace variar el tipo de prótesis a implantar, ya que por su dispositivo de anclaje unas necesitan condiciones anatómicas distintas que otras52. Incluso nuevas prótesis fenestradas permiten su colocación suprarrenal53.
De forma general, para la colocación de endoprótesis en el aneurisma de aorta abdominal infrarrenal son necesarias las siguientes condiciones anatómicas, aceptadas por la gran mayoría de sociedades internacionales54.
El objetivo en esta zona es conseguir el sellado de la endoprótesis, lo cual depende principalmente de la longitud del cuello y del dimensionamiento adecuado de la prótesis. La fijación, además del mecanismo pasivo de fricción por la tendencia autoexpansiva de las endoprótesis, puede verse reforzada por mecanismos de fijación activos por púas o «ganchos» en la endoprótesis, e incluso en algunas con extensión suprarrenal.
- -
Diámetro. Aunque existen diferentes diámetros de prótesis dependiendo del tipo y del fabricante del dispositivo, el diámetro del cuello debe encontrarse entre 17 y 32mm.
- -
Longitud del cuello. Se precisa un cuello mínimo para el anclaje de la prótesis. Es recomendable una longitud igual o superior a 15mm, aunque en anatomía de cuello recto algún fabricante de los que disponen de fijación suprarrenal acepta los 10mm de longitud de cuello como la mínima recomendable.
- -
Angulación. Algunas prótesis son más amoldables que otras, pero lo ideal es que no exista ángulo entre el cuello y el aneurisma por la posibilidad de desplazamientos de la prótesis. Es recomendable que la angulación sea inferior a 60¿.
- -
Calcificaciones y/o trombo mural. La fijación de la prótesis será peor en presencia de calcificaciones y la posibilidad de fugas proximales aumenta, por lo que lo ideal es que no existan. De todas formas, calcificaciones aisladas y no circunferenciales y la presencia de trombo asimismo no circunferencial (<50%) y de escaso espesor (<2mm) no contraindican la colocación de la endoprótesis.
- -
Forma del cuello. La situación ideal es un cuello de forma cilíndrica regular. Los cuellos cónicos, cónicos invertidos, en reloj de arena o en tonel pueden favorecer el desplazamiento de la prótesis. En dichos casos es necesario que la longitud estimada de sellado sea lo suficientemente larga y sólida, respectivamente, para evitar la endofuga proximal. Estos aspectos han tenido gran impacto a la hora del diseño y de la técnica de liberación de las diferentes endoprótesis19.
- -
Diámetro de la luz arterial en la bifurcación aórtica (D4). En los pacientes con diámetros inferiores a 18mm debe considerarse el tratamiento con una endoprótesis aorto-uniilíaca, por imposibilidad de albergar las dos ramas de una bifurcada.
- -
No deben presentar angulaciones excesivas ni elongaciones extremas, sobre todo en presencia de calcificaciones, por la posibilidad de que no se consiga que el dispositivo progrese en sentido ascendente.
- -
La situación ideal es que no tengan estenosis, y si así fuera, estas deben ser dilatadas mediante angioplastia previamente a intentos de navegación con la endoprótesis.
- -
Es recomendable que las ilíacas comunes tengan un diámetro mínimo de 7mm. Pero será la elección de la prótesis de acuerdo con el diámetro de las ilíacas la que determine el mínimo, ya que al igual que en el caso del cuello proximal, los diámetros de los dispositivos varían en función del fabricante, y la tendencia más actual es a la reducción constante del perfil (diámetro externo de 18F o incluso de 14F)
- -
Es conveniente que las ilíacas comunes tengan un calibre máximo que dependerá del tipo de prótesis empleada. Puede hablarse, en general, de un calibre máximo de 20-22mm. Si es superior, hay que plantearse colocar la prótesis en la ilíaca externa.
- -
De la misma forma, la presencia de arterias lumbares muy desarrolladas y la permeabilidad de la arteria mesentérica inferior son situaciones que pueden dar lugar a fugas en estas zonas, manteniendo permeable el aneurisma con el riesgo de rotura diferida que ello conlleva. Por lo tanto, lo ideal es que no existan vasos permeables en él.
- -
No es recomendable que existan arterias renales polares por el riesgo de trombosis de las mismas, que implicaría pérdida de masa renal o, en caso contrario, daría lugar a fugas en esta zona.Algún trabajo reciente y crítico con la REAV como el publicado por Schanzer en Circulation 2011;123: 2848-2855, ha puesto de manifiesto que en general hay una insuficiente adhesión, a l os criterios anatómicos para la indicación de procedimientos endovasculares en para AAA, propuestos en diversas Guías de práctica clínica internacionales. En dicha falta de adhesión dicho trabajo justifica que haya subgupos de pacientes con incremento del diámetro del del saco, y riesgo de rotura, y en definitiva reduciendo la durabilidad de la REVA
- •
El tratamiento está indicado en aneurismas con diámetro máximo de 5,5cm o superior, modificándolo según las particularidades clínicas de cada caso y estableciendo un balance entre el riesgo de rotura, el riesgo operatorio ajustado a la propia experiencia, las expectativas de vida y la anatomía del aneurisma (tabla 1).
Tabla 1.Requerimientos mínimos para las endoprótesis estándar disponibles
Cuello aórtico proximal - Diámetro>17mm y <32mm - Ángulo alfa (entre la aorta supra e infrarrenal): <60¿ - Ángulo beta (entre la aorta infrarrenal y el eje del aneurisma):<60¿ - Longitud del cuello: >10mm - Trombo en el cuello: <50% del perímetro - Calcificación: <50% del perímetro - Dilatación cónica del cuello: <3mm en los primeros 10mm - •
En pacientes con expectativas de vida larga y condiciones anatómicas favorables, la cirugía abierta es aún hoy día la primera opción terapéutica, sobre todo en equipos con buenos resultados de morbilidad y morbilidad inmediata.
- •
En pacientes con un AAA >5,5cm, con una morfología favorable y mayores de 70 años, con riesgo quirúrgico moderado o abdomen hostil, la exclusión endovascular es la opción a considerar.
- •
En pacientes de alto riesgo es necesario lograr una mejoría de su patología asociada antes del tratamiento endovascular para obtener resultados a medio y largo plazo que justifiquen su reparación.
- •
En general, pero sobre todo en el resto de casos, es necesario proceder a una valoración individualizada, ajustada a las posibilidades y a la experiencia de cada grupo quirúrgico y/o cirujano.
- •
Es necesario adherirse a los criterios anatómicos recomendados por las guías de práctica clínica que las sociedades científicas establecen.
Clásicamente la especialidad de angiología y cirugía vascular ha desarrollado y evaluado intervenciones de reconstrucción arterial compleja, ofreciendo formación adecuada en la anatomía, la patología, la historia natural y el tratamiento médico y quirúrgico de la patología aneurismática. En los últimos tres lustros, la explosión del tratamiento endovascular ha sido asimilada por esta especialidad, y actualmente es una práctica habitual. Además dispone de experiencia en el tratamiento de las eventuales complicaciones generadas por los procedimientos endovasculares.
Por ello se ha incorporado como parte de la formación obligatoria en los programas docentes de posgrado, y es una terapéutica incluida en las carteras de servicios de las unidades de angiología y cirugía vascular, sobre todo en las acreditadas para la docencia.
Ello incluye:
Formación en protección radiológicaSiguiendo la normativa europea EURATOM en su artículo 9 de la directiva 97/43, y según se articula en la orden 3276/2007, de 23 de octubre, publicada en el BOE 272, página 46.539, es obligatorio el segundo nivel de formación en protección radiológica de los profesionales que llevan a cabo procedimientos de radiología intervencionista. Ello supone tener primero el título de dirección de instalaciones de radiodiagnóstico, y obtenerlo a través de entidades homologadas por el Consejo de Seguridad Nuclear.
Además, tal como se establece en las recomendaciones para la competencia para el tratamiento endovascular de los aneurismas torácicos que podemos aplicar a los abdominales, para el adiestramiento en la REVA son necesarias la formación y la competencia en los siguientes campos55:
Selección de los pacientesEs preciso estar familiarizado con las técnicas diagnósticas actuales (TC y reconstrucciones 3D), medidas y planteamiento de un procedimiento. Se considera un nivel de formación adecuado la realización de 25 procedimientos de REVA, actuando como primer cirujano en los dos últimos.
Un aspecto de gran importancia es el control de los pacientes y la actuación sobre las endofugas durante el seguimiento, dependiendo de los cambios morfológicos del AAA para evitar el fallo del dispositivo y la rotura del aneurisma
Habilidades endovasculares periféricasEs preciso el dominio de las diferentes técnicas endovasculares para realizar el procedimiento y diagnosticar y tratar las complicaciones. Entre otras hay que considerar:
- •
Técnicas de cateterismo selectivo y selección de catéteres.
- •
Abordaje femoral contralateral.
- •
Abordaje braquio-crural (técnica thru and thru).
- •
Uso de lazos recuperadores.
- •
Técnicas de embolización selectiva.
- •
Mediciones intraoperatorias de longitud y calibre arterial.
- •
Técnicas de angioplastia y stent arterial.
- •
Fibrinólisis intraarterial.
En este aprendizaje debemos incluir la formación en los diferentes aparatos precisos para la realización de estas técnicas.
Conocimiento de la patología de la aorta abdominalEs básico estar habituado al diagnóstico, a la historia natural, a las diferentes opciones de tratamiento y al reconocimiento y el tratamiento de las complicaciones más habituales: fallo renal, isquemia miocárdica, ateroembolismo, entre otras.
Capacidad de solucionar las lesiones en los diferentes accesos mediante tratamiento «abierto»En el caso de los cirujanos vasculares, todos estos apartados figuran en el nuevo programa de formación de la especialidad. Aunque ya se estaba aplicando de una forma oficiosa y generalizada, fue publicado varios años después de estar elaborado, en el BOE 110, página 19.853, del 8 de mayo de 2007, recogiendo la orden SCO/1258/2007, de 13 de abril de 2007. Según este programa, se cuantifica el mínimo de procedimientos diagnósticos y terapéuticos que debe realizar como parte de la formación habitual del cirujano vascular. Únicamente el requisito de tener la acreditación homologada en protección radiológica depende de organismos externos, con los que la propia Sociedad Española de Angiología y Cirugía Vascular (SEACV) acuerda cursos con periodicidad anual para los miembros que no los tienen y para los que están en período de formación.
Como en cualquier especialidad, la formación continuada es fundamental. Probablemente en este campo sea más importante porque la innovación tecnológica es más abundante. El informe del SVS/SIR/SCAI/SVMB Writing Committee to Develop a Clinical Competence Standard for REVAR recomienda la realización de 10 horas de formación continuada específica endovascular55.
Como ocurre en la implantación/desarrollo de cualquier otra técnica quirúrgica, la formación constituye un elemento fundamental para limitar lo que se ha denominado «curva de aprendizaje». Es deseable que las dificultades técnicas y las complicaciones debidas a la falta de experiencia se reduzcan al mínimo. Por ello el entrenamiento en centros con experiencia suficiente —incluyendo los procedimientos de intervencionismo básico, la implantación progresiva en el arsenal terapéutico y la adecuada selección de los casos— es la clave para obtener resultados satisfactorios. No es fácilmente concebible iniciar la experiencia endovascular con una endoprótesis en la aorta abdominal. Esta intervención puede precisar una combinación de habilidades endovasculares que no son aplicables si no existe experiencia previa con ellas.
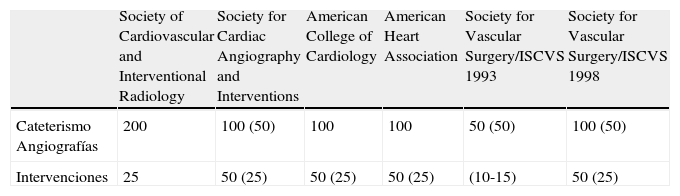
Una cuestión debatida mundialmente es la cuantificación de los procedimientos previos necesarios para poder «acreditarse» como cirujano endovascular. En la tabla 2 se detallan los mínimos requeridos dependiendo de las diferentes sociedades científicas de Estados Unidos.
Mínimos requeridos por las diferentes sociedades en Estados Unidos
| Society of Cardiovascular and Interventional Radiology | Society for Cardiac Angiography and Interventions | American College of Cardiology | American Heart Association | Society for Vascular Surgery/ISCVS 1993 | Society for Vascular Surgery/ISCVS 1998 | |
| Cateterismo Angiografías | 200 | 100 (50) | 100 | 100 | 50 (50) | 100 (50) |
| Intervenciones | 25 | 50 (25) | 50 (25) | 50 (25) | (10-15) | 50 (25) |
Los números entre parenthesis indican intervenciones como cirujano.
Esta tabla puede orientar sobre la experiencia que podría necesitarse para implantar una endoprótesis en un aneurisma de la aorta abdominal, asumiendo que esta técnica podría considerarse como de un nivel medio-alto dentro de la cirugía endovascular.
RecomendacionesEs preciso incluir en la formación del cirujano vascular un adiestramiento en cirugía endovascular, siguiendo los requisitos establecidos en el programa de formación MIR.
Dicha formación debe permitir diagnosticar, evaluar, tratar y resolver eventuales complicaciones de las actuaciones endovasculares.
Los cirujanos formados en cirugía endovascular deben proseguir una formación continuada específica, dado el carácter de evolución continua de la especialidad en todos sus campos, incluidos los aspectos endovasculares. Es esencial mantener la excelencia en Cirugía vascular y además de la formación la mejor práctica clínica es la que se realiza en centros con alto numero de intervenciones de Aneurisma. Siguiendo a la sociedad Europea de Cirugía Vascular, se considera que un numero anual en torno a 50 es el adecuado para ello54.
Aspectos técnicosPreparación del pacientePosición de decúbito supino. El abdomen debe quedar preparado para una eventual conversión a cirugía abierta. Además, la posición debe permitir el desplazamiento del arco radiológico a lo largo de la zona que se va a tratar. La posición más habitualmente empleada es la del brazo derecho separado e izquierdo pegado al cuerpo (para permitir el paso libre del arco), o bien los dos brazos pegados.
AnestesiaPuede ser local, regional o general, aunque la mayoría de autores describe una de las dos últimas.
Disposición en quirófanoSe recomiendan dos cirujanos, aparte de la enfermera, que se sitúa en el lado derecho. Los cirujanos pueden colocarse frente a frente o en el lado derecho del paciente. Esta disposición puede variar según la arquitectura y los hábitos de cada equipo quirúrgico.
Implantación de la endoprótesis56 (tabla 3)Abordaje. La zona de abordaje es la vía femoral bilateral, para la que se puede seguir la punción o la exposición quirúrgica. Lo más común es la quirúrgica, aunque existen dispositivos que permiten el cierre percutáneo de punciones de alto perfil, e individuos con experiencia en ellos57. A pesar de ello, estas técnicas tienen limitaciones en casos de calcificaciones femorales o de elongaciones de la ilíaca externa. Si el dispositivo no se emplea adecuadamente también se producen complicaciones hemorrágicas. Por otra parte, la vía quirúrgica puede ser la única en casos de prótesis aorto-uniilíacas a las que asociar un bypass cruzado fémoro-femoral.
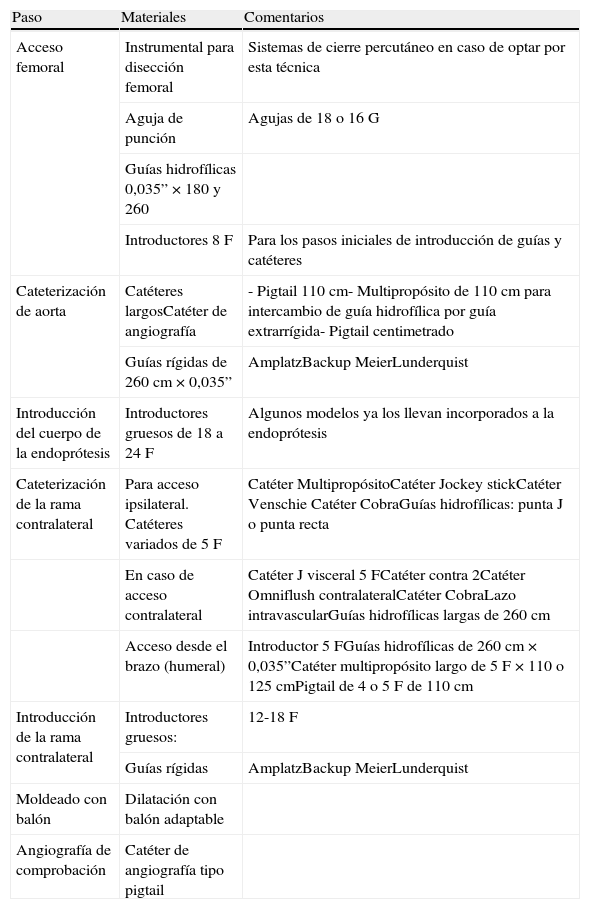
Materiales aconsejados
| Paso | Materiales | Comentarios |
| Acceso femoral | Instrumental para disección femoral | Sistemas de cierre percutáneo en caso de optar por esta técnica |
| Aguja de punción | Agujas de 18 o 16G | |
| Guías hidrofílicas 0,035” × 180 y 260 | ||
| Introductores 8F | Para los pasos iniciales de introducción de guías y catéteres | |
| Cateterización de aorta | Catéteres largosCatéter de angiografía | - Pigtail 110cm- Multipropósito de 110cm para intercambio de guía hidrofílica por guía extrarrígida- Pigtail centimetrado |
| Guías rígidas de 260cm × 0,035” | AmplatzBackup MeierLunderquist | |
| Introducción del cuerpo de la endoprótesis | Introductores gruesos de 18 a 24F | Algunos modelos ya los llevan incorporados a la endoprótesis |
| Cateterización de la rama contralateral | Para acceso ipsilateral. Catéteres variados de 5F | Catéter MultipropósitoCatéter Jockey stickCatéter Venschie Catéter CobraGuías hidrofílicas: punta J o punta recta |
| En caso de acceso contralateral | Catéter J visceral 5FCatéter contra 2Catéter Omniflush contralateralCatéter CobraLazo intravascularGuías hidrofílicas largas de 260cm | |
| Acceso desde el brazo (humeral) | Introductor 5FGuías hidrofílicas de 260cm × 0,035”Catéter multipropósito largo de 5F × 110 o 125cmPigtail de 4 o 5F de 110cm | |
| Introducción de la rama contralateral | Introductores gruesos: | 12-18F |
| Guías rígidas | AmplatzBackup MeierLunderquist | |
| Moldeado con balón | Dilatación con balón adaptable | |
| Angiografía de comprobación | Catéter de angiografía tipo pigtail |
Las técnicas de implantación pueden variar un poco según el tipo de dispositivo58–60, y se describen los pasos más comunes.
Cateterización de la aorta. El objetivo inicial es la colocación de una guía de alto soporte, rígida —o mejor extrarrígida—, que permita el avance seguro del cuerpo principal, que es el que presenta un perfil más alto. Empezando por la colocación de un primer introductor estándar de 5-8F en la femoral, se asciende la guía hasta la aorta suprarrenal. Luego, mediante un catéter largo, se intercambia por una guía rígida —o mejor extrarrígida— (Amplatz superstif, Backup Meier, o Lunderquist, entre otras). El lado de acceso principal depende principalmente de la anatomía, y se suele elegir el que presenta menos elongaciones o menos estenosis. En igualdad de condiciones se suele elegir el lado contrario a la arteria renal más baja, y en general el lado derecho.
A través de la femoral contralateral con introductor estándar de 5-8F, se coloca un catéter de angiografía pigtail sobre D12-L1
Localización de las zonas de sellado. Una vez creado el camino con una guía de alto soporte, se necesita identificar las zonas donde se debe sellar la endoprótesis proximalmente con las referencias necesarias para evitar que la prótesis ocluya las arterias renales y/o que la rama contralateral se quede trabada dentro de la ilíaca común. Es deseable poder identificar y referenciar si es posible en el mismo campo de visión la zona de anclaje distal en las ilíacas. A fin de evitar inyecciones de contraste reiteradas, la primera arteriografía puede realizarse cuando el dispositivo esté en la posición aproximada (según las referencias que de los estudios preoperatorios podamos tener) antes de iniciar su liberación.
Anticoagulación. El paciente debe estar anticoagulado a dosis de 100UI/kg de peso (5.000UI para un peso de 50kg), una vez realizadas las punciones arteriales. Si el procedimiento se alarga es conveniente controlar el tiempo de coagulación activado (ACT) para determinar la conveniencia de añadir heparina y lograr un ACT entre 250 y 300 segundos.
La endoprótesis se prepara, se purga y su orientación se comprueba externamente bajo fluoroscopio, para ser luego introducida en la posición previamente determinada sobre las guías rígidas. Siguiendo las referencias óseas previas, el roadmaping (en este territorio influenciado notablemente por las maniobras respiratorias) o con una inyección de contraste mediante un catéter de angiografía que previamente se ha introducido por la femoral contralateral o en algunos casos desde el brazo, se posiciona la endoprótesis en el lugar elegido y se libera. A la hora de referenciar la zona de anclaje proximal infrarrenal es necesario considerar la anatomía de la aorta y lograr una proyección lo más perpendicular posible a las arterias renales y al eje longitudinal de la aorta, angulando el fluoroscopio en sentido craneocaudal o lateral, ya que la proyección anteroposterior puede llevar a un posicionamiento poco preciso de la endoprótesis19.
En los sistemas modulares el siguiente paso es la cateterización de la rama contralateral, maniobra que incide notablemente en la mayor o menor duración del procedimiento. Para ello se pueden seguir diversas alternativas empleando guías y catéteres de diferentes orientaciones. Esta es la maniobra en función de la cual la duración total del procedimiento se ve más afectada. Por ello es aconsejable fijarse límites de tiempo en los intentos con diferentes catéteres y alternar con otras vías, como la contralateral o la braquial.
Moldeado con balón. Dilataciones con balón conformable para amoldar la endoprótesis a la aorta en las zonas de sellado y en las zonas de unión de componentes modulares.
Arteriografía de control. Para comprobar la presencia de endofugas y la permeabilidad de las arterias implicadas.
Dificultades y posibles soluciones.
- a.
En el avance de la endoprótesis:
- i.
Estenosis en territorio ilíaco: angioplastia previa o con dilatadores arteriales, o emplear lubricantes estériles y específicos para el dispositivo.
- ii.
Elongación arterial: guías extrarrígidas que enderecen el trayecto. También se han descrito las maniobras de compresión externa y la técnica braquiofemoral (body-floss) descrita por Peeters61. Si predomina la calcificación, pueden no ser efectivas.
- i.
- b.
En la liberación de la endoprótesis:
- i.
No se libera el dispositivo: comprobar la liberación de los seguros del dispositivo, o retirar el introductor.
- ii.
Mala posición de la prótesis, una vez liberada: si no se ha anclado se puede traccionar algo con sistemas de guías thru and thru fémoro-femoral o reconvertir a aorto-uniilíaco o a cirugía abierta.
- i.
- c.
En la cateterización de la rama contralateral: En caso de dificultad se puede recurrir a la vía contralateral o al abordaje braquial anterógrado. En último extremo puede procederse a la conversión en un dispositivo aorto-uniilíaco.
Detección de endofugas inmediatas y su posible solución.
- -
Tipo I proximal: dilatación repetida, primero con balón compliante, y si no con balón no compliante, seguido de la colocación de extensor aórtico o de stent balón expandible de medidas apropiadas (tipo Palmaz).
- -
Tipo I distal: colocar un extensor ilíaco.
- -
Tipo III: colocar un nuevo segmento de endoprótesis cubierta en la zona de unión de cuerpo de la prótesis con la rama contralateral.
Conversión a aorto-uniilíaco. Algunos modelos de prótesis disponen de una pieza cónica que convierte el modelo bifurcado en aorto-uniilíaco.
Conversión a cirugía abierta. Situación extrema que acarrea un aumento de la mortalidad; se puede recurrir a ella en caso de complicaciones no solucionables desde el punto de vista endovascular.
Otras consideraciones.
- 1.
Procedimientos asociados. Pueden requerirse y realizarse en otro momento previo a la exclusión endovascular: embolización de hipográstricas, cuando el diámetro de la ilíaca común es superior a 20mm y no tiene cuello distal. La cobertura de la hipogástrica puede no ser suficiente si la ilíaca es aneurismática y crearse una endofuga tipo 2.
- 2.
Minimizar la dosis de radiación ionizante al paciente y al equipo quirúrgico. Seguir los principios ALARA (As Low As Reasonably Achievable), limitando la fluoroscopia al mínimo necesario y con empleo del modo pulsado, colimación del área de trabajo y medios de radioprotección (delantales, collar y gafas), aparte de seguir los controles dosimétricos oportunos.
- 3.
Reducir la toxicidad renal del contraste yodado: limitar el uso de volumen de contraste al mínimo necesario, y prevención de la toxicidad renal con hidratación previa, N-acetil-cisteína, y en ocasiones emplear el contraste diluido al 50%. Otras alternativas son el uso combinado de CO2 y/o gadolinio (aunque este último no es totalmente inocuo desde el punto de vista de la nefrotoxicidad).
La realización de la REVA de forma sistemática, siguiendo cada uno de los pasos, facilita la intervención y disminuye las complicaciones.
Es necesario conocer y disponer del material necesario para cada paso.
Es imprescindible conocer las técnicas de recurso y disponer del material para realizarlas.
Complicaciones peroperatoriasEn este apartado nos referiremos exclusivamente a las complicaciones relacionadas con la introducción y la liberación del dispositivo.
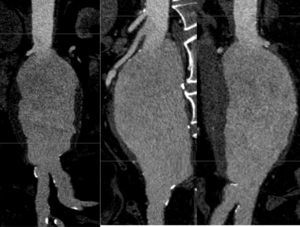
EndofugasLa constatación de que el saco aneurismático sigue opacificándose en la angiografía de comprobación al finalizar el procedimiento, más que una complicación puede considerarse un hallazgo intraoperatorio. En el apartado referente al seguimiento se hará más hincapié en la historia natural y en la importancia de los diversos tipos de endofuga. Solo cabe señalar que la endofuga tipo I (a partir de anclaje proximal o distal) y la tipo III (por las conexiones del injerto) tienen, según el registro EUROSTAR62, una incidencia del 4,1 y del 1,9%, respectivamente, y deben solventarse antes de terminar la intervención; la tipo I proximal es debida a una anatomía del cuello difícil o a la migración del dispositivo en el despliegue (1,1%), lo cual en la mayoría de los casos requiere la colocación de una extensión o cuff aórtico. En algunos casos es preciso el uso de un stent de Palmaz para cerrar una fuga tipo I.
Trombosis del injerto o de sus ramasLa endoprótesis puede trombosarse total o parcialmente, sobre todo en los casos en que no se despliega por completo o queda claramente acodada. La trombosis de rama peroperatoria puede resolverse habitualmente mediante una trombectomía con balón de Fogarty o bien una trombectomía mecánica y la reparación del problema que la hubiese causado, empleando stent para corregir acodaduras y con baloneado exhaustivo en caso de despliegue incompleto. En otros casos puede ser necesario realizar un injerto cruzado fémoro-femoral o axilofemoral. EUROSTAR recoge una incidencia casi anecdótica de casos en que no ha sido posible resolver la trombosis intraoperatoria.
Lesión del acceso arterialDado que las mujeres tienen calibres arteriales significativamente menores que los hombres, presentan un mayor riesgo de complicaciones en el acceso arterial63.
La mayoría de dispositivos tenían un calibre externo en torno a los 21-22F, lo que implica la necesidad de tener una luz arterial de 7mm como mínimo. Sin embargo, la constante evolución de las endoprótesis incluye la reducción de su perfil, en fase de desarrollo hasta hace poco64 pero que desde el año 2010 están disponibles con sistema de introducción de diámetro externo de 16-18F o incluso menor, con lo cual el calibre mínimo de la arteria estaría en torno a los 6mm. Además del menor calibre, ello suele llevar asociado una mejor navegabilidad.
La forma de evitar estas complicaciones es básicamente preverlas y realizar una angioplastia con o sin stent, o bien el uso de dilatadores en caso de lesiones segmentarias, o confeccionar un acceso transitorio en la ilíaca primitiva en caso de arterias difusamente pequeñas o lesionadas.
EmbolizaciónLa manipulación de catéteres y guías —algunas extraordinariamente rígidas— en el interior de arterias aneurismáticas y con trombo mural comporta un elevado riesgo de embolización, que no sólo puede afectar la pelvis o los miembros inferiores sino también ramas viscerales y renales. Se ha descrito la aparición de infartos renales segmentarios en controles postoperatorios y de isquemia de intestino delgado en hasta el 0,85% de los pacientes intervenidos de endoprótesis. Esta complicación es muy grave y comporta una mortalidad del 100% en alguna serie63. La microembolización de las arterias hipogástricas o de los miembros inferiores puede causar isquemia cutánea o muscular, que puede llegar hasta la necrosis. La microembolización masiva de miembros inferiores (trash feet) es extraordinariamente rara en la reparación endovascular, pero se trata de una complicación muy grave que conduce al paciente a fracaso renal agudo y conlleva una elevada mortalidad.
Oclusión de las arterias renalesLa oclusión de una o de ambas arterias renales al desplegar la endoprótesis se recoge con una incidencia del 1,12% en EUROSTAR62. Pocos son los trabajos que reconocen esta complicación, que en caso de ser bilateral comporta una elevada mortalidad y necesidad de diálisis, mientras que cuando es unilateral puede incluso transcurrir de forma subclínica, dependiendo de la capacidad funcional del riñón que queda irrigado.
En caso de cubrir una o dos arterias renales, es útil realizar una maniobra de desplazamiento de la prótesis hacia abajo (pull back) usando una guía que va de una femoral a la otra a través de la bifurcación de la prótesis. En las prótesis aorto-uniilíacas este desplazamiento se puede hacer con un balón hinchado en el cuerpo de la prótesis.
RoturaLa introducción del dispositivo puede a veces resultar difícil, y en pacientes con la pared aórtica debilitada puede romperse. La solución de esta complicación se consigue completando el procedimiento y excluyendo el aneurisma. Sin embargo, cuando la rotura se produce a nivel del cuello esto no será fácil, y posiblemente debamos convertir a cirugía abierta. La incidencia de esta complicación en EUROSTAR62 es del 0,04%.
En el caso de rotura del aneurisma o bien de una ilíaca, puede ser útil la endooclusión mediante balón.
ConversiónLa imposibilidad de hacer progresar el dispositivo o de desplegarlo correctamente en la posición deseada puede, en algunos casos, resultar imposible de solucionar por vía endovascular y precisar una reparación por cirugía abierta. EUROSTAR recoge una incidencia de conversión del 0,95%, aunque grupos con gran experiencia reconocen tener un 1,3%65. La conversión primaria o inmediata es una complicación grave que suele requerir abordajes extensos y conlleva una elevada mortalidad, de hasta el 22% en algunas series65. El planteamiento del procedimiento y la previsión son cruciales para evitar las conversiones.
RecomendacionesNo debe darse por finalizado un procedimiento si existe una fuga tipo I o tipo III.
Se deben conocer las potenciales complicaciones para prevenirlas con una adecuada planificación y una precisa técnica de implante de la endoprótesis, así como las eventuales formas de solución de las mismas.
Es recomendable un estudio preoperatorio minucioso para evitar problemas en la liberación del dispositivo y evitar una conversión, que implica una elevada mortalidad.
Complicaciones postoperatoriasDe forma general, la REVA compite favorablemente respecto a la cirugía abierta convencional (CAC) en relación a las tasas de morbididad sistémica y mortalidad inmediatas. Sin embargo, la REVA se asocia, por el momento, a un riesgo no despreciable de otras complicaciones postoperatorias como, por ejemplo, las complicaciones isquémicas, las asociadas a ruptura o movilización de la endoprótesis y las endofugas. Estas complicaciones pueden afectar hasta al 35% de los pacientes sometidos a REVA frente al 8% tras CAC, como ha puesto en evidencia recientemente el mayor ensayo clínico que compara REVA y CAC: el estudio EVAR I43. La incidencia —no siempre descrita de forma adecuada—, la prevención y el tratamiento de estas complicaciones tienen gran importancia para el cirujano vascular, especialmente si se contempla que la REVA puede reemplazar a la CAC en el tratamiento de los aneurismas aortoilíacos.
Mortalidad inmediataActualmente, la mortalidad inmediata post-REVA es inferior a la descrita para la CAC. En 2002, Adriaensen et al.66 publicaron un metaanálisis que reunía los resultados de 9 estudios sobre 687 REVA y 631 CAC, en el que ya observaron una supervivencia inmediata tras REVA discretamente inferior (3% vs 4%, p=0,03). En 2004 Lee et al.41 publican mejores resultados para la REVA tras valorar la evolución postoperatoria de una muestra no seleccionada de 7.172 pacientes (64% CAC y 36% REVA) procedentes de una base de datos administrativa estadounidense correspondiente al año 2001 (mortalidad, 1,3% vs 3,8%, p<0,001). Los dos clásicos ensayos EVAR1 y DREAM publicaron ya en 200543,44, comparando REVA y CAC, una mortalidad postoperatoria favorable para REVA (EVAR I: 1,7% vs 4,8%, p=0,007; DREAM: 1,2% vs 4,6%, p=0,1). La mortalidad inmediata tras REVA en el registro EUROSTAR (calculada a partir de su última publicación)67 tras 4.888 procedimientos es del 2,6%.
A pesar de estos prometedores resultados, existen grupos de pacientes —en muchos casos aquellos sobre los que la REVA había despertado mayores expectativas— en los que las tasas de mortalidad inmediata parecen mayores. La mortalidad inmediata tras REVA, por ejemplo, podría ser superior en los pacientes con aneurismas grandes68, en los que precisaron algún procedimiento quirúrgico adicional a la colocación de la endoprótesis (6-8%69), en los pacientes no aptos para CAC (9%70) o en los mayores de 80 años (5%66,67).
Morbididad postoperatoria: complicaciones sistémicasLas complicaciones sistémicas, especialmente las cardíacas y pulmonares, son menos frecuentes tras REVA que tras CAC. La REVA ofrece de entrada ventajas teóricas respecto a la CAC en relación a la repercusión que la agresión quirúrgica puede ejercer sobre el organismo. Entre estas se encontrarían la ausencia de un clampaje aórtico convencional, laparotomía, manipulación intestinal y enfriamiento corporal, así como la disminución del dolor postoperatorio, el íleo paralítico y las necesidades de líquidos y derivados hemáticos. Como consecuencia de ello, la REVA se ha asociado a una menor tasa de complicaciones sistémicas que la CAC, en particular cardíacas (11% vs 22%71; 0,3% vs 6,9%41) y pulmonares (3% vs 16%71; 2,9% vs 10,9%44). El Registro EUROSTAR ha descrito una tasa de complicaciones cardíacas del 3,4%, pulmonares del 2% y renales del 2%67 sobre 4.888 procedimientos.
La REVA presenta un riesgo potencial de complicaciones renales postoperatorias por diversos mecanismos: toxicidad por contraste, embolismo de trombo mural y cobertura de una o ambas arterias renales por la endoprótesis. Estos efectos pueden ser más acusados en pacientes con insuficiencia renal previa, incluso al precio de una mortalidad post-REVA elevada72, si bien otros autores estiman que con las protecciones adecuadas el riesgo postoperatorio no es significativamente superior71. Estudios recientes han observado que el riesgo de complicaciones renales post-REVA no difiere del ya asumido para la CAC (4,3% vs 4,2%,71; 1,2% vs 1,1%44).
En el postoperatorio inmediato tras REVA, algunos pacientes desarrollan un cuadro de febrícula/fiebre con leucocitosis y sin focalidad infecciosa (síndrome post-implantación) que se ha atribuido a la trombosis del contenido del aneurisma excluido y que no requiere más tratamiento que el sintomático y la simple observación clínica.
Complicaciones quirúrgicas no propias de la REVA: complicaciones de herida quirúrgicaLa REVA se asocia a una tasa de complicaciones de herida quirúrgica semejante a la observada tras CAC. Diversos estudios han mostrado que la incidencia de complicaciones de herida son semejantes tras REVA y tras CAC (3,5% vs 3,4%44); 6,4% vs 5,7%71; 7,9%68. La incidencia de seromas inguinales tras REVA se ha descrito en torno al 15%, aunque a los 6 meses tienden a desaparecer. En cualquier caso, no debe olvidarse que la mayor parte de la CAC se realiza, a diferencia del REVA, sin necesidad de abordaje inguinal, y que en términos de praxis quirúrgica no se contempla por igual una complicación de herida inguinal que una abdominal.
Complicaciones isquémicas periféricasLas complicaciones isquémicas periféricas, derivadas de la oclusión de una rama de la prótesis, de un embolismo periférico o de una trombosis femoral, son más frecuentes tras REVA que tras CAC. El Registro EUROSTAR describe una incidencia de complicaciones en la arteria de acceso o isquémicas periféricas del 6,4%, así como un 3,7% de complicaciones hemorrágicas o falsos aneurismas62-67. Otros estudios cifran la incidencia de complicaciones isquémicas tras REVA en el 3-10% de los casos73. Estas cifras contrastan con la incidencia de estas complicaciones en las series contemporáneas de CAC, marcadamente por debajo del 5%. En la serie comparativa de Elkouri et al.71, el 5,3% de los pacientes sometidos a REVA tuvieron que ser reintervenidos por problemas isquémicos periféricos, frente al 0,8% de los sometidos a CAC. En los ensayos clínicos DREAM44 y EVAR I43 la incidencia calculada de complicaciones isquémicas, derivadas de trombosis del injerto o periféricas, fueron del 6,4 y del 2,8% en el grupo de pacientes sometidos a REVA y del 2,9 y del 0,3% en el grupo de CAC (p=0,13 y p=0,001, respectivamente).
Las complicaciones isquémicas periféricas tras REVA suelen resolverse satisfactoriamente por medio de procedimientos quirúrgicos convencionales, endovasculares o híbridos. La trombosis de una rama del injerto secundaria a una acodadura, por ejemplo, puede solucionarse mediante trombectomía bajo control fluoroscópico e implantación de un stent. En otros casos, la corrección a distancia puede no ser posible y requerirse un bypass fémoro-femoral. La trombosis local de la arteria femoral puede requerir una endarterectomía con plastia o la interposición de un injerto femoral. Por último, las complicaciones isquémicas distales a la arteria femoral pueden resolverse mediante embolectomía o bypass según la causa de las mismas. Fruto de la amplia experiencia de los cirujanos vasculares en la resolución de este tipo de problemas tras cinco décadas de cirugía aortoilíaca se deriva que la incidencia de amputación mayor de una extremidad tras REVA es prácticamente nula en las series contemporáneas. Las complicaciones femorales e isquémicas periféricas pueden incluso disminuir en el futuro como consecuencia de la utilización de endoprótesis más flexibles y con perfiles cada vez más reducidos que pueden facilitar y acelerar la implantación de la endoprótesis al mismo tiempo que reducen el riesgo de traumatismo local y la posibilidad de embolización.
Complicaciones isquémicas pélvicasLa REVA comporta una mayor frecuencia de oclusión (intencionada o no) de alguna arteria hipogástrica que la CAC (DREAM; 17% vs 4%, p<0,00144), si bien el porcentaje de casos en que ambas quedan ocluidas es muy reducido (1,8% vs 0,6%). Este mayor porcentaje de oclusión hipogástrica explicaría la elevada frecuencia de claudicación glútea tras REVA, que aparece en el 11-50% de los pacientes tras embolización de una o ambas hipogástricas73. En más de la mitad de estos casos la claudicación puede revertir o mejorar, si bien en los restantes puede plantear al paciente un problema clínico de difícil solución.
A pesar de su infrecuencia, las complicaciones pélvicas graves parecen más frecuentes en las REVA que han requerido una oclusión hipogástrica bilateral o unilateral. Favre y Barral74 revisaron los resultados de 4 estudios que reunían 204 y 36 oclusiones hipogástricas uni y bilaterales, respectivamente, detectando 9 complicaciones pélvicas graves: 4 isquemias de colon (3 con oclusión hipogástrica bilateral) y 5 isquemias espinales (3 con oclusión hipogástrica bilateral). La mejor estrategia terapéutica sobre las complicaciones pélvicas graves es claramente su prevención. La contribución de las arterias hipogástricas a la irrigación de la médula espinal es conocida, si bien su importancia funcional parece muy variable e impredecible. Respetar al menos una arteria hipogástrica, como se ha preconizado tradicionalmente en la CAC, es claramente el objetivo para el cual se han diseñado numerosos procedimientos asociados a la REVA (bypass a hipogástrica, endoprótesis ilio-hipogástrica, entre otros). Aunque se suele recomendar la embolización escalonada con unas 2 semanas de intervalo en casos de embolización bilateral, no parece un hecho que evite complicaciones isquémicas pélvicas con respecto a la embolización bilateral simultánea. Si es necesario embolizar una arteria hipogástrica, es conveniente realizar las embolizaciones lo más tronculares posible y preservar la circulación colateral de suplencia femoral75. No obstante, la aparición de fenómenos isquémicos pélvicos graves en pacientes con una única hipogástrica ocluida ha llevado a pensar que los fenómenos hemodinámicos no son los únicos implicados y que el embolismo pélvico puede constituir un mecanismo relevante en la REVA73,76. Las complicaciones isquémicas pélvicas graves se asocian a una morbimortalidad elevada y su tratamiento no difiere del ya conocido para la CAC.
Complicaciones vasculares propias de la REVA: endofugasLos endofugas constituyen una complicación infrecuente del postoperatorio inmediato. La mayor parte de las fugas reconocidas durante los primeros 30 días se detectan ya durante el procedimiento inicial. De 1.000 REVA registrados en el RETA68, se detectaron 146 fugas antes de los 30 días. De las 54 fugas IA, 3 aparecieron tras el primer control TC. Se detectaron 44 fugas tipo II, de las cuales 9 aparecieron en el primer control TC. Finalmente, las fugas tipo IB fueron 19, y 4 de ellas se detectaron en el primer control TC. Una TC en el postoperatorio inmediato constituye una excelente exploración para controlar la eventual persistencia de fugas residuales a la cirugía y para detectar nuevas fugas. El sellado espontáneo de una fuga tipo I o III, sin embargo, puede no constituir un indicador de curación, como se desprende del consenso de expertos organizado por Veith en 200277. Las fugas tipo I aparecidas en el postoperatorio inmediato deben ser tratados de forma precoz mediante extensión proximal o distal, cerclaje, angioplastia o reconversión. El 3,3% de las REVA analizados en el EVAR 143 requirieron procedimientos postoperatorios para corregir fugas. El grupo de expertos reunido por Veith77 cifró en un 7,5% el porcentaje de pacientes que quedan con una fuga tipo I tras la colocación de la endoprótesis y en un 17% los de una fuga tipo II76. Frente a la benignidad inmediata de las fugas tipo II, la persistencia de una fuga tipo I constituye un factor de riesgo de ruptura. En el registro RETA68, 19 pacientes tuvieron una fuga IA persistente, y en 4 (21%) de ellos el aneurisma se rompió a lo largo del año siguiente. Por el momento se desconoce si esta incidencia de ruptura es superior a la previsible por la historia natural del aneurisma tratado.
RecomendacionesSi se precisa una embolización hipogástrica, es aconsejable realizar las embolizaciones lo más tronculares posible y preservar la circulación colateral de suplencia femoral.
Las fugas postoperatorias tipo I y tipo III deben tratarse siempre.
SeguimientoLa exclusión endovascular de un aneurisma de aorta puede no eliminar el riesgo de rotura en el 100% de los casos, y además en la evolución a largo plazo pueden presentarse fallos por fatiga del material, desplazamientos de la endoprótesis por mala fijación inicial o migración posterior, o por cambios con la remodelación del aneurisma tras la exclusión que provoquen el desacoplamiento de piezas y, con ello, la presurización del saco y eventualmente la evolución hacia la rotura. Aunque la seguridad y la durabilidad con respecto a las experiencias iniciales cada vez aumentan más, el seguimiento es algo inherente a la REVA, si se pretende ofrecer una durabilidad del resultado extendida en el tiempo para todos los pacientes.
La reducción del saco es un proceso lento, y dependiendo del método de seguimiento utilizado, los cambios pueden demostrarse antes. Usando mediciones del diámetro en el 50% de los casos puede demostrarse reducción del saco antes de 12 meses, y usando mediciones de volumen del trombo, antes de 6 meses el 60% demuestran un cambio significativo. Así, la reducción del saco parece ser menos pronunciada y menos frecuente cuando se usa un área o diámetro como método de valoración78.
Aunque el número de complicaciones posteriores a la REVA ha disminuido significativamente en los últimos años, sigue siendo necesario un programa de seguimiento. La reducción de los procedimientos secundarios es importante para mejorar la relación coste-beneficio de la REVA79.
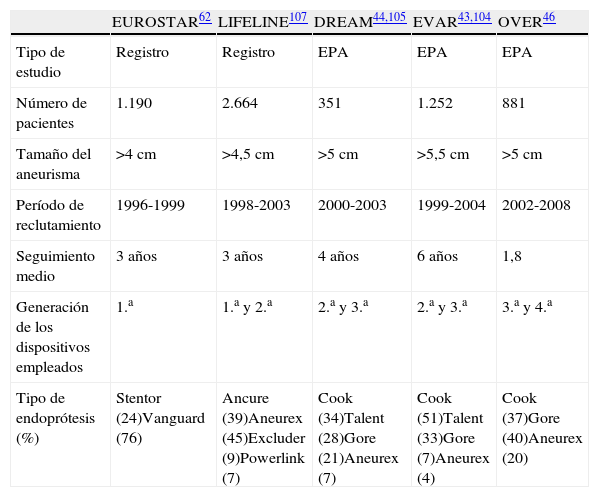
Tradicionalmente, el seguimiento ha sido realizado con una TC a intervalos regulares, combinándolo con radiografías simples abdominales en varias proyecciones. Hay, sin embargo, inconvenientes o desventajas para el uso de TC, especialmente la nefrotoxicidad de los agentes de contraste y las radiaciones ionizantes80. Estas limitaciones de la TC han motivado que se hayan utilizado y comparado otras modalidades diagnósticas para el seguimiento de la REVA (ecodoppler, angioRMN, radiografía simple) (tabla 4).
Las complicaciones relativas al aneurisma o al dispositivo ocurren con una tasa media de 15% al año. Las más comunes son las endofugas y la migración del injerto68.
La detección y la clasificación meticulosa de las endofugas son críticas para el seguimiento de los pacientes que han sido intervenidos mediante REVA. Esta determinación se suele realizar con TC, y mantiene una alta correlación con los hallazgos de la arteriografía por sustracción digital (ASD); sin embargo, el manejo de las fugas requiere realización de arteriografías selectivas para clasificar y tratar con éxito las fugas detectadas por TC81.
La simple medición de la proporción de área ocupada por trombo puede servir para identificar los pacientes con alto riesgo de persistencia de endofuga tipo II. Los pacientes con escasa cantidad preoperatorio de trombo en el saco tendrían una alta posibilidad de aparición de esta complicación82.
La correlación entre migración proximal y dilatación del cuello es estadísticamente significativa; otras variables independientes para la migración son: cuello ancho con diámetro aneurismático, cuello corto, fuga proximal y ausencia de fijación suprarrenal. Ante estas condiciones se debe apurar y ser meticuloso en el seguimiento83.
La dilatación de 3mm o más del cuello parece ser un factor de riesgo para la migración y la posterior fuga proximal; de ahí la necesidad de seguimiento y de disponer de métodos de diagnóstico más precisos84.
La medición del movimiento pulsátil con ultrasonidos de la pared del aneurisma se reduce tras la colocación de una endoprótesis. A pesar de que se reduce permanentemente después de la colocación y que las reducciones más pequeñas aparecen en los casos de endofugas tipo II, no permite la identificación de pacientes con endofugas85.
Los ultrasonidos realzados con material de contraste pueden poner en evidencia endofugas en pacientes con aumento del aneurisma y sin evidencia de endofuga86. Permiten una imagen rápida, no invasiva, fiable y válida que puede ser una alternativa al TC multidetector para la detección de endofugas, y los datos superan a los que ofrecen los estudios ecodoppler color87.
Su uso está especialmente recomendado en pacientes con contraindicaciones al contraste (insuficiencia renal, alergia al yodo)88.
Aunque el ecodoppler color demuestra un alto grado de correlación con la TC en la determinación de los cambios en el tamaño del aneurisma, tiene una baja sensibilidad y un bajo valor predictivo positivo en la detección de endofugas, por lo que no puede reemplazar totalmente la TC en el seguimiento tras REVA89.
El protocolo de seguimiento de Elkouri et al.90 incluye TC seriada y ultrasonidos a intervalos regulares después del procedimiento (antes del alta, al mes y cada 6 meses). En cada examen se compara la capacidad para detectar fugas, las mediciones del diámetro y la capacidad para determinar la permeabilidad del injerto. A pesar de la excelente correlación en el diámetro entre ultrasonidos y TC, hubo discordancia significante en la medición y cambios de diámetro. La sensibilidad de los ultrasonidos es baja para las endofugas comparada con la de la TC, y éste sigue siendo el principal método de estudio.
Tanto la TC bidimensional (diámetro máximo) como la TC tridimensional (volumen total del aneurisma) reflejan cambios en la morfología después de REVA91.
Verhoeven et al.92 inicialmente realizaban TC en todos los controles, y posteriormente emplearon ultrasonidos y radiografías de abdomen utilizando la TC de forma selectiva. En su serie, la REVA se asocia con una baja tasa de reintervenciones (solo el 15%) y su protocolo de seguimiento sin TC regular es largo, simple y efectivo.
Algunos autores informan de la no utilidad de la TC a los 6 meses si la TC realizada al mes ha sido normal, ya que no suelen identificarse hallazgos significativos y abogan por que puede omitirse de forma segura del programa de seguimiento93. En este mismo sentido apuntan estudios más recientes94,95.
La medición de la presión intrasaco es un importante método complementario para la evaluación tras REVA, y posiblemente permite una detección precoz de los fallos. La presión elevada se asocia con expansión del aneurisma y la presión baja con reducción del mismo96. El seguimiento clínico adicional sigue siendo necesario para determinar si la monitorización de la presión en el interior del saco puede reemplazar la TC en el seguimiento de la REVA97.
Referente al seguimiento clínico global, los pacientes con diabetes mellitus tienen una significativamente mayor mortalidad precoz después de REVA, pero la supervivencia a largo plazo es similar a los no diabéticos98.
Los aneurismas grandes (>5,5mm) necesitan un seguimiento más riguroso que los pequeños, en los que los resultados son excelentes99.
Centrar el seguimiento en los primeros 2 o 3 años después de REVA puede reducir la tasa de ruptura, especialmente en pacientes con riesgo aumentado de rotura precoz (diámetro inicial ancho, presencia de endofuga o migración). La prevención completa sigue siendo un desafío futuro, ya que la rotura aórtica puede ocurrir incluso cuando no haya anormalidades predisponentes100.
Uno de los aspectos más importantes para aconsejar un riguroso seguimiento es el conocimiento de la relación coste-beneficio. Comparada con la cirugía abierta, la REVA no ofrece ventajas con respecto a todas las causas de mortalidad y mejoría de la salud en términos de calidad de vida, es más cara (sobre todo si se incluyen los gastos del seguimiento) y conlleva un mayor número de reintervenciones. Sin embargo, sí mejora un 30% la supervivencia relacionada con el aneurisma43,101.
RecomendacionesDespués de la REVA es siempre necesario establecer un protocolo de seguimiento.
Es recomendable partir de un estudio basal inicial dentro de los 30 primeros días con TC + ecodoppler y radiografía simple, entre los que se establece una correlación.
La realización de una TC anual es válida para casos de anatomía compleja con indicaciones límite, anomalías o dudas en la TC basal, discrepancia entre TC y ecodoppler en el control basal, o exclusión con dispositivos de reciente aparición sin seguimientos largos constatados.
Debe tenderse a reducir —y eventualmente anular— el empleo de TC en los casos con anatomía no compleja, buen resultado inicial y correlación basal entre TC ecodoppler y radiografía simple, relegando la TC a casos de variaciones detectadas en el examen con ultrasonidos y radiografía simple.
Resultados tardíosEvidencias sobre la efectividad y la durabilidad del tratamiento endovascularAunque en una técnica en constante evolución en el tiempo los resultados pueden variar de un tipo de estudio a otro102.
Una revisión sistemática realizada en 2005103 estudió 61 publicaciones (3 estudios aleatorizados, 15 estudios controlados no aleatorizados, 16 comparativos observacionales y 27 series de casos) extraídas de 13 bases electrónicas de datos bibliográficos entre enero de 2000 y septiembre de 2004. La totalidad de los estudios evaluaba a 29.059 pacientes, de los que 19.804 fueron sometidos a la REVA y el resto a cirugía convencional. Se estudiaron los parámetros de eficacia y de seguridad relacionados con la REVA y se obtuvieron los siguientes resultados.
La duración del procedimiento, las pérdidas sanguíneas y la estancia hospitalaria fueron claramente favorables a la REVA. La exclusión completa del AAA se observó en el 88,8% de los pacientes tratados mediante REVA. La mortalidad a los 30 días fue significativamente inferior para la REVA, así como la morbilidad asociada al procedimiento. Sin embargo, la tasa de migración fue del 4% durante el seguimiento superior a 12 meses. La trombosis tardía del injerto fue superior en el grupo de la REVA. La presencia de endofugas tipo I se incrementaba con el tiempo (6,8% después de 12 meses de seguimiento). Sin embargo, las fugas tipo II reducían su frecuencia con el tiempo. La tasa de rotura del AAA fue del 0,6% para un seguimiento medio de 17 meses. La conversión a cirugía abierta en el seguimiento fue necesaria en el 2% de los casos. La tasa de reintervención ascendió al 16,2%, y la mayoría fue de carácter endovascular.
Este estudio concluye que, a pesar de la heterogeneidad de los criterios de inclusión, de la experiencia de los equipos y de la diversidad de endoprótesis utilizadas, la REVA tiene una alta tasa de éxito técnico con baja morbi-mortalidad inmediata. Sin embargo, aun no se puede considerar suficientemente duradera con respecto a la cirugía abierta.
Además de este metaanálisis, existen diversos registros de la REVA, como el EUROSTAR62 y el LIFELINE109 en la esfera americana, y estudios prospectivos aleatorizados que comparan el resultado con la cirugía abierta convencional (tabla 5):
- •
EVAR 1. Estudio aleatorizado prospectivo que incluyó 1.252 pacientes en 37 centros del Reino Unido repartidos en un brazo de cirugía abierta y en otro de REVA, con 626 pacientes en cada uno. Todos los pacientes eran aptos para ambas técnicas. Sus resultados a medio plazo43 se han visto complementados con la publicación de resultados a largo plazo en 2010104.
- •
DREAM. Estudio aleatorizado, prospectivo, que reclutó 351 pacientes posibles candidatos a cualquiera de las dos técnicas en estudio, entre noviembre de 2000 y diciembre de 2003, en 24 centros de Holanda y 4 de Bélgica. La publicación de sus resultados a medio plazo, en 200544, también se ha visto actualizada con resultados a más largo plazo en 2010105.
- •
OVER45. Estudio aleatorizado llevado a cabo a partir de 42 centros de Veteranos norteamericanos, que agrupó 881 pacientes que se aleatorizaron a REVA o cirugía abierta.
Características de los estudios más relevantes de la REVA
| EUROSTAR62 | LIFELINE107 | DREAM44,105 | EVAR43,104 | OVER46 | |
| Tipo de estudio | Registro | Registro | EPA | EPA | EPA |
| Número de pacientes | 1.190 | 2.664 | 351 | 1.252 | 881 |
| Tamaño del aneurisma | >4 cm | >4,5 cm | >5 cm | >5,5 cm | >5 cm |
| Período de reclutamiento | 1996-1999 | 1998-2003 | 2000-2003 | 1999-2004 | 2002-2008 |
| Seguimiento medio | 3 años | 3 años | 4 años | 6 años | 1,8 |
| Generación de los dispositivos empleados | 1.a | 1.a y 2.a | 2.a y 3.a | 2.a y 3.a | 3.a y 4.a |
| Tipo de endoprótesis (%) | Stentor (24)Vanguard (76) | Ancure (39)Aneurex (45)Excluder (9)Powerlink (7) | Cook (34)Talent (28)Gore (21)Aneurex (7) | Cook (51)Talent (33)Gore (7)Aneurex (4) | Cook (37)Gore (40)Aneurex (20) |
EPA: ensayo prospectivo y aleatorizado.
En la tabla 6 se presenta un análisis resumido de los resultados a largo plazo de estos estudios.
Resultados comparativos de los diversos estudios
| EUROSTAR | DREAM | EVAR Trial | OVER | ||||
| REVA | Abierto | REVA | Abierto | REVA | Abierto | REVA | |
| Mortalidad operatoria (%, a 30 días) | 2,9 | 4,6 | 1,2 | 6 | 2,3 | 3 | 0,5 |
| Mortalidad tardía en relación al aneurisma (%) | 3 | 5,7 | 2,1 | 1,2/100 pers./año | 1/100 pers./año | 3 | 1,4 |
| Supervivencia tardía libre de episodios (%) | 48 | 65,9 | 65,6 | 54 | 54 | 90,2 | 93 |
| Complicaciones sistémicas (%) | 12,9 | 10,9 | 3,5 | ND | ND | 4,6 | 4,1 |
| Complicaciones en relación al aneurisma | 28 | 8,6 | 16,4 | 2,5/100 pers./año | 12,6/100 pers./año | 11,7 | 13,1 |
| Tasa de reintervención (%) | 14 | 5 | 13 | 1,7/100 pers./año | 5,1/100 pers./año | 12,5 | 13,7 |
Todos estos grupos muestran una mortalidad operatoria a 30 días significativamente menor en la reparación endovascular con respecto a la cirugía abierta. Sin embargo, esta ventaja inicial se diluye a largo plazo en todos los estudios y se hace prácticamente inapreciable, si bien hay algunos matices entre ellos.
En el estudio EVAR la mortalidad relacionada con la rotura del aneurisma tiene un peso relevante. En el estudio DREAM, sin embargo, la mortalidad relacionada con el aneurisma se mantiene estable con los años pero la elevada mortalidad debida a causas cardiovasculares y otras causas médicas hace que los resultados a los 6 años se equiparen también entre el grupo de cirugía abierta y el endovascular.
Estos resultados contrastan algo con el estudio OVER americano, en el cual la mortalidad inicial es menor tanto en el grupo de cirugía abierta como en el endovascular con respecto a los estudios europeos, y además la ventaja inicial en la mortalidad no se perdía a los 2 años de seguimiento (7% en REVA y 9,8% en cirugía abierta).
Entre las interpretaciones dadas por algunos autores106 a estos matices figuran:
- 1.
La experiencia en este campo crece muy rápidamente y mejora la selección de pacientes y anatomías. Reflejo de ello es la espectacular reducción en la conversión a cirugía abierta del 7% en el EUROSTAR a menos del 1% en el OVER. El estudio EVAR se inició antes de que se formalizaran y aceptaran los criterios para publicar los estándares de la REVA, y en el estudio EUROSTAR los criterios anatómicos de selección no estaban totalmente definidos.
- 2.
La mejora en el diseño de las endoprótesis ha permitido desechar las iniciales en las que se basó el registro EUROSTAR a favor de las más actuales, en las que se han subsanado diversas anomalías, reduciéndose problemas como la fractura del stent, la fatiga y rotura del tejido de la endoprótesis, el mejor y más adecuado solapamiento y sujeción entre los componentes modulares de las endoprótesis. El estudio OVER se inició en una etapa más reciente, con lo que se benefició del empleo de endoprótesis más conocidas y mejoradas comparadas con los otros estudios, lo que justificaría su menor tasa de complicaciones y muerte relacionada con el aneurisma.
- 3.
El seguimiento en el estudio OVER es menor que en los estudios europeos, por lo que aún está por demostrar que la ventaja inicial obtenida a los 2 años de seguimiento, respecto a los otros estudios europeos, se mantiene a más largo plazo.
En relación a la calidad de vida, tanto en DREAM44 como el EVAR43 señalan que es mejor para los pacientes tratados con REVA durante los primeros meses pero que esta ventaja se diluye con el tiempo.
En términos de coste-eficacia, el EVAR43 destaca que la REVA es sustancialmente más caro debido al precio de las endoprótesis y a la necesidad de un seguimiento con imagen más costoso. Sin embrago, es pronto para hablar de coste-eficacia, ya que se precisa mayor tiempo de seguimiento.
Más sorprendente han sido los resultados del EVAR 270, que comparaba el tratamiento médico y el seguimiento con la REVA en pacientes no aptos para cirugía abierta. Los pacientes tratados con REVA presentaron una inesperada mortalidad perioperatoria del 9%. En esta mortalidad se incluyeron los pacientes que fallecieron esperando ser tratados, ya que era un estudio basado en la intención de tratamiento. La mortalidad durante el seguimiento fue muy similar en los dos grupos de tratamiento. Una explicación es que la tasa de rotura de aneurisma no tratado fue del 9/100 pacientes/año, muy inferior a la esperada según otros estudios epidemiológicos. Una recomendación que deriva del EVAR 2 es mejorar la calidad de salud de los pacientes antes que someterlos precipitadamente a la REVA. La aplicación en pacientes de alto riesgo o rechazados para cirugía abierta, que precisamente fueron el motivo de la idea original de Parodi, queda en entredicho a raíz de estos resultados del EVAR 2.
Si nos fijamos en los resultados de los dos registros más importantes que existen sobre REVA, el EUROSTAR63 y el LIFELINE109, ambos, sin ser estudios aleatorizados, conducen a resultados superponibles a los derivados de los estudios aleatorizados y controlados. Es decir, la mortalidad perioperatoria se sitúa en torno al 2%, con escasa morbilidad. Del mismo modo, la tasa de reintervenciones alcanza el 18% al cabo de 6 años de seguimiento, con una tendencia clara hacia la mejora de los resultados con la mejora de las nuevas generaciones de endoprótesis107.
Conclusiones- -
La REVA ofrece menores tasas de morbilidad y mortalidad en el post-operatorio inmediato, pero sus deficiencias en términos de durabilidad, hacen que se deba considerar aún una alternativa a la cirugía abierta en la mayoría de casosa.
- -
No hay diferencias en la calidad de vida ni en la supervivencia a largo plazo.
- -
En pacientes de muy alto riesgo deben mejorarse sus condiciones mórbidas antes de aplicar la REVA.
- -
La REVA es más cara que el tratamiento convencional, aunque la mejora en la eficiencia terapéutica de los dispositivos y la consecuente racionalización de los protocolos de seguimiento pueden cambiar esto en sentido positivo.
- -
Las reintervenciones, aunque menores, condicionan un seguimiento estricto y costoso, y la reducción de estas con la mejora de los dispositivos puede aliviarlo.
- -
Esta información debe ser transmitida a los pacientes que se someten a la REVA en el momento de firmar el consentimiento.
- -
Se precisan futuras mejoras tecnológicas para mejorar la durabilidad de la técnica y para recomendarla como primera elección.
Mientras que la reparación endovascular de AAA infrarrenales íntegros goza de una experiencia que se cuenta por decenas de millares de casos en el mundo, la de AAA rotos (REVAR) es mucho menos frecuente.
La primera referencia de uno de estos casos es de 1994108, y desde entonces el interés en ofrecer un menor impacto fisiológico al tratamiento de los AAA rotos se refleja en un número creciente de publicaciones109–127.
Tras más de 15 años de ver que es posible esta opción terapéutica, el tratamiento endovascular ha crecido en experiencia pero aún no ha tenido la aplicación tan extendida como la reparación programada. A ello han contribuido unas barreras como la morfología del aneurisma, la logística y los requerimientos de una endoprótesis con disponibilidad inmediata. Además, aún no hay un nivel de evidencia que justifique el uso sistemático y universal de la REVA en todos los AAA rotos. Algunos estudios apoyan el uso de REVA en los AAA rotos, aunque todos constatan el efecto debido a los sesgos en la selección de pacientes para este tratamiento128–130.
¿Es factible el REVAR?Los trabajos publicados muestran que es posible aplicar el tratamiento, pero cuenta con diversas limitaciones.
Posibilidad de disponer de un estudio previo mínimo. La mayoría de autores abogan por la TC, aunque hay quien prescinde de la TC y se basa exclusivamente en la arteriografía o propone el empleo del intravascular ultrasound (Ultrasonido IntraVascular, IVUS), principalmente para la caracterización del cuello del aneurisma. En los casos que se exija una TC previo, el estado del paciente puede ser determinante a la hora de aceptar esta demora o pasar directamente a la cirugía abierta. Algún autor131 ha constatado que la demora de tiempo media desde la llegada al centro de un paciente con AAA roto y la intervención quirúrgica permitiría en la gran mayoría de casos disponer de la evaluación con TC previa al tratamiento, sin influir en la demora.
Posibilidades anatómicas de poder realizar la reparación endovascular. En estudios de revisión de TC se afirma que en AAA rotos la anatomía impediría en la mayoría de casos (60%) la implantación segura de una endoprótesis132,133, pero en revisiones de casos ya tratados la anatomía de la aorta solo les ha obligado a descartar la reparación endovascular entre el 20 y el 42% de los casos134,135.
Problemas logísticos. Se requiere una buena experiencia en casos programados y disponer de recursos humanos y materiales las 24 h del día. Ello no siempre es factible y supone una causa de pasar a optar por la reparación abierta en vez de la endovascular127,123. Sin embargo, los trabajos más recientes reflejan un impacto favorable de protocolos establecidos que permiten la opción endovascular en todos o en la gran mayoría de los casos anatómica y clínicamente posibles136.
Inestabilidad del paciente. Se considera que la inestabilidad es un factor que va en contra de poder realizar la reparación endovascular, pues se asume que es una situación de extrema urgencia y el pinzamiento aórtico por cirugía abierta es más expeditivo. Ello hace que en tales circunstancias el tratamiento derive en cirugía abierta. La mayoría de autores abogan sin embargo por la «hemostasia hipotensiva»109–127 y ser tolerantes hasta lograr la exclusión endovascular. La mayoría de trabajos recurren a la oclusión aórtica endovascular con balón en pocas ocasiones.
Puntos de controversia en la REVARAnestesia. La mayoría de trabajos procura la anestesia local para evitar el colapso hemodinámico que se produce con la inducción anestésica, asociando eventualmente sedación, al menos hasta que el control hemodinámico con balón de oclusión se haya logrado, y a veces, si el paciente lo tolera, hasta completar la reparación. En la literatura analizada109–127, de los 277 casos en los que figura el dato entre los 355 analizados, el 58% de los casos se completa con anestesia local asociada a mayor o menor grado de sedación, y la anestesia general se da en el 42%. En algunos casos que acabaron con anestesia general se procuró mantener la anestesia local al menos hasta lograr la oclusión aórtica con balón.
Abordaje percutáneo o quirúrgico. La mayoría optan por la disección de la femoral, pero algunos han intentado el abordaje percutáneo asociado a dispositivos de cierre percutáneo137. Sin embargo, en pacientes hipotensos las dificultades de punción aumentan.
Oclusión aórtica. Se realiza en función de la tolerancia clínica y hemodinámica del paciente a la hipotensión, abogando por la «hemostasia hipotensiva», término acuñado para este tema por Veith119, en tanto el paciente mantenga en nivel de conciencia y la colaboración. En general, el empleo del balón previo al implante de la prótesis añade dificultades técnicas, por lo que en general se tiende a prescindir de él. Se ha descrito una técnica de oclusión con balón en dos tiempos para evitar desclampajes antes de la exclusión total den aneurisma137, e incluso un tipo de endoprótesis bifurcada con una válvula unidireccional en la pata corta evita el flujo de sangre por ella hasta que no se ha cateterizado138.
Tipo de endoprótesis. Aunque en los primeros casos se empleaban dispositivos «caseros»139, todos los artículos recientes emplean prótesis comercialmente disponibles, pero entre ellas existen la opción del injerto aorto-uniilíaco + bypass fémoro-femoral y oclusor ilíaco contralateral, y otros por una endoprótesis bifurcada modular. En la bibliografía analizada109–127 se dispone de información en 261 casos de los 355. Entre ellos, la prótesis bifurcada se ha empleado en el 61%, y la aorto-uniilíaca o recta en el 49%.
Control postoperatorio. El control postoperatorio nos enfrenta a un probable aumento de la incidencia de síndrome compartimental abdominal140, lo que requiere una monitorización de la presión intravesical y una actuación de descompresión en caso de elevación patológica de ésta. Además, se plantea el dilema de ser más agresiva de tratar o incluso prevenir las endofugas tipo II, inyectando en el saco aneurismático material trombótico (trombina, fibrina, colas biológicas), en comparación con la reparación programada.
ResultadosLa mortalidad postoperatoria recogida parece inferior a la de la reparación abierta, que tras más de 50 años de experiencia en cirugía abierta por AAA rotos ofrece una mortalidad del 49%141. La REVA en AAA rotos muestra tasas que oscilan entre el 18 y el 53%, con diversos estudios que tienen una mortalidad del 20% o menos142–144.
Los trabajos que establecen comparaciones entre la época en la que solo se practicaba reparación con cirugía abierta y la época en la que se emplea esta además de la endoprótesis en los casos en que es factible, muestran una mejoría notable de la mortalidad inmediata, además de menor pérdida sanguínea, menor estancia en la UCI y menor estancia hospitalaria, y menos complicaciones posteriores127.
Conclusiones- 1.
La experiencia y la bibliografía disponible en este campo no aportan la suficiente evidencia científica como para establecer recomendaciones universales con evidencia alta.
- 2.
El tratamiento endovascular de AAA rotos es factible, y las experiencias de resultados que mejoran la morbimortalidad de la cirugía abierta son considerables; algunos incluso la proponen como solución intermedia hasta poder dar un tratamiento definitivo.
- 3.
Para poder ofrecer este tratamiento de forma óptima a los pacientes es necesario tener la adecuada experiencia en tratamiento endovascular en cirugía programada y disponer de un protocolo definido, así como de recursos materiales y humanos cualificados, de forma ininterrumpida.
- 4.
Parece razonable que los servicios de angiología y cirugía vascular potencien la formación de residentes y de personal de plantilla en estas opciones, si cabe alguna esperanza en reducir la mortalidad en esta patología de presentación clínica tan grave.
Los autores declaran no tener ningún conflicto de intereses.