Las endofugas tipo ii constituyen la principal causa de reoperación a medio y largo plazo utilizando endoprótesis de última generación. Tienen la potencialidad de llevar al crecimiento y ruptura del aneurisma. Exigen un protocolo de seguimiento con imágenes distinto. Sin embargo, no existen pautas claras en cuanto a su algoritmo terapéutico.
ObjetivoEl objetivo del trabajo es analizar los resultados obtenidos del tratamiento de la endofuga tipo ii después del tratamiento endovascular del aneurisma de aorta abdominal.
Material y métodoSobre un total de 214 pacientes operados 32 presentaron una endofuga tipo ii en el primer control postoperatorio. Quince de ellos desarrollaron una endofuga persistente, pero solo 11 se asociaron a crecimiento del saco aneurismático. El tratamiento consistió en la embolización de las arterias lumbares con coils (8 casos) punción translumbar (un caso), embolización de la arteria mesentérica inferior (AMI) (un caso) y ligadura laparoscópica de la AMI (un caso). Los datos fueron analizados empleando el paquete estadístico Medcalc v. 11.
ResultadosMediante técnicas transarteriales o laparoscópicas se obtuvo el tratamiento efectivo de la endofuga, evidenciado por su trombosis y estabilización del saco aneurismático en sucesivos controles tomográficos. No se registró mortalidad, reintervención o ruptura relacionada.
ConclusiónEl estudio demostró que tratar solo aquellas endofugas «persistentes» con crecimiento aneurismático es una conducta segura. Los tratamientos aplicados fueron en este caso efectivos.
The treatment of type ii endoleaks remains controversial. Their long-term natural history and impact on changes in aneurysm morphology are still under review.
ObjectiveThe objective of this study is to present a safe and effective approach to treat type ii endoleaks associated to aneurysm sac enlargement.
Material and methodOut of a total of 214 patients, 32 presented with a type II endoleak in the first post-surgical review. Fifteen of these developed a persistent endoleak, but only 11 of them were associated with growth of the aneurysm sac. The treatment consisted of coil embolisation of the lumbar arteries (8 cases), lumbar puncture (one case), embolisation of the inferior mesenteric artery (IMA) (one case), and laparoscopic IMA ligation (one case). The data were analysed using the Medcalc v. 11 statistics package.
ResultsBy transarterial or laparoscopic techniques effective treatment was obtained of endoleak, evidenced by its stabilization thrombosis and aneurysm sac in successive tomographic controls. No mortality or reoperation related rupture occurred.
ConclusionOnly those patients with persistent typeII endoleak associated with sac enlargement should be treated. Effective techniques were described.
Las endofugas tipo ii son el tipo de endofugas con mayor prevalencia y describen el flujo dentro del saco aneurismático proveniente de sus ramos colaterales (arterias lumbares, mesentérica inferior, sacra media y renales accesorias)1. Estos son normalmente identificados inmediatamente después de implantada la endoprótesis mediante la angiografía final de control o en la tomografía de seguimiento posprocedimiento, llegando a estar presentes hasta en el 30% de los casos2. El impacto clínico asociado a las endofugas tipo ii sobre la expansión aneurismática y posterior ruptura aún se desconoce. Su comportamiento es habitualmente benigno, evidenciándose la trombosis espontánea en la mayoría de los casos durante el primer año del postoperatorio. Sin embargo existe un grupo reducido de pacientes en los que la endofuga tipo ii permanece permeable por más de un año, y es a las que se denominan endofugas tipo ii «persistentes»3. Eventos como la ruptura del aneurisma, la conversión a cirugía convencional, el crecimiento del saco aneurismático o la necesidad de reintervención son algunas de las complicaciones descritas asociadas a estas endofugas tipo ii. Distintas publicaciones se han presentado, con conclusiones muy distintas no concordando en aspectos tales como la indicación y forma de tratamiento3–8.
El objetivo del trabajo es analizar los resultados obtenidos del tratamiento de las endofugas tipo ii persistentes con crecimiento del saco aneurismático.
Material y métodoEstudio retrospectivo sobre 11 pacientes tratados con diagnóstico de endofuga tipo ii persistente asociada a crecimiento del saco aneurismático.
Sobre un total de 214 pacientes con aneurisma de aorta abdominal tratados por vía endovascular entre diciembre de 2006 y diciembre de 2010, 32 presentaron una endofuga en el primer control postoperatorio. Quince de ellos mantuvieron la endofuga presente en el control postoperatorio posterior al año de la cirugía, pero en solo 11 esta se asoció a crecimiento del saco aneurismático.
Nueve eran hombres. La edad promedio de la población fue de 76 años (rango entre 56 a 83 años). El diámetro máximo promedio del aneurisma fue de 61mm (rango 48 a 92mm).
Ocho de los pacientes habían recibido una endoprótesis Excluder (W.L. Gore y Associates, Flagstaff, Ari) y 3 una endoprótesis Zenith (Cook Inc, Bloomington, Ind).
Los controles tomográficos fueron realizados antes y después de los procedimientos al mes y luego anualmente, determinándose el diámetro máximo del saco en 3 posiciones distintas para establecer los cambios morfológicos del mismo. Se definió crecimiento del saco a un aumento del diámetro mayor a 5mm por controles con angiotomografía seriada. Se consideró endofuga persistente a aquella presente en controles después del año de haberse realizado el procedimiento.
Según la fuente de alimentación de la endofuga 2 pacientes tenían una endofuga mesentérica (proveniente de la arteria mesentérica inferior) y 9 eran provenientes de ramas lumbares. Los 2 pacientes con endofuga tipo ii mesentérica también presentaban una endofuga lumbar, pero de menor importancia.
El tiempo promedio desde la reparación endovascular del aneurisma hasta el tratamiento de la endofuga fue de 24±9 meses, con un crecimiento promedio del saco aneurismático de 7,3±2,6mm (rango 5,1 a 12,1mm).
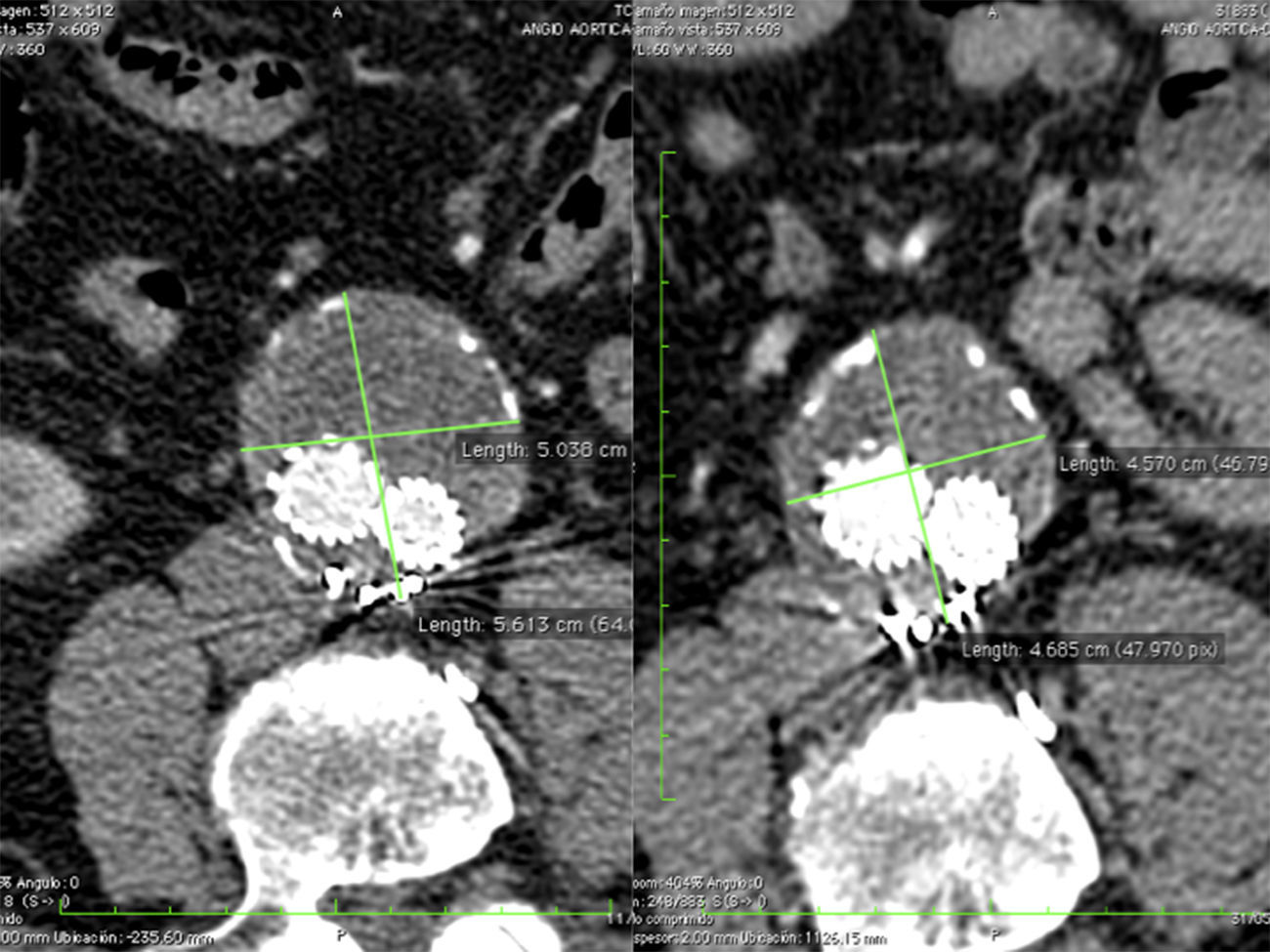
En general todas las endofugas tipo ii fueron manejadas primariamente en forma conservadora. El crecimiento del saco aneurismático mayor a 5mm fue la indicación de tratamiento (fig. 1). En todos los casos se completó el estudio con angiografía para descartar otras endofugas.
La elección del abordaje se tomó en relación con la arteria responsable de la endofuga, la permeabilidad de la arteria iliolumbar y el riesgo quirúrgico del paciente. Las endofugas fueron tratadas mediante 4 abordajes distintos:
- 1.
En 8 pacientes se accedió al saco aneurismático a través de la arteria iliolumbar, rama de la arteria hipogástrica y su anastomosis lumbar.
- 2.
Un paciente con embolización hipogástrica bilateral fue tratado por vía translumbar.
- 3.
En un paciente con riesgo quirúrgico habitual, con endofuga de la arteria mesentérica inferior, el abordaje fue laparoscópico.
- 4.
En el caso de un paciente de más alto riesgo técnico el abordaje del origen de la arteria mesentérica inferior fue por vía transarterial.
El tratamiento efectuado fue distinto también de acuerdo al vaso de alimentación de la endofuga.
En el caso de endofugas por arterias lumbares se realizaron 2 tipos de tratamientos. Para la embolización de las arterias lumbares por vía transarterial la angiografía intraoperatoria demostró la alimentación de la endofuga por al menos una de las 2 arterias iliolumbares, rama de la arteria hipogástrica, que mediante su ramo lumbar se anastomosaba con la arteria lumbar más inferior, rama de la aorta. El flujo retrógrado entonces comenzaba en la arteria iliolumbar, de allí a la arteria lumbar y luego al saco (endofuga), teniendo como vaso aferente de la endofuga una o más arterias lumbares. La arteria iliolumbar derecha fue generalmente la más desarrollada. En 5 pacientes se realizó la embolización de las 2 arterias lumbares más inferiores que alimentaban la endofuga y en 3 pacientes la embolización se realizó en 4 arterias lumbares. El material utilizado en todos los casos para la embolización fueron coils electrodesprendibles marca GDC® (Guglielmi Detachable Coils, Boston Scientific Corp, Gattick, MA) (fig. 2).
En el caso de punción translumbar se realizó mediante guía tomográfica, pero con control angiográfico. De esa manera se pudo realizar una angiografía de la endofuga y selectivamente embolizar con coils y trombina el saco.
Por otro lado, en el caso de la embolización de la arteria mesentérica inferior se realizó mediante la utilización de coils GDC®.
La ligadura laparoscópica, por el contrario, se realizó bajo anestesia general, utilizando 3 trócares y ligando el origen de la arteria mesentérica inferior con Ligaclip® hemostático marca Horizon® (Weck, Limerick, PA) (fig. 3).
Fueron establecidos como puntos finales la mortalidad relacionada con el aneurisma, la ruptura, el comportamiento del saco aneurismático, la persistencia de la endofuga y la reoperación relacionada con el aneurisma.
Los datos fueron volcados en una base de datos (Microsoft Excel 97) y luego fueron analizados empleando el paquete estadístico (Medcalc v. 11). Para todas las variables se estableció su distribución de frecuencias y/o porcentajes en relación con el total de casos. Para aquellas medidas en escala ordinal o superior se computaron las siguientes estadísticas: número de casos, valor mínimo hallado, valor máximo hallado, media aritmética y desviación típica. Cuando fue necesario se realizaron como pruebas de significación (test de Chi cuadrado). El nivel de significación establecido fue de alfa 0,05.
ResultadosEn los 11 pacientes el resultado del tratamiento efectuado fue exitoso, lográndose en todos ellos la trombosis de la endofuga (fig. 4).
No se registraron complicaciones asociadas al procedimiento. No se registró mortalidad, reoperación, ruptura del aneurisma ni explantación de la endoprótesis.
En el control tomográfico al año 9 pacientes mostraron disminución del diámetro del saco aneurismático de 5,9±3,9mm (rango 2 a 14mm). Dos casos, uno lumbar y otro mesentérico, no presentaron cambios morfológicos después del tratamiento de la endofuga. En ambos casos de endofuga mesentérica no requirieron de otro tratamiento y la endofuga lumbar se encuentra bajo seguimiento sin consecuencias morfológicas.
DiscusiónLa evidencia relacionada con la endofuga tipo ii es extensa pero contradictoria, especialmente cuando se refiere al momento y técnica utilizada para su tratamiento. Si bien existen estudios que demuestran una alta tasa de trombosis espontánea9,10, existen otros que la han relacionado inclusive con ruptura del aneurisma2,11. Sobre un total de 273 pacientes tratados mediante EVAR en la Cleveland Clinic el 17% presentó una endofuga tipo ii precoz. La mitad se resolvió espontáneamente (trombosis) y el otro 50% (18 pacientes) presentó una endofuga persistente, con crecimiento del saco aneurismático solo en 7 pacientes (39%)12. Por el contrario, en el grupo de la Mayo Clinic la prevalencia de endofugas tipo ii persistentes fue significativamente menor, pero asociada a una alta tasa de crecimiento aneurismático8. Esto simplemente demuestra que no solo la evolución de estas endofugas se desconoce, sino que la evidencia es contradictoria.
Por otro lado, el impacto clínico asociado a las endofugas tipo ii sobre la posibilidad de producir expansión aneurismática y posterior ruptura tiene sustento en un reducido número de publicaciones13. Eventos tales como la ruptura del aneurisma, la conversión a cirugía abierta, el crecimiento del saco aneurismático o la necesidad de reintervención son algunas de las complicaciones descritas asociadas a endofugas tipo ii14–16. El principal defecto de todas estas publicaciones es que dichas endofugas se asociaron en la gran mayoría de los casos a otras endofugas más peligrosas14, en pacientes con dispositivos de generaciones anteriores15 y sobre pacientes vigilados con distintos protocolos de seguimiento16. En nuestro estudio la selección de pacientes y un estricto protocolo de seguimiento en aquellos con endofuga tipo ii determinó la ausencia de rupturas o conversiones.
Así como la consecuencia clínica de las endofugas tipo ii es controvertida, también lo es la decisión de cuándo y cómo tratar a dichos pacientes. Tal cual describimos anteriormente, la mayoría de los investigadores sostienen el hecho de que la resolución espontánea es el resultado más común, y por tanto el abordaje preferible es la observación del saco aneurismático, siguiendo cuidadosamente la morfología del aneurisma en la tomografía. Sin embargo, algunos autores han determinado presiones sistémicas dentro del saco del aneurisma en presencia de endofugas tipo ii, indicando una situación más preocupante17. Nuestro estudio demuestra que el tratamiento de las endofugas tipo ii con crecimiento aneurismático mayor a 5mm es un abordaje seguro.
En lo que se refiere a tratamiento tampoco hay hoy en día un consenso sobre cuál es el más indicado frente a distintas situaciones. La ligadura laparoscópica de las ramas colaterales del aneurisma fue una alternativa menos cruenta a la laparotomía, pero técnicamente igual o mas dificultosa18. Solo reservamos hoy esta técnica para la arteria mesentérica inferior en un selecto grupo de pacientes, con un riesgo quirúrgico y técnico aceptables que permitan manejarse fácilmente dentro de la cavidad abdominal. Preferimos este abordaje al endovascular para evitar la necesidad de canulación y la posibilidad de daño sobre la arteria mesentérica superior durante su instrumentación intravascular, ya sea trombosis o disección.
La embolización percutánea del saco aneurismático mediante guía tomográfica es un abordaje ya descrito15,19. Sin embargo, los resultados a corto plazo en muchas publicaciones se acompañaron de una nueva repermeabilización con posterior crecimiento aneurismático. Varias series han publicado sus resultados con la embolización de las endofugas con pegamento, también con resultados variables20–22. La embolización con material líquido tiene la desventaja del control de la difusión del mismo, reportándose casos de complicaciones isquémicas incluso graves21,23. En nuestra serie este abordaje fue solo relegado a pacientes de alto riesgo quirúrgico con oclusión bilateral de la arteria hipogástrica. En dichos pacientes la alimentación del saco ocurre mediante colaterales provenientes preferentemente de la arteria femoral común y profunda, y por tanto su canulación endovascular es dificultosa.
Por el contrario, la canulación selectiva de la arteria iliolumbar, con posterior canulación de arterias lumbares y del saco aneurismático con su respectiva embolización fue un tratamiento efectivo. La simplicidad del procedimiento con escasa posibilidad de complicaciones, con eficacia demostrada por disminución o estabilización del tamaño del saco, lo hacen altamente atractivo.
Un punto a remarcar en todos estos casos con endofuga lumbar fue la importancia y tamaño de la arteria iliolumbar, cumpliendo esta un papel protagónico no solo en la etiopatogenia de la endofuga tipo ii, sino en su tratamiento (fig. 5). Fue a través de la canalización selectiva de la arteria iliolumbar que mediante microcatéteres se accedió al saco y a las arterias lumbares responsables de la endofuga.
El tratamiento de la endofuga tipo ii persistente con crecimiento del saco aneurismático parece ser una conducta segura. En el caso de endofuga por arterias lumbares la oclusión con coils del vaso aferente, eferente y el nido es efectivo, demostrando en nuestros casos una conducta favorable del tamaño del saco aneurismático. La ligadura laparoscópica puede ser una alternativa válida en pacientes con endofuga mesentérica.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.