La complejidad de la embriología de la vena cava inferior, con numerosas anastomosis entre pares de venas, puede conducir a multitud de variantes anatómicas. En la población general la agenesia de la vena cava inferior constituye una malformación poco frecuente (0,07%), pero su presencia representa el 5-9,5% de las trombosis venosas profundas idiopáticas en pacientes menores de 30 años y su tratamiento continúa siendo un tema controvertido.
The development of the inferior vena cava is a complex embryological process, with numerous anastomoses among pairs of veins, which may result in many anatomic variants. In the general population, the absence of inferior vena cava is a rare anomaly (0.07%), but this represents 5-9.5% of idiopathic deep venous thrombosis in patients under 30 years-old and its treatment options remain controversial.
Con el desarrollo de las nuevas técnicas de imagen, la relevancia clínica de las variantes anatómicas de la vena cava inferior (VCI) ha adquirido un protagonismo creciente en los últimos años.
Si bien existen múltiples variantes del normal desarrollo de la VCI, el conocimiento de las anomalías más frecuentes resulta fundamental en la práctica clínica diaria. Algunas de estas anomalías son motivo de confusión con adenopatías, masas retroperitoneales y masas mediastínicas, y pueden implicar importantes complicaciones si no se valora su presencia en la planificación de procedimientos invasivos (cirugía, angiografías)1.
Las malformaciones de la VCI constituyen un grupo muy amplio de anomalías del desarrollo embrionario, con diferentes implicaciones clínicas. El término más conocido probablemente es el de «agenesia de VCI», que se usa habitualmente en referencia a la continuación de la VCI en la vena ácigos2, pero esta representa solo una de las múltiples variantes anatómicas que pueden surgir durante el desarrollo de la VCI.
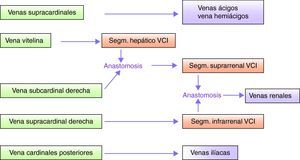
Desarrollo de la vena cava inferiorEn condiciones fisiológicas la VCI está constituida por 4 segmentos: hepático, suprarrenal, renal e infrarrenal1,3 (fig. 1).
El desarrollo del sistema venoso fetal ocurre entre la sexta y la octava semana de gestación e implica la formación, anastomosis y regresión de tres segmentos venosos pares y simétricos4: venas supracardinales, venas subcardinales y venas cardinales posteriores.
El segmento hepático de la VCI deriva de la vena vitelina, y la unión de dicho segmento con la vena subcardinal derecha origina el segmento suprarrenal de la VCI. Si se produce un error en la anastomosis hepática subcardinal el flujo sanguíneo es derivado a la vena ácigos4.
Aunque existe cierta controversia5 se cree que el segmento infrarrenal de la VCI deriva de la vena supracardinal derecha. Las anastomosis entre los segmentos subcardinales y supracardinales originan las venas renales.
Las venas cardinales posteriores regresan casi totalmente, originando únicamente las venas ilíacas. Por encima del diafragma las venas supracardinales dan origen a las venas ácigos y hemiácigos.
Variantes anatómicas en el desarrollo de la vena cava inferiorLa complejidad de la embriología de la VCI, con numerosas anastomosis entre los pares de venas, puede conducir a multitud de variantes anatómicas1. Algunas de estas anomalías tienen relevancia en la práctica clínica diaria. Los principales tipos de malformaciones de VCI descritos son los siguientes1 (tabla 1):
Anomalías de vena cava inferior
| Tipo | Prevalencia | Relevancia clínica |
| VCI izquierda | 0,2-0,5% | - Confusión masa paraaórtica izquierda- Dificultad implantación filtro VCI transyugular |
| VCI doble | 0,2-3% | - TEP recurrente tras implantación de filtro de VCI- Confusión masa latero-aórtica izquierda |
| Continuación VCI con vena ácigos | 0,3-2% | - Confusión masa paratraqueal derecha- Planificación quirúrgica |
| VRI circunaórtica | 8,7% | - Planificación quirúrgica- Confusión adenopatía retroperitoneal |
| VRI retroaórtica | 2,1% | - Planificación cirugía aórtica |
| VCI doble+VRD retroaórtica+continuación VCI-hemiácigos | - | - Masa mediastínica- Planificación quirúrgica |
| VCI doble+VRI retroaórtica+continuación VCI-ácigos | - | - Masa mediastínica- Planificación quirúrgica |
| Uréter circuncava | - | - ITU obstructiva recurrente |
| Ausencia VCI infrarrenal | - | - TVP/TEP- IVC- Confusión masa paraespinal |
ITU: infección del tracto urinario; IVC: insuficiencia venosa crónica; TEP: tromboembolismo pulmonar; TVP: trombosis venosa profunda; VCI: vena cava inferior; VRD: vena renal derecha; VRI: vena renal izquierda.
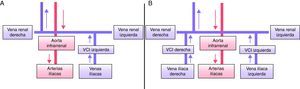
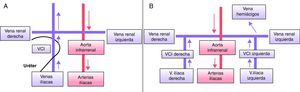
Su prevalencia es del 0,2-0,5%. Típicamente la VCI se une con la vena renal izquierda que cruza con normalidad por delante de la aorta, uniéndose con la vena renal derecha. Es frecuente la confusión en estudios sin contraste con una masa lateroaórtica izquierda6. En caso de implantación transyugular de filtros de VCI, el acceso puede ser complicado en presencia de esta anomalía.
Doble vena cava inferior (fig. 2B)Su prevalencia es del 0,2-3%. Se debe a la persistencia de ambas venas supracardinales. La VCI izquierda termina en la vena renal izquierda, que cruza en posición normal por delante de la aorta y se une a la VCI derecha. Generalmente una está más desarrollada que la otra, que puede pasar inicialmente desapercibida. Esta malformación se asocia con la posibilidad de padecer episodios de tromboembolismo pulmonar (TEP) recurrente en pacientes portadores de filtro de VCI5. Suelen ser confundidas con adenopatías retroperitoneales en los estudios radiológicos sin contraste.
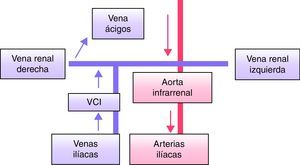
Continuación de la vena cava inferior con la vena ácigos (ausencia del segmento hepático de la vena cava inferior) (fig. 3)Su prevalencia es del 0,3% en la población general7,8 y del 0,6-2% en pacientes con otras anomalías cardiovasculares3,8. En esta malformación la porción renal de la VCI recibe el flujo de ambos riñones y de ambas extremidades inferiores, ascendiendo en posición posterior a la crura diafragmática y entrando en el tórax como una vena ácigos hipertrofiada, la cual se une a la vena cava superior en el espacio paratraqueal derecho. El segmento hepático de la VCI no está realmente ausente, sino que drena directamente en la aurícula derecha9. Antiguamente esta malformación se consideraba asociada a cardiopatía congénita, situs inversus10, asplenia o poliesplenia, pero actualmente se reconoce en un gran número de pacientes asintomáticos. Se ha descrito asociada a trombosis venosa profunda (TVP), TEP10 y hemoptisis masiva11. Es importante reconocer la dilatación de la vena ácigos tanto en su confluencia con la vena cava superior, como en el espacio retrocural para evitar su confusión con adenopatías7,12 y complicaciones durante intervenciones de cirugía torácica.
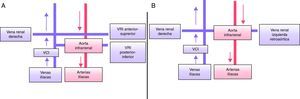
Vena renal izquierda circunaórtica (fig. 4A)Su prevalencia es del 8,7%5. En esta anomalía existen dos venas renales izquierdas. La vena renal izquierda superior recibe el drenaje de la glándula adrenal izquierda y cruza por delante de la aorta. La vena renal izquierda inferior recibe el drenaje de la vena gonadal izquierda y cruza posterior a la aorta. Su conocimiento es importante previo a la realización de una nefrectomía. En los estudios sin contraste es frecuente su confusión con adenopatías patológicas.
Vena renal izquierda retroaórtica (fig. 4B)Su prevalencia es del 2,1%5. Se trata de una anomalía en la que la vena renal izquierda pasa posterior a la aorta. Es importante su conocimiento en la planificación de la cirugía de aorta.
Uréter circuncava (fig. 5A)Esta variación habitualmente ocurre en el lado derecho. En ella el uréter proximal cursa posterior a la VCI. Es causa de obstrucción ureteral en pacientes con infecciones de repetición del tracto urinario.
Doble vena cava inferior asociada a vena renal derecha retroaórtica y continuación de la vena cava inferior con la vena hemiácigos (fig. 5B)En esta variación coexisten varias anomalías. Por un lado, el drenaje hepático es directo a la aurícula derecha y, por otro, la vena renal derecha y la VCI derecha cruzan posteriormente a la aorta para unirse con la VCI izquierda y continuar cranealmente por la vena hemiácigos hipertrofiada. En el tórax la vena hemiácigos cruza posterior a la aorta a nivel de T8-T9 y se une con la vena ácigos. Como alternativa la vena hemiácigos puede continuar cranealmente hasta el seno coronario a través de una vena cava superior izquierda persistente, o puede continuar hasta el tronco braquiocefálico izquierdo. Es causa de confusión con masas mediastínicas y su conocimento es importante en la cirugía torácica.
Doble vena cava inferior con vena renal izquierda retroaórtica y continuación de la vena cava inferior con la vena ácigosSimilar al caso anterior, pero con drenaje a través de la vena ácigos hipertrofiada.
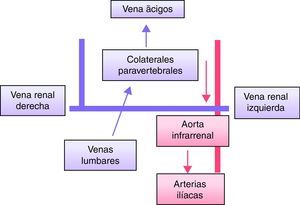
Ausencia de vena cava inferior infrarrenal con preservación suprarrenal (fig. 6)Existen casos documentados de ausencia completa de la VCI13,14, pero se trata de una malformación extremadamente rara15,16. Resulta más frecuente la ausencia de VCI infrarrenal con preservación suprarrenal2,3,13,15. Existe controversia sobre si se trata de una anomalía o de una trombosis perinatal2,13,15. En caso de ausencia simultánea de ambas venas iliacas primitivas, el drenaje de los miembros inferiores recogido por las venas ilíacas externas e internas se lleva a cabo por venas lumbares hipertrofiadas que drenan —vía colaterales paravertebrales anteriores hipertrofiadas— en la vena ácigos o hemiácigos. Cursan frecuentemente con clínica de insuficiencia venosa crónica o TVP idiopática2,17. La abundante circulación colateral paravertebral puede confundirse con una masa paraespinal13.
Anomalías cogénitas vasculares asociadas a malformación de la vena cava inferiorEstudios familiares realizados en pacientes con anomalías de la VCI han permitido identificar anomalías arteriales y venosas concomitantes.
El screening realizado por Obernosterer et al.18 mediante angiorresonancia magnética (ARM) en pacientes con anomalías conocidas de VCI y en sus familiares de primer grado detectó asociación con la presencia de arterias renales accesorias (44%), venas renales accesorias (12%), alteraciones de la arteria hepática común (6%) y presencia de arteria hepática izquierda accesoria (6%). No hubo casos de malformación de vena cava en los familiares de primer grado.
Las arterias renales accesorias surgen tras el fallo de regresión de las arterias segmentarias renales durante el ascenso embriológico de la pelvis a la región lumbar. Una arteria renal accesoria se define como una arteria renal adicional que nace desde la aorta u otra arteria que no sea la renal19. La literatura indica una prevalencia en la población general del 26%18. En los pacientes con anomalías de VCI se observa una prevalencia de arterias renales accesorias del 44%. Los pacientes con arterias renales accesorias padecen hipertensión arterial con más frecuencia que los que poseen arterias renales únicas19,20.
Trombosis venosa profunda y agenesia de la vena cava inferiorLa prevalencia de la ausencia de VCI infrarrenal varía según la población estudiada.
En la población general constituye una malformación poco frecuente (0,07%)21, pero su presencia representa el 5-9,5%20,22,23 de las TVP idiopáticas en pacientes menores de 30 años24.
En pacientes de edad pediátrica el número de casos publicados es menor. Shah et al.25 publicaron 80 casos de malformación de VCI en el contexto de TVP, de los cuales 41 fueron pacientes pediátricos con cardiopatía congénita cianosante asociada26.
La clínica asociada a la ausencia de VCI infrarrenal depende nuevamente del rango de edad en que nos encontremos. En la edad adulta habitualmente se trata de un hallazgo casual durante la realización de un estudio de imagen por otro motivo, encontrándose asintomáticos el 69% de los pacientes22,26.
El inicio con clínica de TVP en enfermos con anomalías de VCI se produce a una edad media significativamente menor que aquellos pacientes con TVP y que no padecen dicha alteración (33±12 años)26.
Se han descrito casos de dolor lumbar intratable y radiculopatía en pacientes con TVP secundaria a agenesia del segmento infrarrenal de la VCI, acompañada de un desarrollo hipertrofiado del plexo venoso epidural en el canal espinal lumbar3 o lumbosacro27–29.
Aunque no es difícil distinguir las estructuras vasculares en la TC con contraste, en los estudios sin contraste suelen producirse errores diagnósticos (confusión con linfomas, masas retroperitoneales, masas mediastínicas) en presencia de estas variaciones anatómicas.
El tratamiento de la TVP asociada a agenesia de VCI ha resultado bastante controvertido, tanto en la fase aguda como a largo plazo, dada la escasa literatura existente al respecto, con descripciones de series de casos puntuales y poca evidencia científica.
Anteriormente se suponía que la interrupción de la vena cava inferior con drenaje a través de venas accesorias constituía un factor protector frente a la embolia pulmonar, pero aunque existen pocos casos se ha descrito la presencia de TEP sintomático en pacientes con dicha anomalía4,23.
Por otro lado, dada la alta incidencia de episodios recurrentes de TVP y la gravedad de la secuela postrombótica en un paciente joven con tendencia a la estasis venosa, la recomendación actual consiste en mantener la anticoagulación de forma prolongada durante al menos un año26, existiendo grupos que proponen el tratamiento con anticoagulantes orales de forma indefinida3.
Dado que la anomalía es congénita, es imprescindible evitar de forma indefinida los factores protrombóticos clásicos (inmovilización prolongada, ingesta de anticonceptivos orales) para prevenir trombosis recurrentes26. Múltiples estudios fármaco-económicos han demostrado que las medidas profilácticas habituales son coste-efectivas en la prevención de la enfermedad tromboembólica recurrente y de sus complicaciones a largo plazo30.
Existen grupos que han propuesto durante la fase aguda de la TVP la trombectomía quirúrgica, pero esta cursa con una alta tasa de reoclusión a corto plazo18, por lo que se trata de una alternativa terapéutica en desuso.
La descripción del tratamiento trombolítico18 en la fase aguda de la TVP se limita a casos puntuales, siendo la terapia de elección en la mayoría de grupos la anticoagulación precoz a dosis plenas.
ComentariosLas malformaciones de VCI, especialmente la ausencia de VCI infrarrenal, constituyen un potente factor de riesgo de TVP debido a la dificultad que implica el retorno venoso desde los miembros inferiores a través de colaterales4,24.
Se trata de pacientes jóvenes con episodios trombóticos de repetición tras la suspensión del tratamiento anticoagulante26, con graves secuelas postrombóticas22,31, tendencia al desarrollo de alteraciones cutáneas y riesgo de úlceras crónicas en los que, además, no se puede excluir la posibilidad de embolismo pulmonar.
Por todo ello, parece razonable recomendar la realización de una TC abdominal con contraste o RMN como técnica de cribado de anomalías vasculares congénitas en los casos de enfermedad tromboembólica venosa en pacientes jóvenes sin factores de riesgo identificados, sin excluir la posibilidad de combinar la existencia de malformaciones de VCI con la presencia de trombofilia hereditaria (déficit de proteína C o S, déficit de antitrombina III, mutación del factor V, síndrome antifosfolípido, etc.)26,31,32.
En adultos la ausencia de la VCI infrarrenal suele cursar de forma asintomática, encontrándose únicamente en los familiares de primer grado una alta prevalencia de arterias renales accesorias sin relevancia clínica, lo cual no justifica el estudio familiar de forma rutinaria.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.