Valorar la utilidad clínica de la introducción rutinaria del mapeo ecográfico de extremidades superiores en el estudio preoperatorio de los pacientes candidatos a un acceso vascular (AV) para hemodiálisis.
Material y métodosEstudio unicéntrico retrospectivo de 4 años de duración. Incluimos pacientes con enfermedad renal crónica terminal (ERCT) candidatos a un AV para hemodiálisis, excluyendo a aquellos con fístulas arteriovenosas (FAV) previas en la misma extremidad superior. Dos grupos de estudio: exploración física (EF: junio de 2011-febrero de 2014) y mapeo ecográfico (ECO: marzo de 2014-junio de 2015). Analizamos: variables demográficas, comorbilidad y tipo de AV. En el subgrupo FAV radiocefálicas, analizamos la tasa de permeabilidad inmediata (48 h), precoz (4 semanas), tardía (6 meses) y los procedimientos realizados.
ResultadosEstudiamos a 81 pacientes (EF: 42; ECO: 39), de los que el 63% eran hombres, con una edad media de 66,5±13,1 años. El 81% fueron izquierdos. No se evidenciaron diferencias significativas entre los grupos respecto a demografía, comorbilidad ni etiología de la ERCT. Tipo de AV (EF vs. ECO): FAVRC* (47,6 vs. 69,2%; *p<0,05); húmero-cefálicas* (38,1 vs. 10,3%); húmero-basílicas (11,9 vs. 17.9%) y prótesis húmero-axilares (2,4 vs. 2,6%). Tasa de permeabilidad FAV radiocefálicas: inmediata (90 vs. 85,2%); precoz (75 vs. 100%*) y tardía (55 vs. 88,9%*), respectivamente. Solo observamos un mayor número de AV realizados en otros territorios (25 vs. 3,7%*) en el grupo EF de las FAV radiocefálicas.
ConclusionesEn nuestro centro, la introducción rutinaria del mapeo ecográfico de las extremidades superiores en el estudio preoperatorio de los pacientes candidatos a un AV permitió optimizar el territorio vascular distal y mejorar la permeabilidad precoz y tardía de las fístulas radiocefálicas.
To assess the clinical usefulness of routine doppler ultrasound vascular mapping of upper extremities before creating a vascular access (VA) for haemodialysis.
Material and methodsA retrospective single-centre study conducted over a four-year period including end-stage renal disease (ESRD) patients referred to for VA creation for haemodialysis. Patients with previous VA in the same upper extremities were excluded. Two study groups were formed: Physical examination (PE: June 2011-February 2014) and ultrasound mapping (US: March 2014-June 2015). An analysis was performed on the demographic variables, comorbidities and AV location. The results of the patency rates of the radio-cephalic fistulae (RCF) subgroup were recorded, immediately (48h), early (4 weeks), and late (6 months).
ResultsThe study included a total 81 patients (42 PE, 39 US), with 63% males. The mean age was 66.5±13.1 years, and 81% were affected on the left side. There were no significant differences between the groups as regards, demographics, comorbidities, or ESRD aetiology. The VA type (PE vs. US): 47.6 vs. 69.2% radio-cephalic fistula* (*P<.05), 38.1 vs. 10.3% brachial-cephalic fistula*, 11.9 vs. 17.9% brachiobasilic fistula, and 2.4 vs. 2.6% humeral-axillary grafts. RCF patency rates: Immediate 90 vs. 85.2%, early 75 vs. 100%*, and late 88.9 vs. 55%*; respectively. However, an increase in AV performed in other territories was observed in PE group (25 vs. 3.7%*) in RCF.
ConclusionsRoutine doppler ultrasound mapping of upper extremities before VA creation in our centre allowed the distal vascular territory to be optimised, and improved the primary patency rates of both early and late radio-cephalic fistulas.
Los accesos vasculares (AV) son una condición indispensable para que los pacientes puedan iniciar tratamiento sustitutivo renal mediante hemodiálisis (HD)1,2. Existe un amplio consenso en que las fístulas arteriovenosas (FAV) son los AV de primera elección, por presentar una mayor permeabilidad y una menor tasa de complicaciones3,4. De los distintos tipos de FAV existentes, las radiocefálicas (FAVRC) descritas en el año 1966 por Cimino y Brescia5 son el AV ideal, por lograr preservar el territorio venoso y presentar menor comorbilidad asociada6.
Tradicionalmente, la selección de los vasos utilizados en la construcción de las FAV se basaba en la exploración física (EF) de las extremidades superiores (EESS), que aporta información detallada de la circulación venosa superficial, pero la información respecto a la circulación arterial era limitada, y se considera insuficiente en un porcentaje considerable de pacientes (25-50%)7. Del mismo modo, el progresivo envejecimiento de la población en programa de HD y el mayor número de comorbilidades que presentan estos pacientes generan un efecto negativo en la permeabilidad y supervivencia de las FAV8.
Por estos motivos, en los últimos años está cobrando gran importancia la valoración preoperatoria mediante mapeo ecográfico de las EESS. La ecografía es una exploración accesible, reproducible, poco costosa, no invasiva y sin riesgos añadidos; capaz de aportar información, tanto morfológica como funcional, del sistema venoso superficial y de la circulación arterial. De esta forma, es posible seleccionar el tipo de acceso más apropiado para cada paciente. No obstante, su uso no está instaurado completamente en la práctica clínica habitual9.
El objetivo de nuestro estudio es valorar el aumento en la creación de AV distales y la mejoría de su supervivencia, en aquellos casos en los que se realiza mapeo ecográfico preoperatorio en nuestro centro.
Material y métodosSe trata de un estudio unicéntrico retrospectivo con 2 cohortes establecidas, entre junio de 2011 y junio de 2015, aprobado por el Comité Ético de nuestra institución y realizado de acuerdo con las normas de la declaración de Helsinki, para valorar la utilidad clínica de la introducción rutinaria del mapeo ecográfico en el estudio preoperatorio de las EESS en los pacientes candidatos a la creación de un AV para HD.
A partir del registro quirúrgico informatizado de nuestro centro, seleccionamos a aquellos pacientes con enfermedad renal crónica terminal (ERCT) a los que se les realizó un AV primario en EESS para HD con seguimiento mínimo de 6 meses posterior a la intervención. Se excluyó a aquellos pacientes con FAV previas en la misma extremidad superior.
Tras la revisión de las historias clínicas, se recogieron las principales variables demográficas (sexo, edad), etiología y situación de la ERCT (prediálisis, HD o diálisis peritoneal), tipo de AV así como la presencia de los principales factores de riesgo cardiovasculares tradicionales: hipertensión arterial (HTA), diabetes mellitus (DM) y dislipidemia (DLP).
Según la valoración realizada previamente a la cirugía, se establecieron 2 grupos de estudio: grupo exploración física (EF: de junio de 2011 a febrero de 2014) y grupo mapeo ecográfico (ECO: de marzo de 2014 a junio de 2015). El grupo EF fue valorado exclusivamente mediante EF; el grupo ECO, adicionalmente mediante mapeo ecográfico EESS (Siemens Sonoline G40, Siemens Medical Solutions USA, Inc.).
La EF consistía en la valoración visual en ambas EESS de limitaciones articulares, déficits motores o sensitivos, grosor de la piel y grasa subcutánea, presencia de cicatrices o edema de la extremidad, así como existencia de circulación colateral en brazo u hombro. Se valoraba la presencia y calidad de los pulsos arteriales mediante palpación digital, incluyendo la maniobra o test de Allen; la toma de presiones arteriales en ambas EESS y la exploración del sistema venoso mediante la palpación venosa con y sin torniquete.
Los datos ecográficos analizados en ambas EESS fueron los diámetros (mm) de la arteria radial (AR), arteria humeral (AH), vena cefálica antebrazo (VCA) y del brazo, diámetro y profundidad de la vena basílica de brazo, así como la permeabilidad y continuidad de todos los vasos. Del mismo modo, se obtuvieron las velocidades (cm/s), el pico sistólico de AR y de la arteria humeral y el índice de resistencia de la AR tras el test de hiperemia reactiva.
Todas las intervenciones fueron realizadas por el mismo equipo de Cirugía Vascular, mediante la técnica quirúrgica habitual según el tipo de procedimiento. Todos los pacientes siguieron los mismos cuidados postoperatorios y fueron visitados a los 7 días de la intervención para comprobar el correcto funcionamiento de la FAV. Continuaron posteriormente sus controles habituales nefrológicos.
En el subgrupo de las FAVRC, se analizó la tasa de permeabilidad inmediata (48 h), precoz (4 semanas) y tardía (6 meses) así como los procedimientos realizados sobre ellas (reanastomosis quirúrgica, angioplastia percutánea o nuevo AV) en el período de estudio.
El análisis estadístico se realizó con el programa SPSS versión 19.0 (SPSS Inc, Chicago, IL, EE. UU.). Los datos presentaban una distribución normal. Las variables cuantitativas se expresaron mediante la media y la desviación estándar. Las variables cualitativas, mediante porcentaje o distribución de frecuencias. La comparación entre grupos se realizó mediante el test estadístico t de Student para variables cuantitativas y el test de chi cuadrado para las variables cualitativas (con la correlación de Fisher cuando lo requería). Se estableció como nivel de significación estadística un valor de p<0,05.
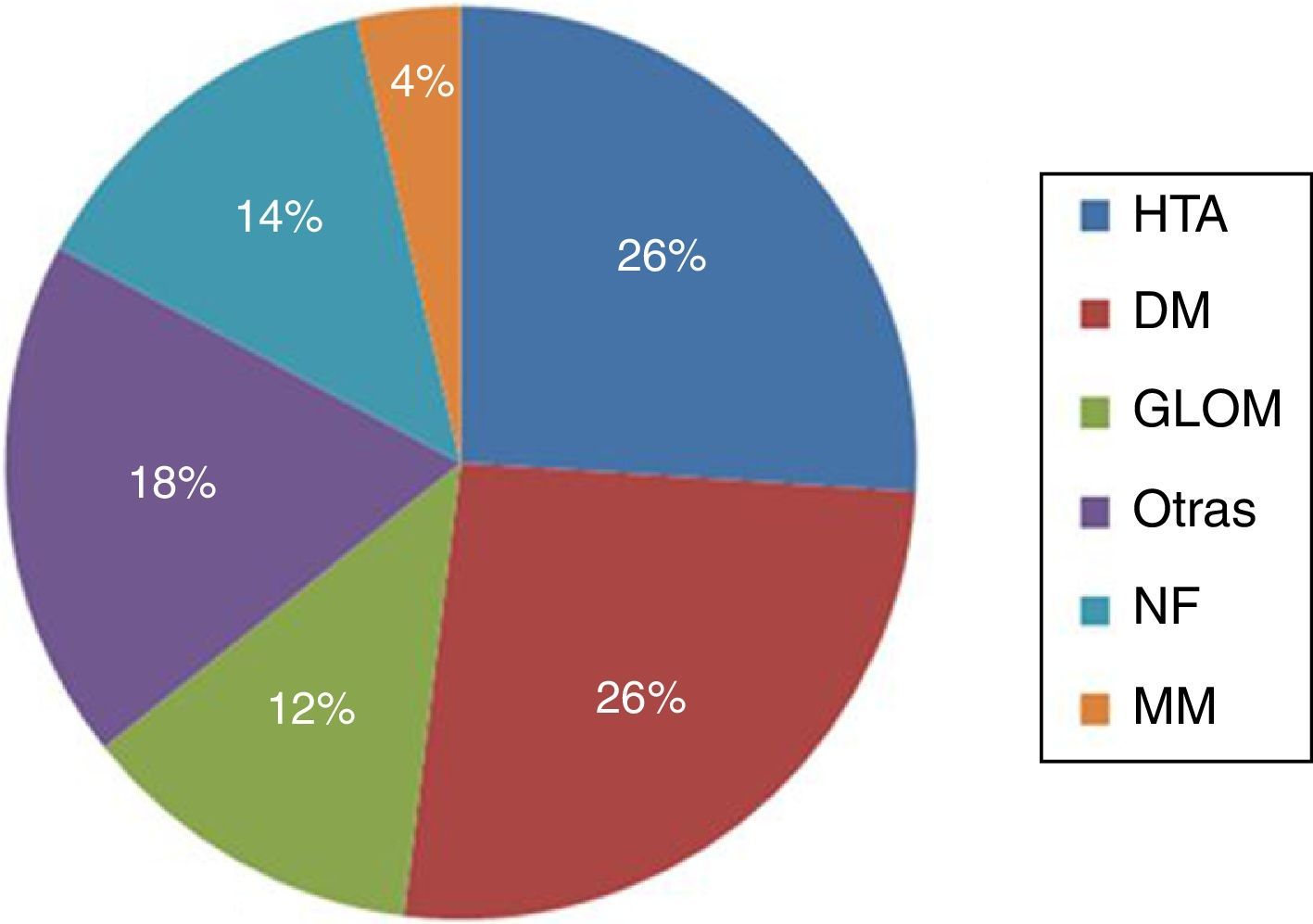
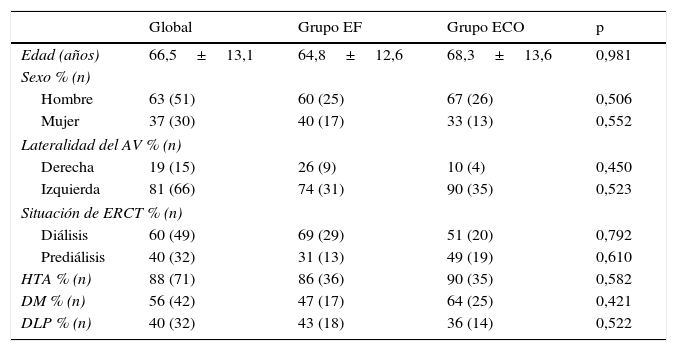
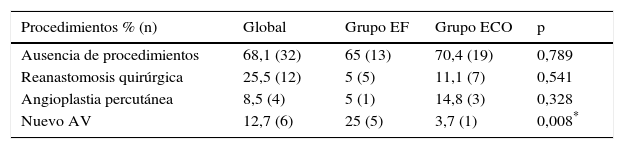
ResultadosEn el período de estudio, se realizaron en nuestro centro un total de 117 AV para HD. De estos, 36 pacientes fueron excluidos. Los motivos de exclusión fueron: presencia de AV previos en la misma extremidad superior (21), AV realizado en extremidades inferiores (9) y seguimiento inferior a 6 meses (6). Un total de 81 pacientes fueron incluidos en nuestro trabajo (42 pacientes en el grupo EF; 39 en el grupo ECO); con un total de 81 AV primarios. La edad media fue de 66,5±13,1 años, 51 hombres (63%). Un total de 66 AV (81%) fueron realizados en la extremidad superior izquierda. En el momento de la realización del AV, un 60% de los pacientes se encontraban en tratamiento sustitutivo renal (54% HD; 6% DP) y un 40% en situación de prediálisis. Las principales comorbilidades asociadas fueron la HTA (88%), DM (56%) y DLP (40%). La principal etiología de la ERCT queda reflejada en la figura 1; la HTA 26% y la DM 26% fueron las más prevalentes. No se evidenciaron diferencias significativas en las características basales de los grupos de estudio respecto a las variables demográficas, etiología de la ERCT ni comorbilidades asociadas (tabla 1).
Principal etiología de la enfermedad renal crónica terminal.
DM: diabetes mellitus; ERCT: enfermedad renal crónica terminal; GLOM: enfermedad glomerular; HTA: hipertensión arterial; MM: mieloma múltiple; NF: no filiada; Otras: otras enfermedades renales (poliquistosis, túbulo-intersticiales, nefrectomía, etc.).
Datos demográficos, parámetros clínicos, comorbilidad asociada y situación de la enfermedad renal
| Global | Grupo EF | Grupo ECO | p | |
|---|---|---|---|---|
| Edad (años) | 66,5±13,1 | 64,8±12,6 | 68,3±13,6 | 0,981 |
| Sexo % (n) | ||||
| Hombre | 63 (51) | 60 (25) | 67 (26) | 0,506 |
| Mujer | 37 (30) | 40 (17) | 33 (13) | 0,552 |
| Lateralidad del AV % (n) | ||||
| Derecha | 19 (15) | 26 (9) | 10 (4) | 0,450 |
| Izquierda | 81 (66) | 74 (31) | 90 (35) | 0,523 |
| Situación de ERCT % (n) | ||||
| Diálisis | 60 (49) | 69 (29) | 51 (20) | 0,792 |
| Prediálisis | 40 (32) | 31 (13) | 49 (19) | 0,610 |
| HTA % (n) | 88 (71) | 86 (36) | 90 (35) | 0,582 |
| DM % (n) | 56 (42) | 47 (17) | 64 (25) | 0,421 |
| DLP % (n) | 40 (32) | 43 (18) | 36 (14) | 0,522 |
Grupo EF (n=42) y ECO (n=39) al inicio del estudio.
AV: acceso vascular; DLP: dislipidemia; DM: diabetes mellitus; ERCT: enfermedad renal crónica terminal; HTA: hipertensión arterial.
Significación estadística: *p<0,05.
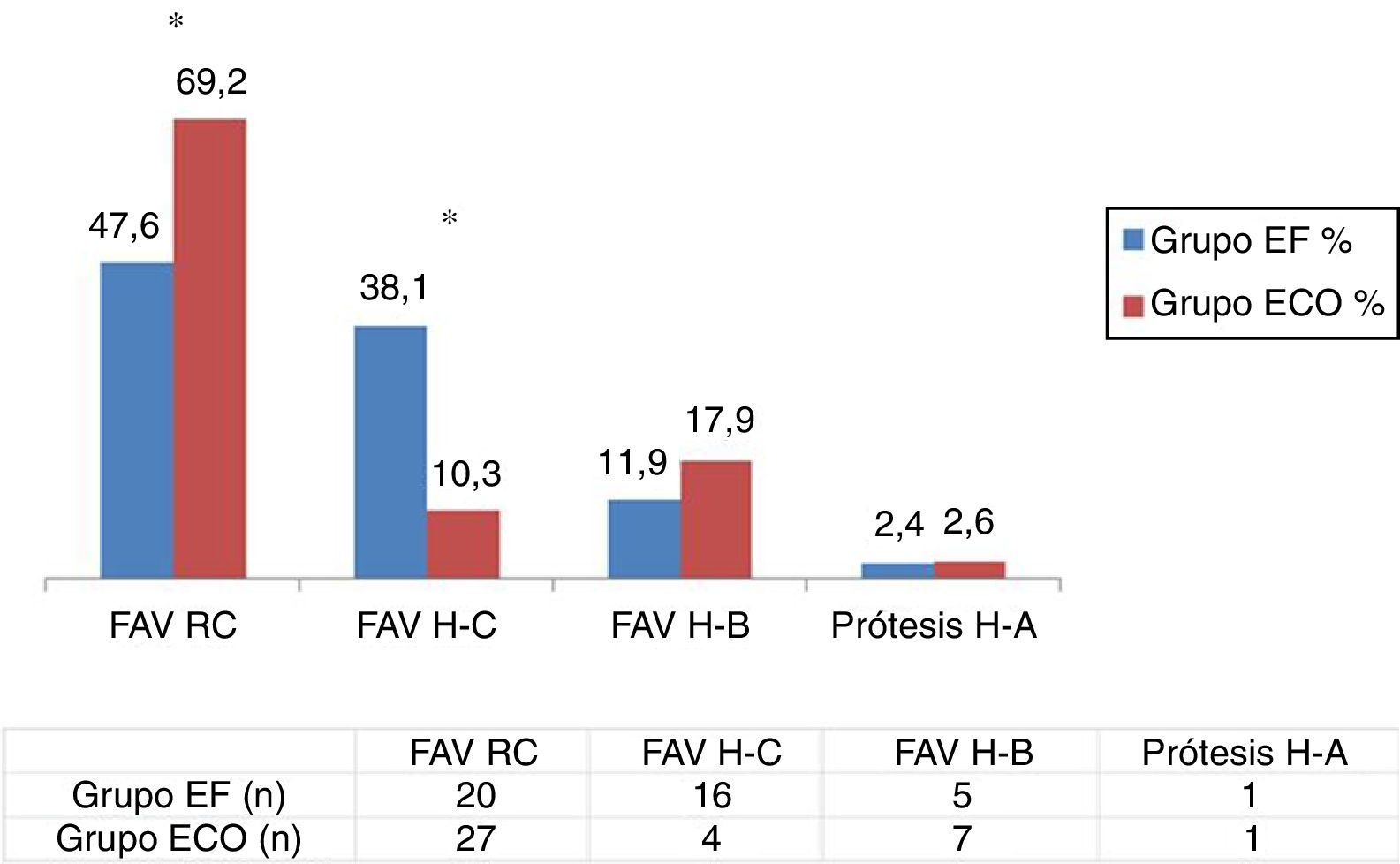
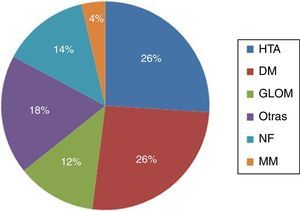
Los datos relativos al tipo de AV confeccionado (EF vs. ECO) se muestran en la figura 2. En nuestro estudio observamos significativamente un mayor número de FAVRC (47,6 vs. 69,2%; p < 0,05) y menor número de FAV húmero-cefálicas realizadas en el grupo ECO (38,1 vs. 10,3%; p < 0,05), mientras que no observamos diferencias relevantes entre grupos con relación a las FAV húmero-basílicas (11,9 vs. 17,9%) ni prótesis húmero-axilares (2,4 vs. 2,6%) realizadas. Únicamente a 2 pacientes del grupo ECO, a los que se les había indicado preoperatoriamente una FAVRC, se decidió realizarles una FAV húmero-cefálica tras los hallazgos intraoperatorios de los vasos.
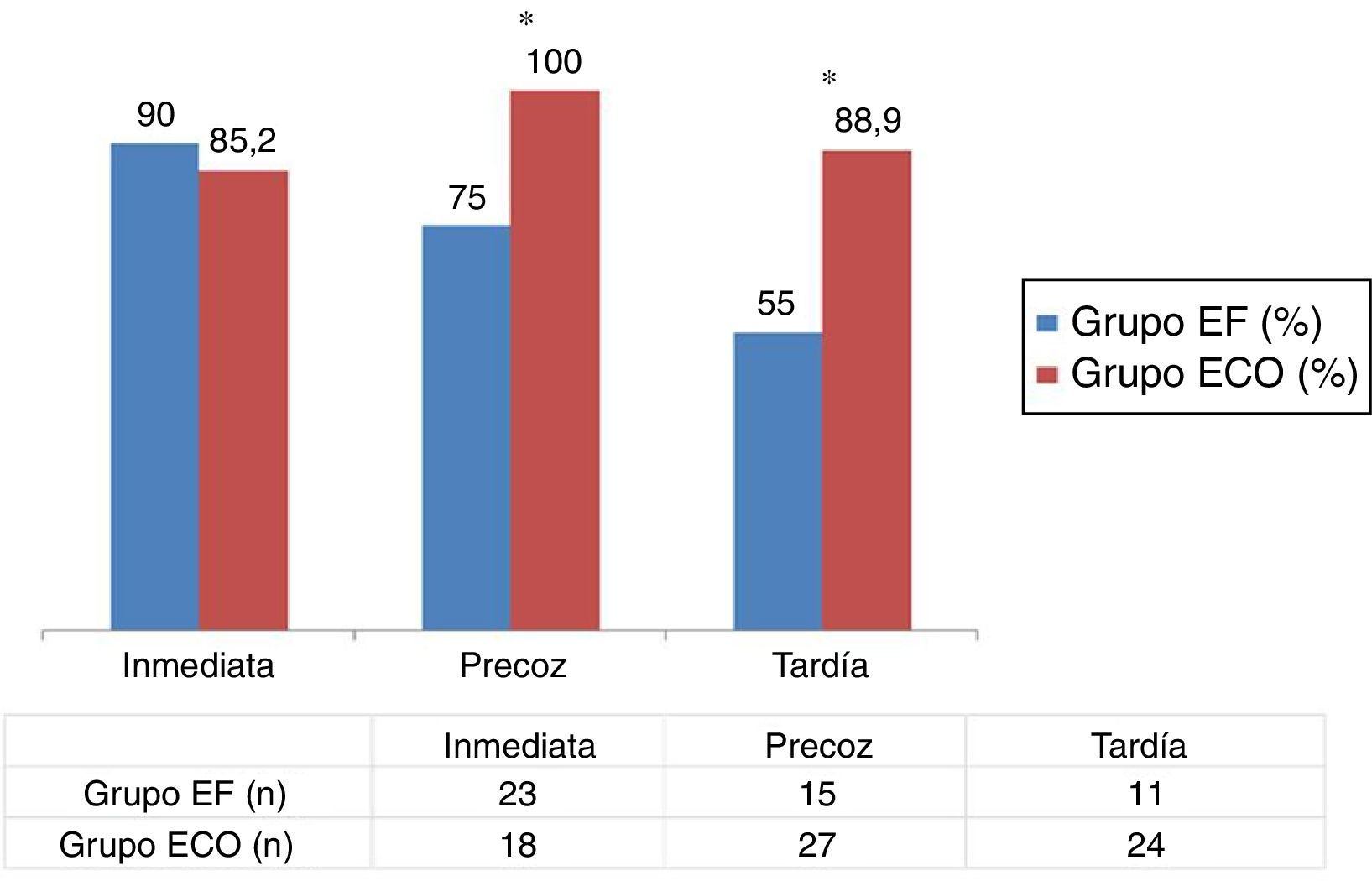
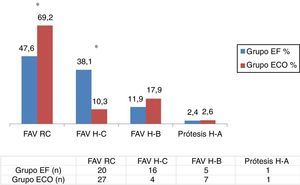
Con relación al análisis del subgrupo de las 47 FAVRC realizadas, la figura 3 muestra los resultados de las tasas de permeabilidad inmediata (48 h), precoz (4 semanas) y tardía (6 meses) en ambos grupos. En el grupo ECO observamos, de manera estadísticamente significativa, una mayor permeabilidad precoz (75 vs. 100%; p < 0,05) y tardía (55 vs. 88,9%; p < 0,05), respectivamente. No se observaron cambios relevantes en la permeabilidad inmediata, si bien esta fue ligeramente mayor en el grupo EF.
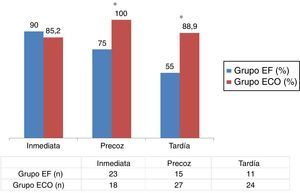
Con relación a los procedimientos realizados sobre las FAVRC durante el período de seguimiento, no se encontraron cambios relevantes entre los grupos de estudio con relación al número de angioplastias percutáneas ni de reanastomosis quirúrgicas, si bien todos estos fueron mayores en el grupo ECO. Únicamente observamos de forma significativa un mayor número de nuevos AV realizados en otros territorios en el grupo EF (25 vs. 3,7%; p < 0,05) (tabla 2).
Procedimientos realizados en el subgrupo de las fístulas arteriovenosas radiocefálicas en el período de estudio (ausencia de procedimientos, angioplastia percutánea, reanastomosis quirúrgicas y creación de nuevos accesos vasculares en otros territorios)
| Procedimientos % (n) | Global | Grupo EF | Grupo ECO | p |
|---|---|---|---|---|
| Ausencia de procedimientos | 68,1 (32) | 65 (13) | 70,4 (19) | 0,789 |
| Reanastomosis quirúrgica | 25,5 (12) | 5 (5) | 11,1 (7) | 0,541 |
| Angioplastia percutánea | 8,5 (4) | 5 (1) | 14,8 (3) | 0,328 |
| Nuevo AV | 12,7 (6) | 25 (5) | 3,7 (1) | 0,008* |
Grupo EF (n=20) y ECO (n=27).
AV: acceso vascular.
Significación estadística: *p<0,05.
Con relación a los valores ecográficos de las FAVRC realizadas en el grupo ECO, el diámetro medio de la AR fue de 2,6±0,4mm, VCA 3,1±0,7mm, pico sistólico de la AR 60,2±12cm/s y el índice de resistencia de la AR 0,76±0,08.
DiscusiónLas características del territorio vascular así como la necesidad de iniciar HD a través de una AV funcionante son algunos de los factores involucrados en el complejo proceso de elección del tipo de AV en los pacientes con ERCT. Si bien las FAV son el AV ideal, uno de sus principales inconvenientes, en especial de las FAVRC, es su baja supervivencia y permeabilidad, con una tasa de fallo precoz estimada del 15,3%, una supervivencia primaria del 62,5% y secundaria del 66% a los 12 meses, en un reciente metaanálisis publicado por Rooijens et al.10. Clásicamente, la edad avanzada, el sexo femenino, la presencia de DM y de arteriopatía periférica11–16 son algunos de los factores relacionados con peor supervivencia.
En vista de estos resultados, uno de los aspectos cruciales es utilizar nuevas herramientas para mejorar la supervivencia global de las FAV. Una de las estrategias que se han llevado a cabo en los últimos años es la incorporación del mapeo ecográfico de EESS en la planificación preoperatoria de los AV. La ecografía es una exploración accesible, reproducible, poco costosa, no invasiva y sin riesgos añadidos; capaz de aportar información morfológica y funcional del sistema venoso superficial y de la circulación arterial, lo que hace posible seleccionar el tipo de AV más apropiado para cada paciente.
Si bien las guías K/DOQI2 recomiendan la realización de esta exploración en todos los pacientes candidatos a un AV, en la actualidad su uso no está instaurado completamente en la práctica clínica. Esto es debido a la falta de evidencia suficiente para recomendar su aplicación de manera rutinaria. En algunos estudios publicados, los autores refieren que la realización de esta exploración permite aumentar el número de FAV nativas respecto a fístulas protésicas y mejorar, de manera significativa, la tasa de fallo precoz y su permeabilidad a corto plazo17–20. Mientras que una revisión sistemática publicada por Wong et al.21 concluye que, si bien el mapeo preoperatorio puede mejorar las tasas de maduración, los resultados no presentaron significación estadística. Un reciente metaanálisis publicado por Georgadis et al.22, en el que se compara la realización del estudio preoperatorio mediante EF reglada frente al mapeo ecográfico, recomienda que la EF sea siempre complementada con el mapeo ecográfico antes de la creación de un AV. De este modo, se consigue evitar exploraciones quirúrgicas negativas, así como reducir la tasa de fracaso inmediato de los AV de forma significativa.
De forma global, estos resultados son similares a los obtenidos en nuestro trabajo, donde observamos un mayor número de FAVRC, así como una mayor permeabilidad precoz y tardía tras la introducción rutinaria del mapeo ecográfico en la valoración preoperatoria de los pacientes con ERCT candidatos a un AV. Curiosamente, observamos una mayor permeabilidad inmediata, sin significado estadístico, en el grupo valorado por EF. En nuestra opinión, este hallazgo podría atribuirse a la utilización en el grupo ECO de vasos de tamaño y características limítrofes que, posiblemente, por EF no hubieran sido aptos para la realización de un AV distal. En este aspecto, en la literatura no existe un claro consenso acerca del diámetro recomendado de los vasos en la construcción de una FAVRC. Según los distintos autores, el diámetro de la VCA varía entre 2 y 2,6mm23,24, y de la AR entre 1,5 y 2,1mm25,26, datos que son similares a los utilizados en nuestro estudio.
En cuanto a la mejor permeabilidad precoz y tardía observada tras la introducción rutinaria del mapeo ecográfico, cabe mencionar que fue a expensas de un aumento no significativo del número de angioplastias percutáneas y reanastomosis de los pacientes del grupo ECO. Adicionalmente, evidenciamos un mayor número de nuevas FAV realizadas en otros territorios en el grupo EF. En nuestra opinión, estos resultados pondrían de manifiesto la utilidad de la ecografía en la elección del territorio vascular más adecuado para cada paciente, y permiten optimizar el territorio vascular distal.
Entre las limitaciones de nuestro estudio, cabe mencionar el diseño retrospectivo y el período de seguimiento no superior a 6 meses. Esta última limitación fue debida a la reciente incorporación del mapeo ecográfico preoperatorio del AV de forma habitual en nuestro centro. A su vez, mencionamos el escaso tamaño muestral de las FAVRC; este subgrupo de AV fue prioritario en nuestro análisis principalmente por los múltiples beneficios que ofrece a los pacientes, considerándose el AV de primera elección.
Concluimos que, en nuestro centro, la introducción del mapeo ecográfico de EESS en el estudio preoperatorio de los pacientes con ERCT candidatos a AV para HD permitió optimizar el territorio vascular distal y mejorar la tasa de permeabilidad precoz y tardía de las FAVRC. Con los resultados obtenidos, consideraremos su introducción rutinaria en nuestra práctica clínica habitual.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesNo existe conflicto de intereses.
Este trabajo de investigación se ha realizado en el marco del programa de Doctorado en Cirugía de la Universidad Autónoma de Barcelona (UAB).