A oclusão de ramo é uma importante complicação do endovascular aneurysm repair (EVAR). Pretende‐se realizar uma revisão sistemática da literatura existente de forma a avaliar a ocorrência e o tempo médio de oclusão de ramo, bem como identificar os fatores de risco associados.
Material e métodosFoi efetuada uma pesquisa bibliográfica com recurso à query EVAR LIMB OCCLUSION, limitada temporalmente aos últimos 10 anos, aos artigos escritos em português e inglês. Foram selecionados 20 artigos com dados originais; 14 provenientes da pesquisa bibliográfica e 6 provenientes das referências bibliográficas dos artigos lidos durante o processo de seleção.
ResultadosA frequência da oclusão de ramo varia entre os 0 e os 24%. Em grande parte dos estudos, o tempo decorrido até à oclusão de ramo raramente ultrapassa os 6 meses. A idade, índice de massa corporal, tortuosidade dos vasos ilíacos, estenose da artéria ilíaca ou femoral>70%, o tipo, configuração e kinking do ramo da endoprótese, ancoragem na artéria ilíaca externa (AIE), hospital terciário, a não realização do stenting primário aquando do procedimento índice e o incumprimento das instruções específicas para uso da endoprótese foram identificados como fatores de risco da oclusão de ramo.
ConclusãoOs fatores demográficos/comorbilidades parecem ter uma menor importância no outcome oclusão de ramo, comparativamente aos fatores de risco relacionados com a anatomia arterial e relacionados com a técnica cirúrgica. O tipo de endoprótese, a zona de ancoragem na AIE e a tortuosidade dos vasos ilíacos parecem ser os fatores de risco mais importantes.
Limb occlusion is an important complication of endovascular aneurysm repair (EVAR). We intend to conduct a systematic review of the literature to assess the occurrence and the average time of limb occlusion and identify associated risk factors.
Material and methodsA literature search was performed using the query EVAR LIMB OCCLUSION, limited in time to the last ten years, to articles written in Portuguese and English. We selected twenty articles with original data; fourteen from the literature and six from the reference lists of articles read during the selection process.
ResultsThe frequency of limb occlusion varies between 0% and 24%. In most studies, the elapsed time to limb occlusion rarely exceeds six months. Age, body mass index, tortuosity of the iliac vessels, stenosis of the iliac or femoral artery>70%, graft type and configuration, limb kinking, anchoring in the external iliac artery (EIA), tertiary hospital, absence of primary stenting during the index procedure and failure to comply to the specific instructions for use were identified as risk factors for limb occlusion.
ConclusionsDemographic/co‐morbidities factors seem to have a minor impact in outcome limb occlusion compared to risk factors related to arterial anatomy and related to the surgical technique. The type of graft, the anchoring zone in the EIA and the tortuosity of the iliac vessels seem to be the most important risk factors.
O aneurisma da aorta abdominal (AAA) é uma doença degenerativa da aorta abdominal, podendo ser definida como a presença de um diâmetro igual ou superior a 3cm, no plano ântero‐posterior ou transverso1.
Uma das formas de tratamento usado é o endovascular aneurysm repair (EVAR), sendo considerado por alguns o procedimento standard na correção cirúrgica dos AAA2. O advento do EVAR trouxe uma redução na morbilidade pós‐operatória, tempo de internamento e de recuperação3. Ainda que esta técnica tenha mudado o paradigma do tratamento de AAA, o EVAR é um procedimento não isento de complicações3.
A oclusão de ramo é uma das complicações possíveis, podendo pôr em causa a vida ou a viabilidade de membro do doente4. A sua incidência é muito variável, com valores que oscilam entre os 0 e os 24%5. Esta discrepância pode ser explicada pelos vários fatores de risco associados a esta ocorrência. Estes podem ser divididos em 3 grupos: fatores de risco demográficos/comorbilidades, onde podemos encontrar a idade6 ou o índice de massa corporal (IMC)4; relacionados com a anatomia arterial, sendo a tortuosidade dos vasos ilíacos um exemplo4; e fatores de risco técnicos, como o tipo de endoprótese utilizada6.
Com este estudo pretende‐se realizar uma revisão sistemática da literatura existente de forma a avaliar a ocorrência de oclusão de ramo e seu tempo médio de surgimento após EVAR; identificar fatores de risco associados à oclusão de ramo, expondo e discutindo a associação e peso na oclusão.
Material e métodosPara a realização deste trabalho foi efetuada uma pesquisa bibliográfica na MEDLINE e SCOPUS usando para tal a query EVAR LIMB OCCLUSION (fig. 1). Esta pesquisa foi limitada temporalmente de forma a abranger artigos dos últimos 10 anos e escritos em português ou inglês. À data da realização da pesquisa, 1 de setembro de 2014, foram encontrados 76 artigos na MEDLINE e 109 artigos na SCOPUS, totalizando 185 artigos. Após a leitura dos abstract, excluíram‐se os artigos que apresentavam um abstract não relevante, a não abordagem do EVAR, estudos de caso, revisões bibliográficas, metanálises e artigos em duplicado (n=115).
Foi efetuada a leitura completa dos artigos selecionados (n=70), tendo sido excluídos 56 artigos por não abordarem a oclusão de ramo ou possíveis fatores de risco, estando ou não associados, e por abordarem o EVAR apenas em situações de emergência; destes 56 artigos, 15 não se encontravam disponíveis.
Foram incluídos para a revisão sistemática 20 artigos com dados originais; 14 provenientes da pesquisa bibliográfica, 6 provenientes das referências bibliográficas dos artigos lidos durante o método de seleção.
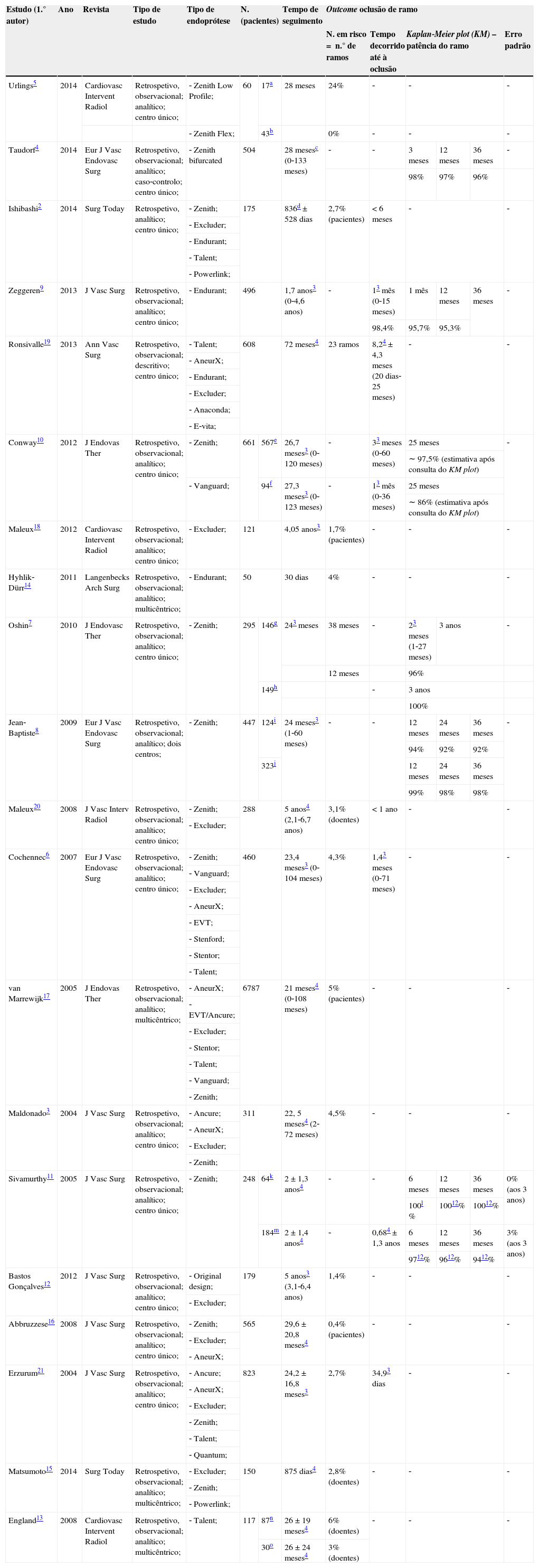
ResultadosSão vários os métodos utilizados para estimar a frequência do outcome oclusão de ramo (tabela 1). Existe uma grande variabilidade na percentagem de oclusão de ramo/pacientes com oclusão de ramo, sendo apresentados valores entre os 0 e os 24%5.
Síntese do outcome oclusão de ramo
| Estudo (1.° autor) | Ano | Revista | Tipo de estudo | Tipo de endoprótese | N. (pacientes) | Tempo de seguimento | Outcome oclusão de ramo | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| N. em risco= n.° de ramos | Tempo decorrido até à oclusão | Kaplan‐Meier plot (KM) – patência do ramo | Erro padrão | ||||||||||
| Urlings5 | 2014 | Cardiovasc Intervent Radiol | Retrospetivo, observacional; analítico; centro único; | ‐ Zenith Low Profile; | 60 | 17a | 28 meses | 24% | ‐ | ‐ | ‐ | ||
| ‐ Zenith Flex; | 43b | 0% | ‐ | ‐ | ‐ | ||||||||
| Taudorf4 | 2014 | Eur J Vasc Endovasc Surg | Retrospetivo, observacional; analítico; caso‐controlo; centro único; | ‐ Zenith bifurcated | 504 | 28 mesesc (0‐133 meses) | ‐ | ‐ | 3 meses | 12 meses | 36 meses | ‐ | |
| 98% | 97% | 96% | |||||||||||
| Ishibashi2 | 2014 | Surg Today | Retrospetivo, analítico; centro único; | ‐ Zenith; | 175 | 836d± 528 dias | 2,7% (pacientes) | <6 meses | ‐ | ‐ | |||
| ‐ Excluder; | |||||||||||||
| ‐ Endurant; | |||||||||||||
| ‐ Talent; | |||||||||||||
| ‐ Powerlink; | |||||||||||||
| Zeggeren9 | 2013 | J Vasc Surg | Retrospetivo, observacional; analítico; centro único; | ‐ Endurant; | 496 | 1,7 anos3 (0‐4,6 anos) | ‐ | 13 mês (0‐15 meses) | 1 mês | 12 meses | 36 meses | ‐ | |
| 98,4% | 95,7% | 95,3% | |||||||||||
| Ronsivalle19 | 2013 | Ann Vasc Surg | Retrospetivo, observacional; descritivo; centro único; | ‐ Talent; | 608 | 72 meses4 | 23 ramos | 8,24±4,3 meses (20 dias‐25 meses) | ‐ | ‐ | |||
| ‐ AneurX; | |||||||||||||
| ‐ Endurant; | |||||||||||||
| ‐ Excluder; | |||||||||||||
| ‐ Anaconda; | |||||||||||||
| ‐ E‐vita; | |||||||||||||
| Conway10 | 2012 | J Endovas Ther | Retrospetivo, observacional; analítico; centro único; | ‐ Zenith; | 661 | 567e | 26,7 meses3 (0‐120 meses) | ‐ | 33 meses (0‐60 meses) | 25 meses | ‐ | ||
| ∼97,5% (estimativa após consulta do KM plot) | |||||||||||||
| ‐ Vanguard; | 94f | 27,3 meses3 (0‐123 meses) | ‐ | 13 mês (0‐36 meses) | 25 meses | ||||||||
| ∼86% (estimativa após consulta do KM plot) | |||||||||||||
| Maleux18 | 2012 | Cardiovasc Intervent Radiol | Retrospetivo, observacional; analítico; centro único; | ‐ Excluder; | 121 | 4,05 anos3 | 1,7% (pacientes) | ‐ | ‐ | ‐ | |||
| Hyhlik‐Dürr14 | 2011 | Langenbecks Arch Surg | Retrospetivo, observacional; analítico; multicêntrico; | ‐ Endurant; | 50 | 30 dias | 4% | ‐ | ‐ | ‐ | |||
| Oshin7 | 2010 | J Endovasc Ther | Retrospetivo, observacional; analítico; centro único; | ‐ Zenith; | 295 | 146g | 243 meses | 38 meses | ‐ | 23 meses (1‐27 meses) | 3 anos | ‐ | |
| 12 meses | 96% | ||||||||||||
| 149h | ‐ | 3 anos | |||||||||||
| 100% | |||||||||||||
| Jean‐Baptiste8 | 2009 | Eur J Vasc Endovasc Surg | Retrospetivo, observacional; analítico; dois centros; | ‐ Zenith; | 447 | 124i | 24 meses3 (1‐60 meses) | ‐ | ‐ | 12 meses | 24 meses | 36 meses | ‐ |
| 94% | 92% | 92% | |||||||||||
| 323j | 12 meses | 24 meses | 36 meses | ||||||||||
| 99% | 98% | 98% | |||||||||||
| Maleux20 | 2008 | J Vasc Interv Radiol | Retrospetivo, observacional; analítico; centro único; | ‐ Zenith; | 288 | 5 anos4 (2,1‐6,7 anos) | 3,1% (doentes) | <1 ano | ‐ | ‐ | |||
| ‐ Excluder; | |||||||||||||
| Cochennec6 | 2007 | Eur J Vasc Endovasc Surg | Retrospetivo, observacional; analítico; centro único; | ‐ Zenith; | 460 | 23,4 meses3 (0‐104 meses) | 4,3% | 1,43 meses (0‐71 meses) | ‐ | ‐ | |||
| ‐ Vanguard; | |||||||||||||
| ‐ Excluder; | |||||||||||||
| ‐ AneurX; | |||||||||||||
| ‐ EVT; | |||||||||||||
| ‐ Stenford; | |||||||||||||
| ‐ Stentor; | |||||||||||||
| ‐ Talent; | |||||||||||||
| van Marrewijk17 | 2005 | J Endovas Ther | Retrospetivo, observacional; analítico; multicêntrico; | ‐ AneurX; | 6787 | 21 meses4 (0‐108 meses) | 5% (pacientes) | ‐ | ‐ | ‐ | |||
| ‐ EVT/Ancure; | |||||||||||||
| ‐ Excluder; | |||||||||||||
| ‐ Stentor; | |||||||||||||
| ‐ Talent; | |||||||||||||
| ‐ Vanguard; | |||||||||||||
| ‐ Zenith; | |||||||||||||
| Maldonado3 | 2004 | J Vasc Surg | Retrospetivo, observacional; analítico; centro único; | ‐ Ancure; | 311 | 22, 5 meses4 (2‐72 meses) | 4,5% | ‐ | ‐ | ‐ | |||
| ‐ AneurX; | |||||||||||||
| ‐ Excluder; | |||||||||||||
| ‐ Zenith; | |||||||||||||
| Sivamurthy11 | 2005 | J Vasc Surg | Retrospetivo, observacional; analítico; centro único; | ‐ Zenith; | 248 | 64k | 2±1,3 anos4 | ‐ | ‐ | 6 meses | 12 meses | 36 meses | 0% (aos 3 anos) |
| 100l % | 10012% | 10012% | |||||||||||
| 184m | 2±1,4 anos4 | ‐ | 0,684±1,3 anos | 6 meses | 12 meses | 36 meses | 3% (aos 3 anos) | ||||||
| 9712% | 9612% | 9412% | |||||||||||
| Bastos Gonçalves12 | 2012 | J Vasc Surg | Retrospetivo, observacional; analítico; centro único; | ‐ Original design; | 179 | 5 anos3 (3,1‐6,4 anos) | 1,4% | ‐ | ‐ | ‐ | |||
| ‐ Excluder; | |||||||||||||
| Abbruzzese16 | 2008 | J Vasc Surg | Retrospetivo, observacional; analítico; centro único; | ‐ Zenith; | 565 | 29,6±20,8 meses4 | 0,4% (pacientes) | ‐ | ‐ | ‐ | |||
| ‐ Excluder; | |||||||||||||
| ‐ AneurX; | |||||||||||||
| Erzurum21 | 2004 | J Vasc Surg | Retrospetivo, observacional; analítico; centro único; | ‐ Ancure; | 823 | 24,2±16,8 meses3 | 2,7% | 34,93 dias | ‐ | ‐ | |||
| ‐ AneurX; | |||||||||||||
| ‐ Excluder; | |||||||||||||
| ‐ Zenith; | |||||||||||||
| ‐ Talent; | |||||||||||||
| ‐ Quantum; | |||||||||||||
| Matsumoto15 | 2014 | Surg Today | Retrospetivo, observacional; analítico; multicêntrico; | ‐ Excluder; | 150 | 875 dias4 | 2,8% (doentes) | ‐ | ‐ | ‐ | |||
| ‐ Zenith; | |||||||||||||
| ‐ Powerlink; | |||||||||||||
| England13 | 2008 | Cardiovasc Intervent Radiol | Retrospetivo, observacional; analítico; multicêntrico; | ‐ Talent; | 117 | 87n | 26±19 meses4 | 6% (doentes) | ‐ | ‐ | ‐ | ||
| 30o | 26±24 meses4 | 3% (doentes) | |||||||||||
Vários autores incluem no seu estudo uma análise de sobrevivência por Kaplan‐Meier4,7–10 e pelo método acturial11 (tabela 1). Taudorf et al. apresentam valores de patência do ramo de endoprótese de 98, 97 e 96% aos 3, 12 e 36 meses, respetivamente4. Já o grupo de trabalho liderado por Zeggeren9 apresenta patência de 98,4, 95,7 e 95,3% ao fim de um, 12 e 36 meses, respetivamente. Conway et al.10 realizaram 2 análises de sobrevivência, apresentando patências estimadas de ramo da endoprótese, após consulta do Kaplan‐Meier plot, de 97,5% aos 25 meses, com zona de ancoragem na artéria ilíaca comum (AIC); e de 86% aos 25 meses, com zona de ancoragem na artéria ilíaca externa (AIE). Já Oshin et al.7 apresentam patências de ramo de 100% a 3 anos em doentes que foram submetidos a stenting, decididos pré‐operatoriamente, com base na presença de tortuosidade e/ou estenose da AIC e utilização da AIE como zona de ancoragem, com recurso a tomografia computorizada (TC), e de 96% a 3 anos em doentes submetidos a stenting ad hoc. Jean‐Baptiste et al.8 apresentam no seu estudo patências de ramo de 94, 92 e 92% aos 12, 24 e 36 meses, respetivamente, nos pacientes que foram submetidos a EVAR com endoprótese aorto‐uni‐ilíaca (AUI); e de 99, 98 e 98%, aos 12, 24 e 36 meses, respetivamente, nos pacientes que foram submetidos a EVAR com endoprótese aorto‐bi‐ilíaca (ABI). Por sua vez, Sivamurthy et al.11, através de uma estimativa feita pelo método acturial, apresentam no seu estudo patências de ramo de 100% aos 36 meses, com erro padrão (EP) de 0%, nos pacientes que foram submetidos a stenting primário com base na presença de kinking ou compressão externa do ramo da endoprótese, tortuosidade dos vasos ilíacos e/ou zona de ancoragem na AIE; e de 94% aos 36 meses, com EP de 3%, nos pacientes que não foram submetidos a stenting primário.
No que concerne ao tempo decorrido até à oclusão de ramo, os resultados são igualmente variáveis. Em alguns estudos esta informação é até omissa3,8,12–18. Verifica‐se que, à exceção do estudo liderado por Ronsivalle19, em que a média de tempo decorrido até à oclusão de ramo é 8,2±4,3 meses e do estudo liderado por Maleux20, em que o tempo médio é inferior a um ano, a média/mediana raramente ultrapassa os 6 meses2,6,7,9–11,21 (tabela 1).
O tempo médio/mediana de seguimento é variável nos estudos apresentados (tabela 1), sendo o mínimo 30 dias14 e o máximo 5 anos12,20.
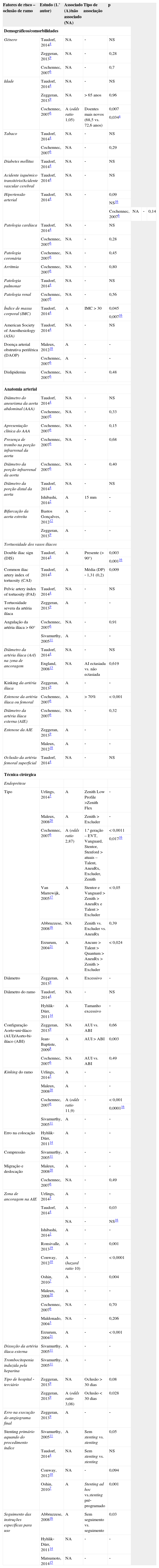
A tabela 2 é um resumo dos fatores de risco apresentados pela literatura selecionada, estando classificados em associados (A), quando são mencionados como preditores de oclusão de ramo, ou o inverso, não associados (NA). Os fatores de risco encontram‐se organizados em 3 grupos, demográficos/comorbilidades, relacionados com a anatomia arterial e relacionados com a técnica cirúrgica.
Síntese dos fatores de risco para oclusão de ramo
| Fatores de risco – oclusão de ramo | Estudo (1.° autor) | Associado (A)/não associado (NA) | Tipo de associação | p |
|---|---|---|---|---|
| Demográficos/comorbilidades | ||||
| Género | Taudorf, 20144 | NA | ‐ | NS |
| Zeggeran, 20139 | NA | ‐ | 0,28 | |
| Cochennec, 20076 | NA | ‐ | 0,7 | |
| Idade | Taudorf, 20144 | NA | ‐ | NS |
| Zeggeran, 20139 | NA | >65 anos | 0,96 | |
| Cochennec, 20076 | A (odds ratio 1,05) | Doentes mais novos (68,5 vs. 72,6 anos) | 0,007 | |
| 0,034a | ||||
| Tabaco | Taudorf, 20144 | NA | ‐ | NS |
| Cochennec, 20076 | NA | ‐ | 0,29 | |
| Diabetes mellitus | Taudorf, 20144 | NA | ‐ | NS |
| Acidente isquémico transitório/Acidente vascular cerebral | Taudorf, 20144 | NA | ‐ | NS |
| Hipertensão arterial | Taudorf, 20144 | NA | ‐ | 0,09 |
| NS16 | ||||
| Cochennec, 20076 | NA | ‐ | 0,14 | |
| Patologia cardíaca | Taudorf, 20144 | NA | ‐ | NS |
| Cochennec, 20076 | NA | ‐ | 0,28 | |
| Patologia coronária | Cochennec, 20076 | NA | ‐ | 0,45 |
| Arritmia | Cochennec, 20076 | NA | ‐ | 0,80 |
| Patologia pulmonar | Taudorf, 20144 | NA | ‐ | NS |
| Patologia renal | Cochennec, 20076 | NA | ‐ | 0,56 |
| Índice de massa corporal (IMC) | Taudorf, 20144 | A | IMC >30 | 0,045 |
| 0,00716 | ||||
| American Society of Anesthesiology (ASA) | Taudorf, 20144 | NA | ‐ | NS |
| Doença arterial obstrutiva periférica (DAOP) | Maleux, 201218 | A | ‐ | ‐ |
| Cochennec, 20076 | A | ‐ | ‐ | |
| Dislipidemia | Cochennec, 20076 | NA | ‐ | 0,48 |
| Anatomia arterial | ||||
| Diâmetro do aneurisma da aorta abdominal (AAA) | Taudorf, 20144 | NA | ‐ | NS |
| Cochennec, 20076 | NA | ‐ | 0,33 | |
| Apresentação clínica do AAA | Cochennec, 20076 | NA | ‐ | 0,15 |
| Presença de trombo na porção infrarrenal da aorta | Cochennec, 20076 | NA | ‐ | 0,68 |
| Diâmetro da porção infrarrenal da aorta | Cochennec, 20076 | NA | ‐ | 0,40 |
| Diâmetro da porção distal da aorta | Taudorf, 20144 | NA | ‐ | NS |
| Ishibashi, 20142 | A | 15mm | ‐ | |
| Bifurcação da aorta estreita | Bastos Gonçalves, 201212 | A | ‐ | ‐ |
| Zeggeran, 20139 | A | ‐ | ‐ | |
| Tortuosidade dos vasos ilíacos | ||||
| Double iliac sign (DIS) | Taudorf, 20144 | A | Presente (>90°) | 0,003 |
| 0,00116 | ||||
| Common iliac artery index of tortuosity (CAI) | Taudorf, 20144 | A | Média (DP) ‐ 1,31 (0,2) | 0,009 |
| Pelvic artery índex of tortuosity (PAI) | Taudorf, 20144 | NA | ‐ | NS |
| Tortuosidade severa da artéria ilíaca | Zeggeran, 20139 | A | ‐ | ‐ |
| Angulação da artéria ilíaca >60° | Cochennec, 20076 | NA | ‐ | 0,91 |
| Sivamurthy, 200511 | A | ‐ | ‐ | |
| Diâmetro da artéria ilíaca (ArI) na zona de ancoragem | Taudorf, 20144 | NA | ‐ | NS |
| England, 200813 | NA | AI ectasiada vs. não ectasiada | 0,619 | |
| Kinking da artéria ilíaca | Zeggeran, 20139 | A | ‐ | ‐ |
| Estenose da artéria ilíaca ou femoral | Cochennec, 20076 | A | >70% | <0,001 |
| Diâmetro da artéria ilíaca externa (AIE) | Cochennec, 20076 | NA | ‐ | 0,32 |
| Estenose da AIE | Zeggeran, 20139 | A | ‐ | ‐ |
| Maleux, 201218 | A | ‐ | ‐ | |
| Oclusão da artéria femoral superficial | Taudorf, 20144 | NA | ‐ | NS |
| Técnica cirúrgica | ||||
| Endoprótese | ||||
| Tipo | Urlings, 20145 | A | Zenith Low Profile >Zenith Flex | ‐ |
| Maleux, 200820 | A | Zenith > Excluder | ‐ | |
| Cochennec, 20076 | A (odds ratio 2,87) | 1.ª geração – EVT, Vanguard, Stentor, Stenford > atuais – Talent, AneuRx, Excluder, Zenith | <0,0011 | |
| 0,01716 | ||||
| Van Marrewijk, 200517 | A | Stentor e Vanguard > Zenith > AneuRx e Talent > Excluder | <0,05 | |
| Abbruzzese, 200816 | NA | Zenith vs. Excluder vs. AneuRx | 0,39 | |
| Erzurum, 200421 | A | Ancure > Talent > Quantum > AneuRx > Zenith > Excluder | <0,024 | |
| Diâmetro | Zeggeran, 20139 | A | Excessivo | ‐ |
| Diâmetro do ramo | Taudorf, 20144 | NA | ‐ | NS |
| Hyhlik‐Dürr, 201114 | A | Tamanho excessivo | ‐ | |
| Configuração Aorto‐uni‐ilíaco (AUI)/Aorto‐bi‐ilíaco (ABI) | Zeggeran, 20139 | NA | AUI vs. ABI | 0,66 |
| Jean‐Baptiste, 20098 | A | AUI > ABI | 0,003 | |
| Cochennec, 20076 | NA | AUI vs. ABI | 0,49 | |
| Kinking do ramo | Urlings, 20145 | A | ‐ | ‐ |
| Maleux, 200820 | A | ‐ | ‐ | |
| Cochennec, 20076 | A (odds ratio 11,9) | ‐ | <0,001 | |
| 0,000116 | ||||
| Sivamurthy, 200511 | A | ‐ | ‐ | |
| Erro na colocação | Hyhlik‐Dürr, 201114 | A | ‐ | ‐ |
| Compressão | Sivamurthy, 200511 | A | ‐ | ‐ |
| Migração e deslocação | Maleux, 200820 | A | ‐ | ‐ |
| Cochennec, 20076 | NA | ‐ | 0,49 | |
| Zona de ancoragem na AIE | Urlings, 20145 | A | ‐ | ‐ |
| Taudorf, 20144 | A | ‐ | 0,03 | |
| NA | ‐ | NS16 | ||
| Ishibashi, 20142 | A | ‐ | ‐ | |
| Ronsivalle, 201319 | A | ‐ | 0,001 | |
| Conway, 201210 | A (hazard ratio 10) | ‐ | <0,0001 | |
| Oshin, 20107 | A | ‐ | 0,004 | |
| Maleux, 200820 | A | ‐ | ‐ | |
| Cochennec, 20076 | NA | ‐ | 0,70 | |
| Maldonado, 20043 | NA | ‐ | 0,206 | |
| Erzurum, 200421 | A | ‐ | <0,001 | |
| Disseção da artéria ilíaca externa | Sivamurthy, 200511 | A | ‐ | ‐ |
| Trombocitopenia induzida pela heparina | Sivamurthy, 200511 | A | ‐ | ‐ |
| Tipo de hospital ‐ terciário | Zeggeran, 20139 | NA | Oclusão >30 dias | 0,08 |
| Zeggeran, 20139 | A (odds ratio 3,08) | Oclusão <30 dias | 0,028 | |
| Erro na execução do angiograma final | Zeggeran, 20139 | A | ‐ | ‐ |
| Stenting primário aquando do procedimento índice | Sivamurthy, 200511 | A | Sem stenting vs. stenting | 0,05 |
| Taudorf, 20144 | NA | Sem stenting vs. stenting | NS | |
| Conway, 201210 | NA | ‐ | 0,094 | |
| Oshin, 20107 | A | Stenting ad hoc vs.stenting pré‐programado | 0,001 | |
| Seguimento das instruções específicas para uso | Abbruzzese, 200816 | A | Sem seguimento vs. seguimento | 0,03 |
| Hyhlik‐Dürr, 201114 | NA | ‐ | ‐ | |
| Matsumoto, 201415 | NA | ‐ | ‐ | |
NS: não significativo.
No que diz respeito aos fatores de risco demográficos/comorbilidades, a idade, o IMC e a doença arterial obstrutiva periférica (DAOP) são fatores associados a um aumento de risco para oclusão de ramo4,6,18.
São 3 os estudos4,6,9 que avaliam a idade como fator de risco para oclusão de ramo, mas só um deles estabelece a associação como fator de risco independente (p=0,034)6. Para além disso, esse estudo também refere que os doentes mais novos (média de idades=68,5 anos) têm um odds ratio (OR) de 1,05, comparativamente aos doentes mais velhos (média de idades=72,6 anos).
O IMC >30 atua de forma independente como fator de risco de oclusão de ramo (p=0,007)4. A DAOP é uma causa presumida da oclusão de ramo6,18.
Relativamente aos fatores de risco relacionados com a anatomia arterial, a estenose da AIE9,18, o kinking da artéria ilíaca9, a tortuosidade severa da artéria ilíaca9, a angulação da artéria ilíaca >60°11, a bifurcação estreita da aorta9,12 e o diâmetro da porção distal da aorta2 são causas presumidas de oclusão de ramo. No entanto, através de análise univariada, Taudorf et al.4 e Cochennec et al.6 concluíram que não havia associação entre o diâmetro da porção distal da aorta (p=não significativo [NS]) e angulação da artéria ilíaca >60° (p=NS), respetivamente, com a oclusão de ramo.
A tortuosidade dos vasos ilíacos foi estudada através de diversos métodos. Para o double iliac sign (DIS) a associação encontra‐se quando a angulação da artéria ilíaca é superior a 90° (p=0,003), sendo um fator de risco independente para oclusão de ramo (p=0,001)4; já no common iliac artery índex of tortuosity (CAI), a associação verifica‐se para um índice médio de 1,31 (p=0,009)4. Não só a tortuosidade, mas também a estenose da artéria ilíaca ou femoral >70% está associada a oclusão de ramo (p <0,001)6.
A endoprótese foi estudada sob diversas perspetivas, tendo sido encontradas associações entre o tipo utilizado5,6,17,20,21, o diâmetro9, o diâmetro do ramo14, a configuração8, o kinking do ramo5,6,11,20, erros na colocação14, compressão11 e a migração e deslocação da endoprótese20. Cochennec et al.6 referem que as endopróteses da 1.a geração estão associadas a um OR de 2,87 (p=0,0011), sendo mesmo um fator de risco independente para oclusão de ramo no estudo por eles liderado (p=0,017). Esse mesmo estudo também calcula um OR de 11,9 para o kinking do ramo e define‐o igualmente como fator de risco independente (p=0,0001).
Erzurum et al. (p <0,024)21 e Van Marrewijk et al. (p <0,05)17 encontram igualmente associação entre tipo de endoprótese e a oclusão de ramo, estando em concordância em relação à Excluder® como a endoprótese que menos associada ao outcome.
Já Jean‐Baptiste8 encontra associação entre a configuração da endoprótese e o risco de oclusão, afirmando que a endoprótese AUI aumenta o risco de oclusão (p=0,003).
A zona de ancoragem na AIE foi associada ao outcome em diversos estudos2,4,5,7,10,19–21, sendo que num deles o hazard ratio (HR) é 1010. Por sua vez, Taudorf et al.4 encontram associação (p=0,03), mas não como um fator de risco independente após análise multivariada (p=NS).
É importante referir que o tipo de hospital aumenta o risco de oclusão de ramo, com um OR de 3,08 para um tempo médio de oclusão <30 dias em hospitais terciários (p=0,028)9.
A disseção da AIE11, a trombocitopenia induzida pela heparina11 e um erro na execução do angiograma final9 são causas presumidas de oclusão de ramo.
A não realização do stenting primário do procedimento EVAR está associada à oclusão de ramo (p=0,05)11. Oshin et al. afirmam que a forma como se planeia o stenting é igualmente importante como fator de risco associado à oclusão de ramo (p=0,001)7.
O incumprimento das instruções específicas para o uso da endoprótese foi associada como fator de risco por Abbruzzese et al. (p=0,03)16.
DiscussãoA oclusão de ramo é uma importante complicação pós‐EVAR. Este outcome tem sido estimado por metodologias, amostras (entre 50‐6.787 pacientes), tipos de endoprótese (16 tipos) e tempos de seguimento (entre 30 dias a 5 anos) diferentes, como se pode verificar na tabela 1. A heterogeneidade na abordagem do tema pode explicar a grande variabilidade de dados apresentados em cada estudo. A percentagem de oclusão de ramo (entre 0‐24%) não é exceção, levando a pressupor uma etiologia multifatorial, dificultando a tarefa de prever o contributo de cada um dos fatores no outcome, tal como é observado na tabela 2. A variabilidade da metodologia utilizada nos estudos analisados, o número de pacientes englobados e o elevado número de variáveis em estudo contribuem igualmente para a dificuldade em avaliar o contributo de cada um dos fatores no outcome, igualmente observado na tabela 2.
O tempo decorrido até à oclusão de ramo é variável, mas a maioria dos estudos aponta para uma média inferior a 6 meses após EVAR, sendo esta informação omissa em alguns estudos (n=11). Esta precocidade leva a supor que os fatores de risco que mais influenciam o tempo de oclusão estão relacionados com a técnica cirúrgica, comparativamente aos restantes grupos de fatores de risco. Posto isto, sublinha‐se a importância da implementação de uma planificação correta dos períodos pré, intra e pós‐operatório, no sentido de definir estratégias para detetar e corrigir situações que possam aumentar o risco de oclusão de ramo. Para além disso, o follow‐up deve ser mais apertado, com recurso a meios auxiliares de diagnóstico mais precisos e correção intensiva de fatores de risco.
O EP é omisso em todos os artigos, à exceção de um11. O seu cálculo aumentaria a confiança da precisão dos resultados apresentados em relação ao tamanho da amostra.
No que diz respeito aos fatores de risco demográficos/comorbilidades, os que estão associados à oclusão de ramo são a idade, IMC e DAOP. A idade apresenta resultados variáveis, sendo que é classificada como NA4,9 e A6; no último estudo, a sua associação é independente para a oclusão de ramo, tal como o IMC4. Os autores não apresentam justificação para a associação dos pacientes mais novos, comparativamente aos mais velhos, terem um aumento do risco de oclusão. Alguns dos fatores de risco abordados neste estudo, como a DAOP ou a tortuosidade dos vasos ilíacos, agravam‐se com a idade, o que levaria a pensar numa associação diferente da apresentada. Em relação ao IMC, pensa‐se que esta associação se poderá dever ao facto de a gordura visceral tornar a anatomia dos vasos ilíacos menos favorável e levar a um aumento do risco tromboembólico4.
O número de vezes que os fatores de risco relacionados com a anatomia arterial estão associados ou presumidamente associados à oclusão de ramo é diferente do grupo anterior. Estes parecem ter um papel mais preponderante no outcome oclusão de ramo, indo de encontro ao resultado obtido por Abbruzzese et al.16, que verificam um aumento significativo de ramos ocluídos quando as instruções específicas para uso da endoprótese não são seguidas, ou seja, utilizadas em pacientes com anatomia mais desfavorável.
A anatomia dos vasos ilíacos parece ser o fator de risco anatómico mais importante. Os diferentes métodos de cálculo da tortuosidade dos vasos ilíacos demonstram que, mais importante do que afirmar a presença ou ausência de tortuosidade, é a forma como esta se calcula. O DIS parece ser uma ótima opção para calcular a tortuosidade. A sua presença está associada à oclusão de ramo, sendo fator de risco independente e mais fácil de calcular, comparativamente ao CAI4.
Também a estenose da artéria ilíaca ou femoral está associada a oclusão de ramo. Isto poderá ficar a dever‐se à redução do outflow arterial6,9. Esta associação ganha força quando se olha para os dados da tabela 2. Verifica‐se que os fatores de risco que podem reduzir o outflow arterial estão associados ou são causas presumidas de oclusão de ramo, como DAOP, tortuosidade dos vasos ilíacos, kinking ou estenose de vasos, kinking ou compressão da endoprótese ou do seu ramo. De forma clara se verifica a importância em adotar estratégias em todas as fases cirúrgicas, pré, intra ou pós‐operatório, como já foi referido anteriormente, de forma a prevenir a redução do outflow arterial.
Uma das formas de prevenção passa pela execução do angiograma final, nomeadamente sem o fio guia e sem as guias rígidas dentro do paciente9, como é referido na tabela 2, com o objetivo de prevenir, diagnosticar e tratar as situações acima descritas que possam levar à redução do outflow arterial.
O stenting primário aquando do procedimento índice é outra forma de prevenção. Sivamurthy et al.11 apresentam, aos 36 meses, patência de ramo de 100% em pacientes que foram submetidos a stenting primário com base na presença de kinking ou compressão externa do ramo da endoprótese, tortuosidade dos vasos ilíacos e/ou zona de ancoragem na AIE, valor bem diferente dos 94% aos 36 meses em pacientes que não foram submetidos a stenting primário. Posto isto, não só a sua não realização está associada à oclusão de ramo, mas também o timing da decisão7, devendo esta estratégia ser decidida idealmente no pré‐operatório. A importância de dados mais objetivos sobre a anatomia do paciente, através de TC ou angiografia como auxílio para a decisão de stenting primário, pode ter um impacto significativo na redução de oclusões de ramo.
Fator de risco incontornável é o tipo de endoprótese utilizado, tendo sido descrito em diversos estudos (n=6). As endopróteses de 1.a geração apresentam um OR de 2,876 em relação às endopróteses atuais. Este resultado está em convergência com outros estudos apresentados17,21. As endopróteses atuais, como a Zenith® ou Excluder®, parecem apresentar resultados muito semelhantes. No entanto, em 3 estudos verifica‐se para a Excluder® um risco menor para oclusão de ramo, comparativamente às restantes endopróteses17,20,21. Esta afirmação é efetivamente comprovada por Van Marrewijk et al.17, apresentando o menor HR ajustado (0,18) do estudo.
A configuração da endoprótese, AUI/ABI, apresenta resultados variáveis6,8,9. Por norma, a configuração AUI é indicada para pacientes com anatomia da bifurcação da aorta menos favorável ou com doença arterial severa de uma das artérias ilíacas6. Ao olhar para as indicações, constata‐se que os pacientes que são submetidos a EVAR utilizando uma endoprótese AUI apresentam, à partida, fatores de risco associados à oclusão de ramo. Torna‐se, portanto, um viés importante, tal como nos refere Jean‐Baptiste et al.8, ao afirmarem que a configuração AUI representa um desafio cirúrgico maior. Para além disso, a configuração AUI pode ter um impacto na hemodinâmica, diminuindo a velocidade do fluxo e, consequentemente, o outflow arterial. Esta redução, como já se verificou neste estudo, associa‐se à oclusão de ramo.
A utilização da AIE como zona de ancoragem é o fator de risco que mais vezes aparece associado à oclusão de ramo (n=8), todavia os resultados não são consistentes. No estudo conduzido por Taudorf4 verifica‐se que, após uma análise multivariada, a zona de ancoragem na AIE não é um fator de risco independente para oclusão de ramo. Esta decisão cirúrgica está associada, portanto, a outros fatores de risco como tortuosidade e diâmetro mais pequeno da AIE2,4,7, a predisposição ao kinking7, fatores que podem diminuir o outflow arterial9.
Tendo sido já abordada a importância do stenting primário e da forma como é tomada a decisão de o realizar, a utilização da AIE como zona de ancoragem pode beneficiar da utilização do stenting primário, tornando desta forma a transição entre o ramo da endoprótese e a artéria mais suave e contrariando a predisposição ao kinking7.
O tipo de hospital foi igualmente estudado e associado como fator de risco para oclusão de ramo nos primeiros 30 dias. Embora os autores9 não discutam esta associação, esta pode prender‐se com os meios complementares de diagnóstico disponíveis em cada instituição, bem como o tipo de endoprótese utilizada ou a experiência da equipa cirúrgica. Os motivos ganham maior peso quando se constata que esta associação se verifica nos primeiros 30 dias, apontando para fatores de risco relacionados com a técnica cirúrgica.
ConclusãoA oclusão de ramo é uma complicação importante do EVAR, de etiologia multifatorial.
Os fatores de risco demográficos/comorbilidades parecem associados de maneira menos evidente ao outcome oclusão de ramo, comparativamente aos fatores de risco relacionados com a anatomia arterial e com a técnica cirúrgica.
Na realização do EVAR, as endopróteses atuais parecem ter uma melhor performance, comparativamente às endopróteses de primeira geração. Nos doentes que apresentem uma anatomia arterial mais desfavorável, representando desta forma um maior desafio cirúrgico, há alguma evidência que pode fazer da Excluder® uma boa opção.
A utilização da AIE como zona de ancoragem e a configuração AUI devem ser evitadas por apresentarem um maior risco de oclusão de ramo. Não sendo possível, o estudo e acompanhamento dos pacientes no pré, intra e pós‐operatório deve ser feito de forma mais exigente.
O stenting primário como complemento ao EVAR parece reduzir a incidência de oclusão de ramo, mantendo a patência a longo prazo. A decisão do stenting deve ser tomada no pré‐operatório através de TC ou angiografia.
Em suma, a oclusão de ramo da endoprótese resulta de uma conjugação de fatores de risco. A enumeração destes fatores e a adoção de uma estratégia integradora para a sua correção levará a uma minimização das consequências devastadoras desta complicação.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.