A presença de rutura é um facto que condiciona negativamente o prognóstico imediato da doença aorto‐ilíaca. Com lugar estabelecido no tratamento eletivo dos aneurismas da aorta, a reparação endovascular do aneurisma (EVAR) tem vindo a ser utilizada nas situações de urgência, sendo capaz de reduzir a elevada mortalidade perioperatória associada à rutura aórtica.
ObjetivosAnálise retrospetiva de uma série consecutiva de doentes submetidos a EVAR em contexto de urgência, com rutura aórtica ou ilíaca (rEVAR), num período consecutivo de 6 anos.
MétodosTodos os doentes tratados por EVAR em contexto de urgência, no período compreendido entre março de 2008 e março de 2014, foram identificados com recurso a uma base de dados prospetivamente construída. Rutura foi definida com identificação em angioTC de hematoma retroperitoneal ou extravasamento de contraste. Apesar de não existir capacidade institucional para oferecer EVAR universalmente, é dada preferência ao EVAR sobre cirurgia aberta em doentes anatomicamente favoráveis.
Procedeu‐se à revisão dos casos clínicos, incluindo dados demográficos dos doentes, características clínicas de base, avaliação hemodinâmica e laboratorial no perioperatório, detalhes intraoperatórios e outcome clínico. O endpoint primário aferido foi a mortalidade perioperatória/precoce (30 dias/intra‐hospitalar) e, o secundário, as complicações perioperatórias major.
ResultadosForam tratados 49 doentes por rEVAR, dos quais 43 (88%) homens e com uma idade média de 73,7±10,6 anos (47‐90 anos).
O EVAR realizou‐se maioritariamente por patologia aneurismática degenerativa, 35 dos quais da aorta abdominal (72%) e 9 aneurismas ilíacos (18%; n=4 ilíaca comum; n=5 ilíaca interna). O diâmetro médio do aneurisma era de 7,6±1,7cm. As restantes indicações foram: rutura aórtica espontânea/iatrogénica em 3 casos (6%), rutura pós‐EVAR num caso e pseudoaneurisma anastomótico de interposição aorto‐aórtica prévia num caso. Foram implantadas 26 endopróteses aorto‐bi‐ilíacas (53%), 18 aorto‐mono‐ilíacas e crossover (37%), e 5 embolização e exclusão endovascular com ramo ilíaco (10%). O uso de balão intra‐aórtico verificou‐se apenas em 2 casos. Como procedimentos adjuvantes não planeados, foi realizado um stenting ilíaco e uma extensão proximal com cuff por endoleak tipo IA. O modelo de endoprótese utilizado teve a seguinte distribuição: Endurant Medtronic® em 59%, Excluder Gore® em 12%, Zenith Cook® em 22%, Excluder C3 Gore® em 5% e Talent Medtronic® em 2%. Trinta e dois por cento dos procedimentos foram realizados sob anestesia local. A taxa de mortalidade aos 30 dias/intra‐hospitalar foi de 26,5%, apresentando uma tendência decrescente ao longo dos anos, e verificou‐se uma taxa de complicações aos 30 dias: locais em 20,4% dos doentes e sistémicas em 53%. A presença de síndrome compartimental abdominal verificou‐se em 20,4% dos doentes e constituiu um fator de mau prognóstico. A mediana de tempo de internamento foi de 7 dias (0‐92) e de 2 dias (0‐65) em unidade de cuidados intensivos.
ConclusãoO EVAR é uma abordagem terapêutica válida e eficaz para o tratamento da patologia aorto‐ilíaca com evidência de rutura. Os resultados apresentados estão em conformidade com os de outros estudos randomizados.
Rupture has a negative impact on abdominal aortic or iliac pathology. Endovascular aneurysm repair (EVAR) is an established treatment in the elective setting which has increasingly been applied in urgent patients and may be associated with a decrease in perioperative mortality.
ObjectivesOur primary outcome was perioperative/early mortality. Secondary outcomes include perioperative hemodynamics and procedure‐related complications.
MethodsA prospectively maintained single center database was retrospectively enquired. Patients who underwent rEVAR between March 2008 and March 2014 were included. Rupture was defined as the presence of a retroperitoneal hematoma or extraversion of contrast on a CTA. Although there's no institutional capacity to offer EVAR to all ruptured aneurysms, it is given preference to endovascular repair over open surgery in patients with suitable aortic anatomy for EVAR.
Demographic, perioperative hemodynamics and laboratorial data were assessed. Primary outcome was perioperative/early mortality. Secondary outcomes include procedure‐related and systemic complications.
ResultsForty‐nine patients were included, 43 of whom (88%) were males and mean age was 73.7±10,61 years (range 47 to 90).
Thirty‐five patients presented rAAA (72%) and 9 ruptured iliac aneurysms (18%). Mean aneurysm diameter was 7.6±1.7cm. Other indications for rEVAR were spontaneous/iatrogenic aortic rupture (6%; n=3), late aneurysm rupture following EVAR (n=1) and a case of an anastomotic pseudoaneurysm. Deployed endograft configuration was aortic bi‐iliac in 26 cases (53%), aortic mono‐iliac in 18 (37%) and embolization and endovascular exclusion with iliac branch (10%). Deployed devices were Endurant Medtronic® in 59%, Excluder Gore® in 12%, Zenith Cook® in 22%, Excluder C3 Gore® in 5%, e Talent Medtronic® in 2%. 32% were treated under local anesthesia. The 30 dias/intrahospitalar mortality rate was 26.5%, which progressively decreased during the study period. The 30‐day complication rate was local in 20.4%, systemic in 53%. Abdominal compartment syndrome occurred in 10 cases (20.4%), and was found to be a negative prognostic factor. Median hospitalization duration was 7 days (0‐92) and median stay in the intensive care unit was 2 days (0‐65).
ConclusionEVAR is a valid treatment in the urgent setting for patients with abdominal aortic or iliac rupture. Our results are comparable to the randomized controlled studies
A presença de rutura é um fator que condiciona negativamente o prognóstico imediato da doença aorto‐ilíaca. A rutura aórtica no contexto de doença aneurismática atinge 5,6‐17,5/100.000 pessoas/ano nos países ocidentais1. É reconhecida a elevada mortalidade associada à rutura que globalmente atinge os 80%2,3. A cirurgia convencional continua a associar‐se a mortalidade operatória de 40‐70%3, sem redução recente documentada4. Contudo, após o período perioperatório, o prognóstico dos doentes com aneurismas da aorta abdominal em ruptura (rAAA) é, pelo menos, tão bom como o dos doentes eletivos5.
A reparação endovascular de aneurisma (EVAR) é, na atualidade, a abordagem preferencial no tratamento eletivo do aneurisma da aorta abdominal (AAA), sendo realizado em cerca de 60‐70% dos casos6.
Com lugar estabelecido no tratamento eletivo dos aneurismas da aorta, o EVAR tem vindo a ser utilizado nas situações de urgência, sendo capaz de reduzir a elevada mortalidade perioperatória associada à rutura aórtica. Historicamente, o tratamento endovascular de AAA em rutura foi introduzido em 19947,8. No Hospital de Santa Marta, o 1.° EVAR por aneurisma da aorta roto foi realizado em 2004.
Vários estudos observacionais single center apresentam resultados favorecendo o EVAR em relação ao tratamento cirúrgico convencional, traduzindo‐se numa redução média da mortalidade aos 30 dias de 38% no aneurisma com rutura4. A vantagem na sobrevida para o a reparação endovascular de aneurisma em ruptura (rEVAR), com redução de 2 vezes da mortalidade precoce após rAAA, persiste durante os primeiros 3 anos após intervenção6.
A menor permanência em unidade de cuidados intensivos e alta mais precoce são outras potenciais vantagens, que ilustram a menor invasibilidade e morbilidade do tratamento endovascular na rutura aorto‐ilíaca9.
A realização de EVAR no contexto da urgência levanta algumas questões fundamentais para alcançar um bom desfecho. Os principais problemas prendem‐se com a distância e referenciação tardia ao serviço de urgência; as condições do transporte destes doentes, com manutenção da sua estabilidade hemodinâmica, até admissão nos hospitais de referência; a disponibilidade para realização de angiotomografia (angioTC) de boa qualidade10; a presença de uma anatomia favorável para a realização do EVAR – em 46‐64% dos casos de aneurismas rotos2; um stock razoável de endopróteses disponível; e uma equipa multidisciplinar rotinada10.
Material e métodosTodos os doentes tratados por EVAR em contexto de urgência, no período compreendido entre março de 2008 e março de 2014, foram identificados com recurso a uma base de dados prospetivamente construída. Rutura foi definida com identificação em angioTC de hematoma retroperitoneal ou extravasamento de contraste. Apesar de não existir capacidade institucional para oferecer EVAR universalmente, foi dada preferência ao EVAR sobre cirurgia aberta em doentes anatomicamente favoráveis durante todo o período do estudo. O tipo de endoprótese implantada (aorto‐bi‐ilíaca vs. aorto‐mono‐ilíaca) baseou‐se em critérios anatómicos, critérios de instabilidade hemodinâmica do doente, e preferência e experiência da equipa cirúrgica.
Procedeu‐se à revisão dos casos, incluindo dados demográficos dos doentes, características clínicas de base, avaliação hemodinâmica e laboratorial no perioperatório, detalhes intraoperatórios e outcome clínico. O endpoint primário aferido foi a mortalidade a 30 dias ou intra‐hospitalar e o secundário as complicações relacionadas com o procedimento e sistémicas a 30 dias.
A pressão intra‐abdominal foi extrapolada através da medição da pressão intraluminal vesical e foi definida síndrome compartimental abdominal (SCA) como pressão intra‐abdominal superior a 20mmHg, associada a disfunção de órgão de novo (insuficiência renal com oligoanúria, insuficiência respiratória ou instabilidade hemodinâmica refratárias)17. Na ausência de dados objetivos no processo clínico para a definicão de SCA, esta foi considerada nos casos de realização de laparotomia descompressiva.
As variáveis categóricas são apresentadas como contagem e percentagem. As variáveis contínuas são apresentadas como média e desvio padrão ou mediana e intervalo, conforme a distribuição paramétrica ou não‐paramétrica.
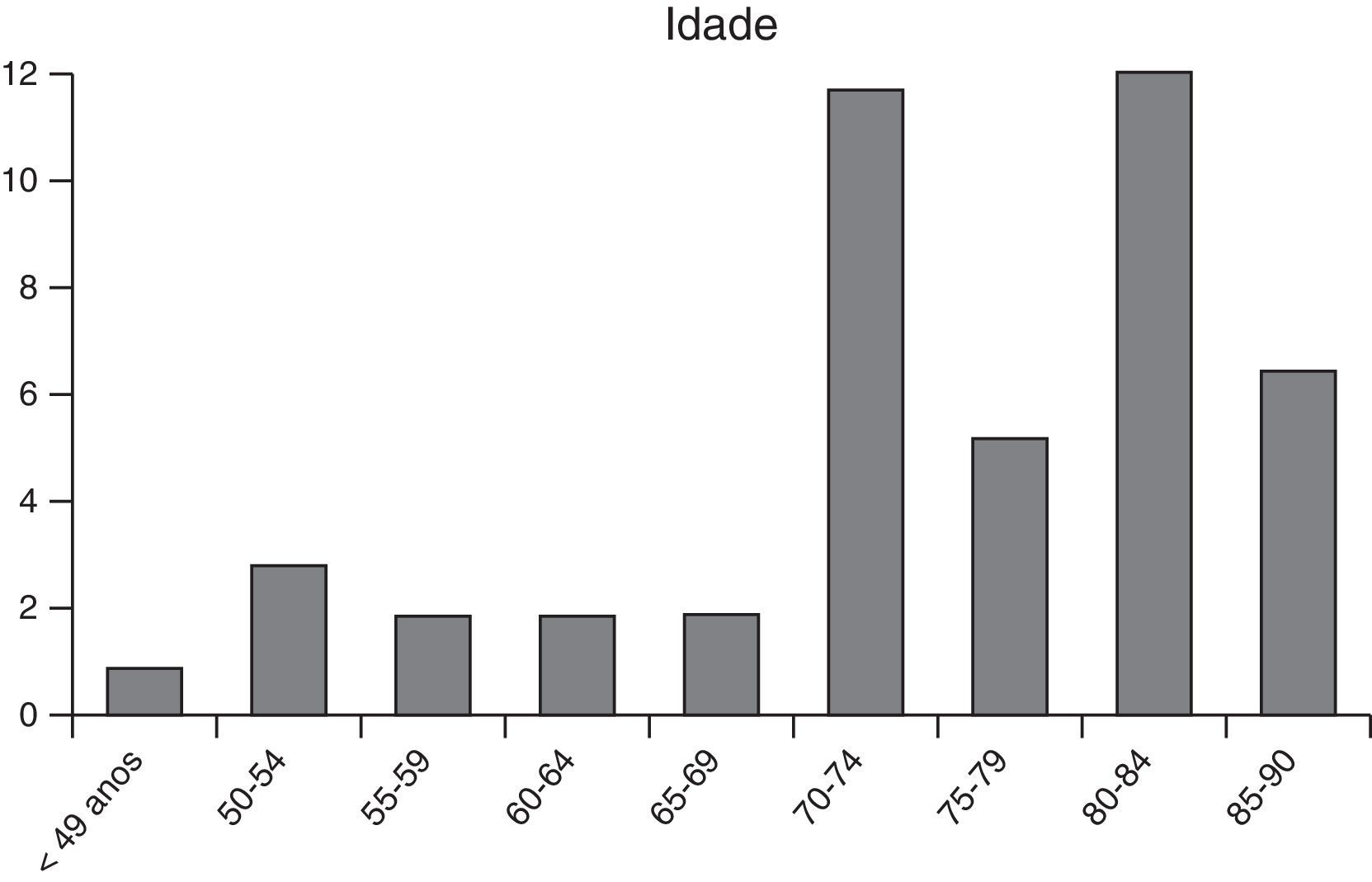
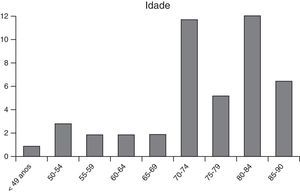
ResultadosNo período de março de 2008 a março de 2014 foram tratados 49 doentes por rEVAR, dos quais 43 (88%) homens e com uma idade média de 73,69 anos (±10,61; min=47 anos, máx=90 anos). Na distribuição etária dos doentes tratados (fig. 1) verificou‐se que 73% (n=36) apresentavam mais de 70 anos.
Dos fatores de risco da população intervencionada, a hipertensão era o mais prevalente, com 73% dos doentes (n=36). Tabagismo (n=23) e dislipidemia (n=24) apresentavam o seguinte peso percentual: 47 e 49%, respetivamente. Das comorbilidades de base, verificou‐se a presença de diabetes mellitus em 10% (n=5), doença pulmonar obstrutiva crónica em 18% (n=9), insuficiência renal crónica em 22% (n=11), cardiopatia isquémica em 20% (n=10) e insuficiência cardíaca em 16% (n=8).
À admissão, na avaliação dos parâmetros hemodinâmicos, foi evidente um perfil tendencialmente hipotensivo com medianas de tensão arterial sistólica de 110mmHg (40‐203) e de tensão arterial diastólica de 62mmHg (20‐113). Analiticamente, a creatinina mediana foi 1,39mg/dL (0,6‐5,14) e em 22 doentes (45%) foi evidente a presença de insuficiência renal com creatinina>1,5mg/dL. Nos doentes com mortalidade aos 30 dias/intra‐hospitalar, à admissão hospitalar foi evidente em 54% (n=7) a presença de insuficiência renal com creatinina>1,5mg/dL (creatinina mediana de 1,72mg/dL). A hemoglobina média à admissão era de 9,97±2,47g/L.
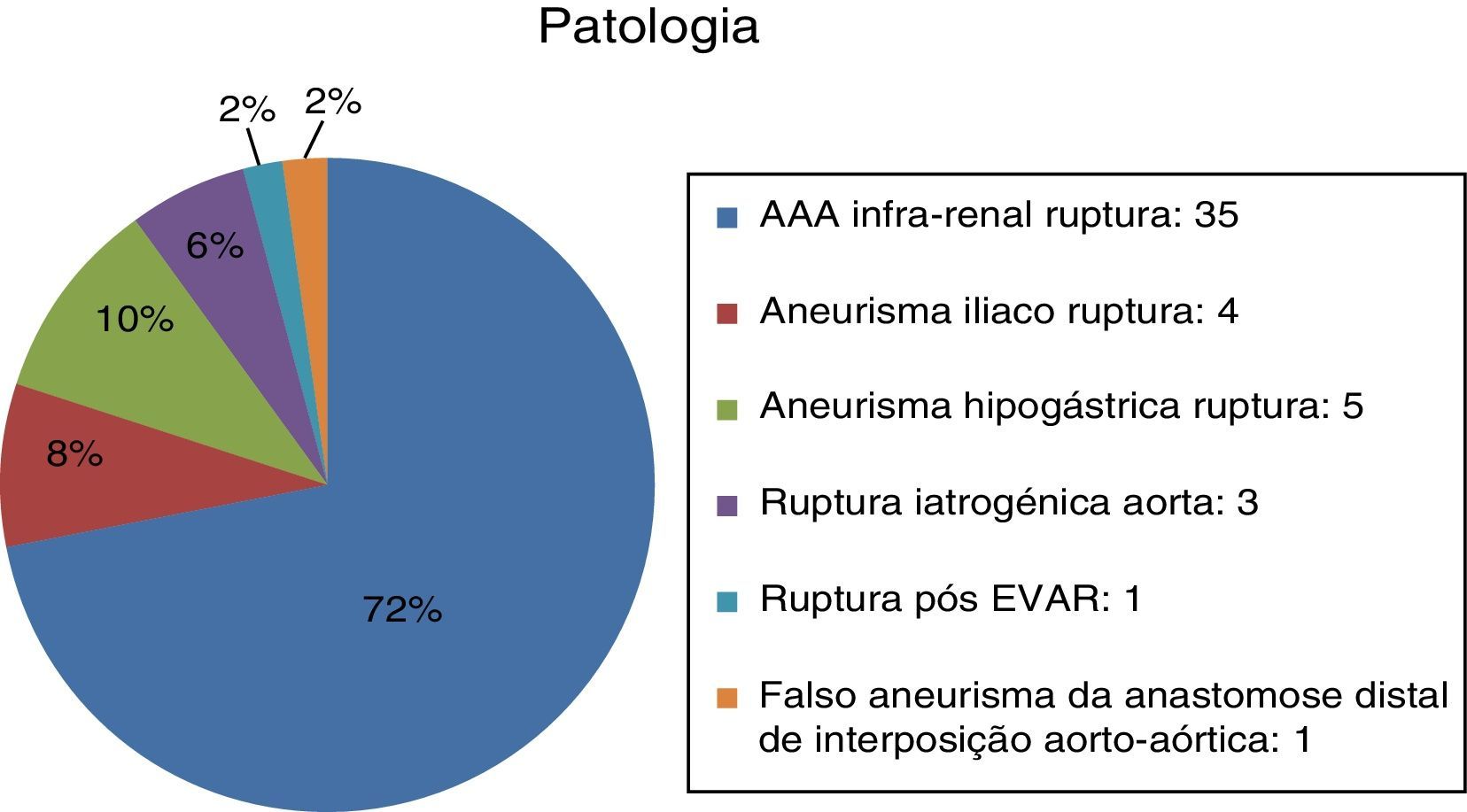
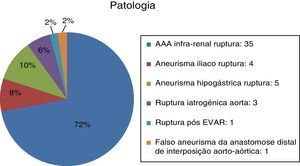
O EVAR realizou‐se maioritariamente por patologia aneurismática degenerativa com 35 aneurismas da aorta abdominal rotos (72%) e 9 aneurismas ilíacos isolados (18%; n=4 ilíaca comum; n=5 ilíaca interna) (fig. 2). Dos AAA, o diâmetro médio na rutura era de 7,62±1,70cm (min: 5,2; máx: 12,6). Nos aneurismas da hipogástrica o diâmetro médio foi de 8,08cm e nos isolados da artéria ilíaca comum foi de 9,5cm.
As restantes indicações foram: rutura aórtica (6%; n=3), rutura pós‐EVAR (2%; n=1) e rutura pseudoaneurisma da anastomose distal de interposição aorto‐aórtica prévia (2%; n=1).
Foram implantadas 26 endopróteses aorto‐bi‐ilíacas (53%), 18 aorto‐mono‐ilíacas e crossover (37%), e 5 embolização e exclusão endovascular com ramo ilíaco (10%). O uso de balão de oclusão aórtica verificou‐se apenas em 2 casos. Como procedimentos adjuvantes não planeados, foi realizado um stenting ilíaco e extensão proximal com cuff por endoleak tipo IA.
O modelo de endoprótese utilizado teve a seguinte distribuição:
- ‐
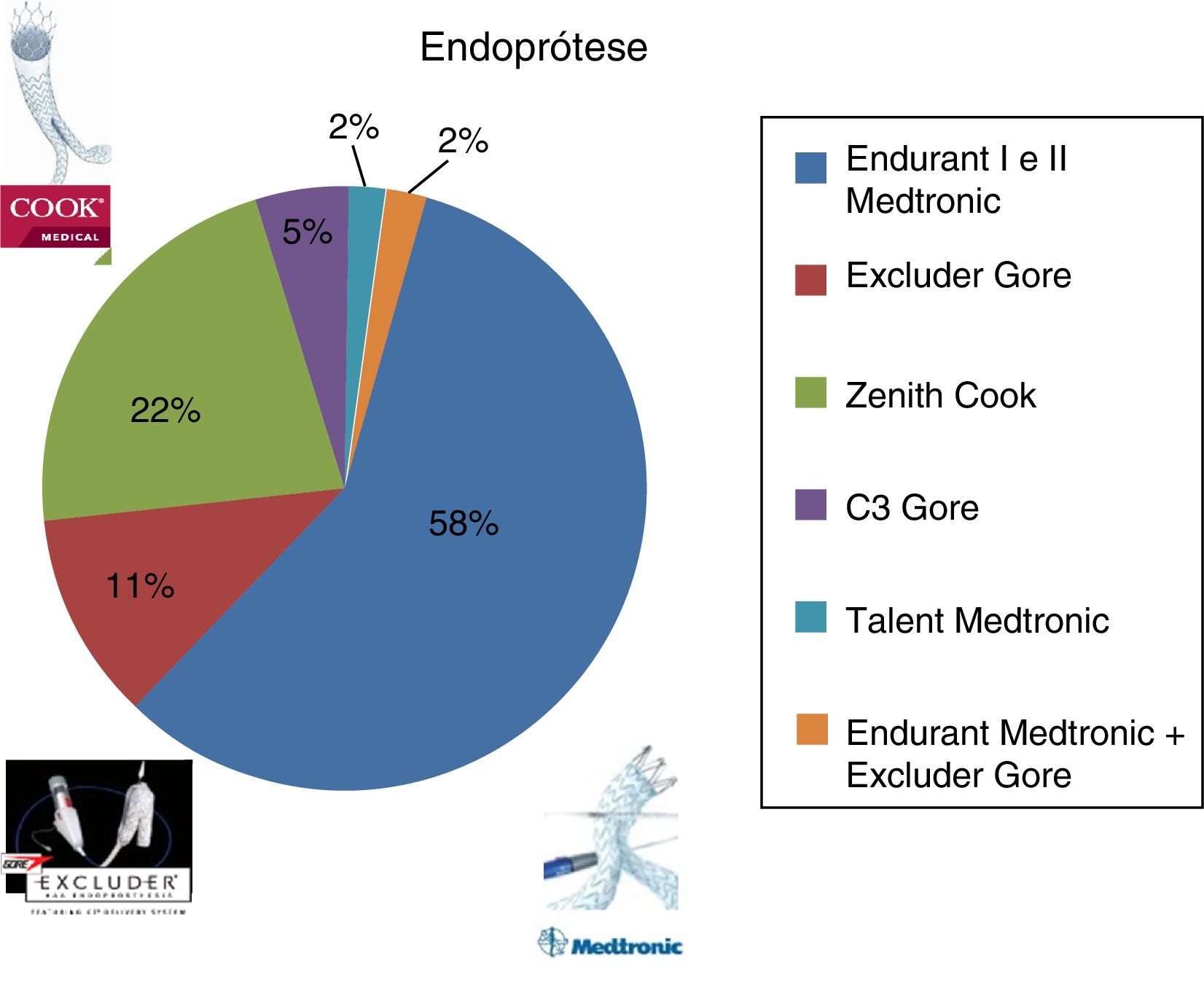
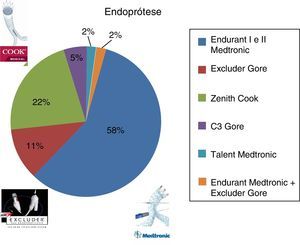
Endurant Medtronic® em 59%, Excluder Gore® em 12%, Zenith Cook® em 22%, Excluder C3 Gore® em 5%, e Talent Medtronic® em 2% (fig. 3). O número médio de componentes de endopróteses utilizado por procedimento foi 3,09 (min: um, máx: 8).
Trinta e dois por cento dos procedimentos (n=16) foram realizados sob anestesia local, seguida de anestesia geral em 4 doentes. A anestesia geral foi usada na maioria dos doentes (68%).
No que concerne aos detalhes das intervenções: a duração média de 131±50min, o tempo de fluoroscopia teve uma mediana de 27min (4‐118) e o volume de contraste utilizado apresentou uma mediana de 89mL (30‐210).
Relativamente ao suporte transfusional necessário, registrou‐se uma mediana de 4,5 unidades de concentrado eritrocitário (0‐21) e uma mediana de 1,64 unidades de plasma fresco congelado (0‐7).
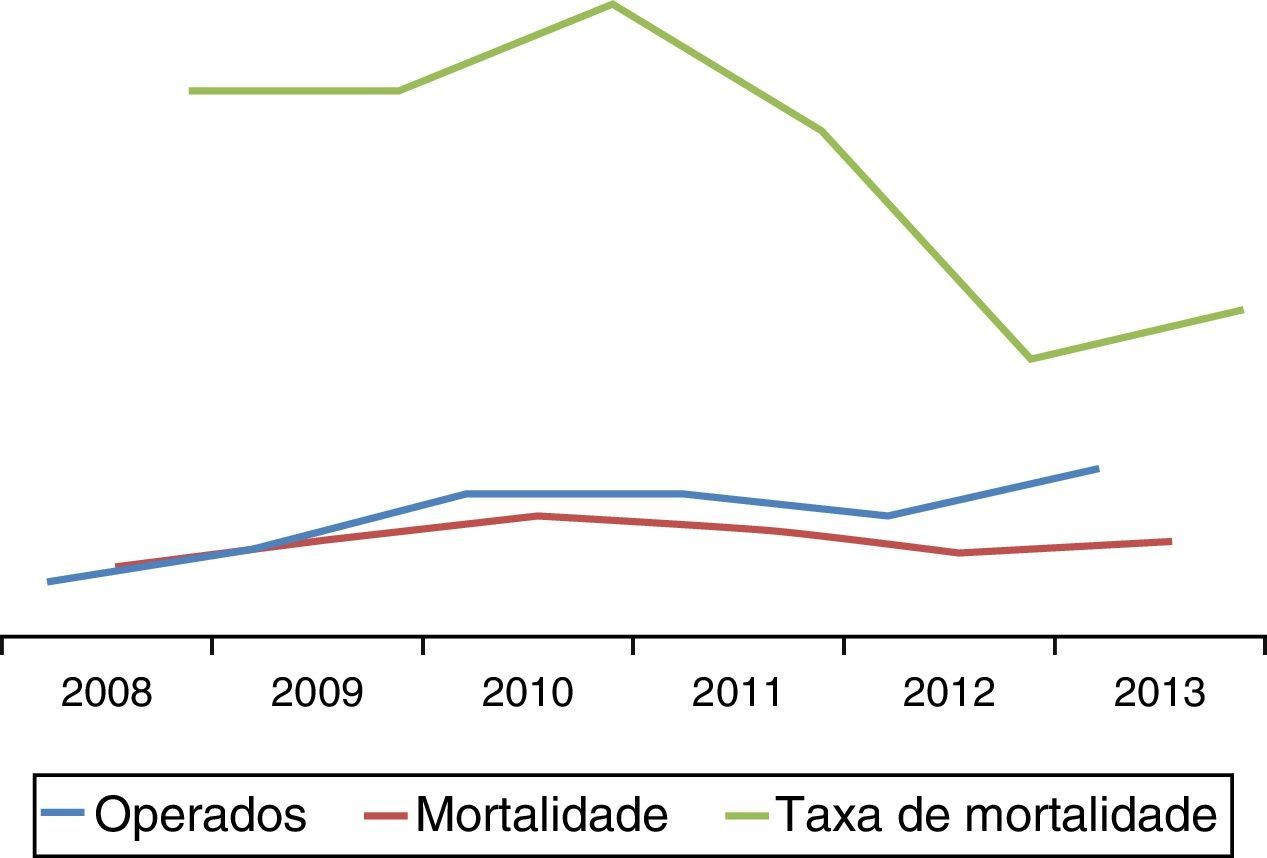
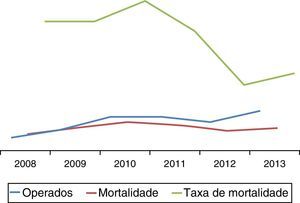
A taxa de mortalidade aos 30 dias/intra‐hospitalar foi de 26,5%, correspondendo a 13 doentes. Intraoperatoriamente verificaram‐se 4 mortes (8%) na sequência de choque refratário. Em 6 doentes verificou‐se morte no 1.° dia de pós‐operatório por choque irreversível com falência multiorgânica, dos quais 4 após laparotomia descompressiva. As outras causas de mortalidade relacionaram‐se com um caso de com isquémica mesentérica e as restantes com choque irreversível. A distribuição da taxa de mortalidade ao longo dos anos é ilustrada pela figura 4, aparentando uma tendência decrescente.
A taxa de complicações aos 30 dias: relacionadas com o procedimento em 20,4% dos doentes e sistémicas em 53% (tabelas 1 e 2).
Complicações aos 30 dias sistémicas
| n | |
|---|---|
| Insuficiência renal aguda com necessidade de terapêutica dialítica | 5 |
| Colecistite aguda alitiásica | 1 |
| Pulmonar | 5 |
| Isquemia mesentérica | 1 |
| Acidente vascular cerebral | 1 |
| Insuficiência hepática aguda | 1 |
| Enfarte agudo do miocárdio | 1 |
| Choque séptico | 1 |
| Síndrome compartimental abdominal | 10 |
A presença de SCA verificou‐se em 20,4% dos doentes (n=10), associando‐se a uma taxa de mortalidade de 70% (n=7/10). Por outro lado, avaliando os casos de mortalidade, registou‐se uma prevalência de SCA em mais de metade dos doentes (54%).
No contexto da SCA, foram realizadas 6 laparotomias descompressivas usando preferencialmente como técnica o saco de Bogotá, das quais metade se efetuaram no final do procedimento endovascular.
A mediana de tempo de internamento foi de 7 dias (0‐92) e de 2 dias (0‐65) em unidade de cuidados intensivos.
DiscussãoApesar da evolução na prestação de cuidados intensivos do doente crítico nas últimas décadas, a mortalidade associada ao tratamento cirúrgico convencional do rAAA tem‐se mantido elevada11.
Com uso globalizado no tratamento eletivo do AAA, o EVAR surge em estudos observacionais como uma alternativa com melhores resultados na sobrevida dos doentes com rutura11. O presente estudo demonstra essa tendência no nosso contexto de instituição terciária nacional com uma alargada rede de referenciação, apresentando taxas de mortalidade e morbilidade precoce comparáveis aos estudos randomizados e outras séries institucionais.
O uso crescente de EVAR nas situações de rutura foi elucidado no estudo de McPhee et al., no qual, num período de 5 anos, o rEVAR se realizou em 5,1% dos rAAA em 2001, passando para 18,9% em 2006. Neste estudo verificaram, ainda, que a vantagem na sobrevida do rEVAR estava dependente da experiência na técnica traduzida pelo volume anual de EVAR eletivos. O rEVAR apresentava melhores resultados em centros com taxas de EVAR eletivo>19/ano12,13. Lesperance et al. reportaram ainda uma mortalidade mais elevada com rEVAR em centros não‐universitários, quando comparados com hospitais com universitários (55 vs. 21%; p<0,01)12,14.
A revisão sistemática/metanálise de Antoniou et al.11 dos estudos comparativos EVAR vs. tratamento cirúrgico convencional do AAA em rutura realça um benefício superior do tratamento endovascular em diferentes outcomes perioperatórios, nomeadamente: menor mortalidade intra‐hospitalar, menor taxa de complicações cardíacas e respiratórias, menor risco de insuficiência renal e menor taxa de intervenções secundárias no período perioperatório. Foram também evidentes a menor necessidade de transfusões no período perioperatório e o menor tempo de internamento associados ao tratamento endovascular.
Na série apresentada, foi evidente a menor invasibilidade e menor morbilidade da técnica endovascular na rutura aorto‐ilíaca, associando‐se a poucos dias de permanência em unidade de cuidados intensivos (mediana 2 dias), menor tempo de internamento (mediana 7 dias), assim como menor necessidade de suporte transfusional (mediana de 4,5 unidades de concentrado eritrocitário e de 1,64 unidades de plasma fresco congelado).
O tipo de anestesia escolhido é um fator que pode condicionar o prognóstico da intervenção endovascular no AAA em rutura. A anestesia local foi preconizada em 32% dos procedimentos, seguida de anestesia geral nos casos de EVAR aorto‐mono‐ilíacos após exclusão da rutura, para a realização do crossover. Os benefícios potenciais desta abordagem anestésica estão relacionados com o facto da anestesia local evitar a perda de tónus simpático no doente hemodinamicamente comprometido com rutura aneurismática, prevenindo o colapso hemodinâmico causado pela indução da anestesia geral10,15.
Dos estudos randomizados, a mortalidade precoce aferida aos 30 dias para o tratamento endovascular do aneurisma da aorta em rutura foi de 21% no AJAX trial e de 25% na análise de subgrupos do IMPROVE trial9,10,16.
Na série apresentada foi aferida uma mortalidade aos 30 dias ou intra‐hospitalar de 26,5%, encontrando‐se em linha de conta com os resultados dos principais estudos randomizados. A mortalidade intraoperatória da série apresentada atingiu os 8%. Na série de Von Meijenfeldt et al. a mortalidade intraoperatória atingiu os 5% no grupo de rEVAR e 9% no grupo de cirurgia aberta6.
A maioria das causas de mortalidade precoce relacionaram‐se com choque hemorrágico irreversível.
Foi ainda evidente uma tendência decrescente da taxa de mortalidade ao longo dos anos, podendo traduzir uma melhoria dos resultados com o aumento de volume de doentes com rutura aorto‐ilíaca realizados.
A taxa de complicações major do foro médico aos 30 dias ou intra‐hospitalares atingiu metade dos doentes intervencionados e esteve relacionada, maioritariamente, com complicações pulmonares e de insuficiência renal aguda. As complicações relacionadas com o procedimento aos 30 dias ou intra‐hospitalares ocorreram em 20% dos doentes, mas, considerando o procedimento endovascular, verificou‐se uma taxa de 8%, correspondendo a 2 endoleaks e 2 casos de dissecção ilíaca.
A taxa reportada de SCA após tratamento endovascular na meta‐análise de Karkos et al. é de 8%, mas pode atingir 20% nos estudos em que se procede a uma monitorização mais rigorosa17. Diferentes fatores podem contribuir para o seu desenvolvimento, nomeadamente: o uso de balão de oclusão aórtica, a necessidade de politransfusão massiva (média de 8 unidades de concentrado eritrocitário) e a coagulopatia10.
Dois estudos avaliaram o efeito da SCA sobre a mortalidade após tratamento endovascular dos rAAA – a experiência de Mehta et al.18 e Mayer et al.19 demonstrou que a taxa de mortalidade era significativamente superior nos doentes com SCA do que naqueles sem SCA (38 vs. 9%)17.
Na série apresentada, a presença de SCA foi de 20,4%, associando‐se a uma elevada taxa de mortalidade neste subgrupo de doentes, que atingiu os 70%.
Também Mehta et al. verificaram na sua experiência um semelhante aumento significativo da mortalidade nos doentes com SCA (67%), em comparação com os doentes sem SCA (10%)10.
Além da maior mortalidade, é reconhecida uma maior morbilidade major, internamento mais prolongado e maior taxa de reintervenções nos doentes que desenvolvem SCA17.
Na nossa experiência institucional, os princípios fundamentais para o sucesso do EVAR na rutura aorto‐ilíaca relacionam‐se com uma referenciação precoce dos doentes com hipotensão hemostática permissiva (a restrição na ressuscitação com fluidoterapia e manutenção de pressão arterial sistólica tendencialmente baixa é bem tolerada e limita a hemorragia interna)4,6,10,20; a existência de angioTC de boa qualidade; o planeamento rigoroso do procedimento; a disponibilidade de um bom stock de endopróteses e em hospitais com capacidade de realização de cirurgia aberta4,10,19; exclusão endovascular da rutura, sempre que possível sob anestesia local; controlo com balão de oclusão aórtica supracelíaco pode ser usado nos casos de colapso hemodinâmico15,16; um elevado índice de suspeição de SCA com laparotomia descompressiva precoce; experiência prévia significativa em EVAR eletivo4,10 e a existência de uma equipa multidisciplinar dedicada e rotinada, incluindo cirurgiões, anestesistas, enfermeiros e técnicos de radiologia10.
A implantação de protocolos institucionais específicos para o tratamento do AAA em rutura está associada a melhores resultados no tratamento endovascular11.
A literatura atual não é totalmente esclarecedora em relação aos resultados a médio e longo prazo do EVAR nos rAAA, podendo ser necessários mais estudos para aceitação da superioridade do rEVAR em relação ao tratamento cirúrgico convencional e a sua adoção universal no tratamento da rutura aorto‐ilíaca4,11.
O presente estudo apresenta algumas limitações de relevo. O desenho retrospetivo do estudo, apesar de baseado numa coleção prospetiva de dados, pode resultar num importante viés. Devido à amostra reduzida, não foi possível proceder a estudo de fatores de risco associados a mortalidade e morbilidade. Apesar disto, é a maior série nacional publicada até à data sobre o tratamento endovascular da aorta em rutura.
ConclusãoO EVAR é uma abordagem terapêutica efetiva e segura para o tratamento da patologia aorto‐ilíaca com evidência de rutura, aplicável no contexto de uma instituição terciária nacional. A série apresentada traduz uma experiência institucional favorável com resultados em conformidade com os de outras séries, sendo de realçar a taxa de mortalidade alcançada (26,5%), sobreponível à dos principais estudos randomizados e observacionais disponíveis.
Responsabilidades éticasProteção dos seres humanos e animaisOs autores declaram que os procedimentos seguidos estavam de acordo com os regulamentos estabelecidos pelos responsáveis da Comissão de Investigação Clínica e Ética e de acordo com os da Associação Médica Mundial e da Declaração de Helsinki.
Confidencialidade dos dadosOs autores declaram ter seguido os protocolos de seu centro de trabalho acerca da publicação dos dados de pacientes.
Direito à privacidade e consentimento escritoOs autores declaram ter recebido consentimento escrito dos pacientes e/ ou sujeitos mencionados no artigo. O autor para correspondência deve estar na posse deste documento.
Conflito de interessesOs autores declaram na¿o haver conflito de interesses.