O tratamento endovascular da aorta torácica (TEVAR) é uma modalidade terapêutica emergente que tem vindo a revolucionar a abordagem de diferentes tipos de patologia da aorta na sua localização torácica.
ObjetivosAvaliação da experiência institucional do serviço de angiologia e cirurgia vascular.
MétodosAnálise retrospetiva da série consecutiva de todos os doentes com patologia da aorta torácica e/ou toracoabdominal submetidos a TEVAR na nossa instituição. Foram excluídos aqueles com uso concomitante de endopróteses fenestradas/ramificadas abdominais.
ResultadosDesde abril de 2005 até abril de 2014, 79 doentes foram submetidos a TEVAR, com idade média de 66±12,83 anos (máx: 86; mín: 14). As indicações incluíram: 46 aneurismas (58%), 17 dissecções aórticas clássicas tipo B (22%), 13 no contexto de outras síndromes aórticas agudas (16%), 2 por ateroembolismo (3%) e um por fístula aortoesofágica (1%).
Na patologia aneurismática, a distribuição anatómica da doença foi a seguinte: 5 na aorta ascendente e arco aórtico (11%), 35 na aorta torácica descendente (76%) e 6 toracoabdominal (13%).
O diâmetro médio das dilatações aneurimáticas foi de 69,64mm (máx: 150mm). A rotura foi uma apresentação da patologia em 21,5% dos doentes (n=17); 20,9% dos doentes tinham antecedentes de cirurgia aórtica prévia.
A dissecção aórtica tipo B complicada foi a segunda indicação mais comum, sendo de apresentação aguda em 13 (76%) e crónica em 4 (24%). As complicações na base da intervenção foram dilatação aneurismática em 35% (n=6), malperfusão com isquemia de órgão alvo 47% (n=8), desconhecida em 18% (n=3). Foi realizada extensão distal com stent descoberto (Petticoat) em 9 casos (41,2%) e foram realizados procedimentos adjuvantes em 18% (stenting renal n=2; stenting ilíaco n=1).
Dentro das outras síndromes aórticas agudas, o TEVAR foi realizado no contexto de úlcera aórtica penetrante (n=4), hematoma intramural (n=4) e os restantes por rotura/pseudoaneurisma (n=5).
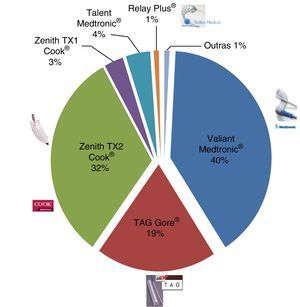
As endopróteses utilizadas foram: 32 Valiant Medtronic®, 15 TAG Gore®, 25 Zenith TX2 Cook®, 2 Zenith TX1 Cook®, uma Relay Plus®, 3 Talent Medtronic® e outras em 1%. A mediana de dias de cuidados intensivos foi 2 (intervalo 0‐42) e a mediana de suporte tranfusional foi de 2UCE.
A taxa de mortalidade aos 30 dias ou intra‐hospital foi de 18% (n=14). Atendendo ao timing da cirurgia, a taxa de mortalidade aferida nos casos electivos foi de 8% (4/50) e nos urgentes atinge os 35% (10/29). Intraoperatoriamente foram tratadas 7 complicações relacionadas com vaso de acesso membro, 2 casos de dissecção aórtica iatrogénica, um caso de trombose arterial inferior e um endoleak tipo IA. A taxa de reintervenções foi de 17%, com as seguintes indicações: 9 endoleaks, 2 isquemias mesentéricas e 2 fístulas aortoesofágicas.
ConclusõesA série apresentada traduz uma experiência institucional favorável com resultados reprodutíveis e que o TEVAR é um procedimento seguro e eficaz para o tratamento de diferentes patologias da aorta torácica, quando comparado com o tratamento cirúrgico aberto.
Endovascular treatment of the thoracic aorta is a technique which has revolutionized the treatment of different aortic pathologies.
ObjectivesOur purpose is to evaluate our institutional experience
MethodsWe present a retrospective analysis of a consecutive series of patients who underwent TEVAR at our Instituition. Patients who received fenestrated/branched abdominal devices were excluded.
ResultsFrom April 2005 to Abril 2014, 79 patients with a mean age of 66±12.83 years (range 14 to 86) underwent TEVAR. The indications included: 46 thoracic aortic aneurysms (TAA) (58%), 17 aortic dissections (AD) Stanford B (22%), 13 due to other acute aortic syndromes (AAS) (16%), 2 due to atheroembolism (3%) e 1 due to an aortic‐esophageal fistula (1%).
The aortic aneurysms were located to the ascending aortic and arch in 5 cases (11%), the descending thoracic aorta in 35 (76%) and the thoracoabdominal aorta in 6 (13%).
Mean aneurysm diameter was 69.64mm (max 150mm). Rupture was the clinical presentation in 21.5% of the patients (n=17). 20.9% of the patients had previous aortic surgery.
TEVAR was performed for acute complicated Stanford type B AD in 13 patients (76%) and for chronic AD in 4 (24%). AD‐related complications included aneurysmatic dilatation in 35% (n=6), organ malperfusion in 47% (n=8). The Petticoat technique was performed in 9 cases (41.2%) and adjuvant procedures were necessary in 18% (renal artery stenting in 2; iliac artery stenting in 1).
Regarding the other AAS, TEVAR was performed due to penetrating aortic ulcer in 4 cases, intra‐mural hematome in 4 and in 5 cases due to rupture/pseudoaneurysm.
The deployed endografts included 32 Valiant Medtronic®, 15 TAG Gore®, 25 Zenith TX2 Cook®, 2 Zenith TX1 Cook®, 1 Relay Plus®, 3 Talent Medtronic®. The median length of stay in the intensive care unit was 2 days (range 0‐42) and median 2 units of erythrocytes was transfused per patient.
Thirty‐day/intrahospitalar mortality was 18% (n=14). Mortality in elective procedures was 8% (4 in a total of 50) and 35% in urgent cases (10/29). Intraoperative additional interventions were required in 7 patients due to access vessel complications, in 2 due to iatrogenic AD, in 1 case due to acute limb thromboembolic ischemia and in 1 case to to a type IA endoleak. Reintervention rate was 17%, with the following indications: 9 endoleaks, 2 mesenteric ischemias and 2 aortic‐esophageal fistulae.
ConclusionsOur series represents an encouraging institutional experience, with reproducible outcomes. TEVAR is a safe and effective intervention for the management of different thoracic aortic pathologies, when compared to open surgery.
A aorta torácica pode ser alvo de diferentes tipos de patologias que se podem associar a elevada morbilidade e mortalidade. Desde a patologia mais frequente, a doença aneurismática degenerativa, até às mais raras síndromes aórticas agudas, o planeamento endovascular pode assim ser mais complexo pela multiplicidade de patologias e potencial envolvimento dos troncos supra‐aórticos1.
Na última década, thoracic endovascular aortic repair (TEVAR) surge como uma modalidade terapêutica emergente, que tem vindo a revolucionar a abordagem dos variados tipos de patologias da aorta na sua localização torácica2,3. Atualmente, pode ser considerado tratamento de primeira linha, em particular nas lesões aórticas traumáticas e dissecção aórtica aguda complicada, onde mais se torna evidente a melhor sobrevida em comparação com a cirurgia convencional4,5.
O TEVAR apresenta‐se como uma alternativa menos invasiva, segura e tecnicamente reprodutível6,7.
Iniciada em 2005, a utilização do TEVAR no Serviço de Angiologia e Cirurgia Vascular do Hospital de Santa Marta alterou a abordagem terapêutica da patologia da aorta torácica. Ao mesmo tempo que se associa a uma menor morbimortalidade, permitiu à cirurgia vascular, possuindo os skills já conferidos pelo domínio das técnicas endoluminais, o acesso a um segmento tradicionalmente reservado à cirurgia cardiotorácica.
O objetivo deste trabalho é avaliar os resultados institucionais com a aplicação de TEVAR para o tratamento eletivo e urgente da patologia da aorta torácica. Adicionalmente, foi avaliada a possível diferença entre resultados em doentes tratados por patologia aneurismática e não‐aneurismática.
Material e métodosProcedeu‐se à análise retrospetiva da série de casos de patologia da aorta torácica e/ou toracoabdominal submetidos a TEVAR até abril de 2014, realizados no Serviço de Angiologia e Cirurgia Vascular do Hospital de Santa Marta. Foram excluídos aqueles com uso concomitante de endopróteses fenestradas/ramificadas abdominais.
Os dados foram colhidos recorrendo ao processo clínico dos doentes e informação do sistema informático da instituição. Em particular, foram selecionados dados demográficos dos doentes, comorbilidades de base, indicações na base da intervenção, detalhes intraoperatórios e procedimentos adjuvantes, bem como complicações intraoperatórias e secundárias com procedimentos associados. Foi aferida a mortalidade aos 30 dias ou intra‐hospitalar e averiguado o follow‐up, incluindo sobrevida e complicações relacionadas com procedimento.
As patologias major da aorta torácica subdividiram‐se: em doença aneurismática degenerativa com ou sem evidência de rotura, dissecções clássicas da aorta Stanford tipo B complicadas agudas (<14 dias) e crónicas, e outras síndromes aórticas agudas. Dentro destes foi definida úlcera aórtica penetrante como: aterosclerose severa ulcerada com disrupção da média em segmento limitado da aorta; hematoma intramural como: hematoma na média, sem evidência de lâmina íntima de reentrada; e os restantes corresponderam a rotura/pseudoaneurisma. As outras indicações estiveram relacionadas com presença de trombo aórtico embolígeno (ateroembolismo)8 e fístula aorto‐esofágica.
Em doentes com admissão anterior a 2008, por ausência de dados no sistema informático de apoio e no processo clínico, não foi possível a colheita de todas as variáveis.
As variáveis categóricas são apresentadas como contagem e percentagem. As variáveis contínuas são apresentadas como média e desvio padrão, ou mediana e intervalo, conforme a distribuição paramétrica ou não‐paramétrica. Nos casos de existirem valores omissos, foram considerados os valores dos doentes em que os dados estavam presentes.
A estimativa de sobrevida foi obtida através da curva de Kaplan Meier.
Constituíram‐se ainda 2 grupos, patologia aneurismática degenerativa e patologia não aneurismática, e analisaram‐se as diferenças entre variáveis (fatores de risco mais prevalentes, evidência de rotura, tipo de anestesia, timing da cirurgia (electivo vs urgente) e mortalidade aos 30 dia/intrahospitalar; medianas das variáveis creatinina e hemoglobina à admissão, status hemodinâmico, duração da cirurgia, dias de internamento em unidade de cuidados intensivos e unidades de concentrado eritrocitário usadas). As variáveis categóricas foram testadas utilizando teste qui‐quadrado. Uma vez que as variáveis contínuas eram de distribuição não paramétrica foi usado teste de Fisher para avaliar diferenças entre medianas. Foi considerado significado estatístico se p<0,05. Para a análise estatística foi utilizado o software SPSS v20 para Windows.
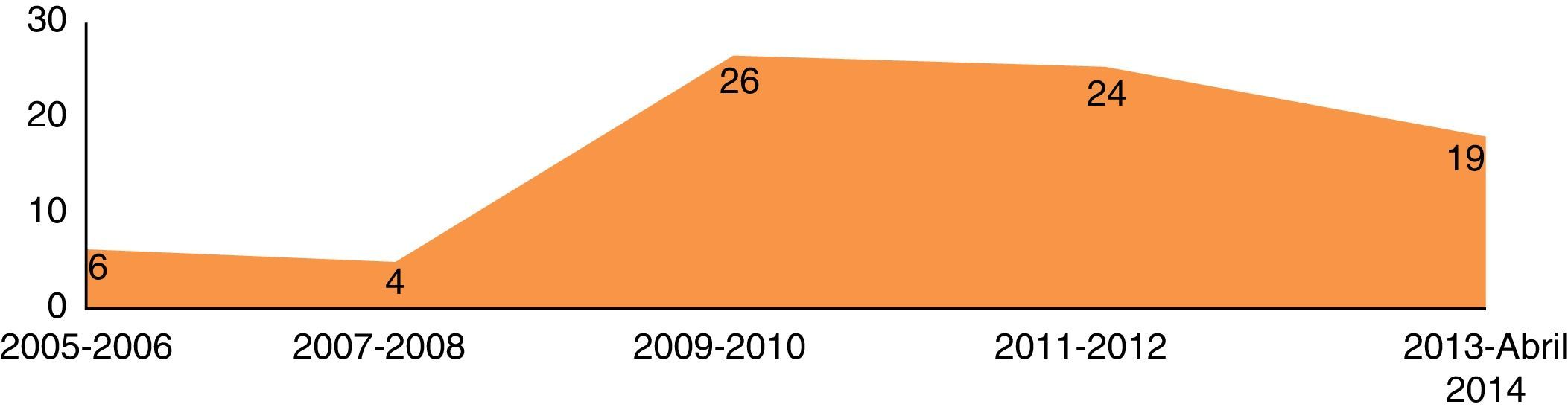
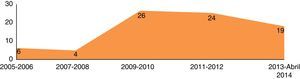
ResultadosDo período de abril 2005 até abril de 2014, 79 doentes com patologia do território da aorta torácica foram submetidos a TEVAR. Verificou‐se um incremento gradual no número de procedimentos realizados ao longo dos anos (fig. 1).
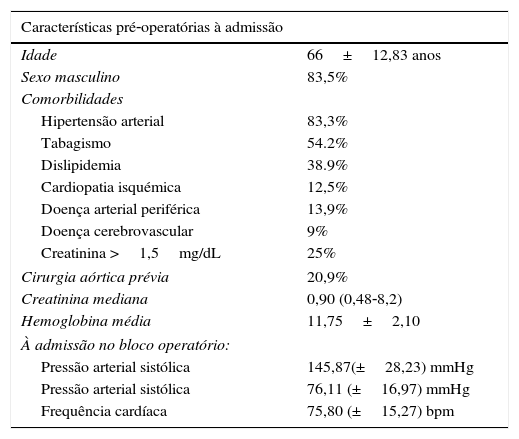
Dos dados demográficos da população intervencionada observa‐se: idade média de 66±13 anos (máximo: 86; mínimo: 14) e um predomínio significativo do sexo masculino (n=66; 83,5%).
Os fatores de risco mais prevalentes foram hipertensão arterial (83,3% dos doentes), tabagismo (54,2%; ativo em 26,4% e interrompido em 27,8%) e dislipidemia (38,9%) (tabela 1).
Características pré‐operatórias da população
| Características pré‐operatórias à admissão | |
|---|---|
| Idade | 66±12,83 anos |
| Sexo masculino | 83,5% |
| Comorbilidades | |
| Hipertensão arterial | 83,3% |
| Tabagismo | 54.2% |
| Dislipidemia | 38.9% |
| Cardiopatia isquémica | 12,5% |
| Doença arterial periférica | 13,9% |
| Doença cerebrovascular | 9% |
| Creatinina >1,5mg/dL | 25% |
| Cirurgia aórtica prévia | 20,9% |
| Creatinina mediana | 0,90 (0,48‐8,2) |
| Hemoglobina média | 11,75±2,10 |
| À admissão no bloco operatório: | |
| Pressão arterial sistólica | 145,87(±28,23) mmHg |
| Pressão arterial sistólica | 76,11 (±16,97) mmHg |
| Frequência cardíaca | 75,80 (±15,27) bpm |
Catorze doentes tinham antecedentes de cirurgia aórtica prévia, com a seguinte distribuição: 8 cirurgia por aneurisma da aorta abdominal, dos quais 3 no contexto de rotura (2 EVAR e 6 cirurgia convencional); 4 debranchings dos troncos supra‐aórticos (bypass aorto‐tronco inonimado – carótida esquerda, bypass carotído‐carotídeo) e 2 cirurgias de coartação da aorta complicadas de pseudoaneurisma aórtico.
IndicaçõesAs indicações primárias foram: 46 aneurismas (58%), 17 dissecções aórticas Stanford B (22%), 13 no contexto de outras síndromes aórticas agudas (16%), 2 por ateroembolismo (3%) e um por fístula aortoesofágica (1%) (fig. 2).
Na patologia aneurismática, a distribuição anatómica da doença foi a seguinte: 5 na aorta ascendente e arco aórtico (11%), 35 na aorta torácica descendente (76%) e 6 toracoabdominal (13%).
O diâmetro médio das dilatações aneurismáticas (inclui casos de dilatação aórtica no contexto de dissecção tipo B) foi de 69,64mm (máx: 150mm). A rotura foi uma apresentação da patologia em 22% dos doentes (n=17).
Nos aneurismas toracoabdominais, os procedimentos de revascularização dos ramos viscerais foram realizados através de cirurgia convencional de debranching visceral (n=5; 83%) e através da técnica de Chimney com stents cobertos (n=1; 17%).
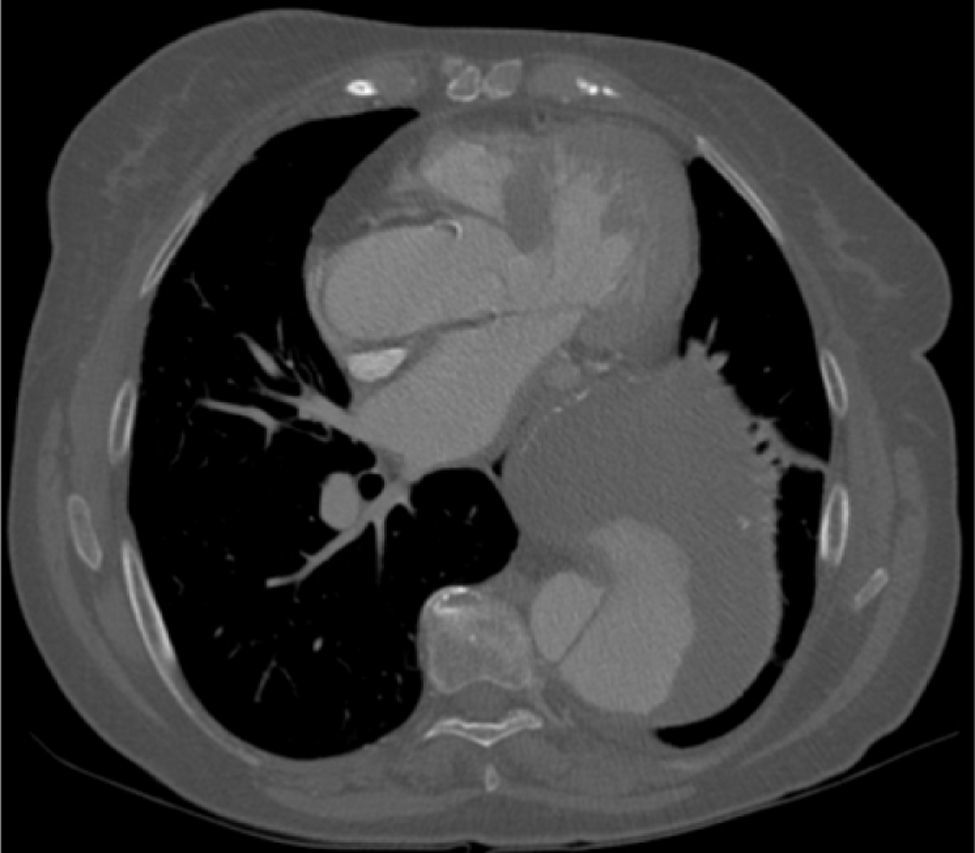
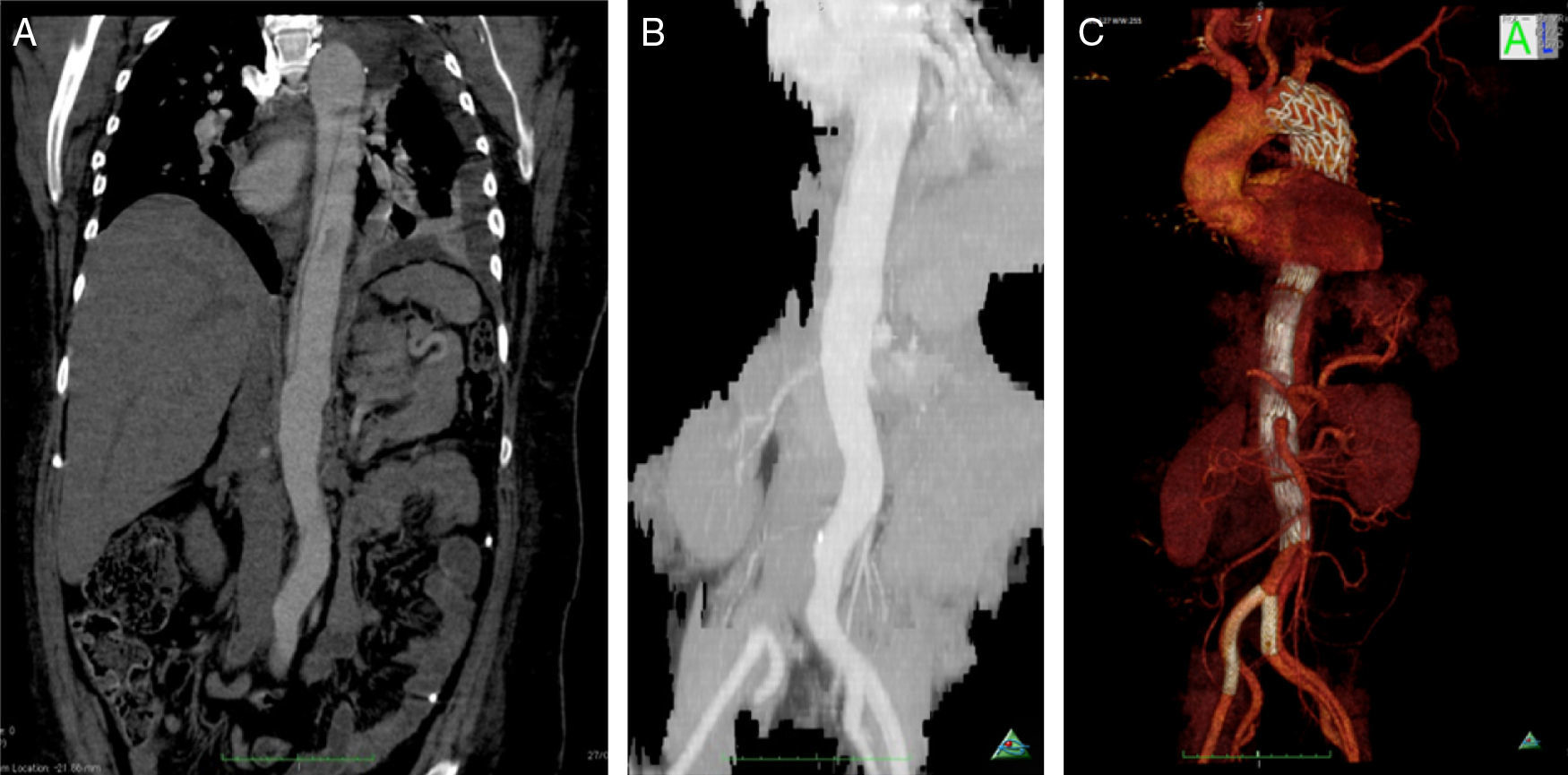
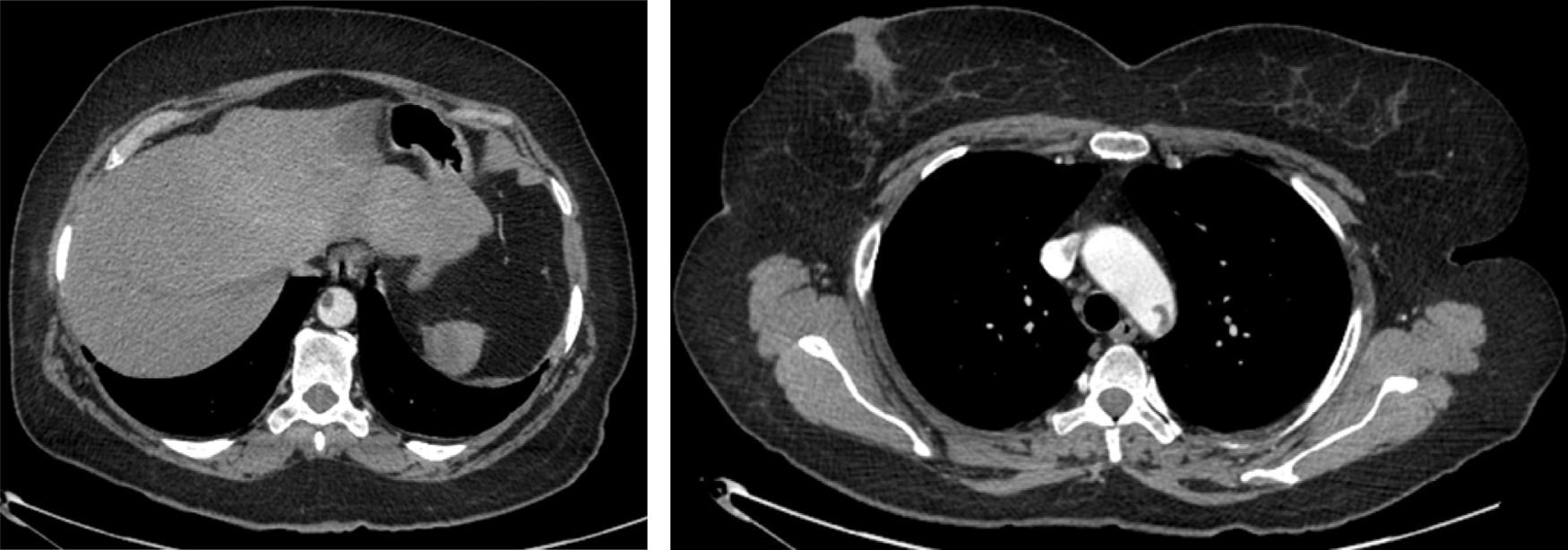
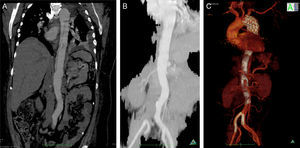
A dissecção aórtica tipo B complicada foi de apresentação aguda em 13 (76%) e crónica em 4 (24%). As complicações na base da necessidade de intervenção foram dilatação aneurismática (fig. 3) em 35,3% (n=6), malperfusão com isquemia de órgão alvo 47% (n=8), desconhecida em 17,7% (n=3). Foi realizado Petticoat com stents descobertos de dissecção em 9 casos, e foram realizados procedimentos adjuvantes em 18% (stenting renal n=2; kissing stent ilíaco n=1). Os casos de malperfusão de órgão corresponderam a 6 oclusões das artérias renais, uma oclusão dinâmica da artéria mesentérica inferior e uma oclusão da artéria ilíaca comum (fig. 4fig. 4 A, B e C).
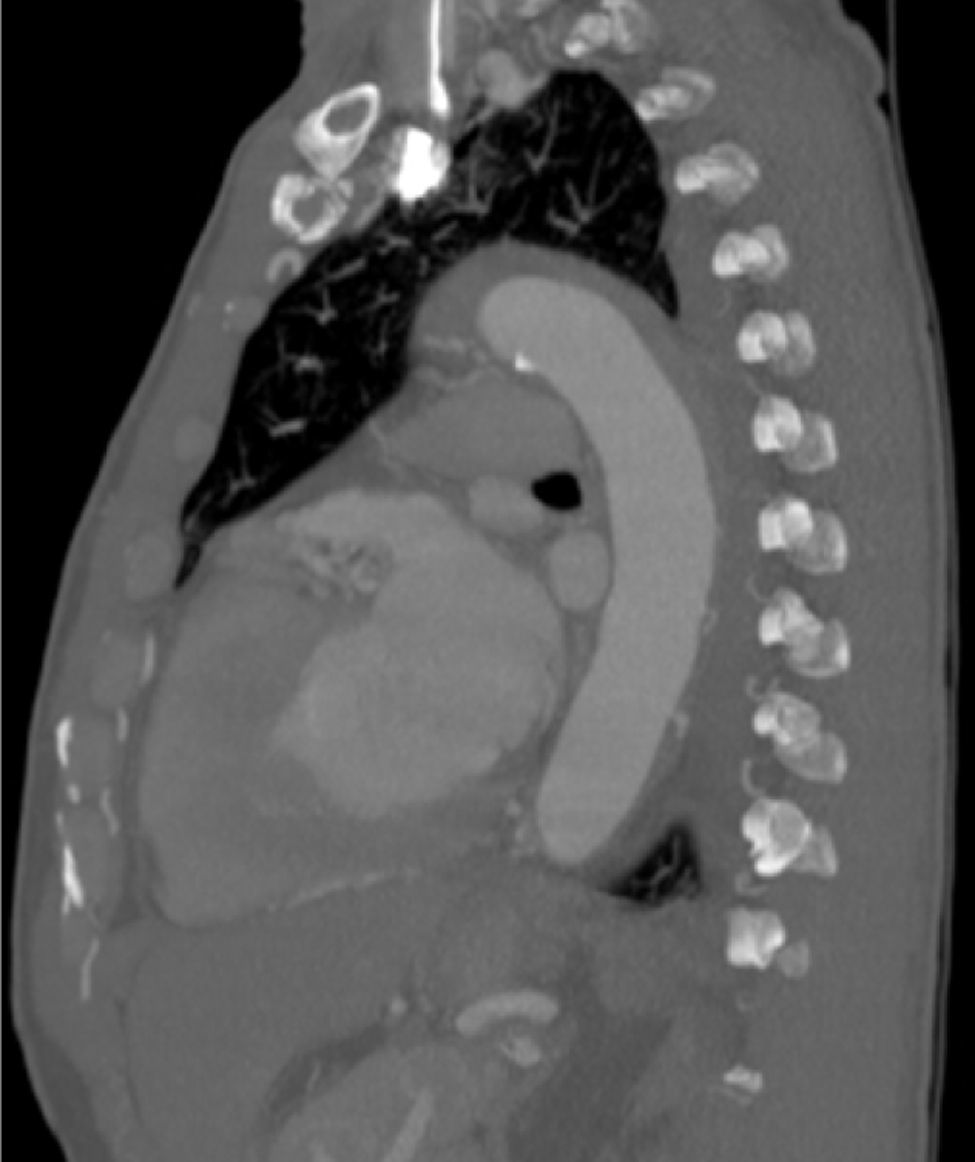
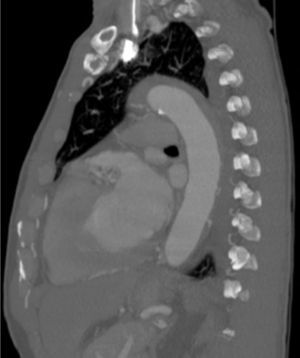
Dentro das outras síndromes aórticas agudas, o TEVAR foi realizado no contexto de úlcera aórtica penetrante (n=4), hematoma intramural (n=4) (fig. 5) e os restantes por rotura/pseudoaneurisma (n=5).
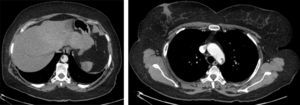
Os 2 casos de cuja indicação para TEVAR foi ateroembolismo foram decorrentes de trombo aórtico mural, condicionando embolias de repetição dos membros inferiores (fig. 6).
Em 16 doentes foi realizada oclusão da artéria subclávia esquerda, tendo‐se procedido à revascularização arterial no mesmo tempo operatório em 5 doentes (com 2 Chimneys com stent coberto para artéria subclávia esquerda; uma transposição artéria subclávia esquerda‐artéria carótida comum esquerda; 2 bypass axilo‐carotídeo com xPTFE) e prévia em 3 (debranchings do arco aórtico).
ProcedimentoA maioria dos TEVAR foi realizada electivamente (n=50, 63%) e em 37% (n=29) como cirurgia de urgência. A rotura foi modo de apresentação em 22% (n=17) dos doentes tratados.
O tipo de anestesia usado foi maioritariamente a geral (85%). A anestesia local foi usada em 10% (7/73) dos casos e a raquianestesia em 5% (4/73 [desconhecida em 6 casos]). Considerando o período temporal a partir do ano de 2013, o peso percentual da anestesia local atinge os 26% (5/19) e foi particularmente usada nos casos urgentes (n=5).
O procedimento foi realizado maioritariamente sob abordagem cirúrgica femoral unilateral e punção percutânea femoral contralateral para controlo angiográfico, e numa minoria foi usado acesso percutâneo umeral angiográfico (8%). Em 2 doentes procedeu‐se à construção de conduto vascular (Dacron 10mm) para introdução da endoprótese.
A taxa de sucesso técnico foi de 97% (n=77/79). Num caso, houve necessidade de realização de stenting carotídeo não programado, e noutro caso de dissecção aórtica tipo B não se conseguiu concretizar a cateteterização do verdadeiro lúmen.
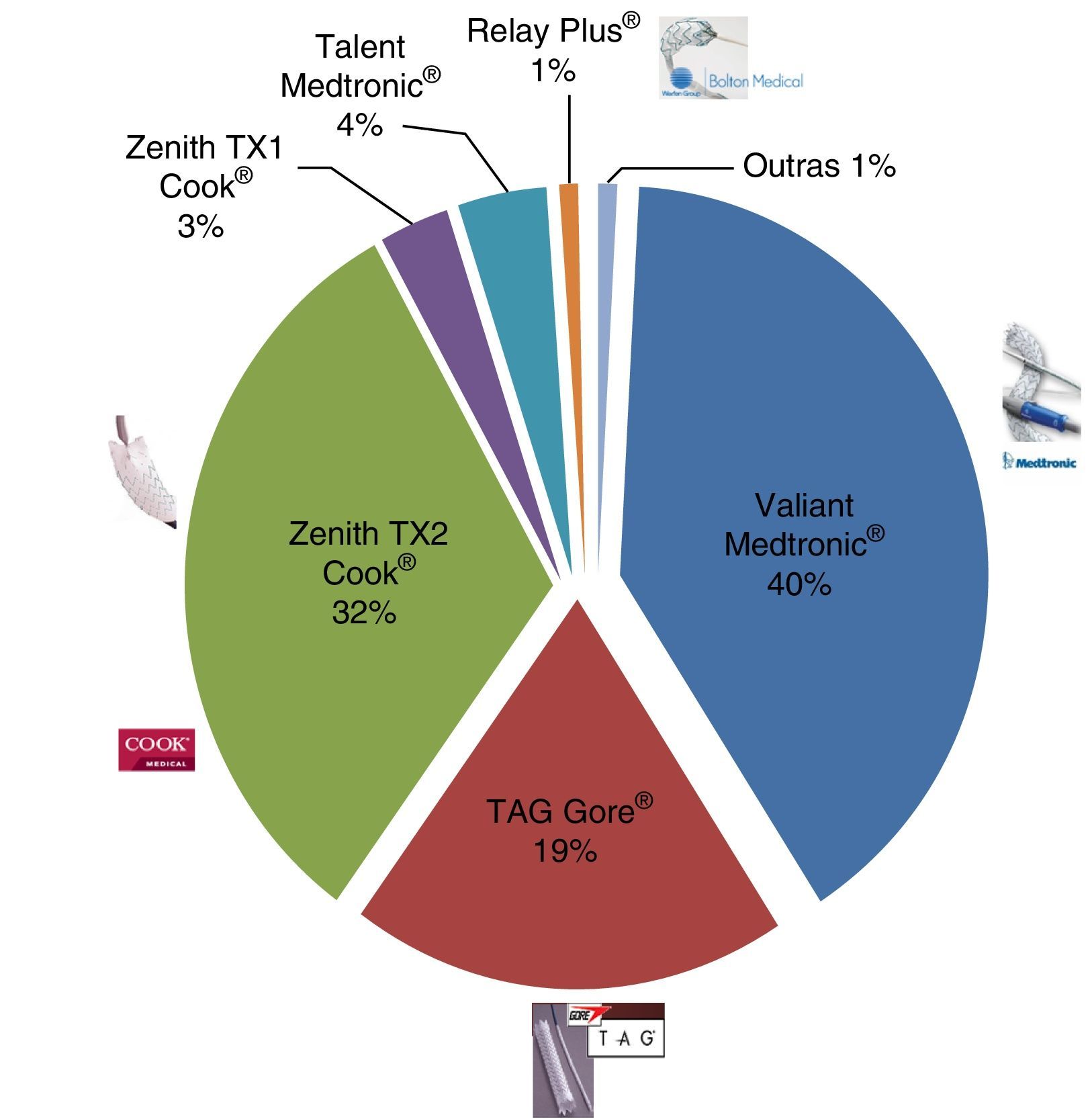
As endopróteses implantadas foram Valiant Medtronic® (n=32), TAG Gore® (n=15), Zenith TX2 Cook® (n=25), Zenith TX1 Cook® (n=2), Relay Plus® (n=1), Talent Medtronic® (n=3), outras (n=1) (fig. 7).
As endopróteses classificadas como outras correspondem a uma Endurant Medtronic® e uma Excluder Gore® usadas no contexto emergente de brindging num doente de 14 anos, cuja indicação foi a rotura de pseudoneurisma aórtico associada a procedimento de dilatação endovascular de stent Atrium de coartação aórtica.
MortalidadeA taxa de mortalidade aos 30 dias ou intrahospitalar global foi de 18% (n=14/79). Atendendo ao timing da cirurgia, a taxa de mortalidade aferida nos casos eletivos foi de 8% (4/50) e nos urgentes atinge os 35% (10/29). As causas estão descritas na tabela 2.
Causalidade da mortalidade
| Causas sistémicas | |
| Pulmonar (pneumonia nosocomial) | 2 |
| AVC | 2 |
| Falência multiorgânica secundária a rotura aórtica | 5 |
| Choque cardiogénico | 1 |
| Choque séptico | 1 |
| Causas relacionadas com procedimento | |
| AVC e isquemia mesentérica – embolização | 1 |
| Isquemia mesentérica – trombose ramos Debranching visceral | 1 |
| Rotura de dissecção aórtica com impossibilidade de cateterização do verdadeiro lúmen | 1 |
| Fístula aorto‐esofágia secundária | 1 |
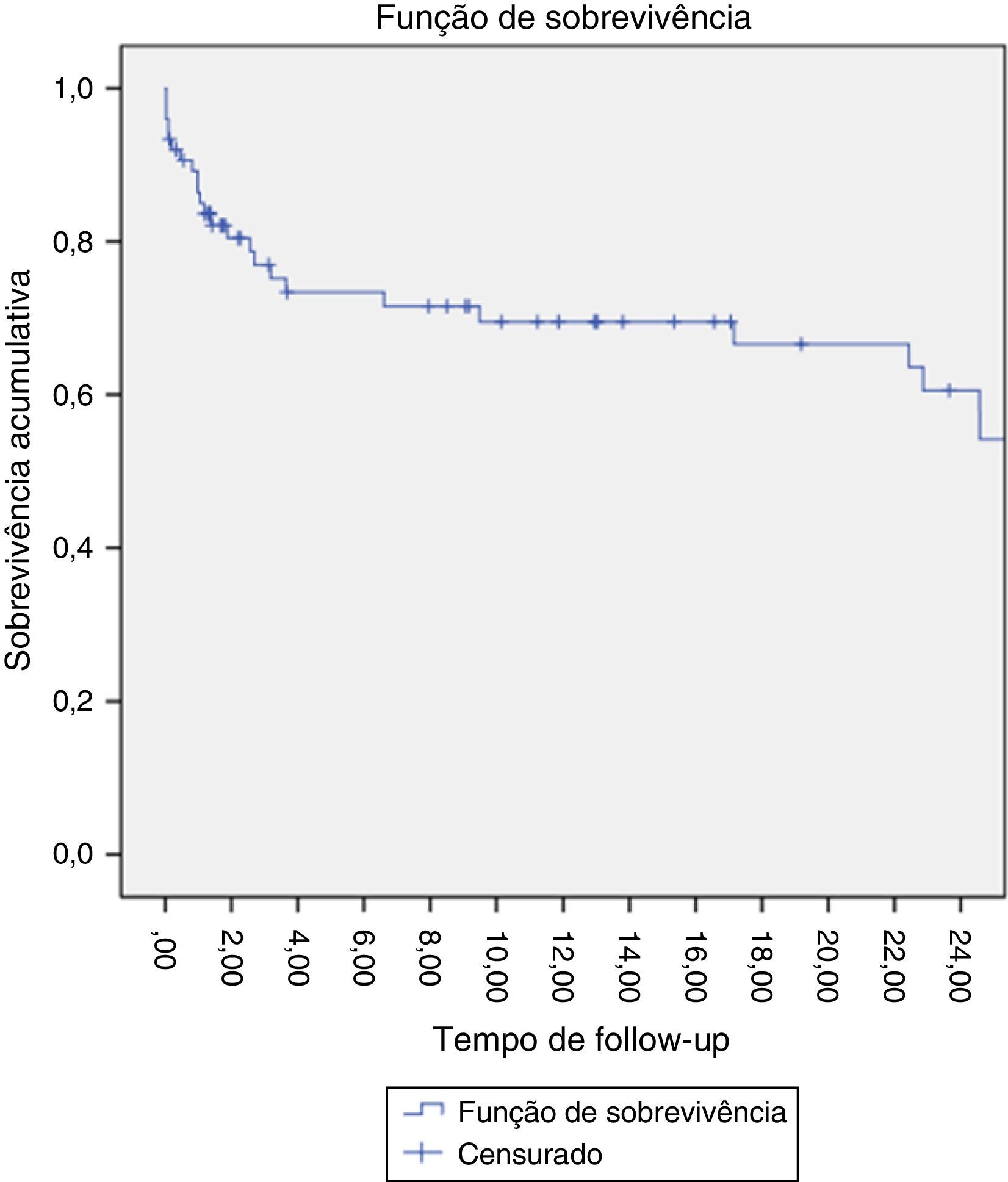
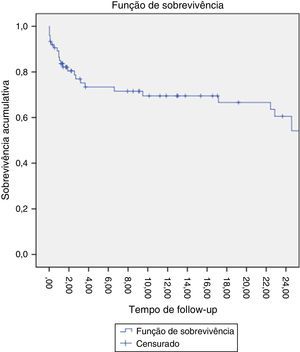
A estimativa da sobrevida aos 24 meses foi de 60% (fig. 8).
Complicações sistémicasDas complicações sistémicas aos 30 dias/intrahospital (tabela 3), a maioria esteve relacionada com patologia pulmonar. Foram contabilizados 3 acidentes vasculares cerebrais e 3 casos de isquemia medular.
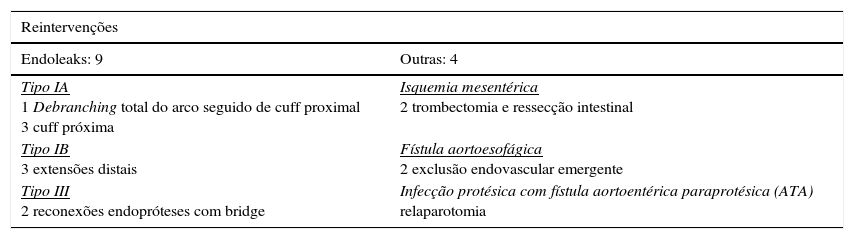
Complicações relacionadas com o procedimento (tabela 4)Durante o seguimento, identificaram‐se 12 endoleaks com a seguinte distribuição: 5Ia, 3Ib, 1II, 2III e um indefinido (tabela 4).
Complicações relacionadas com o procedimento intra‐operatórias
| Complicações de vaso de acesso: 7 | Complicações do procedimento endovascular: 4 |
|---|---|
| Artéria femoral: • 1 dissecção e 3 lacerações | • 1 endoleak tipo Ia ‐ corrigido com cuff proximal e stent coberto para a artéria carótida comum esquerda pela técnica de Chimney |
| Artéria ilíaca: • 3 Roturas iatrogénicas ‐ corrigidas com interposição iliofemoral, bypass iliofemoral e exclusão endovascular com stent coberto Viabahn Gore® | • 2 dissecções aórticas iatrogénicas distais à endoprotese |
| • 1 trombose arterial membro |
A taxa de reintervenção relacionada com complicações do procedimento foi de 17% (tabela 5).
Reintervenções
| Reintervenções | |
|---|---|
| Endoleaks: 9 | Outras: 4 |
| Tipo IA 1 Debranching total do arco seguido de cuff proximal 3 cuff próxima | Isquemia mesentérica 2 trombectomia e ressecção intestinal |
| Tipo IB 3 extensões distais | Fístula aortoesofágica 2 exclusão endovascular emergente |
| Tipo III 2 reconexões endopróteses com bridge | Infecção protésica com fístula aortoentérica paraprotésica (ATA) relaparotomia |
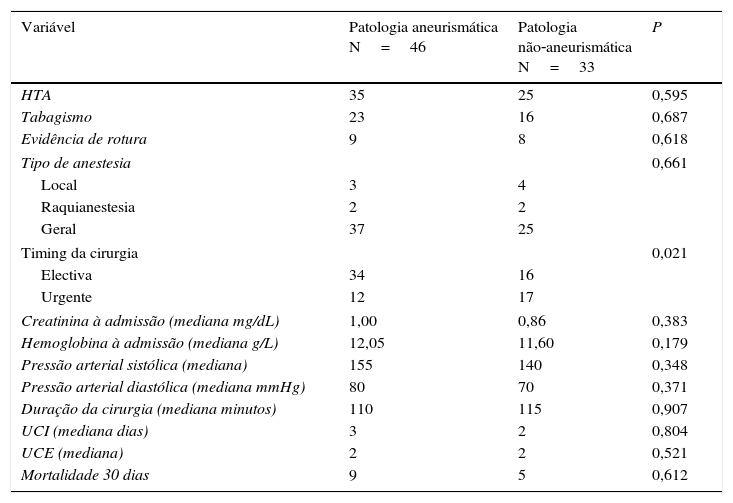
Da análise estatística entre os 2 grupos constituídos (patologia aneurismática vs. patologia não aneurismática (tabela 6)), não se encontraram diferenças estatisticamente significativas entre os 2 grupos de doentes nas seguintes variáveis testadas: fatores de risco mais prevalentes, evidência de rotura, tipo de anestesia e mortalidade aos 30 dias; parâmetros analíticos e hemodinâmicos à admissão; características intraoperatórias. Apenas no timing da cirurgia se verificou uma diferença estatisticamente significativa (p=0,021), a favor de um maior número de urgências na patologia não aneurismática.
Análise estatística comparativa entre grupos (patologia aneurismática vs. patologia não‐aneurismática)
| Variável | Patologia aneurismática N=46 | Patologia não‐aneurismática N=33 | P |
|---|---|---|---|
| HTA | 35 | 25 | 0,595 |
| Tabagismo | 23 | 16 | 0,687 |
| Evidência de rotura | 9 | 8 | 0,618 |
| Tipo de anestesia | 0,661 | ||
| Local | 3 | 4 | |
| Raquianestesia | 2 | 2 | |
| Geral | 37 | 25 | |
| Timing da cirurgia | 0,021 | ||
| Electiva | 34 | 16 | |
| Urgente | 12 | 17 | |
| Creatinina à admissão (mediana mg/dL) | 1,00 | 0,86 | 0,383 |
| Hemoglobina à admissão (mediana g/L) | 12,05 | 11,60 | 0,179 |
| Pressão arterial sistólica (mediana) | 155 | 140 | 0,348 |
| Pressão arterial diastólica (mediana mmHg) | 80 | 70 | 0,371 |
| Duração da cirurgia (mediana minutos) | 110 | 115 | 0,907 |
| UCI (mediana dias) | 3 | 2 | 0,804 |
| UCE (mediana) | 2 | 2 | 0,521 |
| Mortalidade 30 dias | 9 | 5 | 0,612 |
O presente trabalho descreve a experiência institucional no tratamento endovascular da aorta torácica. Apesar do largo espectro de patologias e apresentações clínicas dos doente tratados por TEVAR, os resultados sugerem uma elevada taxa de sucesso técnico e uma morbimortalidade globalmente aceitável comparada com os resultados das opções cirúrgicas abertas para este grupo de doentes.
O TEVAR surge, assim, como uma abordagem menos invasiva, tecnicamente efetiva no tratamento de diferentes patologias da aorta torácica6,7,9. Contudo, os resultados variam consideravelmente, de acordo com a localização da doença nos diferentes segmentos da aorta torácica (ascendente vs. crossa vs. descendente) e com a sua fisiopatologia10,11.
Na série apresentada, foram incluídos 2 tipos de apresentação temporal de dissecção aórtica Stanford tipo B, aguda e crónica, sendo reconhecido o diferente comportamento após TEVAR destes 2 tipos e, consequentemente, diferentes resultados9.
Atendendo às complicações na base da intervenção na dissecção aórtica, a indicação mais prevalente foi a de má perfusão de órgão. Nos casos de malperfusão por compressão dinâmica pelo verdadeiro lúmen, o TEVAR está comprovado como modalidade de tratamento de escolha. O stenting adicional de ramos aórticos pode ser necessário nos casos de oclusão estática5,11. A extensão da aorta com stents descobertos pela técnica de Petticoat foi realizada em 9 casos, apesar de ainda não estarem estabelecidos os resultados desta técnica5.
O tempo médio de internamento e a mediana de permanência em unidade de cuidados intensivos, o tempo do operatório e o suporte transfusional necessário (tabela 7) são ilustrativos da menor invasibilidade da técnica endovascular em comparação com tratamento cirúrgico convencional, e que se traduzirá em menor morbilidade e melhor resultado a curto prazo7,9,11.
Características operatórias
| Características intraoperatórias e pós‐operatórias | |
|---|---|
| Tempo médio de cirurgia | 154min (45‐285) |
| Tempo de fluoroscopia – mediana | 15min (5‐130) |
| Volume de contraste – mediana | 130mL (20‐518) |
| Suporte transfusional (mediana de unidades de concentrado eritrocitário [UCE]) | 2UCE (0‐26) |
| Unidade de cuidados intensivos (mediana de dias) | 2 dias (0‐42) |
| Tempo de internamento (mediana de dias) | 7 dias (0‐113) |
O tempo cirúrgico apurado nesta série é muito variável pela multiplicidade de patologias tratadas e está dependente da existência concomitante de outros procedimentos cirúrgicos como debranching visceral, revascularização da subclávia e técnica de Chimney no mesmo tempo operatório. Excluindo as cirurgias com estes procedimentos de revascularização, a mediana da duração da cirurgia foi de 95min (45‐285min). Nos últimos anos verificou‐se um aumento no uso de anestesia local, em particular nos procedimentos urgentes.
Na série apresentada foi evidente um considerável peso percentual de patologias tratadas em contexto de urgência (37%), o que também contribui para uma mortalidade precoce maior da que a esperada e descrita em séries de casos eletivos11.
A sobrevida a médio/longo prazo deste grupo de doentes é pobre, o que sugere tratar‐se de um grupo de doentes com uma esperança de vida reduzida. No entanto, a proporção de doentes com morte tardia relacionada com eventos aórticos é baixa, sugerindo a eficácia da terapêutica. De facto, além da patologia da aorta torácica ser frequentemente emergente, os doentes são tipicamente de idade avançada e com múltiplas comorbilidades12.
O risco de complicações neurológicas é um fator limitante no tratamento endovascular da aorta torácica. O AVC pode ocorrer em 3 a 5% após TEVAR13. Na série apresentada documentaram‐se 3 casos de acidentes vasculares cerebrais (3,79%). Nos casos mais recentes só houve um evento.
A isquemia medular é outra complicação bem reconhecida devastadora das intervenções cirúrgicas e endovasculares da aorta torácica, associando‐se a diferentes graus de incapacidade7,14. Na cirurgia aberta convencional pode atingir os 20%15. O risco de isquemia medular após TEVAR é reconhecidamente mais baixo, com uma incidência global reportada na revisão sistemática de Wong et al.15 em 3,88%.
Na série apresentada verificaram‐se 3 casos de isquemia medular (3,79%), 2 com isquemia medular reversível (um com cobertura da artéria subclávia esquerda) e um caso de isquemia medular irreversível com antecedentes de cirurgia convencional de aneurisma da aorta abdominal.
Vários fatores podem predispor à sua ocorrência como a permeabilidade das hipogástricas, oclusão das intercostais, cobertura da artéria subclávia esquerda, comprimento de aorta torácica coberto pela endoprótese e cirurgia aorta abdominal prévia. Uma das medidas de reduzir esse risco é a drenagem de líquido cefalorraquidiano, cujo timing profiláctica vs. seletiva ainda está por definir na literatura16. Na série apresentada nos casos posteriores a 2012, foi realizada drenagem profilática de líquor em 18% dos doentes (6/33). A decisão na drenagem esteve relacionada com a extensão de aorta torácica coberta e expetativa de colateralidade (permeabilidade das artérias subclávia e hipogástricas).
As indicações mais comuns para reintervenções são os endoleaks. A incidência reportada de endoleaks na meta‐análise de Cheng et al. relativa ao tratamento endovascular da aorta torácica descendente foi de 12,1%9. Diferentes fatores podem influenciar a sua ocorrência, em especial na aorta torácica: a angulação severa do arco e calcificação aórtica massiva5. Um follow‐up imagiológico seriado é mandatório após o TEVAR, para a deteção e correção atempada de complicações tardias, que podem ocorrer anos após o procedimento inicial5,16.
Da análise estatística entre patologia aneurismática vs. não aneurismática, não se encontraram diferenças estatisticamente significativas na maioria das variáveis testadas. Isto pode advir da complexidade de patologias que os doentes apresentavam e do número da amostra não ser suficiente. Apenas o timing da cirurgia demonstrou uma diferença estatística a favor de um maior número de urgências na patologia não aneurismática. De facto, a patologia não aneurismática inclui maioritariamante síndrome aórticos agudos, cuja forma de apresentação decorre tipicamente num contexto urgente. Os aneurismas da aorta torácica foram tratados preferencialmente de forma eletiva.
Limitações: a miscelânea de patologias e em diferentes contextos de urgência de intervenção torna a amostra demasiado heterogéna para elucidar conclusões em termos de resultados. Além disso, trata‐se de uma análise retrospetiva, o que é um limite importante do estudo pela incapacidade de obtenção de todas as variáveis em todos os doentes.
ConclusãoO desenvolvimento no âmbito das técnicas endovasculares tem vindo a modificar a abordagem terapêutica da aorta. Na experiência desta instituição, o TEVAR é uma abordagem terapêutica efetiva e segura no tratamento de patologias do território da aorta torácica.
A série apresentada traduz uma experiência favorável, com resultados perioperatórios e a médio prazo reprodutíveis, e a técnica permite o tratamento de uma variedade de patologias que podem atingir a aorta na sua localização torácica.
A necessidade de follow‐up a longo prazo é fundamental para a definição de complicações únicas da intervenção endovascular torácica.
Responsabilidades éticasProteção de pessoas e animaisOs autores declaram que para esta investigação não se realizaram experiências em seres humanos e/ou animais.
Confidencialidade dos dadosOs autores declaram que não aparecem dados de pacientes neste artigo.
Direito à privacidade e consentimento escritoOs autores declaram que não aparecem dados de pacientes neste artigo.
Conflito de interessesOs autores declaram não haver conflito de interesses.