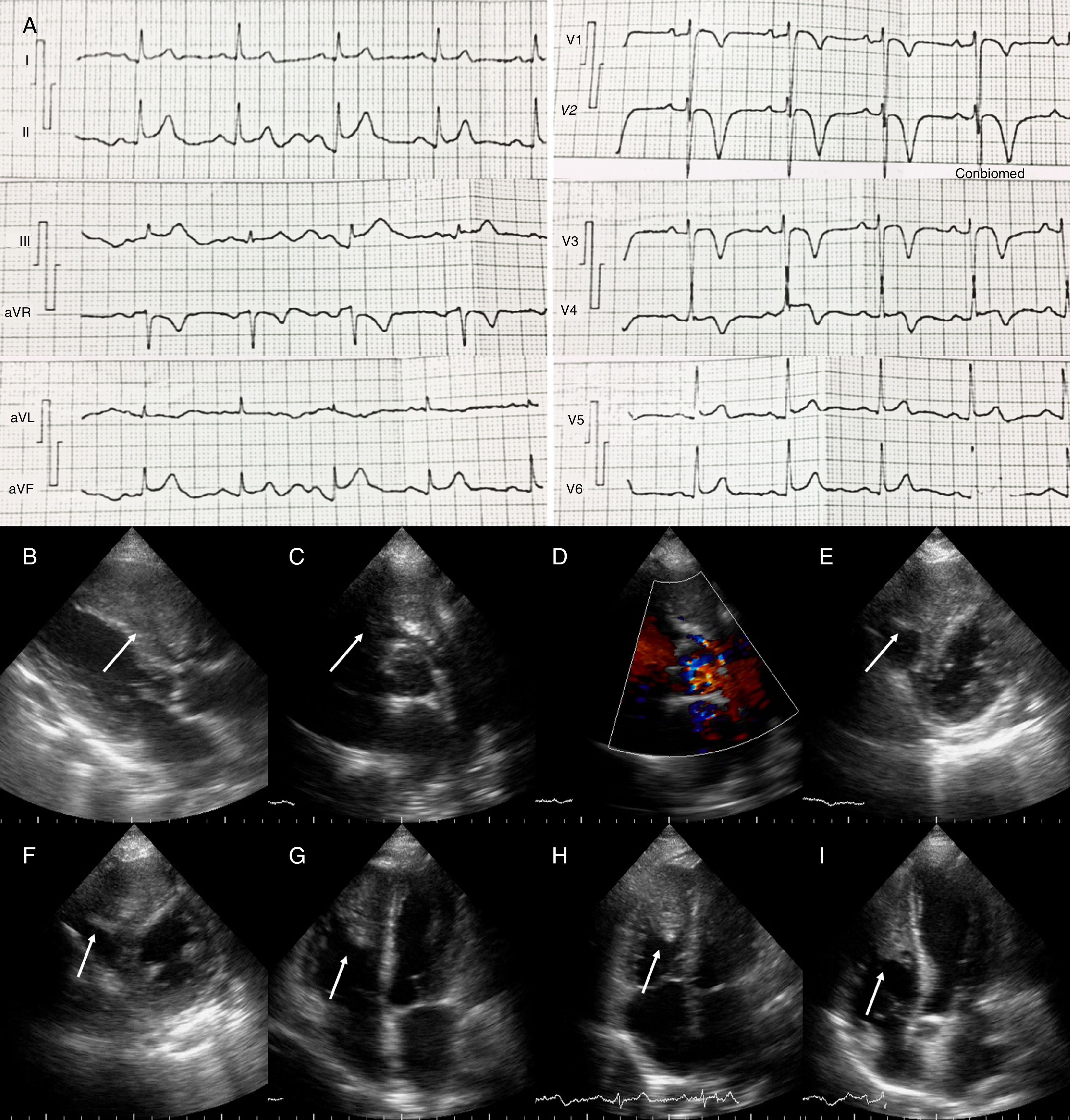
Un niño de 3 años de edad y 17kg de peso fue referido para intervención tras varios episodios de taquicardia paroxística supraventricular y fracaso de 3 fármacos. A los 2 años de edad, en su primera crisis, fue diagnosticado de anomalía de Ebstein (AE), tipo A, siendo su clase funcional, desarrollo pondoestatural y psicomotor adecuados. El examen físico reveló solamente un soplo sistólico, grado 1/6, en el borde esternal izquierdo bajo. El electrocardiograma de superficie evidenció sobrecarga auricular derecha y preexcitación ventricular sugerente de una vía posteroseptal derecha.
En estado postabsortivo, bajo anestesia general y por técnica de Seldinger se puncionaron las venas femorales derecha e izquierda para la colocación de introductores hemostáticos 5F y 4F, respectivamente. Tras obtener los accesos se hizo una confirmación fluoroscópica de 6s de la posición de las guías metálicas. Con un catéter decapolar 4F se realizaron las geometrías auricular y ventricular derechas, utilizando un sistema de mapeo electroanatómico (SMEA) (EnSite System, St. Jude Medical, St. Paul, EE.UU.). Al tiempo de generar los modelos electroanatómicos se identificó y etiquetó el anillo auriculoventricular eléctrico. Para ello, si durante la manipulación del catéter aparecían potenciales con aspecto de contener registros auricular y ventricular, se los estabilizaba para realizar maniobras de disociación a fin de validar la presencia y la relación de sus componentes. De encontrarse una relación AV 1:1, el lugar era etiquetado como anillo. Para mapeo y ablación se insertó un catéter de ablación 5F, punta 4mm, no irrigado. Se mapeó inicialmente la región posterior del anillo, donde los potenciales eran fraccionados, de bajo voltaje y aparentaban fusión. En el extremo inferior del septo interauricular se identificó un potencial con 17ms de precocidad con respecto a la onda delta; aquí la radiofrecuencia eliminó la preexcitación. La estimulación ventricular mostró conducción retrógrada central sin disociación. A los 20min de la aplicación, se indujo una taquicardia ortodrómica incesante. Nuevamente se mapeó el anillo tricuspídeo encontrándose el potencial auricular más precoz en el mismo punto de la aplicación previa. Aquí se liberó la radiofrecuencia revirtiendo la taquicardia en 5s. Esta vez la conducción ventriculoauricular se mostró disociada. La estimulación programada no indujo taquicardia hasta 30min después de la última aplicación. La duración total del procedimiento fue 100min, sin fluoroscopia adicional (fig. 1).
Hasta un 30% de pacientes con AE tienen vías accesorias auriculoventriculares capaces de provocar taquicardias clínicamente significativas en casi la totalidad de pacientes. La mayoría son evidentes y están localizadas en el anillo derecho. La ablación por radiofrecuencia es la primera opción terapéutica, pero con tasas de éxito menor y de complicaciones mayor a la de la población sin cardiopatía1–3. En niños estas taquiarritmias estarían asociadas a una mortalidad de hasta el 5%. Por ello se ha recomendado a la ablación como la estrategia de primera elección para los mayores de 5 años, sintomáticos y de alto riesgo. En pacientes menores, refractarios al tratamiento farmacológico se considera una indicación IIa y es la razón más frecuente de intervención4,5. El procedimiento es técnicamente complejo debido al agrandamiento de la aurícula derecha, la distorsión anatómica del anillo tricuspídeo, la variabilidad anatomofuncional de las vías accesorias, los electrogramas fragmentados procedentes de la zona atrializada del ventrículo derecho y la presencia de vías múltiples hasta en el 50% de casos. Reich et al.5 identifican, también, como predictor de fracaso agudo y a un año, a la superficie corporal <1,7m2. La tasa global de éxito va del 76 al 83%, con un 25% de recurrencia. Las complicaciones alcanzan el 9% y, si bien generalmente se relacionan con los accesos, existe preocupación sobre la evolución de las lesiones en corazones inmaduros. Se sabe que lesiones en el anillo duplican su profundidad con el paso del tiempo, existiendo una relación directamente proporcional entre el número de aplicaciones y la probabilidad de complicaciones4–7.
Por otro lado, la ablación por radiofrecuencia implica una significativa exposición a radiación ionizante para pacientes y operadores. Los daños secundarios tardan años en hacerse evidentes y, si bien el riesgo de desarrollar una neoplasia maligna parece ser globalmente bajo, es mandatorio reducir la dosis efectiva a la mínima razonable, especialmente en niños, cuya expectativa de vida es mayor, con probabilidad de requerir procedimientos repetidos que incrementen su riesgo7. El uso de sistemas no-fluoroscópicos de mapeo reduce significativamente la exposición, con similares resultados y tiempos de procedimiento, incluso para pacientes con anatomías complejas6,7. Existen, sin embargo, pocos reportes de su aplicación en AE. Ai et al., reportan el caso de un paciente adulto con AE, en el que el SMEA permitió identificar mejor el anillo tricuspídeo eléctrico como albo de ablación, sugiriendo que esta técnica sería más favorable para este grupo con anatomía compleja y con potenciales de activación endocavitaria de morfología anormal8. En nuestro caso, una vez generados los modelos, la navegación fue muy fácil y comprobamos que la identificación del anillo eléctrico en este niño también fue posible utilizando un SMEA diferente. Además, ante la recurrencia de la taquicardia, se pudo rápidamente reubicar el catéter en el punto previamente efectivo.
Existen limitaciones que impiden indicar el abordaje con SMEA como el de elección para niños con AE. Los reportes son de experiencias aisladas, se requieren operadores experimentados, no hay recomendaciones específicas para la selección del sistema de referencia, ubicación y adecuación del tamaño de los parches para los navegadores basados en impedancia y, falta desarrollar material de bajo perfil para uso pediátrico9,10.