Introducción
La insuficiencia cardiaca (IC) y su progresión a estadios avanzados continúa en ascenso asociada a morbilidad y mortalidad elevadas, ya que en la mayor parte de los casos los pacientes son refractarios a la terapia médica convencional.
En 2001 Stewart y colaboradores,1 consideraron que hay muchos datos que sugieren que los porcentajes de supervivencia en IC son igual o peores que en los pacientes con diagnóstico de cáncer. Más de 100 000 pacientes presentan diagnóstico de IC refractaria (estadio D American Heart Association/American College of Cardiology), siendo desalentador el pronostico en este grupo con una mortalidad al año de 50%. De los pacientes hospitalizados por IC aguda, entre 30% a 50% mueren al año.2,3
El trasplante cardiaco es de elección para el tratamiento en estos pacientes, aportando beneficios en términos de supervivencia.4 Ante la falta de donantes, 10% de los pacientes en lista de espera mueren cada año y muchos durante ese periodo sufren deterioro hemodinámico, con alto riesgo al momento del trasplante.5 En esta etapa, el uso obligado de fármacos inotrópicos se asocia con elevada mortalidad a mediano y largo plazo.6 La terapia con estas drogas, proporciona apoyo hemodinámico hasta que el corazón de un donante esté disponible para la realización del procedimiento.7,8.
La mortalidad de los pacientes con soporte inotrópico a la espera del trasplante es superior a 50% a los seis meses, siendo muy pocos los pacientes que sobreviven al año.9 Por todo esto, hoy en día la terapia con asistidores mecánicos (AM) es considerada una opción en los pacientes a la espera del trasplante. También como terapia de destino y recuperación del miocardio, alternativas en estudio y de las cuales se esperan resultados alentadores para el manejo en esta etapa de IC.
El objetivo de este trabajo es realizar una revisión sobre los avances y la utilidad de los AM en los pacientes con IC avanzada en los que, hasta ahora, la opción es el trasplante cardiaco.
Historia y avances de los asistidores mecánicos
Los AM son bombas implantables destinadas a proveer soporte hemodinámico en pacientes con falla cardiaca refractaria, aportando beneficios cuando las drogas inotrópicas y el balón de contrapulsación son insuficientes o inadecuados.10
En 1963 fue implantado el primer AM en el ventrículo izquierdo, y a partir del inicio del USA artificial heart program sponsored by the National Heart, Lung and Blood Institute (NHLBI) en 1964, un gran número de AM han sido desarrollados.11 Recién en 1980 la Food and Drug Administration de los Estados Unidos (FDA) aprobó el AM para proveer soporte circulatorio en pacientes con IC avanzada y en 1984 es implementado el primer AM como puente para trasplante. En 1996, después que un paciente con este dispositivo mejoró su función cardiaca posterior a la explantación del mismo, el concepto de puente a la recuperación se convierte en el objetivo en algunos pacientes.11,12
En 2001, el estudio REMATCH11 mostró que los AM son una alternativa como terapia de destino en la etapa final de la IC en pacientes no elegibles para trasplante. En este estudio, 129 pacientes con IC avanzada fueron asignados aleatoriamente para AM y tratamiento médico óptimo sólo. Los resultados mostraron una reducción de 48% en el riesgo de muerte por cualquier causa en el grupo AM comparado con el grupo tratamiento médico (OR: 0.52, IC 95%: 0.34-0.78; p = 0.001) y supervivencia al año de 52% en el mismo grupo.
Nuevos dispositivos están siendo evaluados en numerosos ensayos clínicos en EEUU y Europa. Aún son necesarios estudios aleatorizados y con mayor número de pacientes para evaluar su eficacia como puente a la recuperación y terapia de destino.
Alternativas de tratamiento
Los AM usualmente están indicados en los pacientes que presentan diagnóstico de insuficiencia cardiaca avanzada refractaria al tratamiento médico convencional y son candidatos a trasplante cardiaco. Debido a la escasez de donantes y al hecho de no ser todos los pacientes candidatos para trasplante, se requiere de otras posibilidades.13 Las indicaciones para implantación de AM a largo plazo son tres: puente al trasplante, puente a la recuperación y terapia de destino (Tabla 1). El uso de los AM como puente a la recuperación del miocardio es más exitoso en pacientes con insuficiencia ventricular tras cirugía cardiaca, miocarditis aguda o infarto de miocardio.14The Harefield Recovery Protocol Study (HARPS) señaló recuperación del miocardio en pacientes con IC severa con el uso de AM. En este estudio, los pacientes presentaban cardiopatía dilatada no isquémica y se asoció el AM con clembuterol (agonista de los receptores β2-adrenérgicos) para prevenir la atrofia del miocardio. Los resultados mostraron que en muchos casos con este tratamiento se logra reducir o posponer la necesidad del trasplante.15,16 El estudio de Dipla y colaboradores,17 mostró que los pacientes con AM mejoraron las propiedades de la contractilidad del miocito y el tiempo pico de contracción.
En pacientes no elegibles para trasplante cardiaco por presión pulmonar y resistencia vascular pulmonar (RVP) altas, se observó que el implante de AM redujo la RVP. Posteriormente los pacientes fueron elegibles para trasplante.18,19
El estudio Intrepid20 evalúo el impacto del soporte inotrópico sobre la supervivencia y la calidad de vida en pacientes no elegibles para trasplante cardiaco. El grupo de pacientes tratados con AM tuvieron mayor supervivencia a los seis meses (46% vs. 22%; p = 0.03) y 12 meses (27% vs. 11%; p = 0.02) respectivamente.
Los resultados del REMATCH11 demostraron una supervivencia de 52% al año de tratamiento en los pacientes con AM.
El rol de los AM como puente para al trasplante cardiaco, está definido. Se requieren nuevos estudios que nos aseguren su eficacia como alternativa en pacientes destinados a tratamiento médico.
Elección al momento del implante
La garantía de resultados exitosos se logra con la adecuada selección de los pacientes y las estrategias oportunas al momento del implante, con base en un programa de AM y un equipo multidisciplinario con el conocimiento acerca del paciente y aspectos específicos de los AM.21
El dispositivo ideal debe tener una vida media útil prolongada y proporcionar un flujo sistémico suficiente para satisfacer las necesidades metabólicas tanto en reposo como durante la actividad física. Debe ser pequeño, inmunológicamente inerte, resistente a las infecciones; con mínimo riesgo de trombosis, sangrado o hemólisis y sin la necesidad de anticoagulación.22
Si bien los AM no han igualado los porcentajes de supervivencia que se logran con el trasplante, son muchos los pacientes que pueden beneficiarse con esta terapia.23
Por esto, la selección adecuada y la optimización en las técnicas son esenciales para obtener los mejores resultados en términos de supervivencia.
El estudio Post- REMATCH24 evaluó los resultados de los AM como alternativa al trasplante cardiaco (terapia de destino), así como los predictores de mortalidad posteriores al implante. Para poder determinar la influencia de una selección adecuada de candidatos a esta terapia sobre los resultados, se seleccionaron 222 pacientes con IC avanzada, a quienes se les implantó AM. La supervivencia al año fue de 56%. Este estudio concluyó que la selección adecuada de los pacientes y el momento de la implantación son esenciales para obtener los mejores resultados.
Complicaciones
Las complicaciones más frecuentes en este proceso son: falla multiorgánica, eventos embólicos, sangrados, infecciones, fallas en los AM y disfunción del ventrículo derecho.23 En muchos casos, la falla en los AM requiere explantación del mismo o su reemplazo.24-26 La frecuencia de eventos embólicos es de entre 2.7% a 48.8%. Las infecciones son frecuentes poco tiempo después del implante, y el riesgo se incrementa con el uso de AM.27
Los AM en el ventrículo izquierdo disminuyen las descargas de arritmias ventriculares sostenidas, pero se ha documentado un aumento de arritmias en el corto plazo.28,29 Durante años, la experiencia estuvo centrada en AM de flujo pulsátil, los cuales demostraron ser eficaces a la espera del trasplante. Entre las limitaciones se encuentran alta incidencia de reoperaciones con cambios de los AM debido a disfunción y las infecciones asociadas.30,31
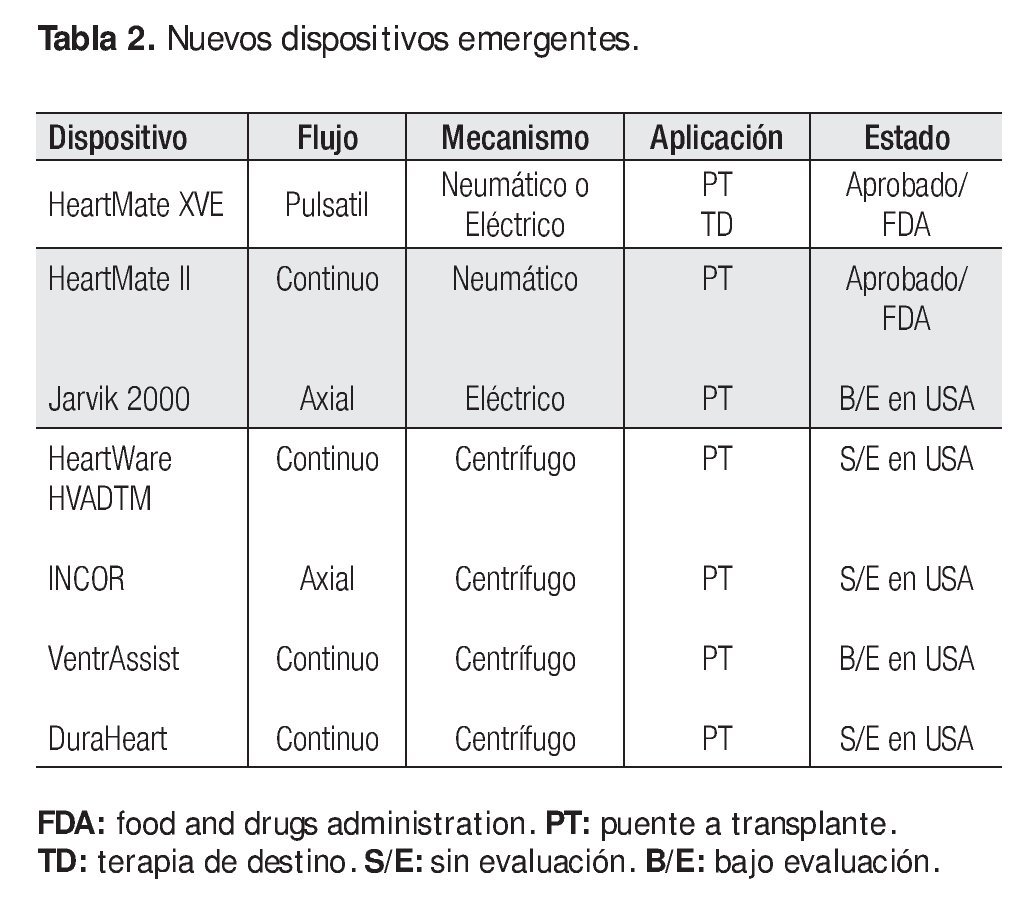
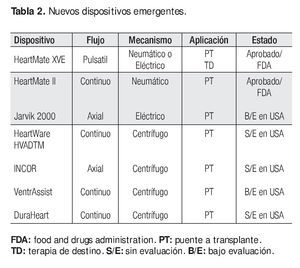
Las nuevas tecnologías, con dispositivos de flujo continuo, permiten una supervivencia igual o mayor;32 son de menor tamaño y las complicaciones relacionadas con procesos infecciosos o fallas mecánicas se presentan en menor número de casos (Tabla 2). 33, 34
Conclusión
En la actualidad, los AM en la IC avanzada constituyen una herramienta eficaz para los pacientes en espera del trasplante cardiaco. Los resultados exitosos y el menor número de complicaciones se relacionan directamente con la selección adecuada de los pacientes, el momento oportuno para su utilización y un equipo entrenado. Si bien la falta de donantes y una espera que muchas veces termina con la muerte del paciente ha sido un problema en el manejo de estos pacientes, los nuevos avances nos permiten tener una mirada más optimista acerca de esta etapa de la enfermedad. A pesar, de ser necesarios mayores estudios aleatorizados que avalen su eficacia como terapia de destino y recuperación del miocardio, esto va a permitir aplicarlo en pacientes no elegibles para trasplante y brindar una mejor calidad de vida a los pacientes.
Correspondencia: Héctor O. Ventura.
Ochsner Heart and Vascular Institute. 1514 Jefferson Highway, Jefferson, LA 70121. USA.
Phone: (504) 842- 3000.
Correo electrónico:hventura@ochsner.org
Recibido el 25 de junio de 2010;
aceptado el 6 de octubre de 2010.