Actualmente las enfermedades cardiovasculares se han convertido en un serio problema para los sistemas de salud de todo el mundo, ya que son la principal causa de muerte y representan una enorme carga económica. Este problema ha sido abordado con diferentes estrategias, entre ellas con la ayuda de terapia celular, aunque sin resultados contundentes.
Durante más de 20 años, se ha utilizado una gran variedad de células madre en diferentes modelos de infarto del miocardio. El uso de células madre cardiacas (CSC) parece ser la mejor opción, pero la inaccesibilidad y la escasez de estas células hacen que su uso sea muy limitado. Además, existe un riesgo elevado pues tienen que obtenerse directamente del corazón del paciente. A diferencia de las CSC, las células madre adultas derivadas de médula ósea o tejido adiposo, entre otras, representan una opción atractiva debido a su fácil accesibilidad y abundancia, pero sobre todo a la probable existencia de progenitores cardiacos entre sus diferentes subpoblaciones.
En esta revisión hacemos un análisis de los marcadores de superficie presentes en CSC en comparación con otras células madre adultas, y sugerimos la preexistencia de células que comparten marcadores de superficie específicos con CSC, la presencia de un inmunofenotipo predecible, aunque en proporciones bajas, pero con un potencial de diferenciación cardiaca similar a las CSC, lo cual podría aumentar su valor terapéutico. Este estudio revela las nuevas perspectivas con respecto a la presencia de dichos marcadores, los cuales comprometerían algunas de estas subpoblaciones a diferenciarse a tejido cardiaco.
It is well-known that cardiovascular diseases are the leading cause of death worldwide, and represent an important economic burden to health systems. In an attempt to solve this problem, stem cell therapy has emerged as a therapeutic option.
Within the last 20 years, a great variety of stem cells have been used in different myocardial infarction models. Up until now, the use of cardiac stem cells (CSCs) has seemed to be the best option, but the inaccessibility and scarcity of these cells make their use unreliable. Additionally, there is a high risk as they have to be obtained directly from the heart of the patient. Unlike CSCs, adult stem cells originating from bone marrow or adipose tissue, among others, appear to be an attractive option due to their easier accessibility and abundance, but particularly due to the probable existence of cardiac progenitors among their different sub-populations.
In this review an analysis is made of the surface markers present in CSCs compared with other adult stem cells. This suggested the pre-existence of cells sharing specific surface markers with CSCs, a predictable immunophenotype present in some cells, although in low proportions, and with a potential of cardiac differentiation that could be similar to CSCs, thus increasing their therapeutic value. This study highlights new perspectives regarding MSCs that would enable some of these sub-populations to be differentiated at cardiac tissue level.
De acuerdo a la Organización Mundial de la Salud, la causa principal de mortalidad a nivel mundial corresponde a las enfermedades cardiovasculares (ECV), las cuales son clasificadas como enfermedades no transmisibles que incluyen: enfermedades coronarias (infartos del miocardio), enfermedades cerebrovasculares (ataques fulminantes), presión sanguínea elevada (hipertensión arterial), enfermedades arteriales periféricas, enfermedades reumáticas del corazón, enfermedades congénitas del corazón y falla cardiaca. Se cree que las principales causas de las ECV se deben al tabaquismo, inactividad física, ingesta de dietas no saludables y al abuso en el consumo de alcohol1.
Dentro de las ECV sobresalen las enfermedades isquémicas del corazón, las cuales representan más de la mitad de decesos entre las ECV1-3, causando un serio problema de salud pública que a futuro podría colapsar las finanzas de las instituciones que administran el sector salud.
La isquemia cardiacaLas enfermedades isquémicas son causadas por una descompensación patológica entre el suplemento y la demanda de oxígeno en el ventrículo izquierdo4; en la mayoría de los casos es provocada por la disminución de la luz arterial a consecuencia de una obstrucción por coágulos o ateromas que bloquean el flujo normal de sangre que irriga el corazón.
Un par de eventos relevantes que alteran el suplemento de oxígeno al miocardio son la isquemia y la hipoxia5. En algunos casos la falta de oxígeno resulta ser una consecuencia secundaria, la cual se debe al decremento en el flujo sanguíneo y en otras al incremento en la demanda de oxígeno que es el principal causante de la isquemia del miocardio6. Así, se afirma que las enfermedades más comúnmente desarrolladas a partir de un evento isquémico derivan en aterosclerosis obstructiva o estenótica de la arteria coronaria4.
Durante el proceso de infarto del miocardio se presentan una serie de eventos, en la zona infartada, que conllevan cambios estructurales y constitutivos: los llamados procesos de remodelación7. La remodelación cardiaca genera el adelgazamiento de la pared del ventrículo izquierdo debido a la proteólisis de la matriz extracelular (MEC)8. La pérdida del balance en la MEC afecta el funcionamiento del corazón creando dilatación en la cámara ventricular y disfunción contráctil. Posteriormente, se da un incremento en la producción de MEC con la formación subsecuente de una cicatriz de colágeno en la zona infartada y fibrosis intersticial en la zona no infartada. La fibrosis intersticial incrementa la rigidez tisular y, a la par, conduce a un decremento en la capacidad de contracción y de supervivencia de los cardiomiocitos, ocasionando un incremento en el riesgo de las arritmias8. La respuesta neoangiogénica posterior al infarto es insuficiente y prácticamente inexistente para proveer la perfusión cardiaca adecuada y atender la demanda de la pared hipertrófica que, a su vez, lleva a la pérdida de cardiomiocitos y la formación de tejido fibroso9.
Opciones para el tratamiento del infarto agudo del miocardioTras un infarto agudo del miocardio, la primera opción a la que se recurre, y mayormente aceptada, es el tratamiento para la revascularización mediante angioplastia primaria y la colocación de un stent coronario que debe realizarse dentro de las primeras 12h a partir del inicio de los síntomas10,11. Otra opción es dar al paciente un tratamiento a base de fibrinolíticos, aunque con menor eficiencia, ya que en poco menos del 50% del total de los casos se da una mejoría12, por lo cual también se requiere al mismo tiempo administrar antiagregantes plaquetarios, inhibidores de glicoproteínas IIb/IIIa y anticoagulantes, causando efectos secundarios pues la administración de esta mezcla de fármacos incrementa el riesgo de presentar hemorragias, que en algunas ocasiones tiene consecuencias fatales o graves13. Para disminuir la tasa de mortalidad en pacientes infartados, se ha sugerido emplear inhibidores de la enzima convertidora de angiotensina después del segundo o tercer día postinfarto, sin importar si hubiese existido o no disfunción ventricular.
Para evitar el curso hacia la necrosis que sigue el tejido infartado, existen diversas estrategias. La más común es que durante la atención intrahospitalaria se administren betabloqueadores que reducen la demanda de oxígeno, previenen arritmias e inhiben la toxicidad directa de las catecolaminas. De igual forma, se recomienda la administración de estatinas previamente al egreso hospitalario para impedir futuros episodios de síndrome isquémico coronario agudo13. Aun cuando diferentes reportes enfatizan una mejoría en la calidad de vida de los pacientes tratados por nuevos fármacos y/o dispositivos innovadores, no necesariamente estos han ayudado a abatir de manera significativa la reducción de la tasa de morbimortalidad14.
Si el daño al miocardio es muy grave, la única opción posible consiste en el trasplante de corazón, a pesar de ser esta la opción más excluyente de todas ya que para ser candidato y acceder al trasplante se requiere cubrir una serie de requisitos que son sumamente estrictos, además de ser un procedimiento costoso e invasivo aunado a la limitada disponibilidad de órganos trasplantables15. Incluso cuando se considera el trasplante como la opción preferencial, el paciente tiene que lidiar con el caso adverso al rechazo15,16. Aunque para prevenir el rechazo del órgano se administren inmunosupresores, el esquema de fármacos que inmunodeprimen al individuo puede traer como consecuencia el riesgo de desarrollar enfermedades recurrentes, ECV y/o cáncer, lo que aumenta la tasa de morbimortalidad17.
Desafortunadamente, los tratamientos actuales no han sido diseñados para mejorar la función cardiaca cuando el paciente se atiende tardíamente y tampoco han sido creados para prevenir la remodelación cardiaca que ocurre durante los procesos de cicatrización después del infarto del miocardio; mucho menos, parece haber opciones que pudieran revertir la remodelación una vez instalada. Aunque el trasplante exitoso de corazón es la solución, la búsqueda por encontrar una alternativa terapéutica para el tratamiento de las ECV continúa, especialmente para el infarto del miocardio.
Medicina regenerativa y terapia celularSi bien muchos tejidos tienen una capacidad de regeneración muy restringida, esta suele ser prácticamente nula en aquellos tejidos que han sufrido heridas o daños físicamente extensos, prácticamente irreversibles para ser reparados por autorregeneración tisular18. En adición a la pobre capacidad regenerativa, las heridas en ciertos órganos específicos provocan dolor intenso y/o discapacidad. Incluso la intervención quirúrgica del órgano afectado para restaurar su función es limitada, y la respuesta al proceso de sanación tiene que ver más con el favorecimiento de procesos de cicatrización en lugar de regeneración19. Sin embargo, en algunos pacientes, debido al porcentaje tan alto de daño que involucra el tejido, puede comprometer la función sistémica20 sin dejar más opciones: la única solución es el trasplante.
Ante este escenario, y como respuesta a la problemática sanitaria que representa el trasplante de órganos, surge la medicina regenerativa, la cual se considera un campo interdisciplinario donde tienen cabida la medicina, la biología celular, la ingeniería genética y la ingeniería biomédica para desarrollar estrategias seguras y accesibles para el tratamiento de diversas enfermedades mediante el uso de células y/o sus productos. La medicina regenerativa trata de integrar los conocimientos de procesos de señalización y control celular involucrados en la capacidad que tienen algunas células para proliferar e inducir la regeneración de tejidos dañados y para mejorar o restablecer su funcionamiento. Esto puede ser de manera directa o a través de sus efectos paracrinos mediante los cuales se estimulan las células residentes del tejido u órgano donde son trasplantadas o insertándolas previamente en materiales biocompatibles para realizar injertos21. De tal manera que estas opciones que la medicina regenerativa nos ofrece denotan un interés exacerbado por el desarrollo de nuevos materiales, la ingeniería de tejidos y la terapia celular.
La terapia celular está incluida dentro de las estrategias de la medicina regenerativa y, como tal, ha sido la más explorada. La terapia celular toma ventaja del potencial de diferenciación que presentan ciertas estirpes celulares para convertirse en células de diferentes tejidos22. En gran medida, la terapia celular converge con la ingeniería de tejidos en el enfoque de implantación dentro del órgano afectado, esto que en principio fue la visión inicial y clásica de la medicina regenerativa. Sin embargo, recientemente se ha puesto mucha atención en los llamados efectos paracrinos, donde el tejido dañado in situ responde a la acción de diferentes moléculas con actividad biológica que son producidas y liberadas por las células y/o tejido trasplantado, o simplemente responden a la administración de elementos y productos celulares, tales como citocinas, quimiocinas y/o factores de crecimiento23-25.
Independientemente del potencial de integración que pudieran tener las células trasplantadas al tejido dañado, resulta muy factible que los efectos paracrinos, probablemente inducidos por las células injertadas, ayuden a estimular procesos de regeneración de órganos afectados, de tal forma que órganos y/o tejidos terminalmente diferenciados pudieran hacer uso de esta estrategia en caso de requerir una reparación profunda para recuperar su función19.
En el caso particular del corazón, hasta hace poco tiempo se tenía el concepto de que este órgano era incapaz de regenerarse cuando sufría fuertes estragos a nivel de tejido cardiaco y vascular a raíz de un infarto, debido a la pobre capacidad de los cardiomicitos para proliferar26; recientemente, se ha desafiado este concepto de considerar al corazón como un órgano posmitótico; es decir, un órgano terminalmente diferenciado incapaz de sustentar la reparación de sí mismo. No fue sino hasta finales de la última década del sigloXX cuando se abordó un escenario interesante en contraposición a dicha diferenciación terminal27. En el 2001 se publicó un artículo innovador28 pero, al mismo tiempo, controversial e inquietante29,30, que puso en tela de juicio el paradigma que consideraba al corazón como un órgano posmitótico pues con ello se demostró la existencia de células cardiacas (progenitoras) con potencial regenerativo y de diferenciación. A partir de entonces, la regeneración cardiaca por medio de la terapia celular no ha sido una mera especulación; al contrario, durante la última década se ha conseguido un gran avance en el interés de la aplicación de este tipo de estrategias, tanto en investigación básica como en modelos animales y su traslación a ensayos clínicos31. No obstante, la promesa inicial de la terapia celular aún no se ha cumplido.
En esta trabajo nos enfocamos a revisar algunos de los tipos celulares empleados en diferentes protocolos que han tenido como objetivo restablecer la función cardiaca, principalmente nos enfocamos en aquellas células que derivan de la médula ósea, de entre ellas: aquellas subpoblaciones que por compartir marcadores de superficie en común se cree que pueden derivar de un progenitor de tipo mesenquimal común y a pesar de ello han sido llamadas de diferentes maneras32.
Terapia celular como alternativa de tratamiento para el infarto del miocardioHoy en día sabemos que existe una amplia gama de posibilidades en el uso de diferentes estirpes celulares que puede cubrir los requisitos que la terapia celular demanda. Estas estirpes las podemos clasificar en dos grandes grupos: células madre embrionarias y células madre adultas; como caso particular tenemos las células madre inducidas pluripotentes (iPSCs).
Podemos decir que el término de células madre comprende todas aquellas células que poseen dos propiedades fundamentales:
- 1.
Autorrenovación, que hace referencia a la capacidad que tienen para proliferar en numerosas ocasiones y al mismo tiempo las hace permanecer en un estado indiferenciado.
- 2.
Potencialidad, característica intrínseca que les permite diferenciarse en células especializadas de diferentes tejidos. Curiosamente, estos conceptos fueron concebidos desde 1960 cuando se estudiaban los componentes responsables de la regeneración de eritrocitos33.
En el caso particular de la terapia celular cardiaca, se han empleado células que provienen de diferentes fuentes, tanto de células madre embrionarias, iPCs y células madre adultas, o células diferenciadas como cardiocitos y mioblastos. Lo cierto es que hasta hoy en día el grupo que más ha sido explorado es el grupo de células adultas aisladas de diferentes fuentes, incluyendo aquellas de origen somático con capacidad para ser reprogramadas15. De las células madre adultas, las más empleadas y estudiadas en diferentes protocolos son las células madre derivadas de médula ósea prácticamente en toda su gama de subpoblaciones, pero particularmente se ha puesto mucho énfasis en las células madre mesenquimales (MSC)34, incluso en aquellas MSC de diferente origen como las que derivan del tejido adiposo que es una fuente rica para su obtención. A pesar de que todas ellas han sido probadas en diferentes modelos animales y en algunos ensayos clínicos, hasta ahora ha resultado difícil localizar la población terapéutica ideal31,35. Por lo tanto, el mayor reto para la medicina regenerativa cardiaca sigue siendo identificar el tipo de célula más adecuada que permita repoblar el tejido dañado con nuevos cardiomiocitos y vasos sanguíneos que ayuden a reestablecer el suministro de oxígeno y nutrientes a las áreas afectadas. En esta ardua búsqueda, algunas poblaciones celulares más que otras comienzan a ganar terreno, ya sea por su potencial o por su compromiso derivado del nicho en el cual son alojadas36. Es así que en términos de potencial de diferenciación hacia el tejido cardiaco, el uso de células madre cardiacas (CSC) parece ser la mejor opción37, ya que su residencia en el corazón del adulto les confiere un compromiso específico para generar tejido vascular y miocárdico27,38.
Tipos celulares usados en la terapia celular cardiacaCélulas madre pluripotentesLas células madre pluripotentes son una estirpe celular que, en teoría, puede diferenciarse en cualquier tipo celular. Las células pluripotentes se dividen en dos grupos: inducidas (iPSCs) y embrionarias (ESC). Las primeras (iPSCs) consisten en reprogramar células adultas in vitro a través de transducción con vectores virales que transportan los factores de transcripción Sox2, Oct3/4, Klf4 y c-Myc que confieren pluripotencialidad al cultivo39 o por medio de la transfección con micro RNAs (miRNAs) específicos40. Las iPSCs se pueden generar a partir de una gran variedad de células, siendo el método más común a partir del cultivo de fibroblastos, sin embargo, existen varias cuestiones pendientes en torno a la seguridad para emplear las iPSCs en cualquier terapia celular por el riesgo de generar tumores41. Otro inconveniente es que no hay un control exacto para conducir su proliferación hacia la población deseada una vez implantadas in situ, y los protocolos existentes han demostrado una baja eficiencia en su capacidad de diferenciación hacia cardiomiocitos27.
Con respecto a las ESC, son la clase de células ideales debido a su amplio margen de diferenciación: no menos de 200 líneas celulares diferenciadas se han logrado diferenciar con ellas42-44. Algunos ensayos que han utilizado estas células demuestran una buena integración e interacción en el tejido cardiaco45, sin embargo, presentan los mismos riesgos que las iPSCs27, además de que la baja disponibilidad y los problemas éticos inherentes a su manipulación son impedimentos para usarlas.
Cardiomicitos inducidos (iCM) por reprogramación celularLa influencia del uso de factores de transcripción para generar iPCs dio pauta de igual manera a utilizar fibroblastos y reprogramarlos para inducir su transdiferenciación a cardiomicitos (iCMs)46 mediante la transducción con factores de transcripción específicos cardiacos (GATA4, Tbx5 y MEF2c)47 mejorando su eficiencia cuando se utilizan con diferentes niveles de expresión48. Otras estrategias de reprogramación celular han sido reportadas con el uso de pequeñas moléculas de RNA no codificable llamados miRNAs, principalmente los miRNA-1, -133, -208, y -499, que al ser inyectados en fibroblastos estos son transdiferenciados a cardiocitos49. No solo la acción de estas moléculas de origen biológico que regulan la expresión de genes involucrados en la diferenciación cardiaca ha sido usada para lograr la reprogramación cardiaca, pues existen protocolos que prescinden del uso de estos factores de transcripción o miRNAs y en su lugar utilizan pequeñas moléculas50 o algunas sustancias químicas como la 5-azacitidina o tricostatina que a través de procesos de metilación o desmetilación de histonas en ADN logran reprogramar MSC a cardiomicitos51. La ventaja de la reprogramación celular directa a iCMs es que, a diferencia de las iPCs, el riesgo de tumorigenicidad es menor después de ser trasplantados, pero su desventaja es que su eficiencia para generar cardiocitos es muy baja, lo que impide su producción a gran escala.
Células madre adultasMiocitosLos primeros ensayos de regeneración celular cardiaca comenzaron empleando progenitores celulares de origen muscular52. Aun cuando existen reportes con resultados alentadores, el riesgo de desarrollar arritmias fue muy elevado53,54. En estudios posteriores se lograron identificar algunas subpoblaciones celulares procedentes de músculo esquelético con mayor tendencia a diferenciarse a cardiocitos, estas células fueron llamadas mioendoteliales. A pesar de presentar un compromiso hacia la diferenciación cardiaca, esta subpoblación tampoco evitó el riesgo de generar arritmias. Las repuestas a estas arritmias parecían estar en la falta de expresión de conexina 43, y la carencia de uniones tipo gap con los miocardiocitos circundantes del injerto54; sin embargo, corregirla usando progenitores de mioblastos que sobreexpresan conexina 43 tampoco fue garantía de reversión de los efectos pro-arritmogénicos55, pues parece ser que el mecanismo es mucho más complicado.
Células madre derivadas de médula óseaCélulas madre hematopoyéticasLas células madre/progenitoras hematopoyéticas (CMH) están constituidas por diversas poblaciones celulares que de manera sencilla se pueden obtener a partir de sangre periférica que, por mucho, es considerado uno de los métodos menos invasivos para la obtención de células madre, aunque también muchas de estas poblaciones se encuentran de manera abundante dentro de la médula ósea y en sangre proveniente del cordón umbilical56,57. La principal ventaja que ofrece este tipo celular es su forma de obtención para realizar trasplantes de manera autóloga y, por lo tanto, la ausencia de rechazo inmunológico; en contraparte, las células sanguíneas de cordón umbilical poseen un mayor potencial de proliferación pero son altamente inmunogénicas58. Otra desventaja es que cuando son aisladas de médula ósea a partir de pacientes de edad avanzada se reduce la eficiencia del trasplante, lo que no sucede con las células sanguíneas del cordón umbilical y les confiere ventaja para su uso59,60.
Las CMH aisladas a partir de médula ósea son las mejor caracterizadas y ampliamente usadas. Históricamente hablando, fueron de las primeras utilizadas para reemplazo terapéutico de médula ósea en enfermedades hematológicas61,62. Dichas células dan origen a los linajes mieloides y linfoides63 con la expresión típica de marcadores de superficie celular como son CD34+ y CD45+, entre otros. Aunque actualmente hay un interés creciente en el uso de este tipo celular, su forma de expansión y cultivo en suspensión se convierten en una desventaja al momento de ser trasplantadas, por lo tanto queda por definir si en realidad la terapia celular basada en su administración presenta mayores ventajas64.
Células endotelialesLas células progenitoras endoteliales (CPE) pueden ser encontradas en sangre periférica y su origen está dentro de la médula; se diferencian a partir de un progenitor mieloide; se caracterizan por la presencia de ciertos marcadores como CD34, CD133 y receptor del factor de crecimiento endotelial vascular65,66. Las células CD133+CD34+podrían jugar un papel fundamental, al expresar diferencialmente miRNAs que previenen la apoptosis, la remodelación del citoesqueleto y promueven la diferenciación67. Hoy en día existe consenso para definir los marcadores de superficie que expresan las CPE: CD31, CD34, CD45, AC133, CD14, CD14a y CD235a68,69, pero también una de las principales características a considerar, para su aislamiento, es su habilidad de crecer en cultivo e indiscutiblemente diferenciarse en célula endotelial. Se cree que la expresión diferencial de CD34+ y/o CD133+puede ser originada por una mezcla de poblaciones celulares que podrían proveer factores paracrinos más efectivos y, al mismo tiempo, dar un mejor estímulo para la neovascularización que células mononucleares provenientes de médula ósea64.
Células estromales mesenquimalesAunque existe un amplio conocimiento de los marcadores que expresan diversas estirpes celulares de origen mesenquimal, los resultados sobre la expresión de algunos de ellos para su clasificación siguen siendo controversiales70. Pese a ello existe un consenso sobre los marcadores mínimos que deberían presentar para considerarse como tal.
Sabemos que la médula ósea es la principal fuente de células madre adultas puesto que almacena diversos tipos de subpoblaciones y que muchas de ellas han sido las mejor caracterizadas64, como es el caso de las MSC. Estas células son excelentes candidatos para terapia celular a causa de su baja inmunogenicidad, facilidad de acceso, amplia diferenciación y efectos inmunomoduladores. Debido a la gran cantidad de células presentes en la médula ósea, muchos investigadores han descrito una amplia colección de subpoblaciones con propiedades parecidas o con rasgos comunes a las MSC, ejemplos son: por sus siglas en inglés, células progenitoras adultas multipotentes (MAPC)71, células madre multipotentes adultas (MASC)72,73, células madre somáticas sin restricciones (USSCs)74, células adultas multilinaje aisladas de médula ósea (MIAMI)75, células madre de diferenciación a multilinaje que soportan el estrés (Muse)76, células de población lateral (SP)77, células embrionarias muy pequeñas (VSEL)78, células CD34+, Lin-C-kit+, células Sca1+79, entre otras.
Es interesante señalar que muchos de los marcadores de superficie celular encontrados en estas células se comparten o se superponen entre ellas mismas y las células de tipo mesenquimal, también procedentes de la médula ósea, lo que sugiere que muchas de estas subpoblaciones pueden surgir de un progenitor común80 todavía no identificado.
A partir del total de las células estromales es posible aislar células MSC ya sea de médula ósea o de la fracción vascular estromal (FVE) en caso de provenir de tejido adiposo; pero en ambos casos estas células poseen múltiples capacidades de diferenciación hacia condrocitos, adipocitos, osteocitos, células estromales que soportan la hematopoyesis, células endoteliales, fibroblastos, mioblastos, entre otras27,64,81.
Los ensayos clínicos, y los protocolos de investigación básica que tienen que ver con terapia celular, han sido dramáticamente influenciados por los primeros ensayos efectuados en los que se emplearon MSC27, de tal modo que, hasta hoy, la administración de MSC junto con la administración de médula ósea total son las terapias que han tenido los mejores resultados en los ensayos clínicos evaluados en diferentes enfermedades, incluidas las ECV62 pues metaanálisis de los ensayos demuestra la seguridad y mejora temporal en la fracción de eyección del ventrículo izquierdo53,82.
Aunado a la abundancia relativa que representa esta población celular dentro de la médula ósea64, y a pesar de que los cálculos sugieren que estas células representan entre el 0.001-0.01% del total de las células nucleadas presentes en médula ósea7, para ser identificadas y consideradas como MSC los marcadores mínimos que deben expresar son CD44+, CD73+, CD90+ y CD105+, y negativos para marcadores hematopoyéticos CD34– y CD45–, marcadores de células endoteliales CD31–, y para macrófagos CD11b83, pero además deben cumplir con otros dos requisitos, mostrar capacidad de adherencia a las placas de cultivo celular y mostrar potencial de diferenciación al menos a tres tipos celulares: osteocitos, adipocitos y condrocitos64.
Como se ha mencionado, las MSC también pueden ser encontradas en tejido adiposo, el cual se considera una fuente de gran abundancia de MSC84,85. En principio se esperaría que el comportamiento de las células aisladas sea similar, ya que expresan los mismos marcadores de superficie con pequeñas diferencias en el porcentaje de algunos de ellos7. Quizá la ventaja superior de aislar MSC a partir de tejido adiposo es su rendimiento en términos de concentración puesto que representan el 2% del total de las células nucleadas70, que puede significar un incremento de 200-300 veces en comparación con las MSC aisladas a partir de médula ósea86.
En busca de la mejor opción en terapia celularCélulas madre cardiacas y progenitores cardiacosUn gran número de estrategias de terapia celular con diferentes linajes celulares ha sido empleado para regeneración de tejido cardiaco19,45. Sin embargo, en términos del potencial de diferenciación, el uso de CSC parece ser la mejor opción, ya que son células no diferenciadas pero comprometidas que residen en el tejido cardiaco adulto36.
En la última década se ha realizado una búsqueda exhaustiva para ubicar, caracterizar y aislar células CSC45, pero también se ha logrado diseñar estrategias para potenciar los mecanismos endógenos de reparación del miocardio a partir de su estimulación in situ87. Dentro de esta ardua búsqueda por identificar los mejores progenitores cardiacos (PC) derivados propiamente del corazón (CSC), se han encontrado células de dos tipos: las cardiomiogénicas y las vasculogénicas88. También se ha logrado identificar algunos de los marcadores de estos progenitores que condicionan la diferenciación, como son los marcadores c-kit, Sca-1, Isl-1 y Abcg2, que fueron obtenidos al purificar cardiomiocitos aislados de corazones de roedores22,24,89-92.
En uno de los primeros ensayos clínicos en el que se administraron PC c-kit+, al mismo tiempo, durante una cirugía de injerto de bypass en la arteria coronaria se tomó una biopsia del apéndice de la aurícula derecha con el fin de aislar, enriquecer y proliferar PC c-kit+93 para su trasplante en la zona infartada. Después de este procedimiento se observó que se requiere de un protocolo riesgoso, costoso e invasivo para poder aislarlas, además de que las células c-kit+ se presentan en una proporción celular baja de 1:30,00094. Otra desventaja es que se requiere de tiempo relativamente largo para aislar, proliferar, seleccionar, enriquecer y trasplantar el mayor número de células al tejido infartado (en este caso fueron administradas 4 meses después de la cirugía)93, lo cual es una ironía pues en casos de daño extremo al miocardio el tiempo es un factor determinante; al no poder acceder a las PC esto pudiera terminar en detrimento del paciente, pero finalmente los resultados iniciales de estos ensayos clínicos delinean una mejora en la fracción de eyección del ventrículo izquierdo y una reducción en el tamaño del infarto93. Debido a los inconvenientes que representa el uso de este tipo celular, nuevos esfuerzos se han enfocado en la búsqueda de una mejor estrategia para conseguir PC de una fuente alterna que pueda cubrir estas necesidades. Una estrategia derivada a consecuencia de su escasez en el corazón adulto y el alto riesgo que implica obtenerlas ha derivado en fusionarlas con MSC que tienen una alta capacidad proliferativa, para formar híbridos y aumentar la reparación cardiaca95.
Los recientes avances en CSC describen una nueva población de células cardiacas madre residentes (CRSC) que son positivas para el antígeno W8B2+ y se obtuvieron del anexo auricular de humanos adultos. El trasplante intramiocárdico de W8B2+ humana CRSC, en ratas inmunodeprimidas, una semana después del infarto del miocardio, mejoró marcadamente la función cardiaca y redujo el tejido fibroso 4 semanas después del infarto. Además, el medio condicionado de estas células mostró efectos de pro-supervivencia, pro-angiogénesis, y pro-migración sobre células endoteliales y sobre la proliferación de cardiomiocitos de rata neonatal96.
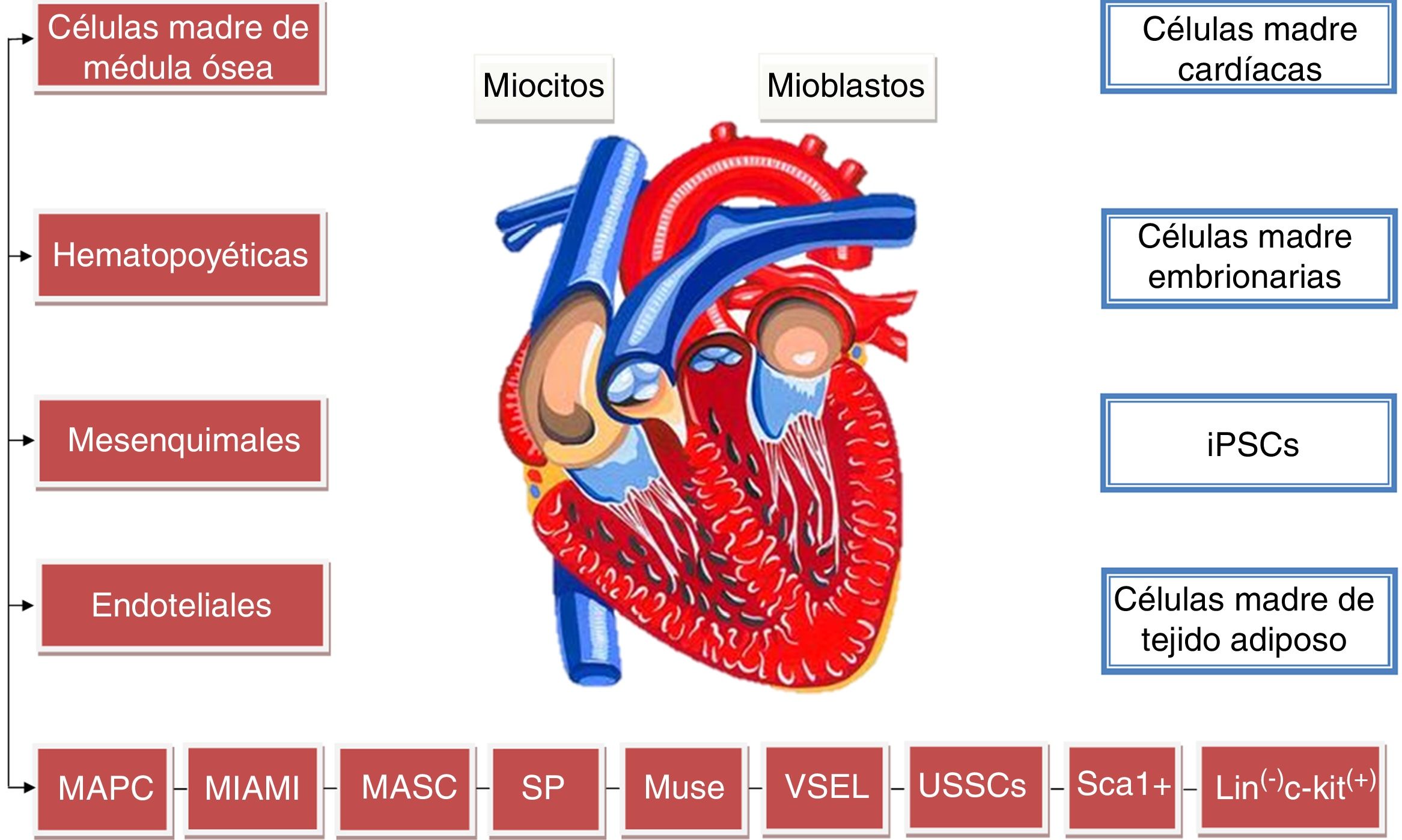
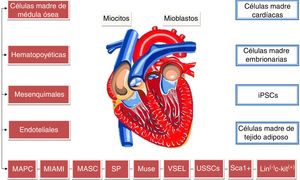
La figura 1 muestra un resumen de los principales tipos celulares que han sido utilizados para restablecer la función cardiaca en corazones infartados.
Principales tipos celulares que a la fecha han sido utilizados y que han mostrado una mejoría al evaluar la función cardiaca en corazones infartados. Muchas de estas células derivan principalmente de subpoblaciones de médula ósea todas ellas (fondo rojo) originadas posiblemente de un mismo progenitor.
iPSCs: células madre inducidas pluripotentes; Lin-c-kit+: células linaje negativo c-kit positivas; MAPC: células progenitoras adultas multipotentes; MASC: células madre multipotentes adultas; MIAMI: células adultas multilinaje aisladas de médula ósea; Muse: células madre de diferenciación a multilinaje que soportan el estrés; Sca1+: células Sca1 positivas; SP: células de población lateral; USSCs: células madre somáticas sin restricciones; VSEL: células embrionarias muy pequeñas.
Siendo una forma de identificar y caracterizar el potencial de diferenciación de una célula mediante la presencia o ausencia de marcadores de superficie, resulta interesante descubrir que muchos de los marcadores expresados en los progenitores cardiacos son marcadores compartidos o que también están presentes en las MSC, pues ya se ha demostrado la presencia de marcadores de MSC en PC97-99, así como también la expresión de marcadores cardiacos específicos en MSC100; lo cual resulta de mucho interés debido a que las MSC pueden generar la aparición espontánea de cardiomiocitos, apoyando así la idea de preexistencia de progenitores cardiacos en nichos diferentes al cardiaco101-103. Por lo tanto, sería prioritario poder identificar la existencia de un inmunofenotipo similar al de los PC en otros tejidos con base en la presencia de marcadores compartidos.
Con base en lo expuesto anteriormente, y analizando la expresión de diversos marcadores de superficie celular, previamente reportados en diversas estirpes celulares cuyo potencial de diferenciación cardiaco ha sido evaluado, sugerimos la preexistencia, aunque en proporciones bajas, de subpoblaciones celulares dentro de la médula ósea comprometidas a diferenciarse hacia tejido cardiaco, que comparten marcadores de superficie específicos con CSC. Proponemos la existencia de un posible inmunofenotipo predecible presente principalmente en algunas MSC que podría proporcionar un potencial de diferenciación cardiaca similar a CSC, lo que podría aumentar el valor terapéutico de las MSC.
La tabla 1 muestra un análisis de los principales marcadores entre diversas células que han mostrado tener capacidad de diferenciación cardiaca y propone la posible existencia de un inmunofenotipo previsible basado en marcadores compartidos que estaría presente en algunas de las tantas poblaciones celulares que constituyen la médula ósea.
Marcadores compartidos entre diferentes estirpes progenitoras celulares. Se muestran aquellos marcadores que comparten cada una de las células progenitoras
| Marcadores | CSC | HSC | MSC | AdSC |
|---|---|---|---|---|
| CD31+ | √ | √ | ||
| CD 34+ | √ | √ | ||
| CD 90+ | √ | √ | √ | |
| CD 105+ | √ | √ | √ | |
| CD133+ | √ | √ | ||
| c-Kit+ | √ | |||
| Mdr | √ | |||
| Islet | √ | |||
| CD44+ | √ | |||
| Sca1+ | √ | |||
| CD45+ | √ | |||
| CD166+ | √ | |||
| CD44+ | √ | |||
| CD106+ | √ | √ | ||
| Stro1+ | √ | √ | ||
| CD45– | √ | √ | ||
| CD 34– | √ | √ | ||
| CD119– | √ | |||
| CD 79– | √ | |||
| CD 14– | √ | |||
| CD 11B | √ | |||
| CD19– | √ | |||
| CD49+ | √ | |||
| CD44+ | √ | |||
| CD116+ | √ |
Si se lograra enriquecer una población de MSC con marcadores de superficie compartidos con las células progenitoras cardiacas o PC, ¿podrían estas células tener mejores resultados en los procesos de regeneración del miocardio en un corazón infartado que cualquier otra subpoblación no purificada? De ser así, entonces, se podrían superar los principales obstáculos que son de alto riesgo y limitan la obtención de muestras de corazón para la extracción de PC autólogos: invasividad y accesibilidad, lo cual limita su uso como una fuente de células estandarizada para la regeneración cardiaca, a diferencia de las MSC cuyas fuentes celulares son de fácil acceso. Por ello, la identificación de subpoblaciones celulares o de progenitores cardiacos en MSC podría ser más benéfica como alternativa que si se trasplantaran MSC no comprometidas, los cuales podrían sufrir una diferenciación anticipada hacia otro tipo celular no deseado.
Hasta hoy no existe consenso sobre los marcadores que deben estar presentes en las CSC; sin embargo, los que han sido propuestos hasta el momento aparecen en la tabla 2 donde también se muestra la función descrita para cada uno de ellos.
Marcadores propuestos para identificar células madre cardiacas y su función
| Marcador | Función |
|---|---|
| CD31+ | También conocido como molécula de adhesión plaqueta-endotelial (PECAM-1), es un receptor hemofílico transmembranal que se expresa en células endoteliales (EC), plaquetas, granulocitos, macrófagos, células dendríticas (DC), células B, T y células natural killer (NK)106. Aunque CD31 fue clasificado inicialmente como una molécula de adhesión celular, estudios posteriores sugirieron que CD31 activa la señalización inhibidora río abajo tras el acoplamiento transhemofílico CD31 durante la interacción célula-célula. CD31 participa de señalización en la regulación de la separación de leucocitos, la activación de células T, la activación de plaquetas, y la angiogénesis, todos los cuales son críticos para la patogénesis de la aterosclerosis y los aneurismas aórticos abdominales107 |
| CD 34+ | Es una glicoproteína transmembranal, identificada inicialmente en las células madre y progenitoras hematopoyéticas. Su función como un antígeno de superficie es desconocida, se ha relacionado con la inhibición o la facilitación de la adhesión, la proliferación celular, y la regulación de la diferenciación108 |
| CD 90+ | CD90 también se conoce como antígeno de diferenciación de timocitosI (Thy-1), es una glicoproteína anclada a la superficie celular a través de un motivo de glicosilfosfatidilinositol (GPI). En los seres humanos, CD90 se expresa en las células madre, incluyendo MSC, HSC y las células madre queratinocíticas (KSCS) y en diferentes niveles en los tejidos no linfoides tales como fibroblastos, neuronas y células endoteliales activadas. CD90 juega un papel importante en la adhesión célula-célula y entre mediadores de la inflamación de la respuesta inmune célula-matriz. CD90 interviene en la inflamación y la cicatrización de heridas por la síntesis y la liberación de factores de crecimiento, citocinas y componentes de la matriz extracelular para ayudar en la reparación de tejidos dañados109 |
| CD 105+ | También conocido como endoglina es una glicoproteína transmembranal homodimérica unida por un puente disulfuro inducible por hipoxia. Es un correceptor accesorio para factor de crecimiento transformante beta (TGF-β), una citocina pleiotrópica que regula la proliferación celular, la diferenciación, la migración, la adhesión y se ha demostrado que se expresa en las células endoteliales110 |
| CD133+ | Prominina-1 o CD133 se identificó en las células madre hematopoyéticas humanas y las células neuroepiteliales de ratón; muchos estudios han puesto de manifiesto que la expresión de CD133 se asocia con células madre/progenitoras, tumores, regeneración, diferenciación y el metabolismo. Se emplea como un marcador de células madre en tejidos normales y cancerosos. Aunque la función fisiológica de esta glicoproteína de membrana conservada evolutivamente sigue siendo difícil de dilucidar, varios estudios han revelado nuevas características biológicas con respecto a las células madre111 |
| CD117 | El receptor de c-kit (CD117) es una proteína transmembranal con actividad de tirosina-cinasa codificada por el pro-oncogén c-kit. Los tipos de células c-kit dependientes incluyen células hematopoyéticas, células germinales, mastocitos, células de melanoma y las células de Cajal del tracto gastrointestinal. El ligando para c-kit es el factor de células madre (SCF). La unión específica de SCF puede inducir la dimerización homóloga, y las unidades de la vía de transducción de señales río abajo, que posteriormente regula la expresión génica, el crecimiento celular, la proliferación y la diferenciación112 |
| Sca1+ | El antígeno-1 de células madre (Sca-1) es una proteína de superficie celular con un glicosilfosfatidilinositol anclado (GPI-AP) de la familia de genes Ly6113 con propiedades de señalización y adhesión celular; está localizado en la superficie de las células madre específicas de tejido hematopoyético. Sca-1 es miembro de una familia de proteínas que contienen un dominio reportero activador de plasminógeno uroquinasa (uPAR), que participan en la adhesión y migración celular a través de la vía de las integrinas y la degradación de la matriz extracelular, respectivamente, además de participar en la señalización para la diferenciación celular114 |
| ISLET1+ | Llamada proteína potenciadora del gen de insulina o ISL-1, como su nombre lo indica esta proteína se une al promotor del gen de insulina, y otros, teniendo un papel importante en la regulación de la expresión de este gen115. Es importante para el desarrollo de linajes de células pancreáticas y también es necesaria para la generación de neuronas motoras. Mutaciones en este gen se han asociado con la madurez de inicio de la diabetes de los jóvenes. Entre sus vías relacionadas se encuentran transporte a Golgi y posterior modificación y diferenciación como progenitor cardiaco116 |
| MDR1 | El gen de multirresistencia a fármacos o ABCB1 se expresa de manera polarizada en la membrana plasmática celular con función excretora y protectora. Tiene un papel importante en la eliminación de fármacos en el primer paso a través de administración oral. En la corteza adrenal juega un rol en transporte hormonal, homeostasis y resistencia a glucocorticoides. En al ámbito inmunológico confiere resistencia viral y está involucrado en el transporte de citocinas. En el retículo endoplásmico está asociado con el transporte celular. Además se sobreexpresa en numerosos tejidos, incluyendo las células progenitoras117 |
En la búsqueda por identificar el tipo de célula más adecuada para repoblar un corazón infartado y restablecer su función, un sinnúmero de tipos celulares se han empleado; en algunos casos los resultados han sido inconsistentes y con un cierto grado de desencanto, mientras que en otros los resultados han sido alentadores. Sin embargo, a pesar de acumular por décadas un conocimiento cada vez más profundo del comportamiento biológico de diversas estirpes, después de descubrir, probar y analizar varios tipos celulares con capacidad cardiogénica, la pregunta que nos seguimos haciendo es la misma: ¿el uso de células para restaurar la función de un corazón humano dañado es una alternativa real en nuestros tiempos?
Aún no; será cuando se logre superar un conjunto complejo de situaciones y problemas, no tanto aquellos que son debidos a la inducción y la diferenciación ya que en ambos casos a nivel molecular se puede controlar y manipular, pues es el área donde más se ha trabajado, sino que más bien habría que superar aquellos obstáculos que han resultado difíciles de controlar, los que son derivados principalmente del tejido receptor: habrá que hacerlo permisible, que ofrezca un ambiente adecuado para la incorporación de nuevas células y así aumentar la capacidad de injerto, que permita la migración de factores solubles y células tanto endógenas como exógenas; al mismo tiempo también habrá que trabajar mucho en la forma en que se debe establecer el acoplamiento electro-mecánico, que permita la contractilidad, entre otros118.
Perspectivas y conclusionesEl empleo de células madre para reparación tisular se ha incrementado de manera exponencial en los últimos años. Por las ventajas que representan en identificación, caracterización, aislamiento y expansión, las MSC han sido las más utilizadas para tratamiento de infarto del miocardio, en comparación con otras subpoblaciones que también derivan de la médula ósea. Por lo que uno de los retos más importantes en la terapia celular basada en MSC para el tratamiento de ECV consiste en identificar el posible progenitor que al parecer es tan versátil que pudiera dar origen a algunas de las células descritas en esta revisión, pues muchas de ellas las podemos identificar a través de marcadores que comparten entre ellas y con las CSC; para ello habrá que considerar:
- 1.
Mejorar la identificación, reclutamiento y expansión de MSC autólogas con un compromiso de diferenciación cardiaca predecible, mediante sus marcadores de superficie.
- 2.
Identificar los factores de atracción y movilización que incrementan el reclutamiento de los posibles progenitores en la zona infartada.
- 3.
Desarrollar estrategias que mejoren la supervivencia de células trasplantadas.
Este proyecto contó con subvención parcial del CONACyT, Proyecto 101596.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.