El cor triatriatum (CTTA) es una malformación congénita que corresponde al 0.1-0.4% de las malformaciones cardiacas congénitas1,2. Los primeros informes datan de 1868 y fueron reportados por Church3, quien describía una aurícula izquierda (AI) dividida por un septum anormal, pero fue Borst en 19051 quien le asignó el nombre de CTTA. La primera corrección quirúrgica se le asigna a Vineberg y Gialloreto en 19561. En 1964, Miller et al. describen el diagnóstico angiográfico en la clínica Mayo, y en 1984 Ostman-Smith et al. dan las pautas para el enfoque diagnóstico ecocardiográfico4.
No se han reportado diferencias en la incidencia entre sexos ni tampoco una asociación con síndromes genéticos específicos, pero hasta en el 80% de los casos existe relación con otras malformaciones congénitas, principalmente conexión anómala de las venas pulmonares, foramen ovale permeable y comunicación interauricular tipo ostium secundum1,3,5.
Describimos el caso de un paciente con esta enfermedad, mostrando el enfoque diagnóstico realizado, el plan de manejo y las complicaciones que llevaron a un resultado adverso. Se trata de un paciente de sexo masculino, 47 años de edad, con antecedentes de hipotiroidismo e hipertensión pulmonar (HTP) idiopática diagnosticada 2 años atrás, por presentar disnea y deterioro de la clase funcional, apoyados por un cateterismo cardiaco derecho extrainstitucional, que reportó una presión media de la arteria pulmonar de 75mmHg, con prueba de vasorreactividad negativa y una ecocardiografía con signos de HTP e hipertrofia ventricular derecha.
Ingresó al servicio de urgencias por palpitaciones y dolor precordial opresivo e irradiado a miembro superior izquierdo, movimientos masticatorios involuntarios sin pérdida de la conciencia y disnea. Al examen físico presentó: presión arterial de 116/80mmHg, frecuencia cardiaca de 98lpm, pulso de 84ppm, saturación de oxigeno del 84%. Ruidos cardiacos arrítmicos, sin soplos, P2 reforzado, ruidos respiratorios disminuidos de forma bilateral. Neurológico sin focalización.
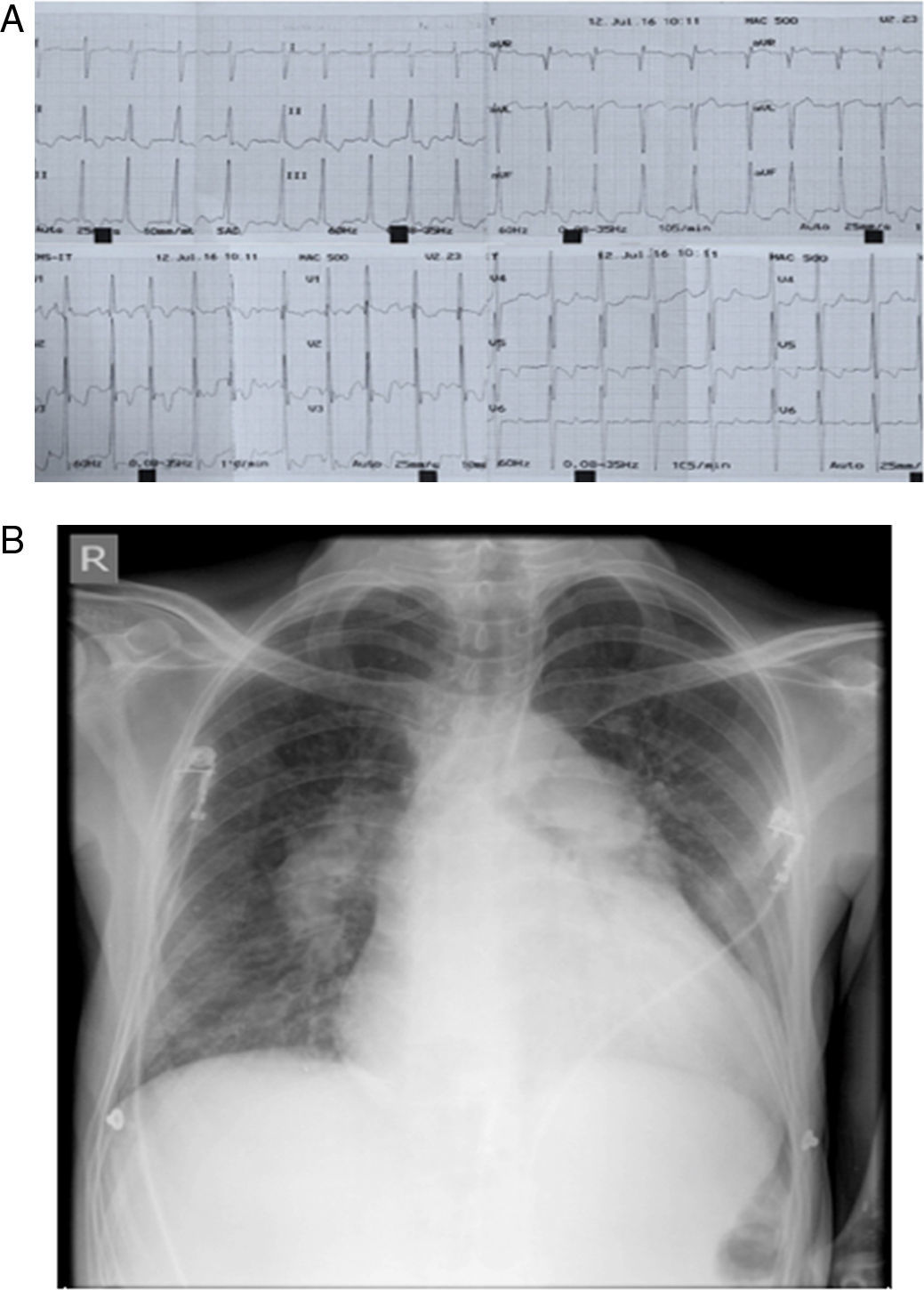
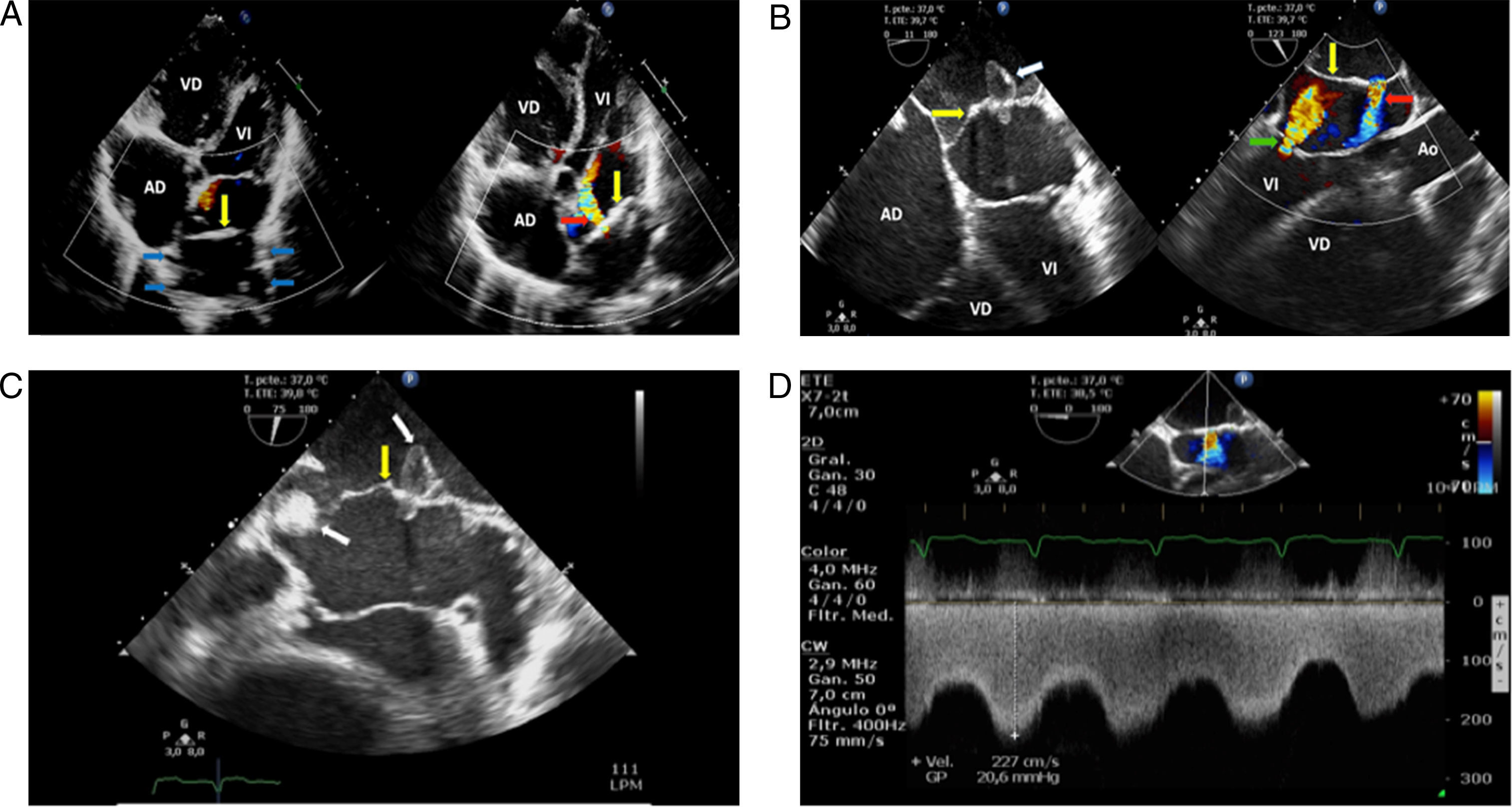
El electrocardiograma mostró fibrilación auricular, frecuencia cardiaca de 140lpm, eje del QRS desviado a la derecha y signos de hipertrofia ventricular derecha (fig. 1a). En la radiografía de tórax: cardiomegalia global, signos de HTP e infiltrados centrales (fig. 1b). Se realizó entonces una ecocardiografía transesofágica (fig. 2) que mostró una AI severamente dilatada, presencia de membrana que divide la AI en dos cámaras, con flujo sistodiastólico hacia la segunda cavidad, más cercana a la válvula mitral por pequeño orificio de 5mm. Las venas pulmonares drenan a la cavidad superior de la AI (fig. 2a). Además, se observan dos masas en cavidad superior de AI adheridas a la membrana, compatibles con trombos (fig. 2b,c). Orejuela izquierda sin trombos, con velocidades doppler pulsado normal. Aurícula derecha severamente dilatada. Insuficiencia mitral leve y tricúspide moderada, presión sistólica de arteria pulmonar 80mmHg. Ventrículo derecho gravemente dilatado, con función sistólica disminuida. Con estos hallazgos se diagnosticó CTTA sinistrum con presencia de trombos en la membrana y se consideró que la HTP con compromiso de cavidades derechas era secundaria a esta enfermedad y no a una HTP idiopática, como se había considerado en otra institución.
a) Electrocardiograma de 12 derivaciones que muestra ritmo de fibrilación auricular, con frecuencia cardiaca promedio de 140lpm, eje del QRS desviado a la derecha y signos de hipertrofia ventricular derecha. b) Radiografía de tórax portátil donde se evidencia cardiomegalia, cono de la arteria pulmonar prominente y aumento del tamaño de las ramas de la arteria pulmonar como signo de hipertensión pulmonar; además, se encuentran infiltrados de predominio central.
a) Ecocardiograma transtorácico ventana cuatro cámaras: la flecha amarilla señala membrana del cor triatriatum sinistrum; las flechas azules muestran las venas pulmonares que drenan en la porción superior de la aurícula izquierda, superior a membrana; la flecha roja indica flujo por doppler color de la cavidad superior de la aurícula izquierda a la cavidad inferior de la aurícula a través de orificio en membrana divisora. b) Ecocardiograma transesofágico en vista de cuatro cámaras: la flecha amarilla señala membrana del cor triatriatum sinistrum; y la flecha blanca indica trombo en membrana del cor triatriatum que obstruye uno de sus orificios, apreciando parte del trombo en cavidad inferior atravesando la membrana. La vista longitudinal en la misma figura muestra: flecha amarilla que señala membrana del cor triatriatum sinistrum, flecha roja que indica flujo por doppler color de la cavidad superior de la aurícula izquierda a la cavidad inferior de la aurícula a través de orificio en membrana divisora, y flecha verde que indica el flujo por doppler color de la insuficiencia mitral. c) Ecocardiograma transesofágico, donde la flecha amarilla señala membrana del cor triatriatum sinistrum, la flecha blanca indica trombos en la membrana, uno de ellos obstruye uno de sus orificios, apreciando parte del trombo en cavidad inferior atravesando la membrana. d) Ecocardiograma transesofágico donde se muestra medición de gradiente a través del orificio del cor triatriatum.
AD: aurícula derecha; Ao: aorta ascendente; VD: ventrículo derecho; VI: ventrículo izquierdo.
Se definió manejo quirúrgico previa compensación de la fibrilación auricular y falla cardiaca; sin embargo, 3 días después del ingreso el paciente presentó deterioro neurológico con hemiparesia derecha y Glasgow 7/15, requirió intubación orotraqueal y ventilación mecánica invasiva. Se documentó ataque cerebrovascular isquémico en territorio de arteria cerebral media y se manejó de forma intravascular (trombólisis intraarterial) ya que la trombólisis sistémica estaba contraindicada por encontrarse anticoagulado.
El paciente evolucionó de forma tórpida, con dependencia de ventilación mecánica, desarrolló neumonía asociada al ventilador por Klebsiella pneumonie, la cual se trató; pero luego de 15 días de hospitalización y 11 días de ventilación mecánica invasiva, posterior a traqueostomía el paciente presentó paro cardiorrespiratorio y falleció.
El CTTA puede comprometer tanto la AI (CTTA sinistrum) como la aurícula derecha (CTTA dextro, 0.025% de las malformaciones cardiacas congénitas)5,6. En este documento nos referiremos solo al CTTA sinistrum, caracterizado por una AI dividida en dos cavidades por una membrana fibromuscular o fibromembranosa denominada «forma clásica»7. La cavidad auricular superior tiene una ubicación posterior, recibe la sangre de las venas pulmonares y generalmente es de mayor tamaño que la inferior; mientras que la cavidad inferior se posiciona de forma anterior, es de menor tamaño, contiene la orejuela y el orificio de la válvula mitral, por lo que se conoce como la aurícula verdadera. La comunicación entre ambas cavidades está dada por uno o varios orificios en la membrana que según el tamaño llevarán a que se presenten o no síntomas1,6. El ventrículo izquierdo es de tamaño normal; pero el ventrículo derecho puede estar dilatado en caso de cortocircuito de izquierda a derecha o HTP, como en el caso que se reporta.
Loefler en 1949 realizó la siguiente clasificación basada en el número y tamaño de las fenestraciones de la membrana: tipoI, aquella sin fenestraciones; tipoII, la que presenta una o más fenestraciones, y tipoIII, una gran fenestración. Esta última es la más frecuentemente reportada como diagnóstico de novo en los adultos, por la poca sintomatología que produce en la infancia1,2,6. Lam et al. revisaron la clasificación de Loeffler en 1962 y generaron su propia clasificación3,8. ClaseA: la cámara proximal recibe todas las venas pulmonares, la cámara distal contiene el apéndice auricular y la válvula mitral. No hay defectos septales. A1: defecto septal entre aurícula derecha y cámara proximal. A2: defecto septal entre aurícula derecha y cámara distal. ClaseB: las venas pulmonares drenan en el seno coronario. ClaseC: no hay conexión anatómica entre las venas pulmonares y la cámara proximal8.
Para explicar esta malformación congénita, se han propuesto varias teorías, aunque ninguna ha sido completamente convincente. Una de ellas es la persistencia de la vena cava superior izquierda, pero a pesar de que existe esta asociación, la mayoría de los pacientes con la forma «clásica» no muestran persistencia del canal venoso sistémico izquierdo. Otra teoría considera una mala incorporación, sugiriendo que las venas pulmonares no se incorporan de forma normal en la AI, dejando como resultado dos cámaras con una apertura estrecha, sin embargo, esta no explica la presencia de la fosa ovalis y fibras musculares auriculares en las paredes de la cámara proximal, donde solo una pared venosa está presente. Otros postulan un crecimiento anormal del septum primum como una teoría de mala septación. En la teoría conocida como atrapamiento, el cuerno izquierdo del seno venoso embrionario atrapa las venas pulmonares comunes, lo cual previene la incorporación dentro de la AI1,7.
Las manifestaciones clínicas dependen del tamaño de la fenestración y la presencia de otras malformaciones, al igual que de la presencia de HTP1,3,6, si bien los pacientes pueden ser asintomáticos. Las fenestraciones pequeñas se comportan de manera similar a una estenosis mitral (disnea, ortopnea, hemoptisis)1,6,9. En la edad adulta, el CTTA puede ser un hallazgo incidental, explicado por una membrana con un orificio de tamaño importante, que evita la creación de gradientes de presión intraauriculares y generación de síntomas; con el paso del tiempo, una vez se fibrosa y calcifica la membrana, se reduce el tamaño del orificio, aparecen síntomas como disnea, ortopnea y en los casos más graves, edema pulmonar. Otras manifestaciones menos frecuentes incluyen arritmias auriculares y fenómenos embólicos incluido el accidente cerebrovascular por trombos formados en las cavidades de la aurícula, generalmente la superior1, y favorecidos por la fibrilación auricular, como el caso en cuestión1,6,9.
Al examen físico puede encontrase un soplo diastólico, un segundo ruido reforzado (P2 >A2), como lo evidenciamos en nuestro paciente, lo que se correlaciona con HTP1,2.
Las ayudas diagnósticas incluyen el electrocardiograma, que puede ser normal o mostrar desviación del eje a la derecha, SIQIII, fibrilación auricular o datos de HTP; mientras que el cateterismo cardiaco permite medir gradientes de presión entre las cámaras auriculares. La ecocardiografía es definitivamente el estudio de elección para el diagnóstico del CTTA, ya que posibilita la evaluación no invasiva delineando la morfología de la membrana y las otras estructuras cardiacas alteradas. La ecocardiografía 3D concede una evaluación más clara de las alteraciones estructurales, permitiendo especialmente diferenciar mejor los orificios1,7,8.
El tratamiento médico dependerá de la sintomatología, de modo que, en caso de disnea o congestión pulmonar, pueden emplearse diuréticos y/o digoxina; en presencia de arritmias el tratamiento es según las guías, incluyendo anticoagulación y ablación por catéter en caso de estar indicados1. El abordaje quirúrgico es el tratamiento de elección, si bien hay reportes de manejo percutáneo con balón, pero se restringe a CTTA aislado3. El manejo quirúrgico se indica en pacientes sintomáticos con obstrucción significativa intraauricular, y consiste en la resección de la membrana y corrección de otras malformaciones congénitas de estar presentes, con una tasa de éxito mayor que el 90% en centros con experiencia, logrando que el paciente quede asintomático1,6,7. Las metas hemodinámicas intraquirúrgicas son similares a la estenosis mitral: control de la frecuencia cardiaca, adecuado balance de líquidos y evitar todos los factores que puedan incrementar la resistencia pulmonar y disminuir el flujo pulmonar9.
Nuestro paciente venía siendo tratado erróneamente con diagnóstico de HTP del grupo1 en otra institución, por pruebas no invasivas y un cateterismo derecho con el cual no se llegó al diagnóstico de CTTA. Al primer contacto con el servicio de cardiología se realizaron las pruebas mencionadas, con lo cual se hizo el diagnóstico y con ello se le ofreció al paciente abordaje quirúrgico, pero este falleció antes de completarse los estudios y realizar el procedimiento.
Agradecemos al paciente y sus familiares, y al Hospital Universitario San Vicente Fundación que facilitó la información de la historia clínica y ayudas diagnósticas.