Introducción
La cardiomegalia es un hecho común en la miocardiopatía chagásica crónica y se asocia a un alto índice de discapacidad a mediano y mortalidad a largo plazo. Por otro lado, a pesar de los grandes avances logrados en la eliminación de la transmisión vectorial y por hemotransfusión de la enfermedad de Chagas, la cardiopatía chagásica aún se distribuye ampliamente en las regiones rurales de Latinoamérica, particularmente en el Cono Sur.1,2
En México, como en otras partes de Latinoamérica, es común observar casos de cardiopatía chagásica "típica" desde los puntos de vista clínico y epidemiológico, que dejan de serlo cuando al realizar los exámenes de laboratorio para el diagnóstico de enfermedad de Chagas, éstos resultan negativos, creando una gran incertidumbre diagnóstica acerca de su etiología.3 También es común encontrar en estudios clínicos en cardiópatas o en las encuestas seroepidemiológicas para enfermedad de Chagas, un porcentaje alto e incluso, a veces, más elevado de anormalidades electrocardiográficas sugestivas de miocardiopatía chagásica en individuos negativos a la serología específica que en los seropositivos.3-8
Este hecho fue estudiado por Novoa Montero9 en las regiones rurales de Venezuela, quien no encontró asociación significativa entre infección chagásica y miocardiopatía al estudiar miocardiopatía y enfermedad de Chagas en 487 campesinos, mediante reacción de hemaglutinación indirecta vs. T. cruzi y electrocardiograma, utilizando la clasificación electrocardiográfica del código de Minnesota,10 con lo que concluyó, dándole la razón a Jaffe y a otros anatomopatólogos venezolanos11-15 sobre la existencia de miocardiopatía crónica indiferenciada o miocarditis venezuelensis, entidad de la que no pudieron precisar su etiología, pero que de ninguna manera atribuyeron a T. cruzi.
Por otro lado, la leptospirosis crónica es una entidad muy común en México16-18 prueba de ello, son los numerosos casos diagnosticados por nuestro grupo, tanto en pacientes como en cadáveres que presentaban o habían presentado un diverso mosaico clínico, así como el aislamiento de 18 cepas de Leptospira interrogans serovariedad Pomona, caracterizadas por el Laboratorio de referencia de Leptospirosis de la Habana, Cuba y por el Laboratorio de Investigación y Diagnóstico en Leptospirosis para la FAO/WHO/OIE de Ámsterdam, Holanda.
Material y métodos
En julio de 2001, estudiamos, asociados a médicos del Servicio de Medicina Interna (unidad 110), Patología y de otros servicios del Hospital General de México, OD, SS, un paciente masculino, mestizo, de 26 años de edad, obrero, que habitaba una vivienda precaria, grandemente infestada de ratas y ratones, el cual ingresó a hospitalización el día 17 de junio de 2001, con un síndrome ictérico iniciado 90 días antes, insuficiencia cardiaca congestiva, miocardiopatía dilatada (cardiomegalia grado IV), así como hepatopatía a determinar. Días después, por la gran cardiomegalia se sospechó cardiopatía chagásica.
A su ingreso, al paciente se le realizaron exámenes de rutina y de gabinete: biometría hemática (BH), examen general de orina (EGO), química sanguínea (QS), radiografía y tomografía de tórax, ultrasonido de hígado y vías biliares y ecocardiografía; así como panel para hepatitis viral y hepatitis autoinmune.
Ante la sospecha de enfermedad de Chagas y de leptospirosis, se realizó, serología y hemocultivo específicos; asimismo se realizó la detección de leptospiras en sangre y orina mediante videograbación en microscopía de campo oscuro (vdgnCO), impregnación argéntica (IA) e inmunodetección por inmunohistoquímica (IHQ) e inmunofluorescencia indirecta (IFI-ag).
La detección de anticuerpos anti T. cruzi se realizó por hemaglutinación indirecta (HAI, utilizando el equipo de Serodia-Chagas®, Bayer), de ELISA (Chagatek-ELISA, Biomerieux) e inmunofluorescencia indirecta (IFI).
Cuando se practicó IFI, se utilizó una suspensión de 3 cepas de T. cruzi aisladas, de casos crónicos de humanos mexicanos, lavadas con solución amortiguada de fosfatos (PBS pH 7.4), ajustadas a 50 parásitos por campo y pegadas sobre placas de 18 pozos cubiertas con teflón (Celline/Erie Scientific CO) y fijadas con metanol. Los sueros se corrieron con un factor de dilución de 2, comenzando a partir de 1:2, se utilizó un anticuerpo anti IgG humano conjugado a isotiocianato de fluoresceína (Zymed) y se leyeron bajo una lámpara de luz ultravioleta en un microscopio Zeiss.
El hemocultivo se realizó en medio NNN17 y EMJH para el aislamiento de T. cruzi y Leptospira interrogans respectivamente.
Para la detección de anticuerpos contra Leptospira interrogans se utilizó la técnica de microaglutinación en placa (MAT), según los lineamientos de la OMS.19
Para la vdgnCO de sangre y orina, se utilizó un sistema de amplificación de imágenes integrado por una videocámara Sony conectada a un monitor Sony.18
La IA se realizó con la técnica de Warthin-Starry.
Para la inmunodetección de antígeno se usó un suero hiperinmune de conejo preparado contra las 13 serovariedades de Leptospira interrogans más comunes en México. Para la IHQ se manejó un anticuerpo anti-inmunoglobulinas totales de conejo conjugado con biotina (SIGMA), la reacción se amplificó con streptavidina-peroxidasa (SIGMA) y se reveló con diaminobenzidina (SIGMA). Para la IFI-ag se utilizó un anticuerpo anti-inmunoglobulinas totales de conejo conjugado a isotiocianato de fluoresceína (SIGMA) la lectura se realizó bajo una lámpara de luz ultravioleta.17-21
En el estudio postmortem, se realizaron los estudios histopatológicos de rutina en todos los órganos, además se llevaron a cabo cortes de miocardio teñidos con Giemsa para búsqueda de T. cruzi e impregnación argéntica para observar daño neuronal. En cortes de pulmón, riñón, hígado, bazo y ganglios linfáticos se realizó búsqueda de M. tuberculosis por coloración de Ziehl Neelsen y cultivo en Lowenstein-Jensen. La búsqueda de Leptospira interrogans se realizó en cortes histológicos de corazón, pulmón, riñón e hígado, mediante IA, IHQ e IFI-ag.
Resultados
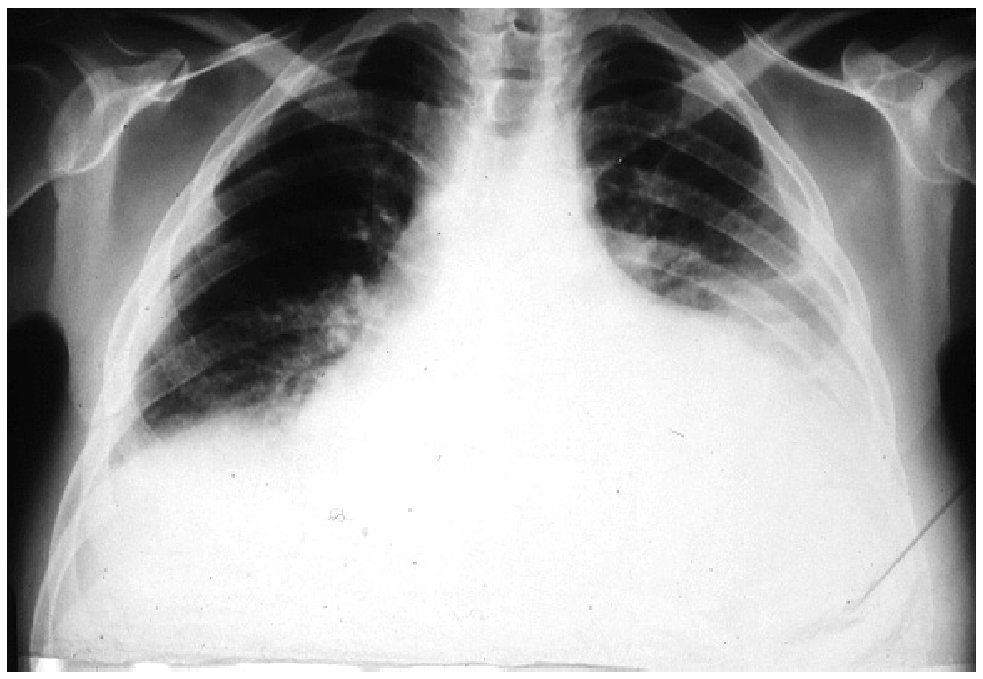
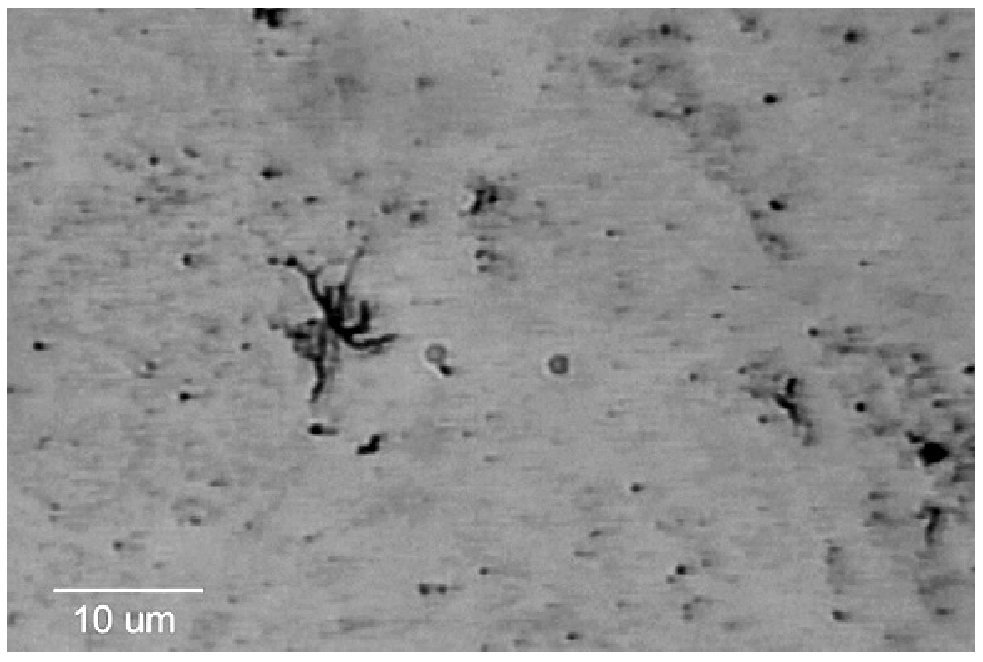
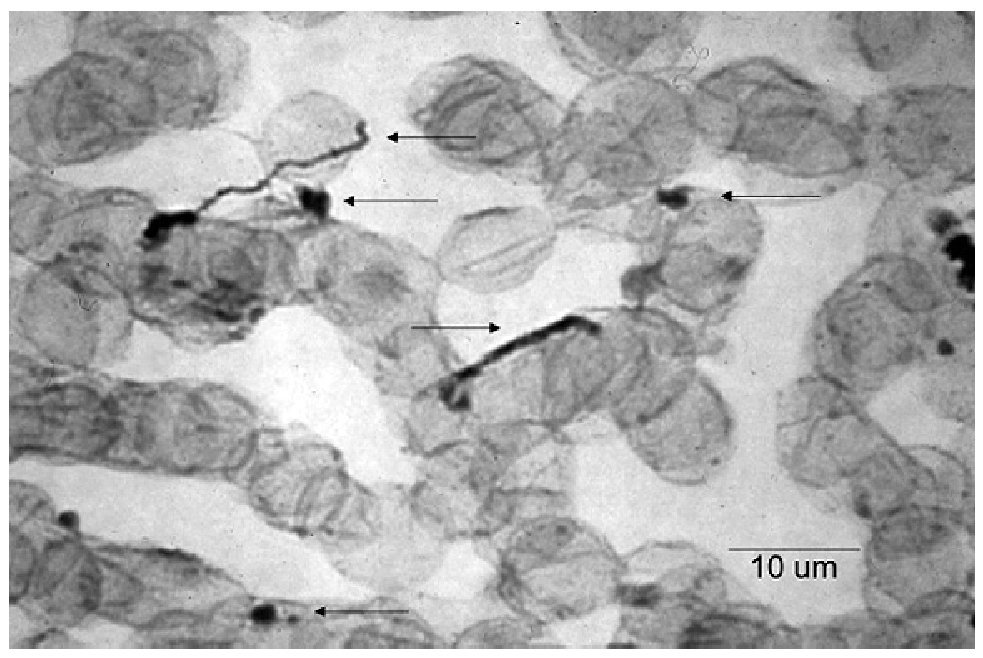
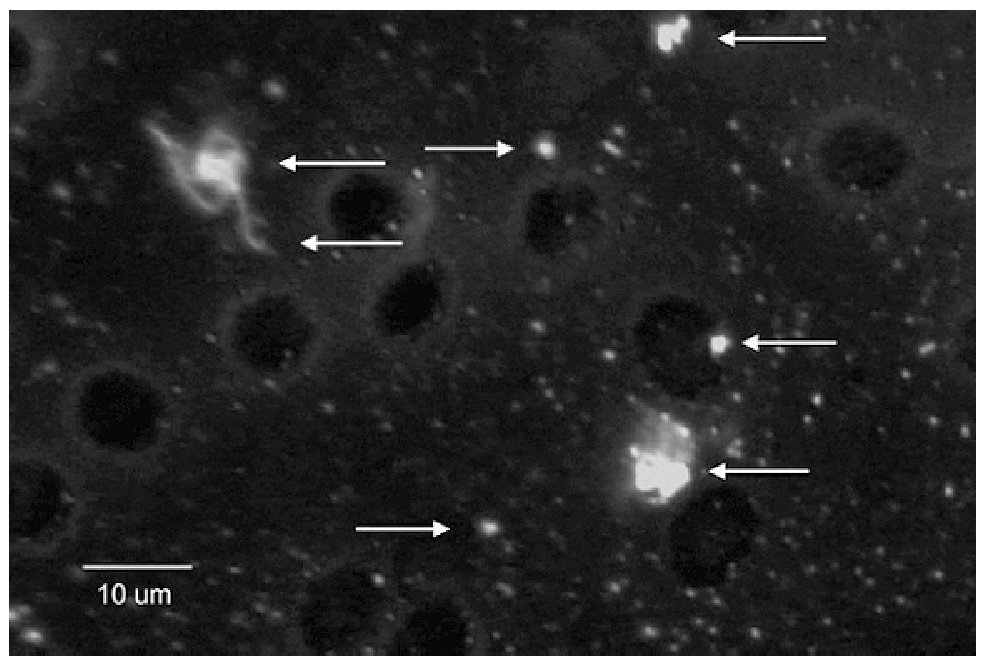
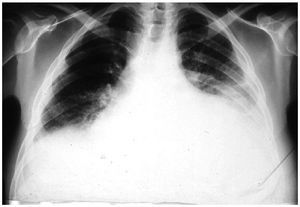
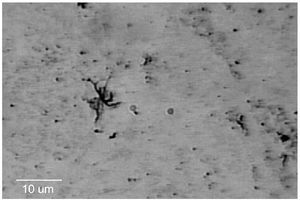
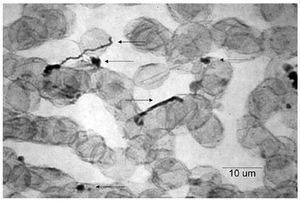
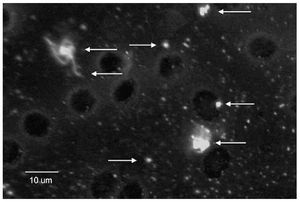
El EGO mostró: orina ictérica, Hb++, proteínas+++, bilirrubina+++. En la química sanguínea las bilirrubinas estuvieron muy aumentadas: bilirrubina total 30.18 mg/dL (límites normales 0.2 a 1.0 mg/dL); bilirrubina directa 23.68 mg/dL (límites normales 0 a 0.2 mg/dL), bilirrubina indirecta 6.50 mg/dL (límites normales 0 a 1.0 mg/dL), sólo se realizaron dos pruebas de funcionamiento hepático con los siguientes resultados: GOT/ AST 125 U/L (normales 5 a 40 U/L) y GPT/ALT 121 U/L (normal de 10 a 60U/L). El ultrasonido de hígado mostró hepatopatía difusa. La radiografía y la tomografía de tórax mostraron una cardiomegalia grado IV (Figura 1) el ecocardiograma mostró dilatación pancavitaria. El panel para hepatitis viral fue negativo, al igual que las pruebas para hepatitis autoinmune. La biopsia hepática sólo mostró colestasis centrolobulillar intensa. La HAI para T. cruzi fue positiva 1:16, pero la ELISA, la IFI y el hemocultivo fueron negativos. En la vdgnCO de orina y sangre, se encontraron numerosas leptospiras. Asimismo, la serología por MAT fue positiva a títulos bajos para L. interrogans serovariedad Pomona (1:80). La IA, IHQ y la IFI-ag en esos fluidos biológicos fueron positivas (Figuras 2, 3, 4, 5).
Figura 1. Radiografía del tórax del paciente, donde se observa Cardiomegalia grado IV.
Figura 2. Leptospiras impregnadas con plata (Warthin-Starry), en sangre del paciente con leptospirosis crónica.
Figura 3. Aglomeración de leptospiras impregnadas con plata (Warthin-Starry), en orina del paciente con leptospirosis crónica agudizada.
Figura 4. Leptospiras en sangre, detectadas mediante inmunohistoquímica. Las flechas señalan leptospiras típicas y formas granulares.
Figura 5. Leptospiras en sangre, detectadas mediante inmunofluorescencia indirecta. Las flechas señalan leptospiras completas y antígeno granular.
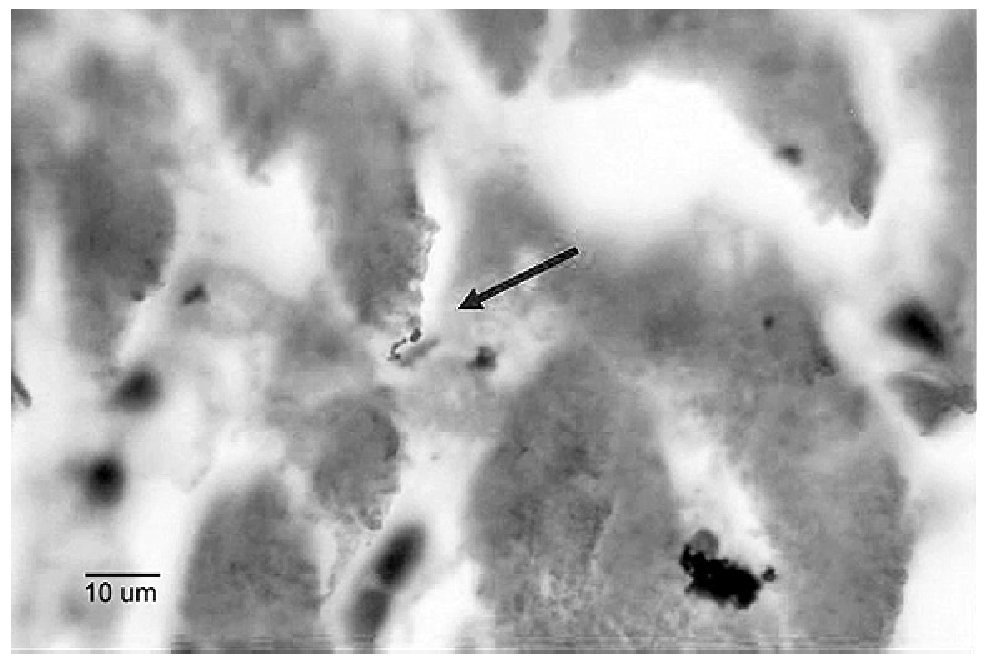
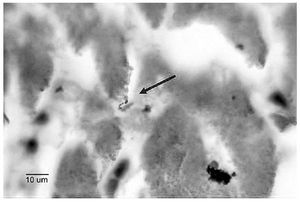
El paciente falleció y los patólogos le realizaron los siguientes diagnósticos anatomopatológicos: cardiomiopatía dilatada idiopática, fibrosis hepática intersticial extensa, colestasis de predominio centrolobulillar y ascitis. Ese mismo departamento descartó miocardiopatía chagásica por no encontrar parásitos, imagen histopatológica compatible, pero observaron imágenes compatibles con tuberculosis miliar en pulmones, riñón, hígado, bazo y ganglios linfáticos, que luego descartaron por no observar M. tuberculosis a la tinción de Ziehl-Neelsen, ni desarrollo en medio de cultivo específico. Desafortunadamente en ese momento no se realizó IA, de manera que no se pudo observar a leptospira en estos tejidos, hasta que nuevos estudios fueron realizados años después, merced a un convenio interdepartamental para el estudio de cadáveres que murieron de cuadros clínicos compatibles de leptospirosis, diagnosticados antes de morir por nuestro laboratorio mediante vdgnCO de sangre y orina, junto con IHQ e IFI-ag para detección de antígeno circulante. Dos meses después de la muerte, el cultivo en medio EMJH se desarrolló a cepa, la cual fue caracterizada como Leptospira interrogans serovar Pomona, por el Laboratorio de Referencia en Leptospirosis de la Habana, Cuba. Años después, cuando se nos facilitaron sus tejidos, en los cortes histopatológicos de corazón (Figura 6), pulmón, riñón e hígado, observamos leptospiras con las diversas técnicas estudiadas.
Figura 6. Leptospira en un corte histológico del corazón del paciente, teñida por Warthin-Starry.
Discusión
A pesar de que la gran cardiomegalia y la insuficiencia cardiaca sugerían enfermedad de Chagas, ésta fue descartada, pese a que una prueba serológica anti-T. cruzi, la hemaglutinación indirecta fue positiva, pero las otras dos: la IFI y la ELISA fueron negativas, lo que sugiere sólo cruce inmunológico.3,17,22,23 Además el paciente, aunque nació en el estado de Guanajuato, aún lactante, fue llevado a residir en la Ciudad de México, donde no existe transmisión vectorial de este parásito, nunca viajó a zonas endémicas, no fue hemotransfundido, su serología fue negativa y no hubo desarrollo de T. cruzi en cultivo.17,22,23 En cambio habitó una vivienda llena de ratas, donde probablemente adquirió la leptospira, tampoco se encontraron parásitos en los tejidos e histopatológicamente no se observaron imágenes sugestivas de miocardiopatía chagásica.
Por otro lado, después de descartar hepatitis viral y hepatitis autoinmune como causas de daño hepático y síndrome ictérico, así como tuberculosis de pulmón, riñón, bazo y ganglios linfáticos y haber demostrado la presencia de leptospira en sangre y orina, primero, mediante vdgnCO y más tarde por IA, IHQ e IFI-ag, además de obtener el desarrollo de Leptospira en el medio de cultivo, hecho que demuestra incontrovertiblemente la etiología de un padecimiento, esta bacteria resultó ser el agente etiológico, no sólo de la hepatopatía y de las lesiones en pulmón, riñón y otros órganos, sino también de la miocardiopatía con cardiomegalia grado IV, que los anatomopatólogos venezolanos han descrito como miocardiopatía rural crónica endémica no chagásica o miocardiopatía venezuelensisNOVOA, a la que en un principio consideraron chagásica, pero a la que le descartaron más tarde tal etiología, al no observar la desnervación del miocardio, ni señales de parásitos y por no haber encontrado signos de otros agentes etiológicos, le atribuyeron una etiología viral, lo que posiblemente en muchos casos puede ser así, pero en el nuestro, sin ninguna duda, se debió a Leptospira interrogans.
Asimismo, aunque en nuestro medio no se considera a la leptospirosis como causa de miocarditis intersticial ni tampoco de otros tipos, existen muchas evidencias de que esta bacteria afecta frecuentemente al corazón causando miocarditis y por lo tanto, puede simular miocardiopatía chagásica y algunas o muchas de esas "miocarditis idiopáticas", reportadas en las autopsias13-16,24-31 son causadas por Leptospira como ocurrió en nuestro caso, en el cual detectamos a esta bacteria en éste y otros órganos (Figura 6), por lo que aventuramos la hipótesis de que esta espiroqueta puede ser la causa de la miocarditis crónica rural no chagásica o miocarditis venezuelensis, sólo que no ha sido buscada histopatológicamente. Además como se ha observado en múltiples ocasiones, el daño pulmonar, esplénico y de ganglios linfáticos, pueden ser causados por esta misma bacteria,25,27,30-35 y no por tuberculosis, como sugirió la observación histopatológica previa, descartada poco después por la negatividad a la coloración de Ziehl-Neelsen y por la ausencia del desarrollo de M.tuberculosis en los medios de cultivo específicos. Asimismo, la colestasis centrolobulillar observada en cortes de hígado es común en leptospirosis grave.36
Finalmente, se puede afirmar que la vdgnCO, la IA en vida y en la necropsia, la IHQ, la IFI-ag y particularmente el aislamiento de Leptospira interrogans, no dejan duda acerca de la etiología de esta enfermedad.
Conclusiones
Después del análisis de este caso y por nuestra experiencia en centenares de enfermos de leptospirosis y en presencia de factores de riesgo epidemiológicamente importantes como la exposición elevada y continua a roedores y a otros animales, se debe considerar a Leptospira. Interrogans como uno de los agentes potenciales en la etiología de miocardiopatía dilatada no chagásica y como un posible agente etiológico de la cardiopatía crónica endémica rural no chagásica o miocardiopatía venezuelensis,16,24-31 por lo que se sugiere a los investigadores de la enfermedad de Chagas, a los cardiólogos, a los patólogos y a muchos otros especialistas, pensar en ella, particularmente cuando no se haya podido confirmar la etiología de la cardiopatía, como sucedió en este caso, ya que antes de que los patólogos conocieran el aislamiento de la bacteria, habían realizado diagnóstico de miocardiopatía dilatada idiopática.
Correspondencia:
Dr. Oscar Velasco Castrejón.
Clínica de Medicina Tropical, 2º piso Unidad de Medicina Experimental, UNAM-Hospital General de México, OD, SS. Dr. Balmis 148, colonia Doctores. México D. F. CP. 06726. Teléfono: (55) 5623 2678, (55) 5623 2677, Fax (55) 8596 4500.
Correo electrónico: oscarvel1@yahoo.com.mx, oscarvelasco@medicina-tropical.com
Recibido el 27 de julio de 2008;
Aceptado el 6 de marzo de 2009.