El infarto de miocardio es la causa más común de fallo cardíaco congestivo. El objetivo de este trabajo es evaluar, en el animal de experimentación, los efectos morfológicos e histológicos de la implantación de plasma autógeno rico en plaquetas en el corazón de ovejas previamente infartadas.
MétodosSe utilizaron 24 ovejas lacha hembras, en las que se produjo quirúrgicamente un infarto agudo de miocardio, mediante toracotomía izquierda y ligadura permanente de 2 arterias coronarias (primera y segunda diagonal). Tras la ligadura de las arterias coronarias 3 ovejas fallecieron por fibrilación ventricular. Pasadas 3 semanas de la ligadura coronaria, las ovejas fueron reoperadas por esternotomía media vertical. En 6 de ellas (grupo control) se inyectó suero fisiológico en la zona del infarto. En 15 se inyectó gel plaquetario. Todas las ovejas fueron sacrificadas a las 9 semanas de evolución de la segunda cirugía.
ResultadosEn los corazones tratados con plasma rico en factores de crecimiento (PRGF) destaca la neoformación vascular en los cortes de hematoxilina-eosina y de factor viii, a diferencia de los no tratados.
Conclusiones La inyección de factores de crecimiento plaquetarios, PRGF, en el corazón de ovejas previamente infartadas favorece la mitogénesis y la angiogénesis. El uso de PRGF autógeno es sencillo y seguro, no provocando toxicidad ni desencadenando reacciones inmunológicas ni inflamatorias.
Myocardial infarction is the most common cause of congestive heart failure. The objective of this work is to evaluate, in experimental animals, morphological and histological effects of the implantation of autologous platelet-rich plasma in infarcted heart sheep.
MethodsTwenty-four ewes were used, they were surgically infarcted through left thoracotomy and two coronary arteries were ligated (first and second diagonal). After coronary artery ligation three sheep died of ventricular fibrillation. Three weeks after coronary ligation, sheep were reoperated through median sternotomy. Normal saline solution was injected in the infarcted zone in 6 of them (control group) whereas platelet gel was injected in 15 of them. All sheep were euthanized at 9 weeks of evolution of the second surgery.
ResultsNoteworthy is the formation of new vessels in hematoxylin-eosin-stained sections and factor viii in plasma rich in growth-factors (PRGF)-treated hearts.
ConclusionsInjection of platelet growth factors, PRGF, in previously infarcted sheep hearts promotes mitogenesis and angiogenesis. The use of autologous PRGF is simple and safe, causing no toxicity or immune-inflammatory reactions.
El infarto de miocardio es la causa más común de fallo cardíaco congestivo1. La respuesta ventricular al infarto de miocardio depende de un complejo interactivo entre el tratamiento del infarto, la localización, la transmuralidad y el estado de perfusión miocárdica2–5. Cuando las condiciones favorecen la expansión del infarto, la remodelación ventricular izquierda conduce a la dilatación ventricular y al fallo cardíaco congestivo6. Una vez establecida la dilatación ventricular es difícil de tratar7. Sin embargo, el curso y la extensión de remodelación ventricular después del infarto son muy variables y difíciles de predecir en el curso precoz del infarto8,9. El trasplante celular, los factores de crecimiento y la terapia génica representan, en la actualidad, tratamientos emergentes destinados a mejorar la viabilidad miocárdica en el fallo cardíaco isquémico. El plasma autógeno rico en factores de crecimiento (PRGF) es una concentración autógena de plaquetas en un pequeño volumen de plasma y contiene altas concentraciones de factores de crecimiento. Se ha utilizado con buenos resultados en clínica dental y cirugía maxilofacial (valorando los beneficios en la regeneración del tejido tisular); en cirugía plástica (estudiando la detención de la hemorragia capilar en los colgajos quirúrgicos de pacientes sometidos a cirugía estética); y en traumatología-reumatología (en la reconstrucción del ligamento cruzado anterior, en la rotura del tendón de Aquiles y en la regeneración del cartílago articular rotuliano10–12). El PRGF igualmente se ha utilizado en cirugía experimental en ovejas para evaluar la consolidación esternal tras esternotomía observándose una aceleración del proceso de consolidación esternal13. Sin embargo, la utilización de PRGF no ha sido aun valorada en la regeneración cardíaca, por lo que nuestra hipótesis de trabajo se basa en la posibilidad de que el gel autógeno plaquetario pueda facilitar la angiogénesis y la regeneración miocárdica después de un infarto agudo de miocardio. El objetivo de este trabajo es evaluar, en el animal de experimentación, los efectos morfológicos e histológicos de la implantación de plasma autógeno rico en plaquetas en el corazón de ovejas previamente infartadas.
MétodosSe utilizaron 24 ovejas lacha hembras, de peso entre 18 y 29kg (media 22.4kg±3.6kg), en las que se produjo quirúrgicamente un infarto agudo de miocardio, mediante toracotomía izquierda y ligadura permanente de 2 arterias coronarias (primera y segunda diagonal). Todos los animales recibieron lidocaína (3mg/kg por vía intravenosa) antes del infarto y una infusión de lidocaína (2mg/min) durante los 60min posteriores al infarto de miocardio. Pasadas 3 semanas de la ligadura coronaria, las ovejas fueron reoperadas. Durante la inducción anestésica se obtuvo el plasma autógeno rico en plaquetas a través de la punción de la vena yugular. Por esternotomía media vertical se accedió al corazón. Se identificó la zona del infarto y el borde del miocardio perfundido. En 6 de ellas (grupo control) se inyectaron, mediante aguja de 21G, 4ml de suero fisiológico en 4 puntos de la zona del infarto. En 15, se inyectaron 4ml de gel plaquetario en la misma forma que en el grupo control.
Todos los animales recibieron antiparasitarios de amplio espectro. No se aceptaron para cirugía aquellos que tuvieron un hematocrito por debajo del 20%. Permanecieron en ayunas 24h antes de la cirugía, no aislándolos nunca del rebaño14–17.
Se indujo la anestesia por inyección intravenosa de propofol (Diprivan) en la vena yugular derecha/izquierda, en concentración de 6mg/kg. La intubación orotraqueal se realizó con un tubo del n.o 7. La respiración mecánica se mantuvo con un equipo Narkomed 2C (Draeger Medical, Telford, PA, EE. UU.) utilizando los siguientes parámetros: volumen de 10ml/kg, frecuencia de 24rpm y una fracción de oxígeno inspirado del 60%. La anestesia se mantuvo por inhalación de isoflorane al 1-2%. Se introdujo una sonda gástrica multiperforada de 1/2 «o 3/8», para atenuar la distensión abdominal. El cuidado postoperatorio consistió en inyección intramuscular de cefazolina (1g/día durante 5días). La analgesia se garantizó utilizando metamizol intramuscular (2g/día durante 5días). Todos los animales recibieron cuidados con arreglo a la European Convention on Animal Care.
Para la preparación del PRGF, se extrajeron 30ml de sangre a través de la vena yugular derecha/izquierda. La sangre se dispuso en tubos de 5ml, conteniendo citrato trisódico al 3.8%. Fueron centrifugados los tubos a 1.800rpm durante 8min (PGRF System II, BTI, Vitoria-Gasteiz, España). La fracción de 1ml aproximadamente, localizada inmediatamente por encima de los hematíes, fue separada cuidadosamente en cada tubo y dispuesta en otro tubo estéril. Se añadieron 50μl de cloruro cálcico al 10% por cada ml de plasma plaquetario enriquecido.
Para el análisis morfométrico, todas las ovejas fueron sacrificadas a las 9 semanas de evolución de la segunda cirugía. El corazón fue explantado y fijado en formol al 10%. El lugar de la lesión miocárdica fue identificado. Se realizaron secciones de la zona infartada y limítrofe, embebiéndolas en parafina. Se realizaron secciones de 3μ de grosor, tiñéndolas con hematoxilina-eosina, Masson, inmunohistoquímica para identificación de células vasculares endoteliales utilizando anticuerpos contra el factor viii de von Willebrand (Dako Japan, Kyoto, Japón). La valoración histológica fue realizada por 2 patólogos de una forma ciega. Se realizó análisis morfométrico mediante microscopia óptica para valorar la densidad capilar. Se observaron 10 campos seleccionados de forma aleatorizada, con un retículo calibrado, midiendo 0.0625mm2, a unos aumentos de 400×, en 2 secciones histológicas diferentes. Se fotografiaron con una cámara digital LEICA DMD 108 (Leica Microsystems, Alemania). La densidad capilar fue determinada contando el número de vasos factor viii positivo, estableciéndose el número de capilares/mm2.
Los resultados son presentados como media±desviación estándar. Las comparaciones entre los 2 grupos se realizaron usando el test de la t de Student. Las diferencias se consideraron estadísticamente significativas cuando p<0.05.
ResultadosA pesar de la utilización de antiarrítmicos durante la cirugía, la fibrilación ventricular fue la mayor complicación, siendo letal en 3 casos (8%). Todos estos casos tuvieron lugar tras la primera cirugía, inmediatamente después de la ligadura de las arterias diagonales.
Durante el seguimiento no hubo ningún otro fallecimiento.
El nivel medio de troponina en suero, medido a las 24h del infarto, fue de 43±4ng/ml.
El estudio histológico de los corazones explantados puso de manifiesto la presencia de fenómenos reparativos, en forma de fibrosis, con fibroblastos activos y escasa celularidad inflamatoria, con áreas de infiltración adiposa.
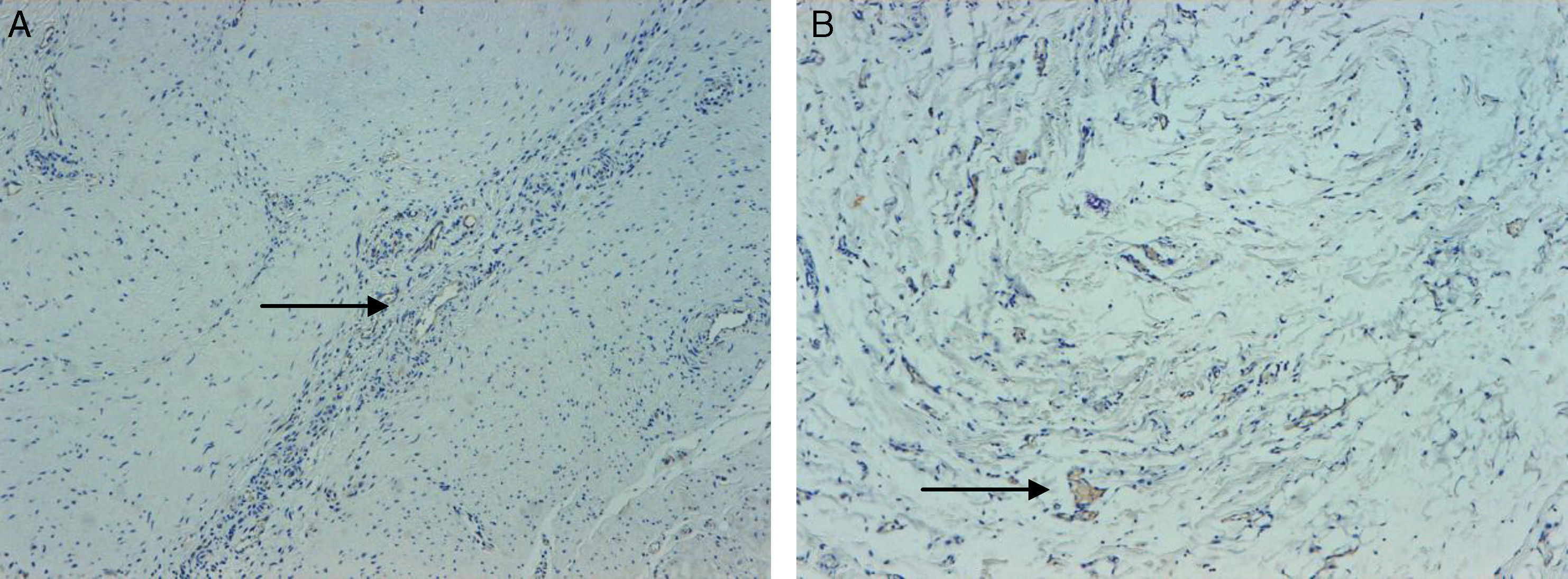
En los corazones no tratados con PRGF (figs. 1 y 2) se observa un colágeno más denso y con menor fenómeno angiogénico, a diferencia de los tratados con PRGF en los que destaca la neoformación vascular en los cortes de hematoxilina-eosina y de factor viii. Las 2 figuras corresponden a una muestra representativa de todas las estudiadas en las cuales podemos observar dichos cambios.
Tinción de hematoxilina-eosina, 10×. A) Microfotografía de miocardio infartado en un caso del grupo control (oveja no tratada con PGRF). Se observa tejido colágeno denso reparativo e infiltración grasa. B) Microfotografía de miocardio infartado en un caso tratado con PGRF. Se observan cambios reparativos postinfarto. Presencia de colágeno celular y neoformación vascular.
Tinción con factor viii, 40×. A) Microfotografía de miocardio infartado en un caso del grupo control (oveja no tratada con PGRF). Se observa escasa aparición de vasos neoformados. B) Microfotografía de miocardio infartado en un caso tratado con PGRF. Se observa colágeno laxo e importante neoangiogénesis.
La densidad capilar fue calculada por el número de vasos factor viii positivo en cada grupo. La densidad capilar fue significativamente más elevada en el grupo tratado con PRGF (640±102 versus 225±59 capilares/mm2, p<0.01). Los neovasos mostraban una morfología lineal sin evidenciarse formaciones angiomatosas.
DiscusiónEl objetivo de este trabajo ha sido comparar los efectos morfológicos e histológicos de la implantación de plasma autógeno rico en plaquetas en un modelo de infarto de miocardio en animales grandes.
La coronaria izquierda en la oveja aporta el riego sanguíneo al ventrículo izquierdo y septo interventricular. La coronaria derecha es pequeña y solamente riega el ventrículo derecho. El tronco coronario izquierdo es muy corto (menos de 3mm) y se divide rápidamente en la arteria homónima (descendente anterior) y circunfleja. De la arteria homónima, dependiendo de su desarrollo, salen 2 o 3 ramas diagonales. La circunfleja da 3 ramas marginales y termina en una descendente posterior de longitud variable. En función del aporte de riego al ápex ventricular hay 2 tipos de anatomía: tipo A, la arteria homónima riega la punta (76% de los casos), y tipo B en el que una de las ramas marginales de la circunfleja riega el ápex18. La ligadura de la primera y segunda diagonal induce un infarto del 20% aproximadamente de la masa ventricular izquierda19.
En este trabajo demostramos en el miocardio infartado ovino la presencia de angiogénesis y mitogénesis. El efecto del PRGF, a través de los numerosos factores de crecimiento que contiene, tales como VEGF, TGF-β1, PDGF-BB, se realiza sobre las células con capacidad reparativa, aumentando su número (mitogénesis) y estimulando el crecimiento vascular20 (angiogénesis).
Estos hallazgos son el primer paso para poder realizar nuevos estudios que logren confirmar una mejora de la función ventricular, atenuando la remodelación cardíaca.
Un biomaterial para regeneración cardíaca debe de ser biodegradable, biocompatible, causar escasa o nula reacción a cuerpo extraño, y aportar soporte mecánico y funcional al corazón lesionado. El uso de PGRF autógeno es sencillo y seguro, no provocando toxicidad ni desencadenando reacciones inmunológicas o inflamatorias. Histológicamente, en todos los casos tratados con PRGF ha sido nula la reacción a cuerpo extraño, siendo marcada la angiogénesis a diferencia de en el grupo control.
Es posible que la inyección de gel plaquetario pudiera preservar la función cardíaca y atenuar el efecto adverso de la remodelación ventricular, porque el material inyectado aportaría un soporte mecánico al corazón incrementando el grosor de la pared ventricular. Sin embargo, se necesitarían más estudios para poder confirmar estas hipótesis y demostrar una mejora de la contractilidad miocárdica a través de estudios de imagen ecocardiográficos.
Por otra parte, el gel plaquetario aporta un soporte biológico al liberar varios factores que favorecen la angiogénesis y la curación miocárdica postinfarto. Existe la posibilidad de que estos factores de crecimiento, incluidos en el PRGF, induzcan a la formación de una red vascular en la zona del infarto miocárdico, que facilite la llegada y asentamiento de las células madre cardíacas, y con ello la regeneración miocárdica. Por estas razones, consideramos que seguimientos a más largo plazo, por encima de los 6 meses de evolución, pueden aclarar la regeneración miocárdica en este modelo experimental.
ConclusionesEn nuestro estudio se ha demostrado que la inyección de factores de crecimiento plaquetarios, PRGF, en el corazón de ovejas previamente infartadas, favorece y estimula un aumento en el número de células miocárdicas y en el de vasos nuevos analizados histológicamente tras 9 semanas después de la inyección de PRGF, a diferencia de los no tratados con PRGF.
Este hallazgo es un primer paso que abre la puerta a nuevos estudios y técnicas sobre la regeneración miocárdica y el remodelado ventricular tras un infarto de miocardio.
El uso de PRGF autógeno es sencillo y seguro, no provocando toxicidad ni desencadenando reacciones inmunológicas ni inflamatorias.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este estudio.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores quieren agradecer a Ina Beltrán de Heredia sus excelentes cuidados de veterinaria al rebaño mientras duró el estudio, y a Ana Aguirre, Mar Artal, Noemí Gutiérrez, Gema Alonso, Esther Corral y Alberto Ortega su ayuda técnica y funciones de enfermería durante la cirugía experimental.