Determinar los efectos del entrenamiento físico prolongado sobre la función y remodelación del ventrículo izquierdo después del infarto miocárdico.
MétodosFueron estudiados 90 pacientes con un primer infarto miocárdico agudo, de localización anterior; todos recibieron el tratamiento médico convencional. Se realizaron pruebas de esfuerzo máximas, ecocardiogramas y ventriculografías isotópicas en reposo y esfuerzo a los 2, 6 y 12 meses de evolución; el seguimiento clínico medio fue de 36.3±17 meses. A todos se les incorporó a un programa de rehabilitación cardíaca con entrenamiento físico moderado o intenso, durante un año como mínimo. Un 41.1% tuvieron una disfunción severa del ventrículo izquierdo.
ResultadosTodos los parámetros ergométricos que expresaron capacidad funcional incrementaron significativamente en la evaluación del sexto mes (p<0.0005), permaneciendo invariables al año. Se comprobó una disminución significativa (p<0.01) de isquemia miocárdica al esfuerzo a los 6 meses. Las variables que midieron tamaño y función del ventrículo izquierdo no se modificaron evolutivamente. La mortalidad total de la serie fue un 13.3%, de causa cardiovascular un 8.9% y la morbilidad un 16.7%.
ConclusionesEl entrenamiento físico prolongado no mostró efectos deletéreos sobre la función y remodelación del ventrículo izquierdo y se obtuvieron efectos funcionales y clínicos beneficiosos en estos pacientes infartados rehabilitados.
To assess the effects of long-term exercise training on the function and remodeling of the left ventricle after myocardial infarction.
MethodsWe studied 90 patients with a first acute anterior-wall myocardial infarction, all received conventional medical treatment. Symptom-limited maximal exercise stress tests, echocardiograms and effort-rest isotopic ventriculographies at 2, 6 and 12 months after myocardial infarction were performed; the follow-up time averaged 36.3±17 months. All patients joined a cardiac rehabilitation program with moderate or intense exercise training lasting at least a year. Of all patients, 41.1% suffered severe left ventricle dysfunction.
ResultsErgometric parameters that expressed functional capacity increased significantly (P<.0005) at the sixth month evaluation and remained unchanged after a year. There was significant decrease (P<.01) of exercise myocardial ischemia at 6 months. The variables that measured size and function of left ventricle did not change during evolution. Morbidity amounted to 16.7% and total mortality of the series was 13.3%, with 8.9% of cardiovascular cause.
ConclusionsLong-term exercise training showed no deleterious effects on left ventricle function or remodeling and beneficial functional and clinical effects were obtained in these rehabilitated postinfarction patients.
El entrenamiento físico (EF) como parte de la rehabilitación cardíaca se prescribe usualmente después del infarto miocárdico (IM) agudo por sus comprobados beneficios sobre la morbilidad, la mortalidad y la calidad de vida1–5; no obstante, determinados efectos sobre el tamaño y la remodelación de ventrículo izquierdo (VI), importante factor pronóstico, pueden ser aun mejor precisados.
Según Pfeffer y St. John Sutton6, la remodelación ventricular es un término que describe la adaptación biológica de las cámaras cardíacas para ajustar su tamaño y configuración en respuesta a alteraciones crónicas de la carga hemodinámica. Sin embargo, la remodelación después del IM se caracteriza por una pérdida abrupta del tejido contráctil que conlleva un adelgazamiento y elongación del segmento infartado; la misma puede ser afectada por diversos factores bien conocidos como es el tamaño del infarto, el estrés de la pared ventricular y la isquemia persistente; algunos medicamentos, como los betabloqueadores y los inhibidores de la enzima convertidora de la angiotensina, pueden tener efectos favorables7–13. Otros factores pocos conocidos, como el ejercicio físico, pueden también afectar el proceso de remodelación ventricular después del IM.
Diversas investigaciones en laboratorios de experimentación han sido realizadas en humanos14–16 o animales17–20 para tratar de precisar los efectos de variados tipos o métodos de ejercicios físicos u otros procedimientos como la implantación de células madres21,22 sobre la remodelación y función ventricular después del IM agudo, habiéndose obtenido resultados prometedores, aunque algunos de ellos contradictorios16,17.
El objetivo de nuestro estudio fue evaluar la evolución clínica, así como la función y el tamaño del VI de pacientes con un IM agudo de pared anterior incorporados durante un año a un programa de EF con ejercicios aerobios moderados o intensos.
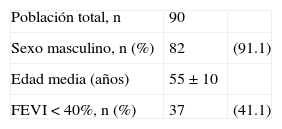
MétodosFueron incluidos en el estudio 90 pacientes, de ambos sexos y sin límite de edad, con el diagnóstico confirmado de IM transmural agudo, de localización anterior, según los criterios de la Sociedad Europea de Cardiología/American College of Cardiology23, egresados vivos del Instituto de Cardiología y Cirugía Cardiovascular de La Habana y que consecutivamente se incorporaron al programa ambulatorio del Centro de Rehabilitación Cardíaca de dicha institución24,25, que fue prescrito por lo menos un año. Se indicó a todos los pacientes un régimen de EF de moderada o elevada intensidad (60-80% de la frecuencia cardíaca de reserva), con una frecuencia de 3 a 5 sesiones por semana y una duración de 30 a 45min cada una. Todas las sesiones de ejercicios se realizaron bajo la supervisión de licenciados en Cultura Física y fisioterapeutas, así como bajo control telemétrico de la frecuencia cardíaca y una derivación electrocardiográfica (CM5). El EF consistió en sesiones con intervalos de calistenia, a manera de «calentamiento», así como ejercicios complementarios de acondicionamiento para incrementar la fuerza, la elasticidad y el equilibrio. También pedaleo en un cicloergómetro vertical, a 50rpm, caminata o carrera en una correa sin fin, así como el empleo de un simulador de remos, todos con la intensidad necesaria para alcanzar y mantener el pulso de entrenamiento predeterminado durante 15 a 30min como mínimo.
A 53 pacientes (59%) se les efectuó trombólisis sistémica con estreptocinasa recombinante en las primeras 6h de evolución del IM; a ninguno se le realizó angioplastia coronaria primaria. Solamente un paciente presentó choque cardiogénico en las primeras 24h de evolución del IM, con evolución satisfactoria con tratamiento farmacológico. El 98% de los casos recibió tratamiento temprano con inhibidores de la enzima convertidora de la angiotensina y el 70% con betabloqueadores. Otra medicación prescrita durante la hospitalización se describe en la tabla 1.
Características demográficas y clínicas
| Población total, n | 90 | |
| Sexo masculino, n (%) | 82 | (91.1) |
| Edad media (años) | 55±10 | |
| FEVI<40%, n (%) | 37 | (41.1) |
| Medicación | n | % |
| Estreptocinasa recombinante mediante TS | 53 | 59 |
| IECA | 88 | 98 |
| Betabloqueadores (atenolol) | 63 | 70 |
| Nitratos | 51 | 57 |
| Diuréticos | 25 | 28 |
| Antagonistas del calcio | 9 | 10 |
| Antiagregantes plaquetarios | 75 | 83 |
| Estatinas | 75 | 83 |
FEVI: fracción de expulsión de ventrículo izquierdo; IECA: inhibidores de la enzima convertidora de la angiotensina; TS: trombólisis sistémica.
Se les realizó seguimiento clínico mediante consultas cardiológicas periódicas en dicho centro, con un tiempo medio de seguimiento de 36.3±17 meses (rango: 3 a 108). Para su evaluación funcional se les efectuaron pruebas de esfuerzo máximas o limitadas por síntomas, ecocardiogramas bidimensionales, ventriculografías isotópicas en reposo y esfuerzo con tecnecio 130 a los 2 (prueba basal), 6 y 12 meses de evolución del IM; en igual período se les efectuó también radiografía dorsoventral para el corazón con distancia foco-película de 2m (telecardiograma). Las pruebas de esfuerzo se efectuaron en un cicloergómetro eléctrico vertical Siemens-Elema 130 (Alemania); se aplicaron cargas de trabajo continuas, sin pausas de reposo intermedio, con una carga inicial de 25w, a manera de calentamiento, e iguales incrementos de 25w cada 3min hasta que se alcanzara la frecuencia cardíaca máxima predicha (220latidos–edad) o se presentaran signos o síntomas que constituyeran criterio de interrupción de la prueba. El esfuerzo se realizó bajo monitorización continua de la frecuencia cardíaca y respiratoria, así como con tomas periódicas de la presión arterial, con una frecuencia de pedaleo de 50rpm y se efectuó registro electrocardiográfico de 12 derivaciones cada minuto, que se continuó hasta 10min después de finalizado el ejercicio, con el paciente en posición de decúbito supino. No se interrumpió el tratamiento médico para la ejecución de ninguna de las pruebas evaluadoras26. Se determinó consumo de oxígeno directo mediante el análisis de gases espirados durante el esfuerzo, utilizando un equipo Schiller CS-200 (Suiza).
Se consideró prueba de esfuerzo positiva de isquemia miocárdica ante la presencia, durante el ejercicio o la recuperación, de desnivel negativo del segmento ST, horizontal o descendente, igual o mayor de 1mm a los 0,08 s después del punto J.
En relación con la carga física de trabajo, obtenida mediante ergometría y expresada en watts, se emplearon los siguientes conceptos:
Carga máxima: mayor carga de trabajo alcanzada.
Carga tolerada: mayor carga que se tolera al menos durante 3min y se alcanza un «steady-state» o estabilización de la frecuencia cardíaca.
Capacidad funcional: carga tolerada en relación con la carga predicha, expresada en porcentaje.
Potencia media: carga media efectuada durante toda la prueba y expresada en watts.
Se consideró incompetencia cronotrópica a la ausencia de incremento fisiológico de la frecuencia cardíaca en relación con la carga de trabajo, o su incremento desproporcionado. Cuando la frecuencia cardíaca no disminuyó en más de un 50% de la máxima alcanzada durante el esfuerzo en el cuarto minuto de la recuperación, se consideró como respuesta anormal.
El ecocardiograma bidimensional y en modo M se efectuó en reposo, con un equipo Toshiba Sonolayer SAC-12.a (Japón), efectuándose cortes en los ejes longitudinal y transversal en las posiciones paraesternal izquierda, subcostal y supraesternal, con cortes hemiaxiales o de 4 cámaras en posición apical. Para la determinación de la fracción de expulsión de ventrículo izquierdo (FEVI) se empleó el método de Simpson26.
Se realizaron ventriculografías isotópicas en equilibrio con el fin de precisar la FEVI y la contractilidad regional de paredes en una gammacámara digital Toshiba GCA-501 (Japón), en proyección oblicua anterior izquierda y se empleó la metodología comúnmente utilizada en nuestro centro26,27.
Para la recolección de los datos y análisis estadístico se empleó una base de datos SPSS, versión 13.0 para Windows (Chicago, Illinois, Estados Unidos). Se empleó una prueba de análisis de varianza para mediciones repetidas multivariadas (ANOVA) para evaluar las diferencias en el tiempo dentro del grupo y la prueba de Chi cuadrado para el estudio de las variables cualitativas o categóricas. Las cifras mostradas en las tablas 2 y 3 representan los valores medios±desviación estándar de la muestra y se consideraron diferencias estadísticamente significativas cuando hubo una p<0,05. Se trata de un estudio longitudinal de intervención, prospectivo, abierto, no controlado, realizado en pacientes consecutivos, no seleccionados, todos los cuales ofrecieron su consentimiento informado antes de ingresar en el estudio, cuyo protocolo había sido previamente evaluado y aprobado por el Comité de Ética del Consejo Científico de la propia institución.
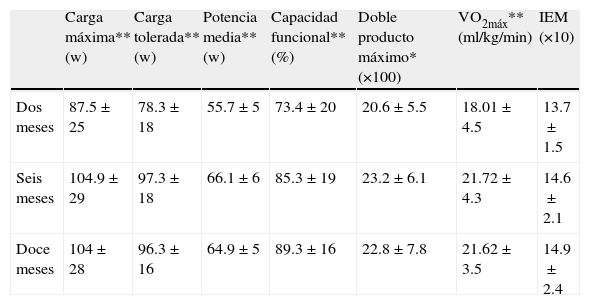
Variables que expresan aptitud física en pruebas de esfuerzo seriadas
| Carga máxima** (w) | Carga tolerada** (w) | Potencia media** (w) | Capacidad funcional** (%) | Doble producto máximo* (×100) | VO2máx** (ml/kg/min) | IEM (×10) | |
| Dos meses | 87.5±25 | 78.3±18 | 55.7±5 | 73.4±20 | 20.6±5.5 | 18.01±4.5 | 13.7±1.5 |
| Seis meses | 104.9±29 | 97.3±18 | 66.1±6 | 85.3±19 | 23.2±6.1 | 21.72±4.3 | 14.6±2.1 |
| Doce meses | 104±28 | 96.3±16 | 64.9±5 | 89.3±16 | 22.8±7.8 | 21.62±3.5 | 14.9±2.4 |
IEM: índice de eficiencia miocárdica; VO2máx: consumo máximo de oxígeno; w: watts.
Seis meses vs. 2 meses: * p=0,001, ** p=0.0005.
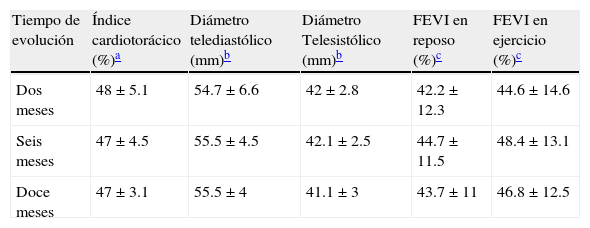
Tamaño y función cardíaca evaluados por radiología, ecocardiografía y ventriculografía isotópica en reposo y esfuerzo*
| Tiempo de evolución | Índice cardiotorácico (%)a | Diámetro telediastólico (mm)b | Diámetro Telesistólico (mm)b | FEVI en reposo (%)c | FEVI en ejercicio (%)c |
| Dos meses | 48±5.1 | 54.7±6.6 | 42±2.8 | 42.2±12.3 | 44.6±14.6 |
| Seis meses | 47±4.5 | 55.5±4.5 | 42.1±2.5 | 44.7±11.5 | 48.4±13.1 |
| Doce meses | 47±3.1 | 55.5±4 | 41.1±3 | 43.7±11 | 46.8±12.5 |
* p: n.s.
La edad media de los pacientes fue de 55±10 años, con un rango de 30 a 77, de ellos 82 fueron del sexo masculino (91%); 37 de ellos (41,1%) tuvieron una FEVI menor del 40%, por lo que fueron considerados como portadores de una disfunción ventricular severa (tabla 1). Los pacientes tuvieron un 85% de asistencia media a las sesiones de EF, más del 90% alcanzaron el pulso de entrenamiento durante las sesiones de ejercicios y no se presentaron complicaciones durante dichas sesiones.
Al evaluar las variables ergométricas que expresan aptitud física, observamos en la tabla 2 que todas ellas, excepto el índice de eficiencia miocárdica28, incrementaron significativamente en la evaluación de los 6 meses en comparación con la del segundo mes, manteniendo similares valores al año de evolución del IM. Así, tanto la carga de trabajo máxima, como la carga tolerada y la capacidad funcional mostraron una mejoría significativa en el sexto mes de evolución; igual comportamiento mostraron el doble producto en carga máxima y el consumo de oxígeno máximo. El tiempo de ejercicio aumentó significativamente de 8min en la prueba basal a 12 y 13min en las pruebas evolutivas respectivamente (p<0,01).
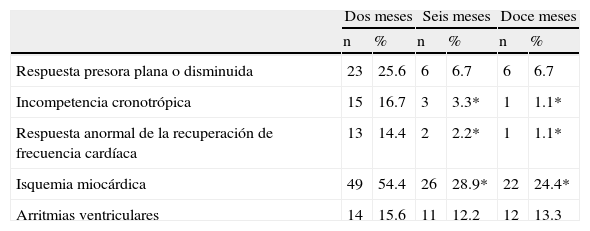
Más de la cuarta parte de los pacientes (25.6%) mostraron una respuesta plana o disminuida de la presión arterial sistólica al ejercicio en la prueba de esfuerzo inicial, disminuyendo a un 6.7% de ellos en las pruebas sucesivas (p: n.s.). El 57% de los casos mostró una respuesta presora normal al esfuerzo en la prueba de los 2 meses y un 16% tuvo una respuesta hipertensiva, los cuales no mostraron cambios significativos en las evaluaciones ergométricas posteriores (tabla 4).
Comportamiento de otras variables durante pruebas de esfuerzo
| Dos meses | Seis meses | Doce meses | ||||
| n | % | n | % | n | % | |
| Respuesta presora plana o disminuida | 23 | 25.6 | 6 | 6.7 | 6 | 6.7 |
| Incompetencia cronotrópica | 15 | 16.7 | 3 | 3.3* | 1 | 1.1* |
| Respuesta anormal de la recuperación de frecuencia cardíaca | 13 | 14.4 | 2 | 2.2* | 1 | 1.1* |
| Isquemia miocárdica | 49 | 54.4 | 26 | 28.9* | 22 | 24.4* |
| Arritmias ventriculares | 14 | 15.6 | 11 | 12.2 | 12 | 13.3 |
Seis y 12 meses vs. 2 meses: * p<0.01.
Un 16.7% de los pacientes mostró signos de incompetencia cronotrópica en la prueba inicial, disminuyendo significativamente (p<0,01) en las evaluaciones de los 6 y 12 meses. También se comprobó una disminución significativa evolutiva de respuesta anormal de la frecuencia cardíaca durante la recuperación después del esfuerzo máximo(tabla 4).
El 54% de los pacientes mostró signos de isquemia miocárdica al esfuerzo en la prueba inicial, disminuyendo al 29 y 24% en las pruebas de los 6 y 12 meses respectivamente (p<0,01). Las arritmias ventriculares, principalmente contracciones ventriculares prematuras, se presentaron en un 16% en la ergometría de los 2 meses y en un 12 y 13% en las siguientes evaluaciones (p: n.s.).
El índice cardiotorácico, evaluado mediante estudio radiológico de corazón, tuvo un valor medio de 0.48 a los 2 meses, sin cambios significativos posteriores. En la evaluación ecocardiográfica se encontraron cifras medias de 54.7mm de diámetro telediastólico y de 42mm de diámetro telesistólico a los 2 meses, con similares valores posteriores. La FEVI media en reposo, determinada mediante ventriculografía radiosiotópica, fue de 42.2% y en ejercicio de 44.6%, con ligeros incrementos no significativos de ambas en las evaluaciones posteriores (p: n.s) (tabla 3).
El estado clínico de los pacientes en el momento de la última consulta externa reportada fue como sigue: asintomáticos, 68 casos (75.5%); con angina de pecho, 17 casos (18.9%); y con síntomas de insuficiencia cardíaca, 5 casos (5.5%). En el primer semestre de evolución después del IM se habían reportado 29 casos con angina (32.2%), 8 con insuficiencia cardíaca (8.9%) y asintomáticos 53 de ellos (58.9%).
En el tiempo de seguimiento, la serie mostró una mortalidad general de un 13.3%, de ella un 8.9% de causa cardiovascular. El tiempo medio de ocurrencia de la muerte fue de 24.5±12 meses, con un rango de 3 a 49 meses. En cuanto a la morbilidad, un 6% tuvo reinfarto cardíaco no fatal, un 7% reingresó por angina de pecho, un 3% por insuficiencia cardíaca y un 1% mostró arritmia ventricular peligrosa, con riesgo inminente para la vida del paciente. Se destacó que el 70% de los casos no presentó complicación alguna durante el tiempo de seguimiento.
DiscusiónMientras que Jugdutt et al.29 informaron en 1988 un deterioro funcional y topográfico del corazón provocado por los ejercicios físicos en algunos pacientes infartados, otros autores30–34 han comprobado una mejoría de los parámetros funcionales en ausencia de cambios sobre el proceso de remodelación del VI. Nuestros resultados coinciden con estos trabajos, pues pudimos comprobar en estos pacientes infartados e incorporados a un programa de rehabilitación con EF de duración prolongada que las variables ergométricas que expresan aptitud física, incluida la capacidad funcional, incrementaron significativamente a los 6 meses de evolución, mejoría que se mantuvo al año de seguimiento clínico en estos casos que aun se mantenían adheridos al programa de ejercicios; ello evidenció una mejoría notable de la calidad de vida de tales pacientes. Igualmente en nuestro estudio todas las variables radiológicas, ecocardiográficas e incluso radioisotópicas, que determinarían cambios en la morfología o dimensiones del VI, no mostraron variaciones evolutivas lo que reflejó la ausencia de progresión de la remodelación ventricular en estos casos con EF en los que se había comprobado afectación inicial de la función de VI, si tenemos en cuenta la moderadamente baja capacidad funcional, el disminuido consumo máximo de oxígeno, y también la disminución moderada de la FEVI, tanto en reposo como en ejercicio.
También el doble producto en ejercicio máximo (con un valor medio de 20.600) se correspondió con un nivel que expresó disfunción de VI y aunque mostró un incremento significativo evolutivo, su valor siempre estuvo en cifras correspondientes a presencia de compromiso de la función cardíaca. Por el contrario, el índice de eficiencia miocárdica, como fue descrito por Aptecar et al.28, y que considera principalmente la extensión y severidad de la enfermedad coronaria, así como la función contráctil del VI, no evidenció cambios evolutivos significativos en estos pacientes infartados y entrenados, aunque sus valores estuvieron desde el inicio en las cifras inferiores de la normalidad; probablemente por estar este índice en niveles normales desde la evaluación inicial, no propició un incremento evolutivo.
Los efectos de la isquemia aguda o recurrente sobre la función ventricular están bien establecidos, sin embargo el papel de la isquemia de esfuerzo sobre el proceso de remodelación después del IM aun no está definitivamente establecido. En este sentido, Giannuzzi et al.35 señalaron que la isquemia inducida por ejercicios podía contribuir al crecimiento ventricular progresivo en pacientes con pobre función de VI después del IM de pared anterior. Nuestros casos mostraron una disminución significativa de la presencia de isquemia miocárdica al esfuerzo en el total de la serie en la evaluación ergométrica del sexto mes, efecto mantenido aun al año de evolución, lo cual pudo estar relacionado con la ausencia de incremento de los signos de remodelación de VI, así como con la adecuada evolución clínica observada.
Las arritmias ventriculares durante el esfuerzo tuvieron igual comportamiento que en series anteriores nuestras en pacientes infartados con o sin compromiso de la función ventricular24,26 y no mostraron cambios evolutivos, por lo que no fueron de utilidad para evaluar los efectos del EF sobre la remodelación del VI.
Nuestros casos mostraron FEVI medias en reposo y ejercicio correspondientes a disfunción sistólica moderada de VI y si bien no comprobamos una mejoría evolutiva de este parámetro tampoco se evidenció un deterioro progresivo de la función del VI lo que concuerda con la ausencia de incremento de la remodelación ventricular antes señalada. Sin embargo el estudio Exercise in Left Ventricular Dysfunction (ELVD)36 reportó en 1997 que el EF atenuaba el desfavorable proceso de remodelación y aumentaba con el tiempo la función del VI en pacientes infartados con disfunción ventricular, incorporados a un programa de 2 meses de duración. Estudios más recientes han encontrado similares resultados37. La mejoría evolutiva de la competencia cronotrópica así como de la recuperación de la frecuencia cardíaca después del esfuerzo máximo en nuestra serie apoyan el criterio del incremento de la función del VI en estos pacientes infartados y rehabilitados con EF de larga duración.
En el metaanálisis publicado por Haykowsky et al. en 201138 se concluyó que el EF tuvo efectos beneficiosos sobre la función y remodelación del VI en pacientes con IM estables clínicamente; observaron los mayores beneficios cuando el programa de ejercicios se iniciaba tempranamente después del IM, desde una semana, y tenía una duración mayor de 3 meses. Señalaron también que demorar el EF una semana después del IM requeriría un mes de entrenamiento adicional para alcanzar iguales cambios de la FEVI. En nuestro estudio los pacientes se incorporaron al programa de EF en los primeros 15 días después del IM y se mantuvieron adheridos al mismo por lo menos un año.
Aun no están bien establecidos los mecanismos fisiológicos que originan el efecto «antirremodelación» del EF después del IM, no obstante pueden estar en relación con la mejoría de la función endotelial coronaria y vascular periférica39,40, la contractilidad miocárdica41, el estrés sistólico o diastólico de la pared ventricular15,42 o del balance autonómico43. También Giallauria et al.44,45 han señalado la disminución en plasma del péptido natriurético cerebral tipo B después del EF, lo cual reduce el volumen telediastólico del VI, entre otros efectos beneficiosos.
Tales efectos «antirremodelación» obtenidos de programas de EF prolongados pueden explicar la disminución de la mortalidad de pacientes infartados incorporados a programas de rehabilitación cardíaca1–3,38,46. En nuestro estudio, con una prolongada adhesión al programa de rehabilitación y un largo seguimiento clínico, obtuvimos una relativamente baja morbimortalidad cardiovascular, si tenemos en cuenta que se trató de pacientes de elevado riesgo por ser portadores de infartos de gran tamaño y con afectación marcada de la función cardíaca. Al final del estudio incrementó el número de pacientes asintomáticos y hubo una tendencia a la disminución de los casos con angina o síntomas de insuficiencia cardíaca. Más del 70% de los casos estuvo libre de síntomas o no presentó complicación alguna durante los más de 3 años de seguimiento medio de la serie, lo que puso de manifiesto el incremento de la calidad de vida de estos pacientes. Por tratarse de un estudio en el que, por consideraciones éticas locales, no se incluyó a un grupo control, no podemos arribar a conclusiones definitivas en este sentido. Estudios controlados previos han informado significativamente de menor frecuencia de eventos clínicos adversos en grupos entrenados en comparación con grupos controles durante un período de 6 meses15,38,47.
ConclusionesEn nuestro programa de rehabilitación cardíaca en pacientes con IM de pared anterior, donde se incluyó un régimen temprano y prolongado de EF de moderada o elevada intensidad, observamos efectos funcionales y clínicos beneficiosos sin efectos deletéreos sobre la remodelación ventricular. Se requiere aun de nuevos estudios controlados y aleatorizados para confirmar la efectividad del EF sobre la remodelación del VI después del IM.