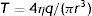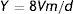La regulación fisiológica de la función vascular es esencial para la salud cardiovascular y depende de un adecuado control de mecanismos moleculares desencadenados por células endoteliales en respuesta a estímulos mecánicos y químicos inducidos por flujo sanguíneo. La disfunción endotelial es uno de los principales factores de riesgo de enfermedad cardiovascular, donde un desequilibrio entre la síntesis de moléculas vasodilatadoras y vasoconstrictoras constituye uno de sus principales mecanismos. En este contexto, el estrés de flujo es uno de los estímulos más importantes para mejorar la función vascular, gracias a que la mecanotransducción endotelial generada por la estimulación de diversos mecanosensores endoteliales induce la generación de estímulos intracelulares que culmina con un incremento en la biodisponibilidad de moléculas vasodilatadoras como el óxido nítrico y, a largo plazo, con la inducción de mecanismos angiogénicos. Estos mecanismos permiten proporcionar el sustento fisiológico a los efectos del ejercicio físico sobre la salud vascular. En la presente revisión se discuten los mecanismos moleculares implicados en la respuesta vascular modulada por estrés de flujo inducido por ejercicio y su impacto en la reversión del daño vascular asociado a las enfermedades cardiovasculares más prevalentes en nuestra población.
The physiological regulation of vascular function is essential for cardiovascular health and depends on adequate control of molecular mechanisms triggered by endothelial cells in response to mechanical and chemical stimuli induced by blood flow. Endothelial dysfunction is one of the major risk factors for cardiovascular disease, where an imbalance between synthesis of vasodilator and vasoconstrictor molecules is one of its main mechanisms. In this context, the shear stress is one of the most important mechanical stimuli to improve vascular function, due to endothelial mechanotransduction, triggered by stimulation of various endothelial mechanosensors, induce signaling pathways culminating in increased bioavailability of vasodilators molecules such as nitric oxide, that finally trigger the angiogenic mechanisms. These mechanisms allow providing the physiological basis for the effects of exercise on vascular health. In this review it is discussed the molecular mechanisms involved in the vascular response induced by shear stress and its impact in reversing vascular injury associated with the most prevalent cardiovascular disease in our population.
La disfunción endotelial es una condición que se caracteriza por un desequilibro en la regulación de la homeostasis vascular, predisponiendo a la pared de los vasos sanguíneos al desarrollo de vasoconstricción, adhesión de leucocitos, activación plaquetaria, estrés oxidativo, trombosis y coagulación1–3. Hoy en día es ampliamente aceptado que este desequilibrio subyace a la patogénesis de la mayoría de las enfermedades cardiovasculares (ECV) y metabólicas1–6.
La relación entre flujo sanguíneo y función endotelial es determinante para la función vascular. Se ha demostrado que el estrés de flujo (EF) constituye el principal estímulo mecánico sobre el endotelio vascular7, generando una respuesta adaptativa gracias a la regulación en la expresión de proteínas que cumplen funciones vasodilatadoras, antiinflamatorias, antioxidantes y de factores de crecimiento involucrados en procesos de angiogénesis y vasculogénesis8,9. Las vías de señalización implicadas se integran desde el estímulo mecánico percibido por la célula, hasta la generación de una señal intracelular vía segundos mensajeros que da origen a una respuesta adaptativa del lecho vascular10.
En la presente revisión se pretende discutir, de manera integral, el efecto de las distintas modalidades de ejercicio físico sobre el patrón de flujo sanguíneo, las respuestas y adaptaciones microvasculares inducidas por la modulación del EF sobre la pared vascular, así como también el efecto fisiológico del ejercicio en la reversión de la disfunción endotelial en la ECV.
Estrés de flujoLas fuerzas hemodinámicas ejercidas por la sangre expulsada por el corazón durante el ciclo cardiaco impactan significativamente en la pared vascular. Estas fuerzas corresponden a la presión de pulso y al EF. La presión de pulso (diferencia entre la presión sistólica y la diastólica) produce tensión radial en las paredes de los vasos sanguíneos, lo que induce la distensión de su pared durante la sístole. Por su parte el EF corresponde al estrés friccional que ejerce el flujo sanguíneo sobre el endotelio vascular. En la mayoría de los estudios el EF es medido de acuerdo a la ley de Poiseuille. In vitro, el EF es generalmente derivado desde las mediciones de flujo (q), radio de la luz (r) y viscosidad del medio (¿) según la siguiente ecuación11.
Por su parte, en estudios clínicos, el EF puede ser calculado a través de la viscosidad sanguínea y la tasa de cizallamiento (γ); siendo este último estimado desde las mediciones de velocidad de flujo sanguíneo (Vm) y diámetro arterial interno al final del diástole (d) según la ecuación:
Donde Vm es la velocidad media de flujo y d el diámetro interno del vaso al final de la diástole. Aplicando la ley de Poiseuille, se ha calculado que el valor del EF en arterias de conducción es de 1.5Pa (15 dyn/cm−2)11.
Diversos métodos se encuentran actualmente disponibles para determinar la tasa de cizallamiento en vasos sanguíneos de acuerdo a su calibre. En arteriolas es habitualmente empleado el método basado en partículas fluorescentes como trazadores de velocidad de flujo; en arterias de conducción, doppler pulsado multicanal, técnicas de ultrasonido y resonancia magnética12.
La magnitud y tipo de EF producido sobre la pared de los vasos, así como la anatomía del árbol vascular, son determinantes para la respuesta al EF12. En zonas de curvatura y ramificación arterial, donde el flujo es bajo y oscilatorio, tienden a ocurrir los eventos ateroscleróticos iniciales13,14. Suo et al. demostraron que los patrones de flujo en aorta ascendente contribuyen a un medioambiente proaterosclerótico principalmente donde el EF fue bajo y oscilatorio. Esto ocurre específicamente en la vecindad de los senos de Valsalva, indicando que un EF bajo se asocia con mayor incidencia de lesiones, mientras que un EF alto se asocia con aéreas resistente a lesión14. Adicionalmente, se ha observado que el EF se relaciona positivamente con un aumento del engrosamiento de la pared arterial y de manera negativa con la formación de placas de ateroma con estenosis avanzada15.
A nivel molecular, la respuesta electrofisiológica del endotelio al EF laminar genera una respuesta caracterizada por hiperpolarización inmediata y despolarización tardía, mientras que el EF oscilatorio genera solo hiperpolarización, siendo el canal de K+ rectificador interno (Kir) y al canal de Cl− rectificador externo (ORCC) los principales mecanosensores de esta respuesta16,17. Las corrientes hiperpolarizantes producidas por el flujo laminar permite la generación de un influjo de Ca2+ en la célula endotelial, activando vías de señalización dependientes del complejo Ca2+/calmodulina como la del óxido nítrico (NO)16,18. Recientemente Figueroa et al. demostraron, en vasos de resistencia, que el EF induce la producción de NO en células endoteliales. Adicionalmente observaron que para este mecanismo se requiere de la translocación de la enzima óxido nítrico sintasa endotelial (eNOS) desde la membrana celular a compartimentos intracelulares, mediante un mecanismo mediado por Ca2+; así como también de la fosforilación mediada por la vía de señalización mediada por fosfoinositol 3 kinasa-Akt (PI3K-Akt)19.
La respuesta crónica al EF, junto con involucrar la activación del complejo eNOS/NO20, también se asocia a la activación de vías de señalización mediadas por cinasas reguladas por señales extracelulares (ERK) y cinasas c-Jun (JNK)21. Adicionalmente, existe un aumento en la expresión de genes vinculados con la defensa antioxidante y anticoagulación, así como también disminución en la expresión de genes vinculados a proliferación de matriz extracelular y proteínas de adhesión9. Los mecanismos desencadenados por EF, a largo plazo, inducen la diferenciación de células progenitoras endoteliales (CPE)22, así como también, la expresión del factor de crecimiento vascular endotelial y su receptor, lo cual da inicio a la angiogénesis23–26.
Estrés de flujo durante el ejercicio: bases fisiológicasEn reposo, el flujo sanguíneo en las arterias de conducción posee un patrón monofásico, puesto que sigue un curso anterógrado durante la sístole y se reduce a cero durante la diástole27. Sin embargo, en ejercicio, existe una gran variabilidad de patrones de flujo en respuesta a las distintas cargas de trabajo. En arteria braquial se han observado aumentos significativos del flujo sanguíneo máximo durante la sístole conforme aumenta la carga de trabajo de extremidades inferiores. No obstante, en diástole se observa un patrón de flujo retrógrado27. En arterial braquial fue observado que el flujo retrógrado diastólico disminuye el flujo sanguíneo medio en intensidades bajas de ejercicio. Lo cual es revertido a medida que aumenta progresivamente la carga de trabajo27,28. Por otra parte, en el ejercicio focalizado en miembros superiores solo se han evidenciado incrementos del flujo anterógrado proporcionales a la intensidad de trabajo29.
Respecto al EF inducido por las distintas modalidades de ejercicio, Gurovich et al. demostraron que el ejercicio de resistencia aumenta el EF anterógrado y retrógrado tanto en la arteria braquial como en la arteria femoral de una manera dependiente de la intensidad. Por otra parte, durante el entrenamiento de fuerza también aumentó el EF anterógrado y retrógrado en la arteria femoral, sin embargo, en la arteria braquial solo el EF anterógrado incrementó significativamente. Adicionalmente, se observó un aumento en el número de Reynolds en ambos patrones de flujo (anterógrado y retrógrado) durante el ejercicio, evidenciando la presencia de flujo turbulento anterógrado (número de Reynolds>4,000) durante el ejercicio de resistencia en arteria femoral y braquial, así como flujo subturbulento retrógrado y anterógrado (número de Reynolds entre 2,000 y 4,000) durante el ejercicio de fuerza en ambas arterias30.
Ejercicio agudoComo fue revisado precedentemente, el ejercicio produce cambios en el patrón de flujo sanguíneo caracterizados por incrementos en el EF sobre la pared de las arterias de conducción27,28. Esto desencadena la liberación de sustancias vasodilatadoras desde el endotelio y produce la vasodilatación mediada por flujo (VMF)31. Se ha demostrado que el NO es esencial para la VMF en arterias de conducción humana, puesto que la infusión del inhibidor de eNOS NG-monometil-L-arginina inhibe esta respuesta tanto en vasos de miembros superiores como inferiores31–33. Incluso, se ha observado que el ejercicio de extremidades inferiores genera adaptaciones vasculares dependientes de NO en extremidades superiores inactivas, lo cual demuestra que el estrés hemodinámico inducido por ejercicio modula la síntesis de NO a nivel sistémico27,28. Recientemente Green et al., mediante una revisión sistemática de la literatura, demostraron que más del 50% de la respuesta dilatadora durante la VMF, observada en humanos, es atribuible al aumento en la biodisponibilidad de NO desencadenado por el flujo sanguíneo34. Estos resultados confirman, con un alto nivel de videncia, la asociación existente entre NO y EF.
En relación con el efecto de las variaciones del flujo vascular, algunos estudios muestran que el patrón de flujo sanguíneo desarrollado durante el ejercicio agudo afecta la biodisponibilidad de NO, debido a que la VMF sería inhibida al disminuir el EF anterógrado, así como también incrementos absolutos del EF retrógrado podrían reducir la reactividad vascular35,36. Por otra parte, se ha observado que altas intensidades de ejercicio físico (90% VO2 máx) podrían atenuar las ganancias en la función endotelial producidas por el ejercicio dinámico debido al alto nivel estrés oxidativo generado a esas cargas de trabajo37–39.
Los mecanismos subyacentes de la respuesta vascular al ejercicio agudo han sido atribuidos a incrementos en la fosforilación de diversos aminoácidos de proteínas claves asociadas con la regulación de la actividad de la enzima eNOS. En este contexto, Zhang et al. observaron, en roedores, que 50min de ejercicio en cinta rodante incrementa la fosforilación de Akt/proteína cinasa B (Akt/PKB) en serina 473, proteína CREB en serina 133 y proteína cinasa activada por AMP (AMPK) en treonina 173. Los cuales, confluyen en la fosforilación de la eNOS en serina 1177 y serina 617. Además verificaron que la inhibición de la vía de señalización Akt/PKB reduce la fosforilación de eNOS en un 50%; no obstante, no sería un factor limitante para su activación40.
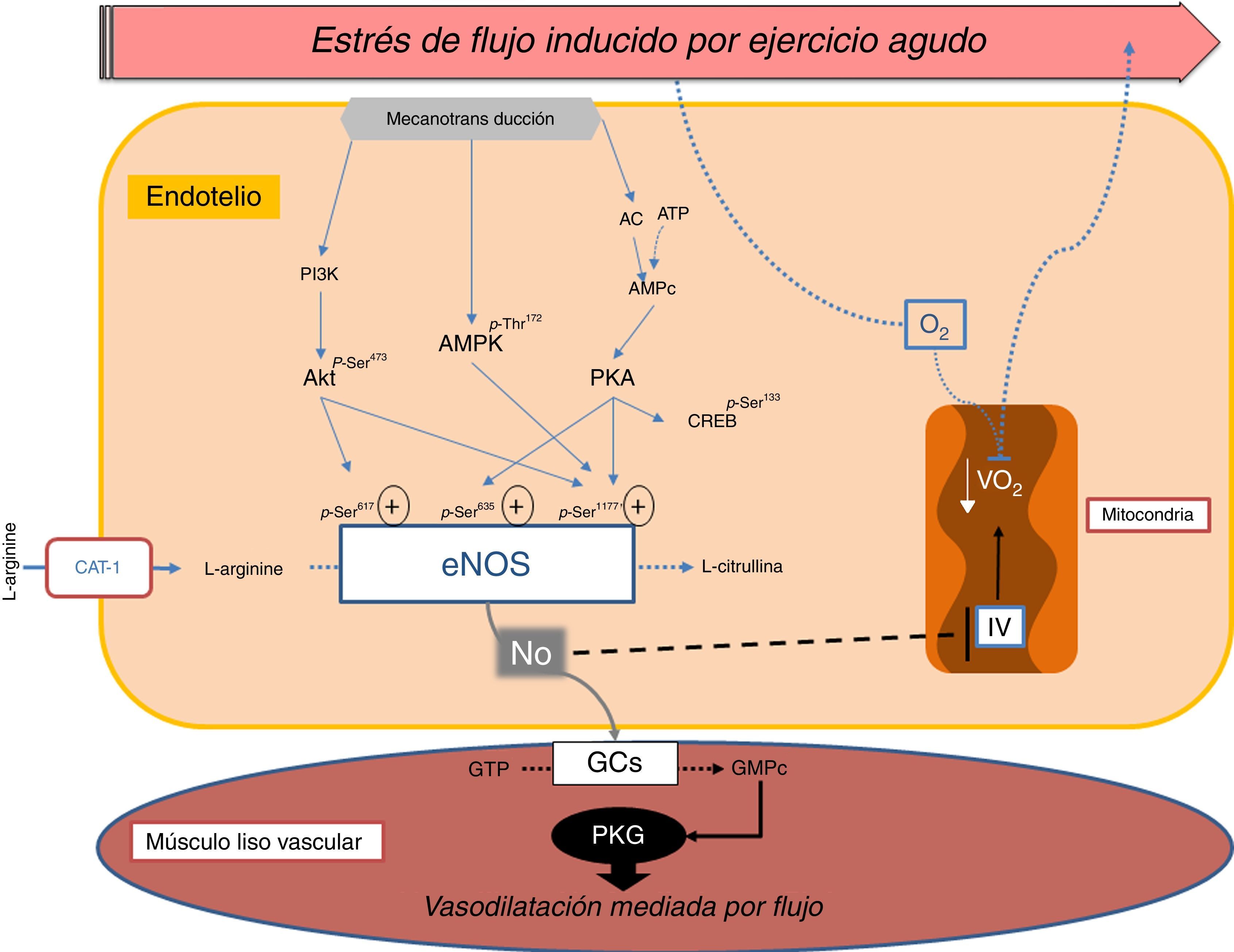
Recientemente han adquirido relevancia los estudios dirigidos a determinar los cambios en la regulación bioenergética de la célula endotelial inducidos por EF y ejercicio. Hoy en día, existe un sinnúmero de reportes que confirman que la principal fuente de trifosfato de adenosina de la célula endotelial no es la fosforilación oxidativa mitocondrial, sino la glucólisis41–43. Incluso, observaciones muestran que la conversión de fructosa-6-fosfato a fructosa-1,6-bisfosfato, a través de la enzima 6-fosfofructo-1-cinasa, sería un factor determinante en la supervivencia endotelial, tanto en condiciones fisiológicas como patológicas44. En este contexto, es establecido que la activación de la vía eNOS/NO inhibe al complejo iv de la cadena transportadora de electrones (citocromo oxidasa c) de una manera inversamente proporcional a la concentración de O2 tisular, es decir, cuando la concentración local de O2 cae, el NO restringe la fosforilación oxidativa permitiendo difundir el O2 a los tejidos periféricos45. Recientemente Kim et al. aportaron datos interesantes a este mecanismo, al observar, en cultivo de células endoteliales de aorta humana, que el EF laminar indujo la expresión de proteínas claves relacionadas con la biogénesis mitocondrial, lo cual se asoció con un aumento significativo de la masa mitocondrial en las células expuesta al EF. No obstante, solo fue observado un incremento en la tasa de consumo de oxígeno endotelial luego de periodos prolongados de exposición al EF46. En la figura 1 se muestra una representación esquemática de los mecanismos que median la respuesta aguda del endotelio al ejercicio.
Imagen esquemática de los mecanismos implicados en la respuesta vascular inducida por estrés de flujo durante el ejercicio agudo.
El ejercicio induce un proceso de mecanotransducción a partir de la apertura de canales de potasio rectificadores internos (Kir2.1), canales de cloruro rectificadores externos (ORCC), activación de receptores acoplados a proteína G y receptores de tirosina cinasa (VEGFR). Lo cual, estimula la síntesis de NO vía eNOS. El NO activa la de guanidilato ciclasa soluble (GCs) en el músculo liso vascular, que transforma GTP en GMP cíclico, lo que conlleva a la relajación del músculo liso vascular. Adicionalmente, el incremento en la biodisponibilidad de NO endotelial disminuye la respiración mitocondrial, favoreciendo la llegada del O2 a nivel tisular.
La exposición repetitiva a ejercicio aeróbico durante periodos prolongados de entrenamiento aumenta la biodisponibilidad de NO en el endotelio, mediante el incremento en la expresión y activación de la enzima eNOS. A largo plazo, existe un aumento en la inducción de factores de transcripción, como el factor semejante a Krüppel-247,48 y Sp149. Esto incrementa la expresión del factor de crecimiento vascular endotelial y su receptor en las células endoteliales, generando así la respuesta angiogénica26,50–52.
Uno de los métodos de estudio del EF in vivo es mediante el tratamiento crónico con prazosina, un antagonista de los receptores α1-adrenergicos, el cual provoca vasodilatación, aumento del flujo sanguíneo y del EF en arteriolas y capilares, de manera semejante a la respuesta observada durante el ejercicio físico53,54. Milkiewicz et al. observaron que el EF inducido por prazosina aumentó la expresión del factor de crecimiento vascular endotelial A y la relación capilar:fibra muscular luego de 2-4 días tras el inicio del tratamiento54. Posteriormente, Baum et al. demostraron que la presencia de la enzima eNOS es fundamental para la angiogénesis inducida por prazosina en músculo esquelético, al observar (en roedores) que el tratamiento crónico con N-omega-nitro-L-arginina metil ester (inhibidor de la enzima eNOS) reduce significativamente el aumento en la relación C:F en los animales tratados53.
Entre los mecanismos que subyacen al aumento en la actividad y expresión de la eNOS inducido por entrenamiento físico, se encuentra la activación de AMPK. Esta proteína es considerada uno de los reguladores claves de la respuesta metabólica durante el ejercicio, puesto que ajusta el consumo y gasto energético muscular de acuerdo a la demanda55. Recientemente Kröler-Schön et al. demostraron que AMPKα1 es un mediador clave en las adaptaciones funcionales del endotelio posterior al entrenamiento físico al observar, en un modelo de rata knock-out para esta enzima (AMPKα1-/−), que la ausencia de esta proteína suprime la expresión del ARNm y fosforilación de la enzima eNOS en el residuo de serina (ser) 1177, posterior a 8 semanas de ejercicio físico voluntario. Esto fue confirmado en los estudios de reactividad vascular, donde fue observada la inhibición del incremento de la dilatación dependiente de endotelio y del aumento en los niveles de nitritos plasmáticos, en los animales AMPKα1-/− posterior al periodo de entrenamiento56.
El único precursor para síntesis de NO es el aminoácido L-arginina, el cual ha mostrado regular la actividad de la enzima eNOS57–59. Este aminoácido entra a la célula endotelial mediante el transportador de aminoácidos catiónicos (CAT-1), el cual es considerado el principal proveedor de sustrato para la síntesis de NO endotelial57,60. Ha sido demostrado que el EF selectivamente incrementa el transporte de L-arginina en el endotelio, fenómeno requerido para la síntesis de NO inducido por EF61. Esto muestra la existencia de interdependencia entre el EF inducido por ejercicio y el transporte de L-arginina. En este sentido, algunos reportes sugieren que el entrenamiento físico aumenta el transporte de L-arginina, lo cual estaría fuertemente asociado con el incremento de la reactividad vascular inducido por ejercicio62,63.
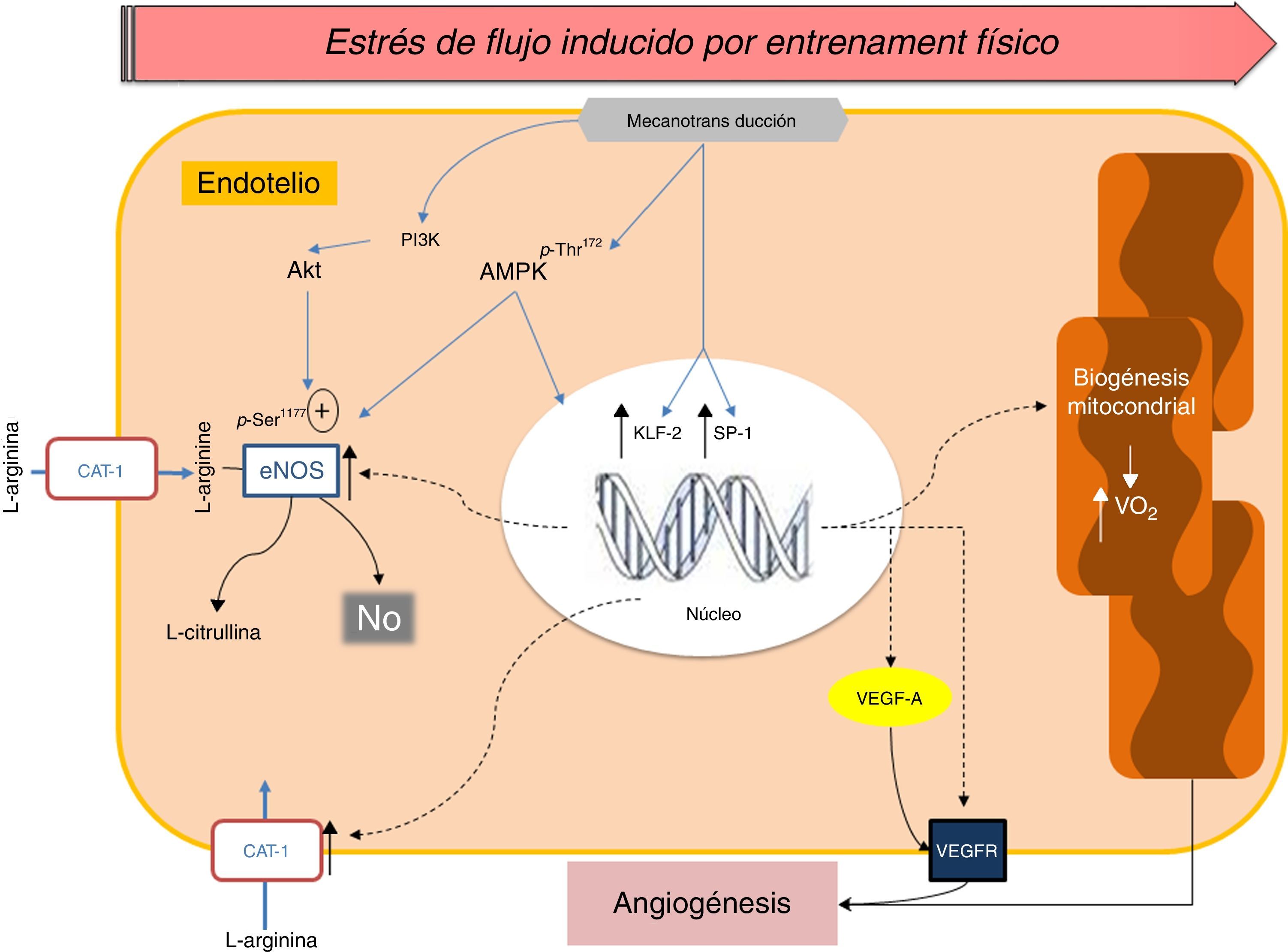
Por otra parte, a diferencia de lo que ocurre en el ejercicio agudo, periodos prolongados de ejercicio físico inducen aumentos en la respiración y biogénesis mitocondrial en la célula endotelial, lo cual, ha sido demostrado, tanto en estudios in vitro42 como en modelos experimentales en roedores46,64. Fue observado recientemente, en aorta abdominal de ratas, que 5 semanas de entrenamiento físico produjo una elevada expresión de ARNm de los marcadores de biogénesis mitocondrial PGC-1α, NRF1, TFAM, p53R2 y SCO1, así como también un mayor contenido de ADN mitocondrial. Interesantemente, estas adaptaciones fueron «territorio-dependientes», debido a que se acentuaron en vasos sin curvatura. Además, en arterias mesentéricas fue observada una reducción del contenido mitocondrial en el grupo de animales entrenados46. Estos resultados apuntan a que la transición metabólica de la célula endotelial (desde un metabolismo glucolítico a un metabolismo aeróbico) es parte de los mecanismos de adaptación inducidos por entrenamiento físico, lo cual pudiese ser un interesante target terapéutico desde el punto de vista farmacológico. Adicionalmente, algunos estudios han mostrado que la inducción de la biogénesis mitocondrial generada por ejercicio se asocia fuertemente con los niveles de micropartículas circulantes (CD31+/CD42a−) liberadas por las células endoteliales, los cuales serían significativamente reducidos (∼40%) después de 6 meses de entrenamiento aeróbico65 (fig. 2).
Imagen esquemática de los mecanismos implicados en la respuesta vascular inducida por estrés de flujo durante el entrenamiento físico.
El incremento sostenido del estrés de flujo sobre la pared endotelial induce mecanismos de señalización que aumentan la activación y expresión de enzimas como: Akt, eNOS, hCAT-1, factor de crecimiento vascular endotelial (VEGF-A) y su receptor (VEGFR). A su vez, la influencia del EF a largo plazo induce la biogénesis mitocondrial y su transición metabólica desde un metabolismo glucolítico a un metabolismo aeróbico.
Con relación al curso temporal de los cambios adaptativos inducidos por ejercicio, se ha visto en arterias de conducción humanas que los cambios funcionales anteceden a los estructurales, observándose incrementos en la biodisponibilidad de NO entre las primeras 2-6 semanas de entrenamiento, para posteriormente dar inicio a la respuesta angiogénica35. Recientemente Schreuder et al. evaluaron el curso temporal de las adaptaciones vasculares en sujetos sanos y con diabetes tipo 2 durante 8 semanas de entrenamiento, observando incrementos en la función endotelial a partir de las 2 semanas de iniciado el protocolo en ambos grupos. Estos incrementos fueron mantenidos durante las 8 semanas de entrenamiento66.
En la figura 2 se muestran los mecanismos de adaptación endotelial inducidos por periodos prolongados de ejercicio (entrenamiento físico).
Impacto clínicoComo ha sido mencionado a lo largo del texto, hoy en día es aceptado que la caída en la biodisponibilidad de NO es un factor patogénico de disfunción endotelial67. Y debido su rol central en la respuesta inducida por EF34, la VMF podría constituir un potencial marcador de riesgo cardiovascuar68. Peters et al. mediante un enfoque metaanalítico observaron que la medición de la VMF, en adición a los parámetros tradicionales de riesgo cardiovascular podría incrementar la exactitud en la estratificación de gravedad de la ECV69. Por otra parte, estudios epidemiológicos realizados en diversas poblaciones sostienen la existencia de una fuerte asociación entre la VMF y factores de riesgo cardiovascular70–72. Recientemente, un metaanálisis realizado por Ras et al. mostró que la VMF braquial está inversamente asociada con ECV futuras, principalmente en aquellos pacientes con una ECV declarada73. Todos estos antecedentes permiten establecer que intervenciones terapéuticas dirigidas al restablecimiento de la VMF podrían contribuir de manera significativa a la prevención y tratamiento de las ECV74. En los párrafos siguientes se discute la evidencia relacionada con el efecto del entrenamiento físico sobre la función endotelial en las ECV más prevalentes de nuestra población.
Hipertensión arterialHoy en día es ampliamente aceptado que la disminución en la biodisponibilidad de NO y la disfunción endotelial son sustratos claves en la patogénesis de la hipertensión arterial75. En este contexto, existe un sinnúmero de estudios avalando el efecto beneficioso del ejercicio físico moderado sobre los incrementos de la dilatación mediada por flujo y presión arterial, tanto en sujetos con hipertensión arterial como en prehipertensos76–80. Interesantemente Nyberg et al. demostraron que 8 semanas de entrenamiento aeróbico de alta intensidad también disminuyó la presión arterial sistólica y la diastólica de sujetos con hipertensión arterial esencial, efecto que fue abolido con la inhibición de la síntesis de NO y sistema prostanoides81.
AterosclerosisLa inhibición en la síntesis de NO, activación endotelial, adhesión e infiltración de leucocitos constituyen etapas esenciales en la formación de lesión aterosclerótica82. Se ha observado que el entrenamiento de intensidad moderada incrementa la expresión y fosforilación de AMPK en vasos de ratas ateroscleróticas, lo cual incrementa la activación y expresión de la enzima eNOS83. En este contexto, el incremento en la biodisponibilidad de NO (inducido por ejercicio) ha mostrado estar asociado con la disminución en los niveles de angiotensina ii, endotelina-1 y la expresión de citocinas proinflamatorias, así como también la expresión del receptor del factor de necrosis tumoral-6 en el lecho vascular de ratas knock-out para apolipoproteína E84.
Estudios realizados en humanos confirman los mecanismos observados en modelos experimentales, al demostrar que la actividad física regular modula la respuesta inflamatoria de bajo grado asociada con la aterosclerosis, al incrementar niveles de citocinas antiinflamatorias, como interleucina (IL) 6, IL-8 e IL-585. Adicionalmente, algunos estudios sostienen, con un alto nivel de evidencia, que la actividad física disminuye los niveles plasmáticos del factor de necrosis tumoral alfa, IL-6, interferón γ, molécula de adhesión celular vascular-1, molécula de adhesión intercelular-1 y los niveles de la proteína C reactiva, así como también aumenta los niveles de CPE86. Estos resultados confirman lo reportado por Jhamnani et al. donde se observó, mediante un enfoque metaanalítico, que el ejercicio físico y modificaciones del hábito alimenticio están fuertemente asociados con la disminución a largo plazo del riesgo aterosclerótico en arterias coronarias y carótidas87.
Enfermedad coronariaHambrecht et al. demostraron que un programa de entrenamiento aeróbico de 30min por 4 semanas incrementó significativamente la VMF de la arteria mamaria interna de pacientes subsidiarios de cirugía de revascularización miocárdica programada. Además, en el análisis in vitro se evidenció una mayor expresión y fosforilación de las enzimas eNOS y Akt en las células endoteliales de la arteria mamaria interna de los sujetos que realizaron ejercicio físico, demostrando que el entrenamiento físico aumenta la biodisponibilidad de NO, mediante modificaciones en la expresión y actividad de enzimas claves para su síntesis como eNOS y Akt, en este lecho vascular50. Más tarde, Edwards et al. confirmaron estos resultados, al demostrar que 12 semanas de un programa de entrenamiento de moderada intensidad (<85% VO2 máx) son efectivas para aumentar la VMF, niveles de nitritos y nitratos plasmáticos, así como también los niveles de superóxido dismutasa circulantes en este grupo de pacientes88. En adición a los efectos sobre la VMF, ha sido también demostrado el efecto beneficioso del entrenamiento físico sobre la biodisponibilidad y supervivencia de las CPE, lo cual se ha asociado fuertemente con niveles aumentados de NO en los vasos sanguíneos89. Incluso han sido reportados los efectos aditivos de modalidades de entrenamiento basados en ejercicios acuáticos sobre los niveles de nitratos plasmáticos circulantes en este grupo de pacientes90.
Enfermedad vascular periféricaLa enfermedad vascular periférica (EVP) contempla una variada gama de síndromes arteriales (no coronarios) que son causados por la alteración en la estructura y función de las arterias que suplen la irrigación del cerebro, órganos viscerales y el miembro inferior, y que confluyen en estenosis y aneurismas vasculares91. Diversos estudios han mostrado los efectos positivos del entrenamiento físico en la reversión del deterioro funcional y calidad de vida de pacientes con EVP, destacando la importancia de los programas de entrenamiento supervisados, los cuales tendrían mejores efectos sobre la funcionalidad general92–94. Recientemente Tompra et al., mediante una revisión sistemática, demostraron que programas de entrenamiento de miembros tanto inferiores como superiores son efectivos en incrementar la funcionalidad, VO2 peak y calidad de vida en pacientes con claudicación intermitente95.
Se ha observado que los cambios hemodinámicos inducidos por el ejercicio declinan la lesión inflamatoria y favorecen la angiogénesis en este grupo de pacientes96. Desde el punto de vista clínico, diversos estudios han observado que el entrenamiento moderado incrementa la VMF y los niveles de nitritos plasmáticos en pacientes con EVP97–99. No obstante, estos efectos pueden ser afectados por enfermedades concomitantes a la EVP como la diabetes94.
Insuficiencia cardiacaLa insuficiencia cardiaca (IC) corresponde a un síndrome clínico complejo que se produce debido a una alteración estructural o funcional del miocardio, comprometiendo su capacidad para llenar el ventrículo o eyectar la sangre a la circulación general100. Varios estudios han mostrado que la reactividad vascular se encuentra reducida en sujetos adultos con IC101 e IC congestiva102,103, lo cual ha mostrado asociación con el desarrollo de un fenotipo protrombótico y proinflamatorio103.
Estudios recientes han mostrado que diversas modalidades de entrenamiento físico han sido efectivas en mejorar la función endotelial en estos pacientes. Gerovasili et al. observaron incrementos absolutos superiores al 10% en la reactividad de la microcirculación periférica de pacientes con IC posterior a 3 meses de entrenamiento físico104. Por su parte, Anagnostakou et al. demostraron que un programa de entrenamiento interválico de alta intensidad combinado con entrenamiento de fuerza induce efectos beneficiosos sobre la reactividad vascular en pacientes adultos con IC estable105. Incluso, protocolos de entrenamiento basados en estimulación eléctrica funcional han mostrado efectos aditivos al entrenamiento físico convencional sobre la función endotelial en este grupo de pacientes106,107. Recientemente Sandri et al., con el fin de determinar el impacto de la edad sobre la respuesta vascular al entrenamiento físico en este grupo de pacientes, estudiaron el efecto del entrenamiento físico sobre la función de CPE y VMF en pacientes con IC de 2 grupos de edades, jóvenes (<55 años) y adultos mayores (>65 años). Interesantemente, observaron que 4 semanas de entrenamiento moderado (60-70% VO2 máx) fue efectivo en mejorar la cantidad y función de las CPE, lo cual fue asociado a un significativo incremento en la VMF en pacientes de ambos grupos de edades, no observándose diferencia entre jóvenes y adultos mayores108.
Diabetes mellitus tipo 2La disfunción endotelial es un factor clave en la fisiopatología de la diabetes mellitus tipo 2, puesto que la existencia de un lecho vascular permeable es importante para una óptima distribución de la insulina en los tejidos109. Diversos reportes han demostrado los efectos benéficos del ejercicio en este grupo de pacientes110–112. Desde el punto de vista molecular se ha demostrado que el ejercicio previene la disfunción endotelial coronaria, incrementa la expresión de las enzimas eNOS, superóxido dismutasa 1 y 2 y también restaura el balance oxidativo en arteria coronaria de ratas con diabetes mellitus tipo 2113.
Desde el punto de vista clínico, Montero et al. demostraron, mediante un enfoque metaanalítico, que 14 semanas de entrenamiento de intensidad moderada (74% FC máxima) son efectivas en mejorar la VMF en pacientes con diabetes mellitus tipo 2112.
ConclusionesHoy en día es aceptado que un bajo nivel de actividad física y capacidad cardiorrespiratoria constituye un importante factor de riesgo cardiovascular en niños, adolescentes y adultos114–116. En este contexto, la evidencia es contundente en establecer que, junto con constituir uno de los factores patogénicos iniciales, la disfunción endotelial posee un fuerte poder predictivo de riesgo cardiovascular73. En virtud de lo anterior, y como fue discutido a lo largo del texto, los cambios hemodinámicos inducidos por ejercicio tienen un rol crucial en la generación de mecanismos biológicos de adaptación vascular que van a contribuir a la prevención y tratamiento de las ECV.
En la presente revisión fueron abordadas las bases fisiológicas que subyacen al impacto del entrenamiento físico sobre la función endotelial, tanto en modelos experimentales como en estudios clínicos, con el fin de discutir la ineludible interdependencia existente entre la investigación básica y clínica en este campo de estudio, aspectos que deben ser tomados en consideración en estudios ulteriores.
FinanciaciónNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.