El conducto arterioso permeable puede provocar hipertensión arterial pulmonar; éste ocupa el primer lugar de las cardiopatías congénitas quirúrgicas en la ciudad de Toluca, México.
MétodosEn el periodo comprendido entre enero del 2006 y diciembre del 2011 se operaron 51 pacientes con conducto arterioso permeable: 34 (66.7%) del sexo femenino. Se estudia la reversibilidad de la presión arterial pulmonar y de la dilatación de cavidades izquierdas posterior al cierre quirúrgico del conducto arterioso permeable y se describen las complicaciones posquirúrgicas en la población de la ciudad de Toluca, localizada a una altitud de 2680 metros sobre el nivel del mar (msnm).
ResultadosLa reversibilidad de la presión pulmonar ocurrió en el 88% de los casos. También se observó una disminución de los diámetros de las cavidades izquierdas, manifestado por una relación de aurícula izquierda/anillo aórtico prequirúrgica de 2.0±0.41 y posquirúrgica de 1.36±0.25 (p<0.001).
El cierre exitoso del conducto arterioso permeable inmediato fue del 94.1% y mediato del 98.0%. Se presentaron complicaciones posquirúrgicas en el 13.8% de los pacientes, todas fueron menores, siendo las principales: infección y hematoma de la herida quirúrgica (5.9%), neumotórax (3.9%), neumonía (2.0%) y derrame pleural (2.0%).
ConclusionesLa hipertensión arterial pulmonar secundaria a conducto arterioso permeable es reversible en la mayoría de los casos después del cierre quirúrgico, incluso en habitantes de localidades por arriba de los 2500 msnm.
Patent ductus arteriosus in Toluca can cause pulmonary hypertension and ranks first surgery of congenital heart disease in Toluca, Mexico.
MethodsIn the period between January 2006 and December 51 patients with patent ductus arteriosus went to surgery: 34 (66.7%) were female. We study the reversibility of pulmonary arterial pressure and the left cavities dilatation after surgical closure of the ductus arteriosus and postoperative complications are described in a population of Toluca, located at an altitude of 2680 meters over the sea.
ResultsThe reversibility of pulmonary pressure ocurred in 88% of cases. We also observed a decrease in the diameters of the left chambers manifested by a ratio of left atrium/aortic annulus before surgery of 2.0 ± 0.41 SD and after surgery of 1.36 ± 0.25 SD, (p<0.001).
The successful closure of the ductus arteriosus was 94.1% immediately and mediate 98.0%. Postoperative complications ocurred in 13.8%, being the main infection and surgical wound hematoma (5.9%), pneumothorax (3.9%), pneumonia (2.0%) and pleural efusion (2.0%).
ConclusionsPulmonary arterial hypertension secundary to patent ductus arteriosus is reversible in the mayority of cases after surgical closure, including residents of village above 2500 meters over the sea.
El conducto arterioso permeable (CAP) es la segunda causa más frecuente de cardiopatía congénita en la República Mexicana, provoca sobrecarga de volumen al lecho vascular pulmonar y al ventrículo izquierdo, que en su evolución natural puede desencadenar hipertensión pulmonar irreversible, insuficiencia cardiaca y endarteritis, con una morbilidad anual del 0.5% a 1%, por lo que el tratamiento definitivo es el cierre del mismo1.
El primer cierre quirúrgico con éxito del CAP fue realizado en 1938 por Robert Edwards Gross en Boston2, y desde entonces se inició su uso en los centros hospitalarios, siendo en la actualidad una cirugía con altos índices de éxito, escasas complicaciones, sin secuelas y bajo costo, que se realiza sin necesidad de circulación extracorpórea3.
El avance de la tecnología en el mundo, incluyendo los Institutos de Salud en México, introdujo nuevas técnicas terapeúticas como el cateterismo cardiaco intervencionista con nuevos dispositivos para el cierre del CAP4, el cual actualmente es tratado mediante intervencionismo con facilidad y pocas complicaciones5,6. Sin embargo, en aquellos hospitales donde no se dispone de Salas de Hemodinamia Pediátrica, el cierre quirúrgico es considerado como un procedimiento de primera elección.
La prevalencia de CAP aumenta con la altitud7. En la República Mexicana, la ciudad de Toluca −capital del Estado de México− es la más alta situada a 2680 metros sobre el nivel del mar (msnm), por lo que en esta ciudad el cierre del CAP es la principal cirugía cardíaca realizada en niños. El objetivo del presente trabajo fue evaluar los cambios morfológicos y hemodinámicos medidos por ecocardiografía bidimensional en niños con CAP residentes en la ciudad de Toluca-México, así como determinar las complicaciones posquirúrgicas del cierre del CAP.
MétodosEn el periodo comprendido entre enero del 2006 a diciembre del 2011, se operaron 51 pacientes: 34 (66.7%) del sexo femenino. La edad promedio fue de 3.6 ± 3.5 años.
Los criterios de inclusión para la cirugía fueron: 1) edad > 6 meses y 2) CAP moderado o grande (boca pulmonar mínima de 4mm medida por ecocardiografía). Los criterios de exclusión: 1) comorbilidades cardíacas, 2) síndromes genéticos. En todos los casos el diagnóstico se realizó por ecocardiograma bidimensional, modo M y Doppler color, pulsado, continuo y todos fueron corroborados con el hallazgo quirúrgico. Se consideró que las cavidades izquierdas estaban dilatadas cuando la relación aurícula izquierda/aorta fue mayor de 1.5.
La evaluación preoperatoria se efectuó en base a los datos obtenidos en la radiografía de tórax, el electrocardiograma y el ecocardiograma. La estancia hospitalaria se contabilizó desde el momento de la cirugía hasta el día del egreso. El cierre exitoso se determinó como la ausencia de flujo residual en el sitio del conducto, en el estudio de ecocardiografía Doppler color y pulsado.
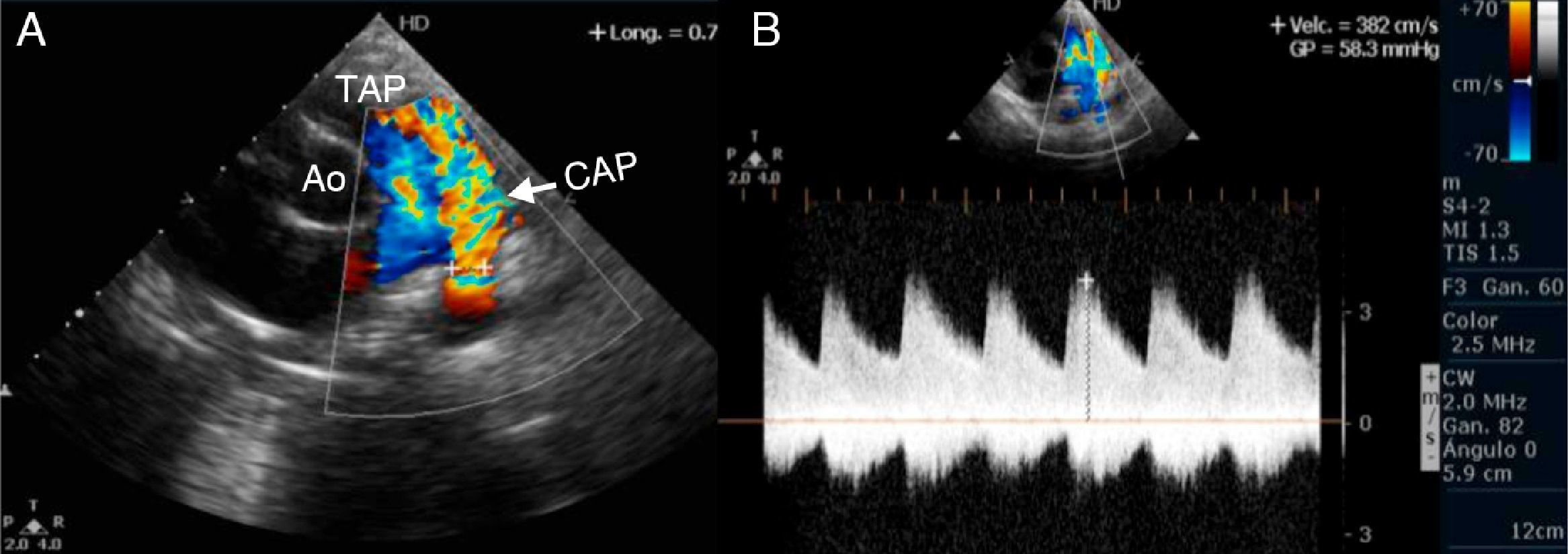
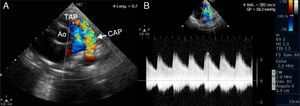
El estudio ecocardiográfico se realizó con un ultrasonido Philips Envisor®, modo bidimensional, Doppler color, pulsado y continuo, según las normas de la Sociedad Americana de Ecocardiografía8. Las vistas utilizadas para valoración del CAP fueron: eje corto paraesternal, donde se observan el CAP, el tronco y las ramas pulmonares (fig. 1); eje supraesternal, que muestra el arco aórtico y las ramas pulmonares, permite medir la boca pulmonar del CAP; y eje paraesternal alto izquierdo, que muestra el CAP y la aorta descendente. En el eje largo parasternal con modo M y bidimensional se midió la aurícula izquierda y la raíz aórtica, y se determinó la relación aurícula izquierda/raíz aórtica (relación de tamaño normal AI/Ao < 1.4, dilatación importante > 2).
A) Imagen ecocardiográfica bidimensional y con Doppler color, en el eje corto paraesternal a nivel de grandes vasos. Se observa el flujo torrencial de aorta a pulmonar a través de un conducto arterioso permeable grande (flecha). B) Estudio ecocardiográfico bidimensional y con Doppler color y continuo, en el eje corto paraesternal a nivel de grandes vasos que muestra la medición del gradiente aorto- pulmonar. Ao: aorta; TAP: tronco de arteria pulmonar; CAP: conducto arterioso permeable.
En el plano apical de 4 cámaras con Doppler color y continuo se calculó la presión sistólica de la arteria pulmonar, mediante el método de insuficiencia tricuspídea, cuantificando el gradiente de insuficiencia tricuspídea con la ecuación de Bernoulli. El gradiente de insuficiencia tricuspídea se multiplicó por 1.23, coeficiente que aproxima la presión sistólica de arteria pulmonar calculada por ecocardiografía a la obtenida por cateterismo cardíaco.
En algunos casos la presión sistólica de la arteria pulmonar se calculó en el eje corto parasternal a nivel de grandes vasos con Doppler color y continuo, la muestra de volumen se colocó en el sitio de la bifurcación de la arteria pulmonar, obteniéndose el gradiente transPCA (aórtico-pulmonar). Se utilizó la siguiente fórmula:
Presión sistólica de arteria pulmonar (PSAP)=Presión sistólica sistémica medida en el brazo - gradiente transPCA.
La población estudiada se dividió en 2 subgrupos de acuerdo al nivel de la PSAP: grupo I con PSAP normal (≤ 35mmHg) y grupo II con hipertensión arterial pulmonar (PSAP ≥ 35mmHg).
Técnica quirúrgicaEn todos los pacientes se utilizó anestesia general, la vía de abordaje quirúrgica fue la toracotomía posterolateral de acuerdo a la técnica previamente descrita9–11. Todos los pacientes fueron extubados al concluir el procedimiento quirúrgico.
El cierre quirúrgico exitoso inmediato se consideró hasta los 30 días posteriores a la cirugía, y el mediato hasta un año después del evento quirúrgico.
Análisis estadísticoPara las variables cuantitativas se utilizaron medidas de tendencia central con cálculo de la media, moda y desviación estándar. Para las variables cualitativas se utilizaron porcentajes y proporciones.
Estadística inferencial: Para determinar si la cirugía modifica el grado de hipertensión arterial se realizó análisis comparativo de la presión arterial pulmonar y de la dilatación de cavidades izquierdas con la prueba t de Student cuando la distribución era gaussiana, antes y después de la cirugía. Para las variables cualitativas se utilizó la prueba de chi cuadrada. Se consideró un valor de p significativo cuando éste fue < de 0.05.
ResultadosVariables demográficasSe operaron 51 pacientes: 44 pacientes (86.3%) (fig. 2) dentro de los 2 primeros años de vida.
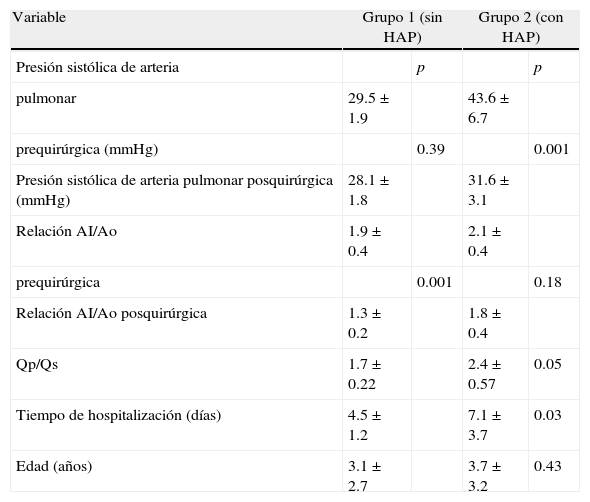
La edad de los pacientes fue de 3.1 ± 2.7 en el grupo I; y de 3.7 ± 3.2 en el grupo II, (p=0.43) (tabla 1).
Variables demográficas y hemodinámicas determinadas por ecocardiografía de los pacientes estudiados
| Variable | Grupo 1 (sin HAP) | Grupo 2 (con HAP) | ||
| Presión sistólica de arteria | p | p | ||
| pulmonar | 29.5±1.9 | 43.6±6.7 | ||
| prequirúrgica (mmHg) | 0.39 | 0.001 | ||
| Presión sistólica de arteria pulmonar posquirúrgica (mmHg) | 28.1±1.8 | 31.6±3.1 | ||
| Relación AI/Ao | 1.9±0.4 | 2.1±0.4 | ||
| prequirúrgica | 0.001 | 0.18 | ||
| Relación AI/Ao posquirúrgica | 1.3±0.2 | 1.8±0.4 | ||
| Qp/Qs | 1.7±0.22 | 2.4±0.57 | 0.05 | |
| Tiempo de hospitalización (días) | 4.5±1.2 | 7.1±3.7 | 0.03 | |
| Edad (años) | 3.1 ± 2.7 | 3.7 ± 3.2 | 0.43 | |
HAP: hipertensión arterial pulmonar; AI: aurícula izquierda; Ao: aorta; Qp: gasto pulmonar; Qs: gasto sistémico.
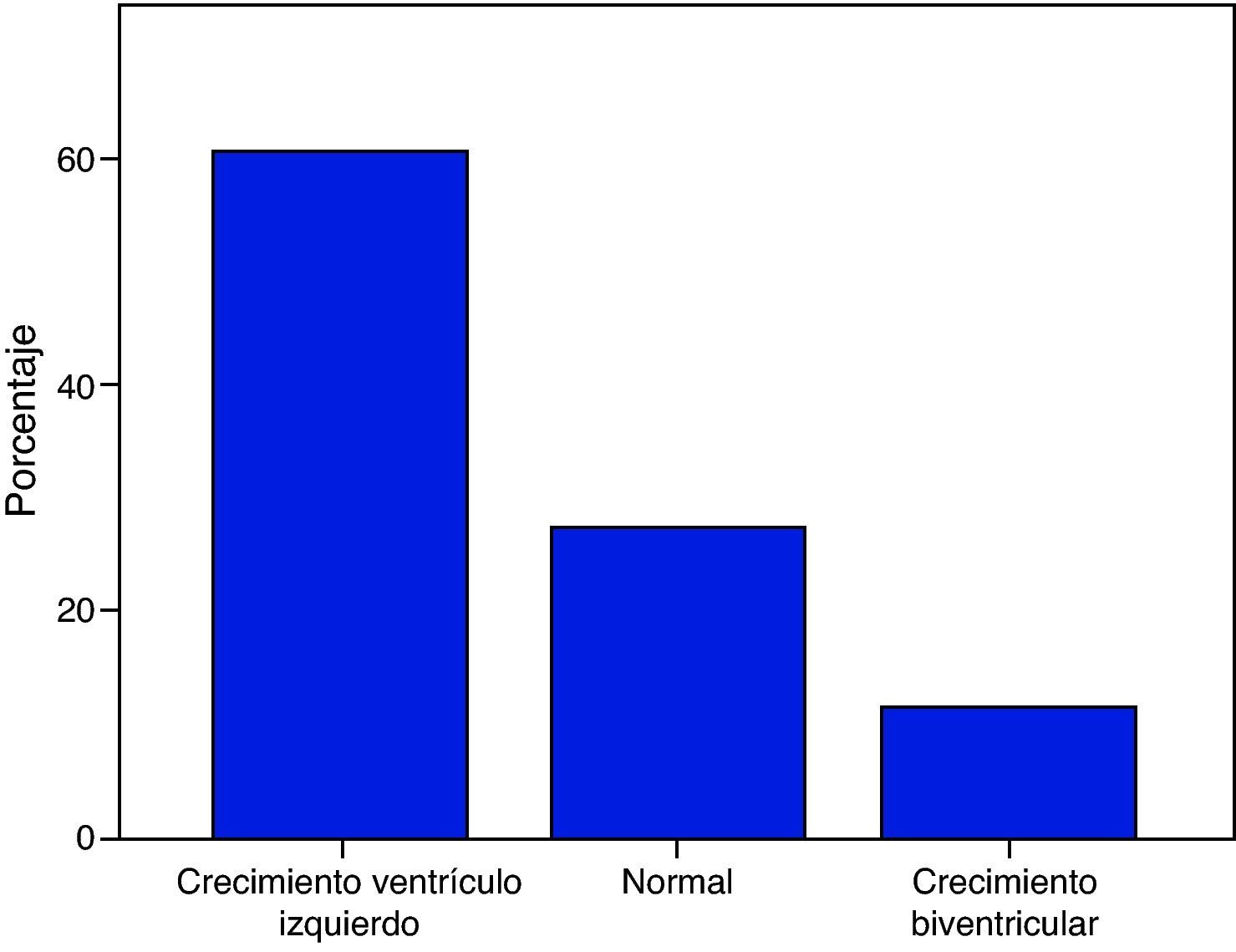
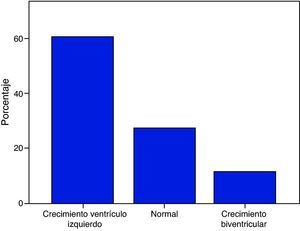
El electrocardiograma realizado previo a la cirugía demostró crecimiento de ventrículo izquierdo en 31 casos (60.8%), en 14 (27.4%) fue normal y en 6 (11.8%) crecimiento biventricular (fig. 3).
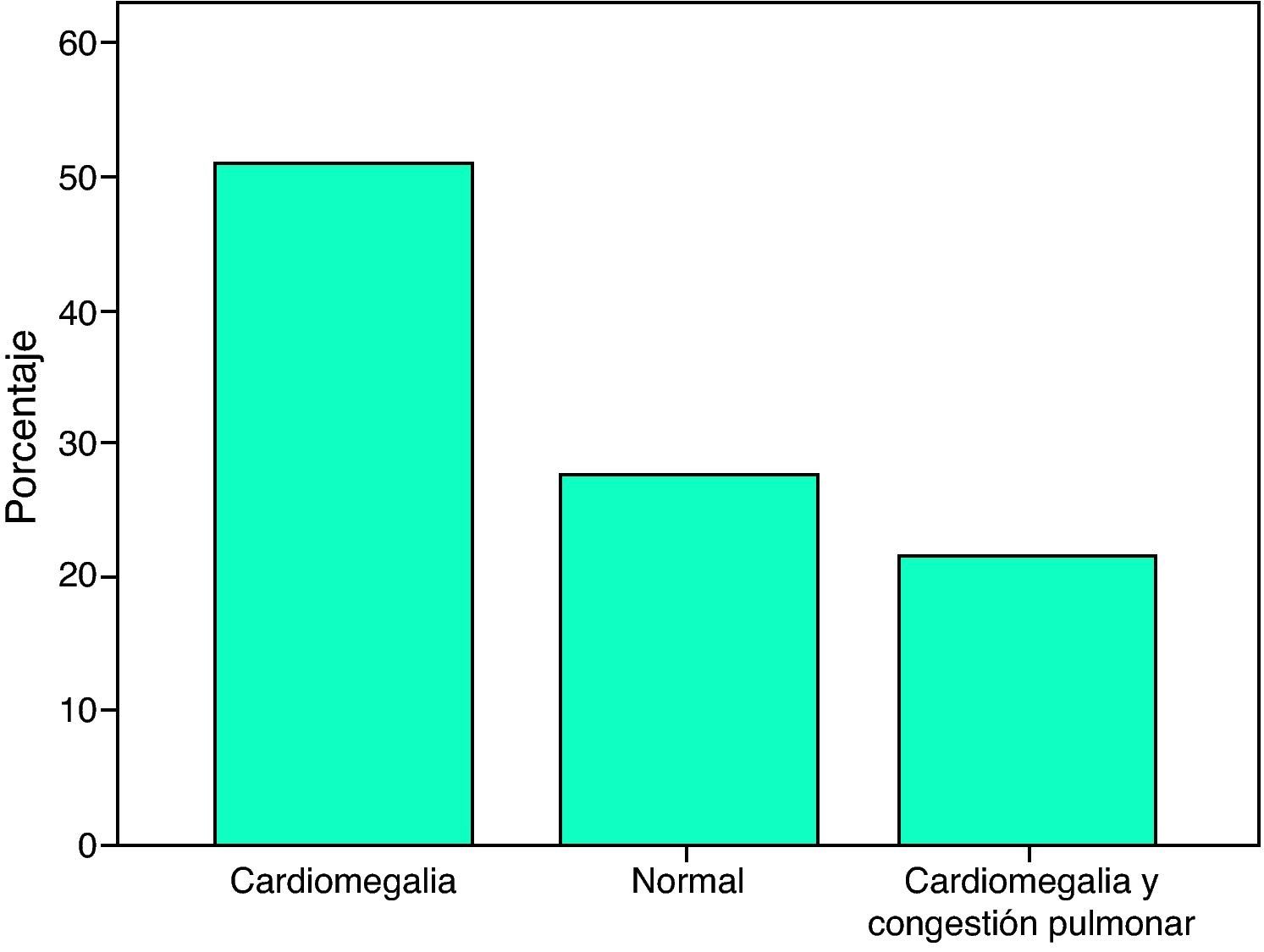
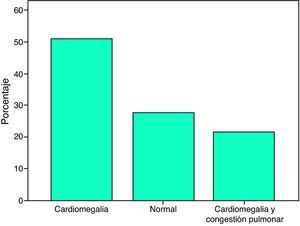
En 27 pacientes (52.9%) se encontró cardiomegalia grado I-II, en 14 (27.5%) la silueta cardíaca era normal y en 10 (19.6%) se demostró cardiomegalia y congestión pulmonar (fig. 4).
La dilatación de cavidades izquierdas se corroboró con la radiografía de tórax en el 51.5% de los casos y en el 60% de los electrocardiogramas.
En la exploración del área precordial y sus alrededores, principalmente en el área subclavicular izquierda se auscultó el característico soplo en maquinaria o continúo en el 85%, y en el 15% de los casos un soplo holosistólico con reforzamiento del segundo ruido cardiaco.
Variables hemodinámicas por ecocardiografíaEl diámetro de la boca pulmonar del conducto arterioso osciló entre 4mm a 10mm con una media de 6mm.
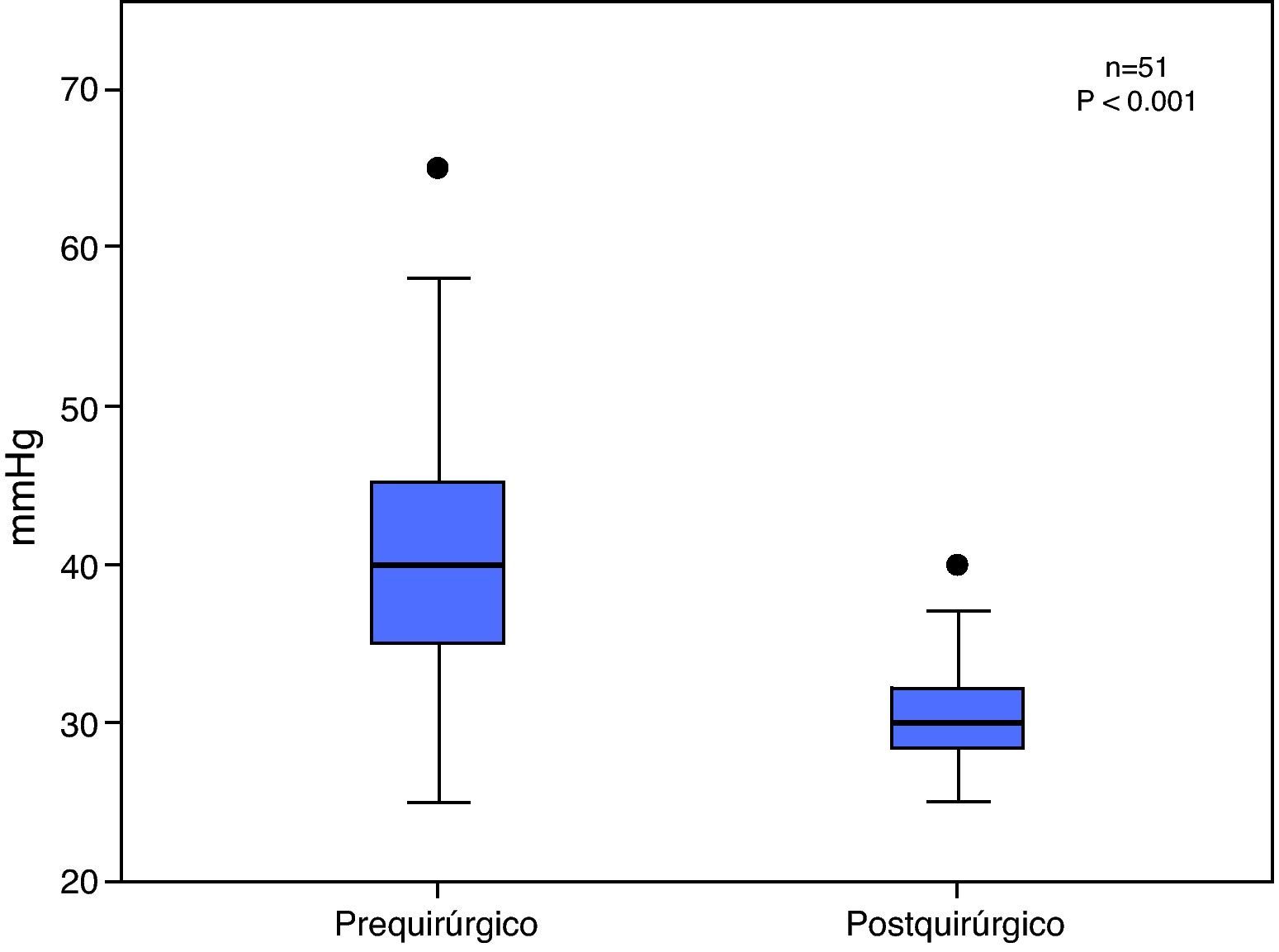
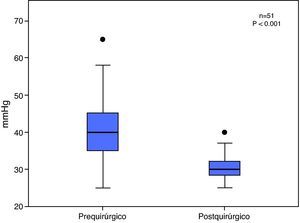
El promedio de la PSAP prequirúrgica en la población total fue 39.6±8.5mmHg y el promedio de la PSAP posquirúrgica fue de 30.8±3.2mmHg, con una diferencia estadísticamente significativa (p<0.001) (fig. 5).
En el grupo I, 15 pacientes (29%) tuvieron una PSAP prequirúrgica promedio de 29.5 ± 1.9mmHg, la cual no se modificó en la evolución posquirúrgica (28.1 ± 1.8mmHg), (p=0.39).
En el grupo II, 36 pacientes (71%) tuvieron una PSAP prequirúrgica promedio de 43.6 ± 6.7mmHg, la cual se redujó significativamente en la etapa posquirúrgica a 31.6 ± 3.1mmHg (p≤0.001).
Al año de evolución posquirúrgica sólo 2 pacientes mostraban aún elevación importante de la PSAP (40.5±0.7mmHg), la cual tuvo una correlación directa con la edad mayor de 10 años de vida.
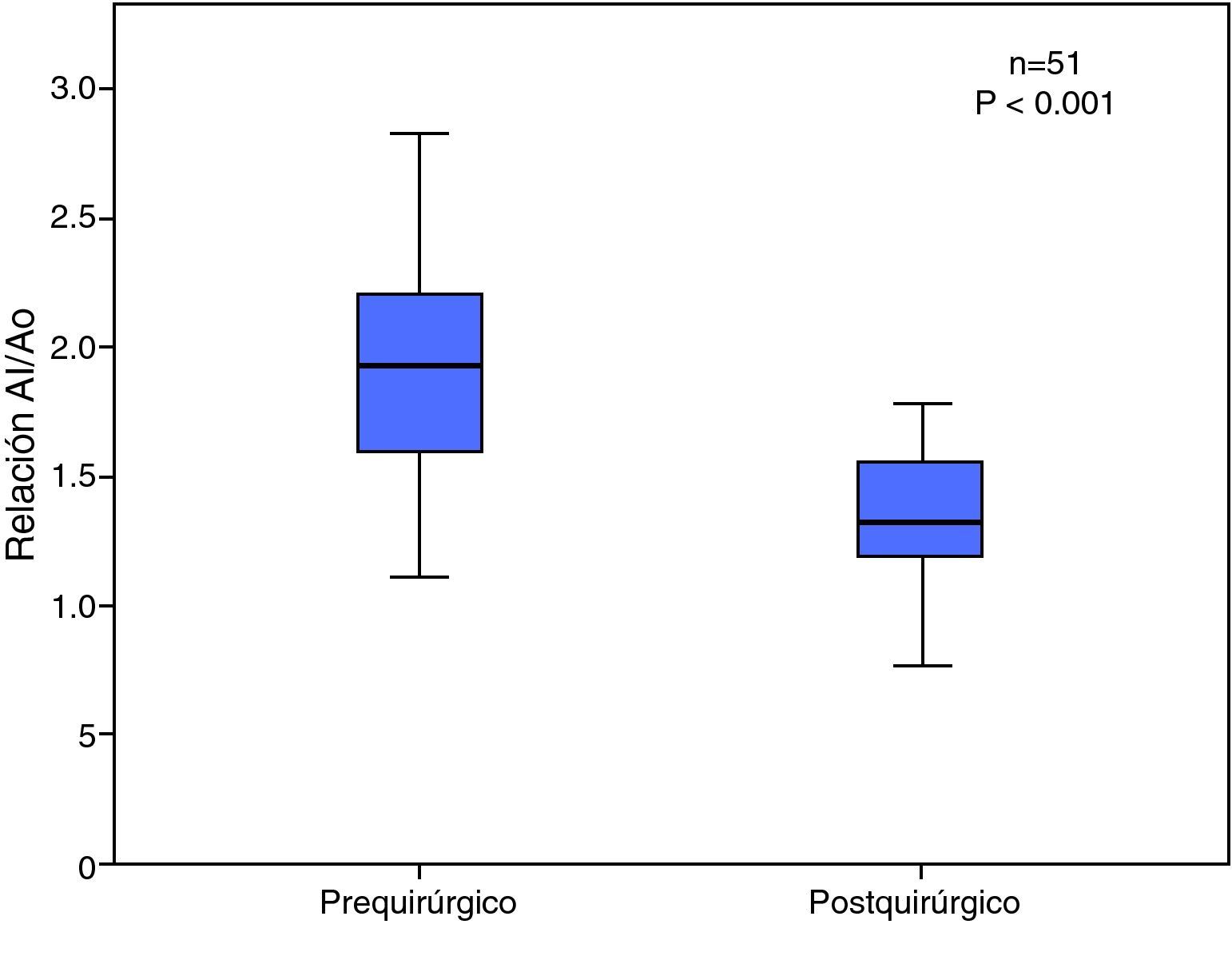
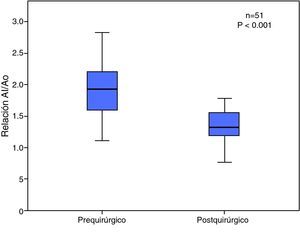
En la etapa prequirúrgica el 91% de todos los casos tuvo dilatación de cavidades izquierdas, la cual disminuyó a 36% en la evolución posquirúrgica (p<0.001). La media prequirúrgica de la relación aurícula izquierda/anillo aórtico fue de 2.0±0.41, y la media posquirúrgica de la relación aurícula izquierda/anillo aórtico fue 1.36±0.25, con una p≤0.001 (fig. 6).
En el grupo I, la relación AI/Ao prequirúrgica fue de 1.9 ± 0.4 y en el posquirúrgico disminuyó significativamente a 1.3 ± 0.2 (p<0.001), y en el grupo II, la relación AI/Ao prequirúrgica fue de 2.1 ± 0.4 y ésta no se modificó en el posquirúrgico (1.8 ± 0.4, p=0.18).
El gasto pulmonar/gasto sistémico (Qp/Qs) fue mayor en los pacientes del grupo II (2.4 ± 0.57 vs 1.7 ± 0.22, p<0.005) (tabla 1).
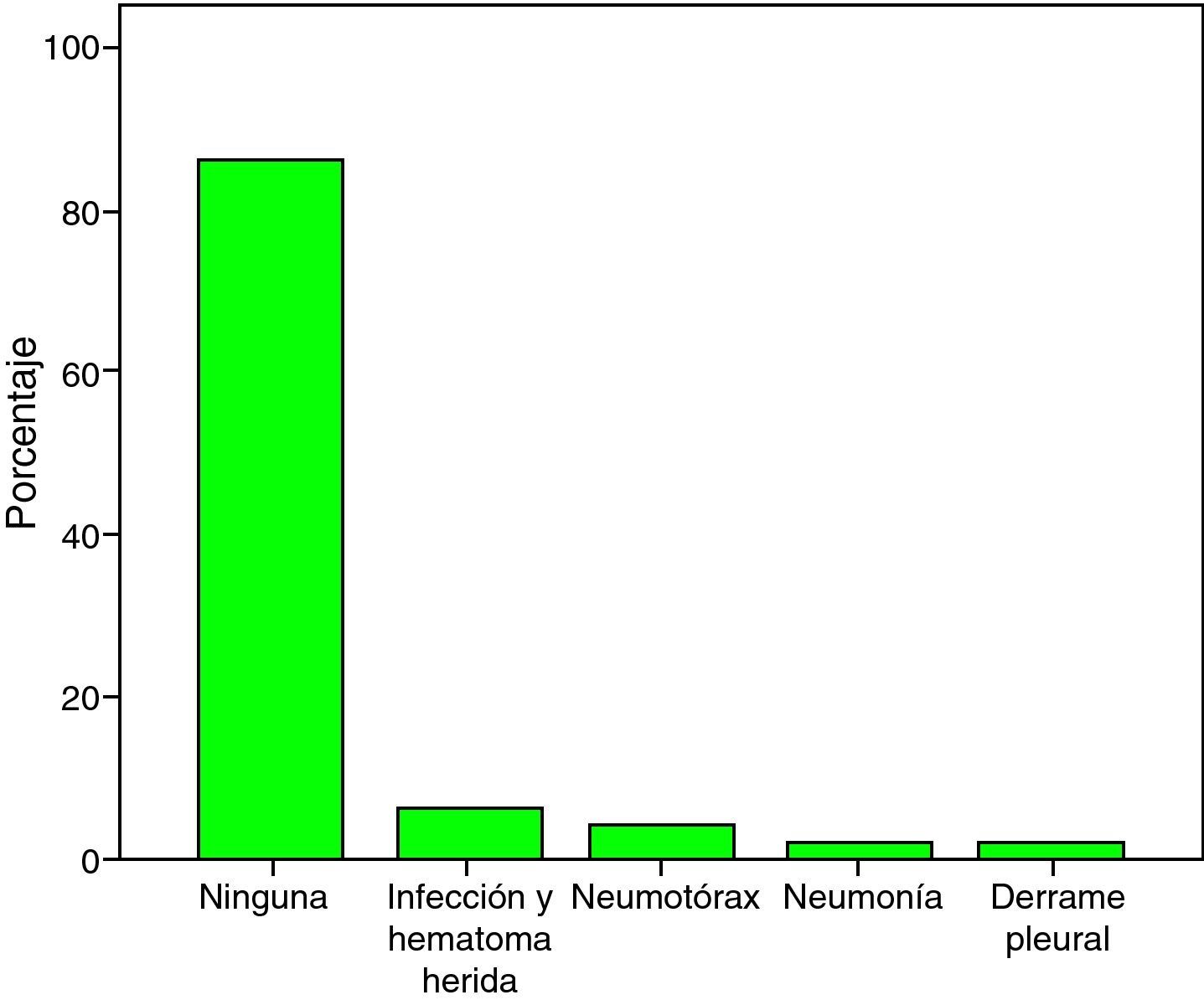
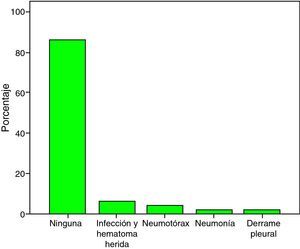
ComplicacionesLas complicaciones posquirúrgicas se presentaron en 7 pacientes (13.8%) distribuidas de la siguiente manera: infección y hematoma de la herida quirúrgica en 3 pacientes (5.9%), neumotórax en 2 (3.9%), neumonía en uno (2%) y derrame pleural en uno (2%) (fig. 7).
Se demostró cortocircuito residual en 3 pacientes (5.9%), en 2 de ellos se observó cierre espontáneo al primer año de seguimiento posquirúrgico, y en el tercero hubo la necesidad de cierre percutáneo con dispositivo Amplatzer. El cierre exitoso inmediato fue del 94.1% y el mediato de 98%.
Estancia hospitalariaLa media de la estancia intrahospitalaria fue de 4.8 días±2.0 días, ésta fue mayor en los pacientes del grupo II (7.1 ± 3.7 vs 4.5 ± 1.2, p=0.03) (tabla 1).
DiscusiónLos pacientes portadores de conducto arterioso con repercusión hemodinámica llegan con frecuencia en insuficiencia cardiaca e hipertensión arterial pulmonar importante, por lo que el tratamiento definitivo es el cierre del CAP independientemente de la edad del paciente, salvo en lactantes asintomáticos donde el cierre del CAP puede ser diferido hasta la edad de un año, con estricto control pediátrico y cardiológico, para así reducir los riesgos de hipertensión arterial pulmonar, endarteritis e insuficiencia cardiaca4,9–11.
El tratamiento quirúrgico con ligadura fue la primera técnica empleada en el tratamiento de CAP, pero existía una posibilidad importante de flujos residuales debido a la dificultad para hacer el cierre adecuado, por lo que esta técnica fue modificada en base a la técnica propuesta por Blalock en 1946. El cortocircuito residual cuando se realiza una ligadura simple es del 22%, y con ligadura doble o triple del 3%. La sección y sutura del conducto evita la posibilidad de flujos residuales, y es hasta el momento el tratamiento más seguro y eficaz. El cierre percutáneo también es eficaz, pero pueden haber casos con cortocircuito residual e incluso en algunos pacientes no se logra el cierre5,6,12. El abordaje habitual que se utilizó en el presente estudio fue la toracotomía posterolateral izquierda con sonda de drenaje13,14. El cierre quirúrgico del CAP continúa siendo un tratamiento seguro, con baja morbilidad y sin mortalidad, siendo de elección en los hospitales donde los recursos de cuidados en salud son limitados como en nuestro Centro, el cierre con dispositivo Amplatzer aún no ha demostrado tener mejor costoefectividad que la cirugía15,16.
En este estudio se identificaron sólo complicaciones menores en el 13.7%, porcentaje similiar al reportado en la literatura médica9,10,17, de las cuales la infección de herida operatoria y el neumotórax fueron las más comunes, que se resolvieron con manejo médico.
La evalución ecocardiográfica posquirúrgica mostró una disminución de la presión sistólica de la arteria pulmonar en el 96% de los casos, lo cual sugiere que la hipertensión pulmonar asociada al conducto arterioso es reversible al corregirse el hiperflujo pulmonar. Sin embargo, 2 pacientes persisten con hipertensión pulmonar importante, la cual está en relación al tiempo de sobrecarga de volumen, la repercusión hemodinámica y la edad de los pacientes. Los pacientes con hipertensión pulmonar tuvieron un Qp/Qs y un tiempo de hospitalización mayor, y la relación AI/Ao mostró sólo una tendencia a la disminución en el postoperatorio.
La hipertensión arterial pulmonar es mucho más frecuente en pacientes que habitan a una altitud mayor a 2600 msnm y ésta se acentúa en pacientes con CAP, pero esto no contraindica la cirugía, ya que en la altitud la vasoconstricción hipóxica protege el lecho vascular pulmonar del hiperflujo pulmonar, que puede causar daño irreversible18,19.
En los pacientes con CAP que tienen incremento de las resistencias vasculares pulmonares por hipertrofia muscular de los vasos pulmonares secundaria a vasoconstricción, se espera una rápida regresión de la hipertensión pulmonar como se observó en la mayoría de nuestros pacientes. En cambio, si las resistencias pulmonares elevadas dependen de la proliferación endotelial, hialinización y fibrosis de la media, es improbable que exista una disminución de la hipertensión pulmonar 20 como ocurrió en 2 de nuestros pacientes a pesar del tratamiento quirúrgico. Estos hallazgos sugieren que la hipertensión pulmonar es reversible al eliminar el hiperflujo pulmonar en la mayoría de los casos, aunque algunos de estos enfermos pueden convertirse en hipertensos pulmonares, por lo que es importante realizar un seguimiento clínico y ecocardiográfico a largo plazo de la PSAP.
ConclusiónEl cierre quirúrgico del CAP en pediatría es un procedimiento seguro, efectivo y de bajo costo. La evolución posquirúrgica en este grupo ha sido satisfactoria, con baja incidencia de complicaciones todas menores y ninguna tardía, lo cual nos anima a continuar realizando este procedimiento.
La hipertensión arterial pulmonar secundaria a CAP es reversible en la mayoría de los casos después del cierre quirúrgico, incluso en habitantes de localidades por arriba de los 2500 msnm.
FinanciamientoNo se recibió patrocinio de ningún tipo para llevar a cabo este artículo.
Conflicto de interesesLos autores declaran no tener conflicto de intereses.