Determinar si la estimulación medioseptal genera menor disincronía interventricular e intraventricular que la apical evaluada mediante ecocardiografía en pacientes con fracción de eyección conservada sometidos al implante de marcapasos VVI.
MétodoEstudio prospectivo que incluyó a 19 pacientes>70 años, con indicación de implante de marcapasos VVI por bloqueo auriculoventricular completo degenerativo, frecuencia ventricular≤50lpm y fracción de eyección≥45%. Se excluyeron portadores de fibrilación auricular, insuficiencia cardiaca, aquellos que en ritmo sinusal presentaron QRS>120mseg o bloqueo de rama izquierda. Se aleatorizaron 19 pacientes a 2 grupos: grupo A (47%) a implante apical y grupo B (53%) a implante septal.
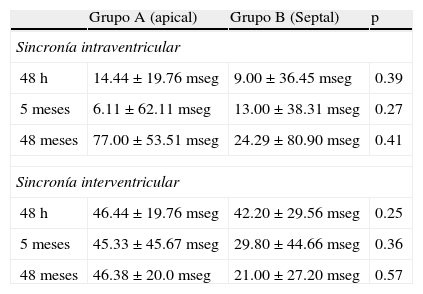
ResultadosLa edad media fue de 75 años (±8). Ninguno tuvo diagnóstico de insuficiencia cardiaca o cardiopatía isquémica. La disincronía intraventricular fue de A: 14.44±19.76mseg vs. B: 9±36.45mseg; A: 6.11±62.11mseg vs. B: 13±38.31mseg; A: 77±53.51mseg vs. B: 24.29±80.90mseg, p=NS. La disincronía interventricular fue de A: 46.44±19.76mseg vs. B: 42.20±29.56mseg; A: 45.33±45.67mseg vs. B: 29.80±44.66mseg; A: 46.38±20.mseg vs. B: 21±27.20mseg, p=NS) a las 48h, 5 y 48 meses, respectivamente.
ConclusiónEl sitio de estimulación no generó diferencias en la disincronía biventricular. La estimulación septal presentó una tendencia no significativa a menor disincronía interventricular.
To determine in patients with normal ejection fraction, undergoing permanent VVI pacing, if medial septal stimulation has lower dyssynchrony than apical stimulation assessed by echocardiography.
MethodA prospective trial, 19 patients>70 years old, scheduled for VVI pacemaker implantation for complete degenerative atrioventricular block, ventricular frequency<50beat per minute and ejection fraction≥45%. Patients with atrial fibrillation, heart failure, left bundle branch block and QRS durations longer than 120milliseconds in surface electrocardiogram with sinus rhythm were excluded. Patients were randomized to apical implantation group A: 47% and septal implantation group B: 53%. Echocardiographic parameters were measured previous to the implant, 48h, 5 and 48 months after implantation.
ResultsNo patients had diagnosis of ischemic cardiomyopathy or heart failure. Echocardiographic parameters for interventricular dyssynchrony between groups were A: 14.44±19.76msec vs. B: 9±36.45msec; A: 6.11±62.11msec vs. B: 13±38.31msec; A: 77±53.51msec vs. B: 24.29±80.90msec, P=NS). For interventricular dyssynchrony were A: 46.44±19.76msec vs. B: 42.20±29.56msec; A: 45.33±45.67msec vs. B: 29.80±44.66msec; A: 46,38±20 msec vs. B: 21±27.20msec, P=NS) at 48h, 5 and 48 months, respectively.
ConclusionApical site of stimulation does not increase ventricular dyssynchrony rate in patients with preserved ejection fraction. Septal stimulation showed decreased trend in interventricular dyssynchrony.
La estimulación crónica del ventrículo derecho (VD) es utilizada como terapéutica de los trastornos del sistema de conducción1,2. El implante del catéter de estimulación a nivel del ápex es la primera opción debido a su facilidad de acceso y estabilidad del umbral de estimulación2,3. La estimulación ventricular unicameral produce alteraciones mecánicas como disincronía inter e intraventricular, empeoramiento de la fracción de eyección, del remodelado ventricular; empeoramiento de la clase funcional, aumento de las internaciones por insuficiencia cardiaca y ensanchamiento del QRS4–11. Por ello se recomienda que en los pacientes con deterioro moderado a severo de la fracción de eyección sea utilizada la estimulación biventricular dejando para los pacientes con fracción de eyección conservada el tratamiento convencional12–16.
Se estima que la causa del efecto deletéreo de la estimulación unicameral es la asincronía de la activación miocárdica produciendo un inotropismo segmentario asimétrico15–17.
La fisiología de la contracción establece que cuanto más cercano sea el sitio de estimulación al haz de His menor disincronía presentará. La estimulación del tracto de salida del VD, por su cercanía al haz de His posee menor disincronía, expresado en una menor duración del QRS estimulado18.
Otra opción es la estimulación del septum interventricular. Algunos estudios han mostrado que presenta menor disincronía que a nivel apical19,20. Kypta et al., en un estudio con pacientes portadores de bloqueo auriculoventricular completo, no observaron diferencias en la fracción de eyección ni en la prueba de ejercicio entre la estimulación apical y septal21. De manera opuesta, Yu et al.22 y Tops et al.23 demostraron en pacientes portadores de fibrilación auricular crónica que recibieron ablación del nodo auriculoventricular e implante de marcapasos que los pacientes con estimulación septal, independientemente de la fracción de eyección previa al implante, presentaron una menor duración del QRS estimulado.
Cano et al. en 93 pacientes encontraron que la estimulación apical se acompañó de mayor disincronía que la estimulación septal24, mientras que Nikoo et al. no hallaron diferencias en los niveles del péptido natriurético auricular entre estos 2 grupos25.
Ante la discordancia en los resultados mostrados, nos propusimos evaluar la hipótesis de que la estimulación a nivel medio del septum interventricular presentara menor disincronía ventricular que la estimulación a nivel del ápex del VD.
MétodosEl departamento de Docencia e Investigación del Instituto de Cardiología de Corrientes aprobó el diseño del estudio y se obtuvo el consentimiento informado de todos los pacientes incluidos. El motivo por el cual los pacientes recibieron marcapasos tipo VVI fue exclusivamente por razones económicas del medio.
Realizamos un estudio unicéntrico, prospectivo, aleatorizado, en el cual se incluyeron 19 pacientes de ambos sexos, mayores de 70 años de edad, con indicación de implante de marcapasos definitivo tipo VVI por bloqueo auriculoventricular completo degenerativo con frecuencia de escape ventricular menor de 50lpm y con fracción de eyección ventricular izquierda≥45%26.
Fueron excluidos del estudio los pacientes portadores de fibrilación auricular crónica o aguda previa al bloqueo auriculoventricular, aquellos en los que en ritmo sinusal previo al bloqueo auriculoventricular la duración del QRS del electrocardiograma de superficie fue ≥120mseg o que presentaban bloqueo de rama izquierda y pacientes con diagnóstico de insuficiencia cardiaca aguda o crónica.
Ingresaron en el estudio 19 pacientes, los cuales fueron asignados a 2 grupos. El grupo A estaba constituido por 9 pacientes (47%) para implante del catéter en ápex del VD, y el grupo B con 10 pacientes (53%) para implante del catéter en la región medioseptal del septum interventricular.
La aleatorización fue 1:1 utilizándose como método una tabla de número generados al azar, y estableciéndose 2 grupos (se asignó los números impares al grupo A y los números pares al grupo B). Se confeccionó un formulario con datos como edad, sexo, factores de riesgo, medicación utilizada, causa de bloqueo auriculoventricular, frecuencia de escape ventricular, síntomas del paciente, necesidad de marcapasos transitorio, fracción de eyección y diámetros ecocardiográficos bidimensionales, valores de Doppler pulsado y continuo, sincronía interventricular e intraventricular previa al implante y durante el seguimiento, duración del QRS en el electrocardiograma de superficie, tiempo de implante del marcapasos determinándose el tiempo desde el momento que se realiza la incisión en piel hasta el momento en que se finaliza la aproximación de los bordes de la incisión posteriormente al implante del generador.
El 58% de los pacientes fueron hombres. La edad media fue de 75 años (±8). El 97% de los pacientes presentaron diagnóstico de hipertensión arterial, el 19% eran fumadores y el 31% diabéticos.
Técnica de implante del catéterTodos los catéteres utilizados fueron endocavitarios, bipolares y de fijación activa. Los implantes se realizaron en la Sala de Electrofisiología monitorizando con polígrafo EMS® versión 4.35 de 12 derivaciones simultáneas. Se obtuvieron distintas proyecciones mediante fluoroscopia con intensificador de imagen o arco en C. Para el implante se preformó el estilete del catéter con curva intermedia (5cm) y se llevó el mismo a la arteria pulmonar utilizándose la proyección anteroposterior.
Una vez en la arteria pulmonar, en el grupo A, se cambió el estilete por otro sin curva y se traccionó hacia el VD y se posicionó en el ápex. En el grupo B se introdujo el estilete con curva corta (3cm) y se traccionó hasta conseguir el ingreso al VD manipulándose el mismo hasta conseguir la posición medioseptal; posteriormente se rotó el catéter en sentido antihorario. La confirmación de la posición correcta del catéter se realizó como control, tanto en proyección oblicua anterior izquierda como en oblicua anterior derecha. La confirmación de la posición del catéter fue realizada mediante los criterios estándares27. Se fijó el catéter y se realizaron las pruebas de umbral, impedancia y amplitud de la onda R sensada, con dispositivo analizador Biotronik® (modelo ERA 20).
Se consideraron parámetros aceptables un umbral<IV, la impedancia entre 200 y 1,500Ohms y el sensado de onda R>0.003V. La frecuencia de estimulación programada fue de 70lpm para todos los pacientes.
EcocardiografíaSe evaluaron las mediciones acordes con las recomendaciones de la Sociedad Americana de Ecocardiografía. Para ello se utilizó un ecógrafo Siemens Acuson CV70® con transductor multifrecuencia 2-4MHz con registro electrocardiográfico simultáneo.
Además de las mediciones habituales, también se midieron las velocidades del Doppler tisular, pico S, E¿, A¿ expresada en cm/seg, y la relación E¿/A¿ con la muestra del Doppler pulsado tisular ubicado en la región lateral y en la región medial a nivel del anillo valvular mitral. La sincronía intraventricular se evaluó mediante la diferencia entre el tiempo desde el comienzo del QRS hasta el valor pico de la onda S del Doppler tisular entre la región lateral y la septal. La sincronía interventricular se evaluó mediante la diferencia entre el tiempo desde el inicio del QRS y el inicio de la eyección aórtica obtenido mediante Doppler pulsado del tracto de salida del ventrículo izquierdo en vista de 5 cámaras y el tiempo desde el inicio del QRS hasta el inicio de la eyección pulmonar obtenido mediante Doppler pulsado del tracto de salida del VD en vista paraesternal eje corto a nivel de los grandes vasos. Se asumió como disincronía intraventricular el retraso≥65 mseg y como disincronía interventricular el retraso≥40mseg28,29.
La fracción de eyección del ventrículo izquierdo se evaluó mediante el método de Simpsom modificado30.
Se realizó un ecocardiograma previo al implante de marcapasos definitivo y a las 48h, 5 y 36 meses vs. 48 meses en todos los pacientes.
Análisis estadísticoPara detectar una diferencia de al menos 30mseg en la disincronía interventricular e intraventricular con un nivel alfa de 0.05 y una potencia del estudio del 80% se estimó necesarios 10 pacientes por grupo.
Los datos numéricos fueron evaluados con medias y desviación estándar (DE) y los cualitativos con porcentajes. La comparación de las variables continuas entre ambos grupos se realizó mediante la prueba U de Mann-Withney, y para evaluar la interacción entre el sitio de estimulación aleatorizado y la sincronía biventricular se realizó una prueba de Kruskal-Wallis. Una p<0.05 fue considerada como estadísticamente significativa.
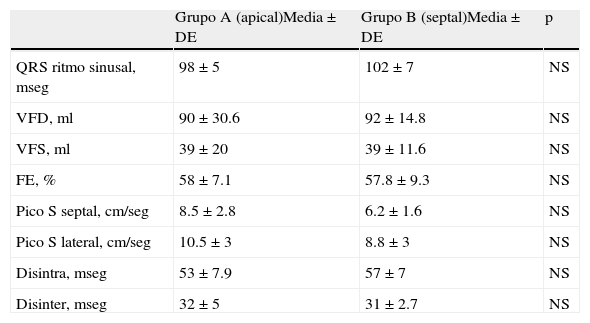
ResultadosNingún paciente presentó diagnóstico clínico de cardiopatía isquémica, como tampoco diagnóstico o antecedentes de internaciones por insuficiencia cardiaca. Ningún paciente recibió implante de marcapasos VVIR. El tiempo medio de implante del catéter fue para el grupo A de 47min y para el grupo B de 56min (p=0.31). El seguimiento medio fue de 34meses (mínimo de 24 máximo de 42). La tasa de estimulación del marcapasos fue del 98% en todos los pacientes. Esta tasa fue constante en todas las visitas de seguimiento. La frecuencia de estimulación programada fue de 70lpm. Las variables ecocardiográficas y duración del QRS en ritmo sinusal medidos previo al implante del marcapasos se muestran en la tabla 1. La duración del QRS estimulado del electrocardiograma de superficie fue para el grupo A 156±22mseg y para el grupo B 149±15mseg (p=0.78). La comparación de los valores ecocardiográficos de cada grupo durante el seguimiento se muestran en la tabla 2.
Variables ecocardiográficas y electrocardiográficas previas al implante
| Grupo A (apical)Media±DE | Grupo B (septal)Media±DE | p | |
| QRS ritmo sinusal, mseg | 98±5 | 102±7 | NS |
| VFD, ml | 90±30.6 | 92±14.8 | NS |
| VFS, ml | 39±20 | 39±11.6 | NS |
| FE, % | 58±7.1 | 57.8±9.3 | NS |
| Pico S septal, cm/seg | 8.5±2.8 | 6.2±1.6 | NS |
| Pico S lateral, cm/seg | 10.5±3 | 8.8±3 | NS |
| Disintra, mseg | 53±7.9 | 57±7 | NS |
| Disinter, mseg | 32±5 | 31±2.7 | NS |
DE: desviación estándar; Disinter: disincronía interventricular; Disintra: disincronía intraventricular; FE: fracción de eyección; NS: no significativo; VFD: volumen de fin de diástole; VFS: volumen de fin de sístole.
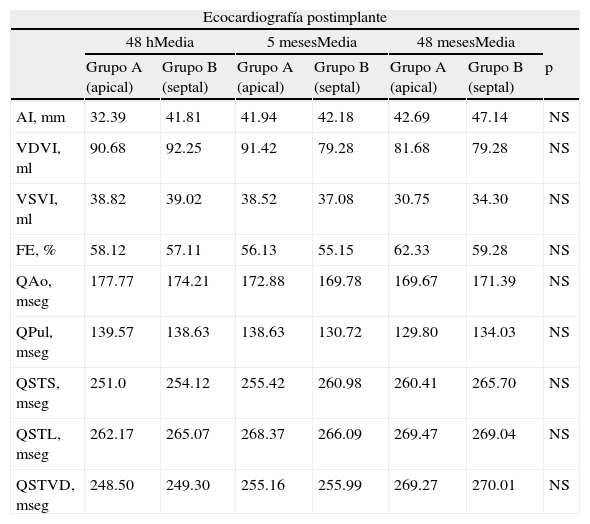
Valores de las mediciones ecocardiográficas en el seguimiento
| Ecocardiografía postimplante | |||||||
| 48hMedia | 5mesesMedia | 48mesesMedia | |||||
| Grupo A (apical) | Grupo B (septal) | Grupo A (apical) | Grupo B (septal) | Grupo A (apical) | Grupo B (septal) | p | |
| AI, mm | 32.39 | 41.81 | 41.94 | 42.18 | 42.69 | 47.14 | NS |
| VDVI, ml | 90.68 | 92.25 | 91.42 | 79.28 | 81.68 | 79.28 | NS |
| VSVI, ml | 38.82 | 39.02 | 38.52 | 37.08 | 30.75 | 34.30 | NS |
| FE, % | 58.12 | 57.11 | 56.13 | 55.15 | 62.33 | 59.28 | NS |
| QAo, mseg | 177.77 | 174.21 | 172.88 | 169.78 | 169.67 | 171.39 | NS |
| QPul, mseg | 139.57 | 138.63 | 138.63 | 130.72 | 129.80 | 134.03 | NS |
| QSTS, mseg | 251.0 | 254.12 | 255.42 | 260.98 | 260.41 | 265.70 | NS |
| QSTL, mseg | 262.17 | 265.07 | 268.37 | 266.09 | 269.47 | 269.04 | NS |
| QSTVD, mseg | 248.50 | 249.30 | 255.16 | 255.99 | 269.27 | 270.01 | NS |
AI: aurícula izquierda; FE: fracción de eyección del ventrículo izquierdo; QAo: tiempo entre inicio del QRS del electrocardiograma de superficie con inicio de jet de eyección aórtico; QPul: tiempo entre inicio del QRS del electrocardiograma de superficie con inicio de jet de eyección pulmonar; QSTL: tiempo entre inicio del QRS del electrocardiograma de superficie con pico S de Doppler tisular lateral del ventrículo izquierdo; QSTS: tiempo entre inicio del QRS del electrocardiograma de superficie y pico S de doppler tisular septal de ventrículo izquierdo; QSTVD: tiempo entre inicio del QRS del electrocardiograma de superficie y pico S del Doppler lateral del ventrículo derecho; VDVI: volumen diastólico del ventrículo izquierdo; VSVI: volumen sistólico del ventrículo izquierdo.
La evaluación de la sincronía intraventricular e interventricular se muestra en la tabla 3. El análisis intrasujeto de la sincronía interventricular e intraventricular se muestra en la tabla 4. La comparación del diámetro de aurícula izquierda durante el seguimiento mostró un aumento progresivo significativo del tamaño (41.96mm±5.96 a las 48h; 41.94mm±5.21 a los 5 meses; 44.76mm±6.25 a los 48 meses, p=0.03). Independientemente del grupo aleatorizado (grupo A: 40.23mm vs. grupo B: 42.47mm, p=0.37; grupo A: 39.21mm vs. grupo B: 44.4mm, p=0.2; grupo A: 42.69mm vs. grupo B: 47.14mm, p=0.28) a las 48h, 5 meses y 48 meses posterior al implante respectivamente.
Sincronía intraventricular e interventricular según el grupo durante el seguimiento
| Grupo A (apical) | Grupo B (Septal) | p | |
| Sincronía intraventricular | |||
| 48h | 14.44±19.76mseg | 9.00±36.45mseg | 0.39 |
| 5meses | 6.11±62.11mseg | 13.00±38.31 mseg | 0.27 |
| 48meses | 77.00±53.51mseg | 24.29±80.90mseg | 0.41 |
| Sincronía interventricular | |||
| 48h | 46.44±19.76mseg | 42.20±29.56mseg | 0.25 |
| 5meses | 45.33±45.67mseg | 29.80±44.66mseg | 0.36 |
| 48meses | 46.38±20.0mseg | 21.00±27.20mseg | 0.57 |
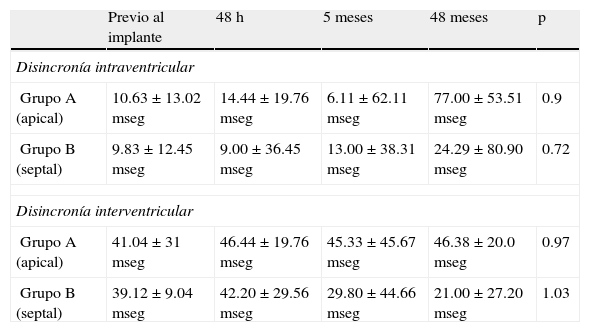
Evolución intrasujeto de las disincronías intraventricular e interventricular
| Previo al implante | 48h | 5meses | 48meses | p | |
| Disincronía intraventricular | |||||
| Grupo A (apical) | 10.63±13.02mseg | 14.44±19.76mseg | 6.11±62.11mseg | 77.00±53.51mseg | 0.9 |
| Grupo B (septal) | 9.83±12.45mseg | 9.00±36.45 mseg | 13.00±38.31mseg | 24.29±80.90mseg | 0.72 |
| Disincronía interventricular | |||||
| Grupo A (apical) | 41.04±31mseg | 46.44±19.76mseg | 45.33±45.67mseg | 46.38±20.0mseg | 0.97 |
| Grupo B (septal) | 39.12±9.04mseg | 42.20±29.56mseg | 29.80±44.66mseg | 21.00±27.20mseg | 1.03 |
La estimulación en el ápex del VD en pacientes con deterioro de la fracción de eyección produce alteraciones mecánicas que se expresan en el electrocardiograma por un aumento del ancho del QRS, un incremento del deterioro de la fracción de eyección y de los volúmenes de fin de diástole asociado a un incremento en la clase funcional e internaciones por insuficiencia cardiaca, generando un aumento de la morbimortalidad6–11. Este impacto puede ser prevenido mediante estrategias de estimulación mínima y terapia de resincronización cardiaca30,31.
Esta evidencia generó la búsqueda de sitios alternativos de estimulación dentro del VD que produzcan menor disincronía como pueden ser el septum interventricular, el tracto de salida y hasta el propio haz de His.
Nuestro trabajo evaluó en pacientes con buena fracción de eyección 2 sitios diferentes de estimulación de VD. La disincronía biventricular evaluada mediante ecocardiografía a corto, medio y largo plazo no evidenció diferencias a favor de la estimulación medioseptal en la disincronía intraventricular (grupo A: 14.44±19.76mseg vs. grupo B: 9±36.45mseg; grupo A: 6.11±62.11mseg vs. grupo B: 13±38.31mseg; grupo A: 77±53.51mseg vs. grupo B: 24.29±80.90mseg, p=NS) como tampoco en la disincronía interventricular (grupo A: 46.44±19.76mseg vs. grupo B: 42.20±29.56mseg; grupo A: 45.33±45.67mseg vs. grupo B: 29.80±44.66mseg; grupo A: 46.38±20mseg vs. grupo B: 21±27.20mseg, p=NS)a las 48h, 5 meses y 48 meses, respectivamente.
A pesar de esto, en la comparación de los grupos durante el seguimiento, se observó que la estimulación medioseptal presentó una tendencia no estadísticamente significativa a menor disincronía biventricular que la estimulación apical (tabla 3). Aún así, en el análisis intrasujeto del grupo con estimulación medioseptal, la disincronía intraventricular si bien se incrementó a lo largo del seguimiento, persistentemente presentó menores valores de disincronía que el grupo A. Esta tendencia tampoco fue estadísticamente significativa mediante la prueba de Kruskal-Wallis (grupo B: 9±36.45mseg, 13±38.31mseg, 24.29±80.90mseg, p=NS) a las 48h, 5 y 48 meses respectivamente. En los pacientes con estimulación apical, la disincronía intraventricular fue incrementándose de manera paulatina con un aumento marcado entre los 5 y 48 meses logrando superar los valores de normalidad (tabla 3), sugiriendo el efecto deletéreo de la estimulación apical. De todas maneras, esta tendencia no logró significación estadística (tabla 3).
En el comportamiento de la sincronía interventricular, se observó que el grupo con estimulación medioseptal presentó una tendencia no estadísticamente significativa a una reducción de la disincronía (tabla 3), y en el análisis individual del grupo, la disincronía tendió, también de manera no estadísticamente significativa, a reducirse a lo largo del seguimiento (grupo B: 42.20±29.56mseg, 29.80±44.66mseg, 21±27.20mseg, p=NS) a las 48h, 5 y 48 meses respectivamente. La posible causa de este fenómeno puede haber sido que ante la pequeña pero factible alteración de la sincronía por el bloqueo auriculoventricular sumado al implante de marcapasos, sabiendo que los fenómenos mecánicos son de lenta recuperación, esta disincronía interventricular tendió a reducirse a lo largo del seguimiento posiblemente por la estimulación próxima al haz de His.
Tampoco se demostraron cambios en la fracción de eyección ni en los volúmenes ventriculares durante el seguimiento.
Como ventajas se expone que: se trató de un trabajo aleatorizado con un seguimiento medio de 34 meses, sugiriendo la posibilidad de que en pacientes con buena fracción de eyección la estimulación a nivel apical no generaría mayor disincronía biventricular que la estimulación en áreas cercanas al haz de His. Se halló una tendencia no significativa de menor disincronía inter e intraventricular en los pacientes que se sometieron a estimulación medioseptal a corto, medio y largo plazo.
La imposibilidad de verificar estadísticamente esta tendencia podría deberse a la reducida muestra obtenida, una de las desventajas de este trabajo.
Varios estudios postularon la superioridad de sitios de estimulación alternativos al apical. Inoue et al. evaluaron la sincronía ventricular en 114 pacientes con fracción de eyección conservada del ventrículo izquierdo mediante ecografía cardiaca con la técnica de seguimientos de marcas, mostrando que la disincronía producida por la estimulación del marcapasos a nivel apical es mayor que la producida por la estimulación septal (índice de disincronía longitudinal: ápex 87±20mseg vs. septum 56±14mseg, p=<0.001; índice de disincronía radial 70±46mseg vs. 44±27mseg, p<0.001 respectivamente). A pesar de esto, no encontraron correlación entre los sitios de estimulación y la duración del QRS ni tampoco en puntos clínicos32. Estos resultados expuestos son diferentes a los hallados por nosotros, posiblemente por la utilización de la técnica de seguimiento de marcas y de índices de disincronía diferentes, los cuales poseen una mayor sensibilidad para la detección de alteraciones en el movimiento ventricular que los métodos utilizados en el presente estudio. Alhous et al. evaluaron la diferencia de la duración del QRS en pacientes sometidos a implante de marcapasos tipo DDD. La evaluacion consistió en el impacto en la disincronía intraventricular, interventricular, duración del QRS, la fracción de eyección, índice cardiaco y la función diastólica de la estimulación transitoria en distintos puntos del VD. La diferencia del QRS fue a favor de la estimulación no apical, siendo menor en el tracto de salida derecho como en el septum (apical 154±18mseg vs. tracto de salida derecho 136±16mseg; medioseptal 147±14mseg, p=0.001 y p<0.001, respectivamente), correlacionándose también la estimulación no apical con mejor fracción de eyección (48±5% vs. 54±6% vs. 52±5%, respectivamente). Concluyeron que los sitios de estimulación alternativos al ápex resultan en una actividad sistodiastólica del VD más cercana a la fisiológica, repercutiendo en un menor deterioro de la fracción de eyección33. Una de las posibles causas por la que hemos obtenidos resultados diferentes es que en el estudio de Alhous et al. la estimulación no solo fue bicameral sino que se realizaron optimizaciones de los tiempos programados de retraso auriculoventriculares mediante ecocardiografía, situación que repercutiría positivamente en la función sistodiastólica. A su vez, el 18% de los pacientes presentaron durante la estimulación AAI bloqueo de rama izquierda, lo que marcaría que este grupo particular poseía alteraciones basales intrínsecas en la conducción y consecuentemente en la mecánica ventricular. En nuestro estudio la estimulación fue unicameral y se excluyeron los pacientes con bloqueo de rama izquierda en ritmo sinusal.
Occhetta et al. evaluaron la seguridad, factibilidad y parámetros hemodinámicos de la estimulación a nivel parahisiano, en pacientes portadores de fibrilación auricular, QRS angosto y buena fracción de eyección que fueron sometidos a una ablación del nodo auriculoventricular con implante de un marcapasos bicameral tipo VDD. Se observó que el posicionamiento del catéter a nivel septal alto impactó, mejorando los parámetros clínicos de manera significativa en la clase funcional de la New York Heart Asociation (1.75 ± 0.4 vs. 2.5 ± 0.4, p = < 0.05) y test de la caminata de los 6 min (431 ± 73 vs. 360 ± 71 m, p = < 0.05)34. Esto evidenciaría una mejora en la mecánica de contracción, situación diferente a lo obtenido en nuestro estudio posiblemente por los beneficios mencionados anteriormente de la estimulación bicameral.
En contrapartida, otros autores han encontrado resultados similares a nuestro trabajo. Wang et al. compararon los efectos de la estimulación a nivel apical con la estimulación a nivel del tracto de salida del VD en la función ventricular global y la motilidad regional ventricular en pacientes con buena fracción de eyección (63% en promedio), sin enfermedad coronaria o valvular activa, fibrilación auricular, insuficiencia cardiaca o bloqueo completo de rama izquierda. No se observaron diferencias en el seguimiento a 12 meses de los puntos finales. Solo se evidenció una reducción significativa del retraso electromecánico interventricular (12.1±21.7mseg vs. 32.9±55.4mseg, p=0.04) y del intervalo preeyectivo del ventrículo izquierdo (114.7±30.3mseg vs. 133.6±33.4mseg, p=0.02) entre la estimulación del tracto de salida del VD y la estimulación apical respectivamente35. Sumado a estos datos, Lieberman et al., no pudieron demostrar diferencias al evaluar parámetros hemodinámicos como fracción de eyección, Dp/Dt, gasto cardiaco y presión de fin de diástole en pacientes con fracción de eyección conservada y deteriorada pero sin indicación de resincronización. Se observó dentro del grupo con fracción de eyección conservada, que no existieron diferencias en los parámetros hemodinámicos y ecocardiográficos medidos entre los diferentes sitios de estimulación a nivel del VD. A su vez, la estimulación a nivel de la pared libre del ventrículo izquierdo como la biventricular solo mostró una menor duración del QRS estimulado36.
¿Deberíamos abandonar definitivamente la estimulación apical derecha? Los datos son claros en el caso de los pacientes con fracción de eyección deteriorada en los cuales se generaría un mayor deterioro37. Pero en el caso de los pacientes con fracción de eyección conservada es necesaria más evidencia que clarifique el mejor sitio de estimulación. Actualmente, se están realizando 3 estudios multicéntricos con este objeto: el Optimize RV Follow-up Selective Site Pacing Clinical Trial (Optimize RV) (ClinicalTrial.gov NCT00422669); The Protection of Left Ventricular Function During Right Ventricular Pacing. Does Right Ventricular High-septal Pacing Improve Outcome Compared With Right Ventricular Apical Pacing? (ClinicalTrial.gov NCT00461734 PROTECT-PACE STUDY); y el Right Ventricular Apical versus Septal Pacing (RASP) (ClinicalTrials.gov NCT00199498) que ayudarán a esclarecer este punto.
Hemos observado un incremento del tamaño de la aurícula izquierda en el seguimiento. Esto se evidenció en todos los pacientes independientemente del sitio de estimulación (41.96mm±5.96 a las 48h, 41.94mm±5.21 a los 5 meses, 44.76mm±6.25 a los 48 meses, p=0.03). La causa de este hallazgo fue posiblemente la disincronía auriculoventricular generada por la estimulación unicameral. Se descartó como causa de este fenómeno el aumento de las presiones de llenado ya que la relación E/E¿ (8.62 vs. 10.4; 8.1 vs. 11.63; 9.47 vs. 13.8, p=NS; grupo A, grupo B a las 48h, 5 meses y 48 meses respectivamente) no mostró diferencias entre los grupos y se descartó también el deterioro de la fracción de eyección porque tampoco presentaron diferencias significativas a lo largo del seguimiento (tabla 2). Ha sido demostrado que la estimulación unicameral genera un remodelado eléctrico auricular y también una mayor incidencia de fibrilación auricular, siendo posiblemente la dilatación auricular izquierda un paso previo y sustrato anatómico para este evento23,38.
LimitacionesUna importante limitación en la extrapolación de los resultados es el reducido número de pacientes incluidos. Aún así, las ventajas de este estudio son que el mismo fue aleatorizado, con un seguimiento del 100% de los pacientes y un promedio de tiempo de seguimiento de 34 meses.
ConclusiónLa estimulación a nivel septal no presentó menor disincronía interventricular e intraventricular que la estimulación a nivel apical al corto y largo plazo. Son necesarios ensayos con mayor número de pacientes para validar estos datos encontrados.
FinanciaciónEl financiamiento estuvo a cargo del Instituto de Cardiología de Corrientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Es deseo de los autores agradecer la valiosa y fundamental ayuda de Luciano Mazzaro, investigador profesional superior del Departamento de Bioingeniería de la Universidad de Denver, Colorado, Estados Unidos de Norteamérica.